Неорганические материалы, 2020, T. 56, № 6, стр. 615-622
Разработка метода магнитной сепарации для выделения РЗЭ и циркония из солевых расплавов
Л. С. Алексеева 1, *, Д. О. Савиных 1, А. И. Орлова 1, М. Ю. Каленова 2, А. М. Кощеев 2, Е. А. Потанина 1, П. Ю. Сальников 1, Д. А. Михайлов 1
1 Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, 23, Россия
2 Ведущий научно-исследовательский институт химической технологии
115409 Москва, Каширское ш., 33, Россия
* E-mail: golovkina_lyudmila@mail.ru
Поступила в редакцию 20.12.2018
После доработки 13.12.2019
Принята к публикации 23.12.2019
Аннотация
Применение магнитных полей в неводных процессах переработки облученного ядерного топлива с использованием солевых расплавов открывает новые возможности избирательного извлечения радионуклидов без разрушения растворителя. В настоящей работе такой подход развит для избирательного выделения РЗЭ и циркония. Исследовались гексаферрит стронция и феррит со структурой шпинели в качестве магнитного носителя, а также возможность его использования в хлоридных расплавах щелочных элементов. Проанализировано влияние условий процесса (температуры, времени выдержки, содержания Zr) на эффективность извлечения Nd и Zr методом магнитной сепарации.
ВВЕДЕНИЕ
Пироэлектрохимическая технология с использованием в качестве растворяющей среды солевых расплавов и, прежде всего, расплавов хлоридов щелочных элементов признана в настоящее время перспективной. Пирохимические процессы характеризуются малыми объемами образующихся отходов, их высокой удельной активностью, практически отсутствием жидких технологических высокоактивных отходов. Эта технология обладает рядом достоинств: расплавы являются хорошей растворяющей средой, они устойчивы при высоких температурах, под действием радиации, их применение позволяет вывести из технологического процесса воду, необходимую для всех живых систем. Работы с хлоридными расплавами с применением их для пироэлектрохимической технологии выполнялись и выполняются во многих странах мира: России [1–7], США, Японии [8], Корее [9], Великобритании [3, 10] (цеолитная сорбция). Поведение U, Np, Pu, Am в расплавах LiCl–KCl охарактеризовано в работах [1, 11–25]. Многообразие исследований, в т. ч. в последние годы [20–23], свидетельствует о том, что проблема является актуальной.
Извлечение из расплава актинидов (Am, Cm), редкоземельных элементов (РЗЭ) и циркония является одной из основных задач, решаемых в рамках этой технологии, в т. ч. в России [5, 6, 24, 25].
Среди методов извлечения, концентрирования, консолидации для последующей изоляции от биосферы продуктов деления актинидов разрабатываются осадительные, ионообменные, зонная кристаллизация, сорбционные.
Для извлечения компонентов, растворенных в расплаве LiCl–KCl, в настоящей работе предлагается использование магнитного поля.
В качестве магнитных носителей, способных включать в свой состав извлекаемые компоненты расплава, внимания заслуживают гексаферрит стронция со структурой магнетоплюмбита, включающий актиниды и РЗЭ, и ферриты со структурой шпинели, включающие цирконий.
Гексаферриты М-типа, изоморфные минералу магнетоплюмбиту, примерный состав которого описывается формулой Pb2Fe15Mn7AlTiO38 [26], представляют собой твердые оксидные соединения с общей формулой MFe12O19 (M = Ba, Sr, Pb). Такие гексаферриты могут включать в свой состав лантаниды. К настоящему времени изучены Sr-ферриты, в составе которых Sr и Fe участвуют в гетеровалентных замещениях: La3+–Co2+ [27, 28], La3+–Cu2+ [29], La3+–Zn2+ [30], Ln3+–Fe2+, Ln3+–Co2+ (Ln = Pr, Nd, Sm) [31–34], а также Nd3+–Zn2+ [35], Pr3+–Zn2+ [36].
Гексаферриты стронция обладают хорошими магнитными характеристиками (температура Кюри 737 K [37]) и высокой химической стабильностью.
Ферриты со структурой шпинели характеризуются общей формулой BFe2O4, где B = Mg, Mn, Fe, Co, Ni, Cu, Zn, Cd. Они кристаллизуются в кубической решетке с пр. гр. Fd3m, Z = 8 [38]. Феррошпинели обладают уникальными физико-химическими свойствами, в том числе отличными магнитными характеристиками, высокой химической стабильностью. Благодаря этим свойствам они рассматриваются в качестве магнитных сорбентов для извлечения ионов тяжелых металлов и радионуклидов из водных растворов [39–43].
Литературных данных о применении таких соединений для извлечения компонентов расплавов, в т. ч. расплавов щелочных хлоридов, не обнаружено.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. Объектами исследования являлись катиондефицитные гексаферриты со структурой магнетоплюмбита Sr1 – x[ ]xFe12 – xCuxO19 (x = 0.4), где [ ] – вакантные позиции с предполагаемыми заселяющими катионами, в частности неодимом, а также твердый раствор FeO–Fe2O3–ZrO2 со структурой шпинели.
В настоящей работе в качестве катионов, размещающихся в позициях структуры магнетоплюмбита, выбран неодим как представитель лантанидов, входящих в состав продуктов деления ядерного топлива, а также как химический и структурный аналог актинидов (Am и Cm) [44], накапливающихся в ядерном топливе в процессе работы атомного реактора.
Методы исследования, приборы и установки. Фазовый состав образцов исследовали методом рентгенофазового анализа (РФА) на рентгеновском порошковом дифрактометре Shimadzu LabX XRD-6000 (CuKα-излучение, λ = 1.54056 Å).
Концентрацию Sr, Ba, Cu, Fe, Nd и Zr определяли методами атомной абсорбционной спектроскопии и атомной эмиссионной спектроскопии с индуктивно-связанной плазмой (ИСП-АЭС) на атомно-абсорбционном cпектрофотометре AA-240FS Varian и эмиссионном спектрометре с ИСП Agilent 725 ICP-OES, Agilent Technologies.
Эксперимент проводили в трубчатой печи (рабочая температура до 1000°C) с термоконтроллером в потоке аргона (ТУ 6-21-12-94, “ос. ч.”). Для удаления остаточной воды аргон пропускали через концентрированную серную кислоту. Магнитную фазу извлекали из расплава с помощью электромагнита.
Работы проводились в инертном боксе 850-NB Plas-Labs (США) в атмосфере аргона.
Подготовка расплава к работе. В экспериментах по изучению устойчивости магнетоплюмбита для получения расплава смесь (мол. %) безводных хлоридов: 55.7 LiCl (ООО “Ланхит”, “ос. ч.”) и 44.3 KCl (АО “Химреактив”, “х. ч.”), содержащую (% от массы расплава): 0.5 CsCl (ООО “Ланхит”, “ос. ч.”), 0.1 SrCl2 (ООО “Ланхит”, “ос. ч.”), 0.3 BaCl2 (ООО “Ланхит”, “ос. ч.”), помещали в фарфоровый тигель, просушивали в трубчатой печи (в атмосфере аргона) при температуре 150°C в течение 30 мин, затем нагревали до 450°C и выдерживали при этой температуре в течение 1.5 ч. К исходной смеси добавляли безводные хлориды (% от массы расплава): 1 NdCl3 (ООО “Ланхит”, “ос. ч.”) и 0.1, 1 и 10 ZrCl4 (ООО “Ланхит”, “ос. ч.”).
Для предотвращения перехода исходных хлоридов в оксидную форму к смеси добавляли хлорид аммония NH4Cl (АО “Вектон”, “х. ч.”), при нагревании создающий поток хлороводорода.
Используемый электролит по составу моделировал расплав LiCl–KCl, получаемый в технологии пирохимической переработки отходов ядерного топлива (ОЯТ), содержащий, помимо извлекаемых компонентов (Am, Cm, РЗЭ и Zr), в примесных количествах хлориды цезия, стронция и бария, наличие которых может влиять на извлекаемость Nd и Zr из электролита.
Синтез. Катиондефицитное соединение со структурой магнетоплюмбита Sr1 – x[ ]xFe12 – xCuxO19 (x = 0.4) получали исходя из предположения, что вакантные позиции структуры в дальнейшем займут ионы Nd из расплава.
Порошок готовили смешиванием 0.5 М водных растворов SrCl2, Fe(NO3)3 и CuCl2 в стехиометрических соотношениях. Полученную смесь сушили при 90°C в течение 20 ч. Сухой остаток термостатировали при 500, 900, 1100°C в течение 10 ч на каждой стадии.
Твердый раствор FeO–Fe2O3–ZrO2 со структурой шпинели получали в расплаве LiCl–KCl. Для этого в расплав дополнительно вносили смесь оксидов железа II и III.
Выделение Nd и Zr из расплава. В расплав модельного состава вносили смесь оксидов железа II и III, готовый сорбент и смесь карбонатов: 55.7 мол. % Li2CO3 (АО “Химреактив”, “х. ч.”) и 44.3 мол. % K2CO3 (АО “Химреактив”, “ч. д. а.”) – в количестве, необходимом для перевода неодима и циркония в оксидную форму. Расчет массы сорбента проводили исходя из количества неодима в расплаве (моли): n(Nd) = 2.5n(Sr0.6[Nd0.4]Fe11.6Cu0.4O19).
После выдерживания системы при 450°C в течение 3 ч магнитную фазу извлекали электромагнитом из расплава. Оставшийся расплав растворяли в дистиллированной воде, выделенную магнитом фазу также промывали дистиллированной водой. Растворы анализировали на содержание Sr, Ba, Cu, Fe, Nd и Zr. Определяли элементный и фазовый составы извлеченных проб и оставшегося в расплаве нерастворимого осадка. Оставшийся в расплаве осадок представлял собой смесь магнитной и немагнитной фаз. С помощью магнита их разделяли. Магнитное разделение осадка проводили для изучения его фазового состава; поскольку рентгенограммы железосодержащей фазы имеют высокий фон, максимумы отражения примесных фаз было бы сложно или даже невозможно анализировать.
Влияние условий эксперимента на магнитное выделение Nd и Zr из расплава. Для установления зависимости эффективности процесса магнитного извлечения Nd и Zr из расплава от условий эксперимента опыты проводили при разных содержаниях циркония (0.1, 1 и 10 мас. %), разных температурах (400 и 450°C) и разных временах выдержки сорбента в расплаве (3 и 6 ч).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Устойчивость магнетоплюмбита Sr1 – x[Nd]xFe12 – xCuxO19 (x = 0.4) в расплаве LiCl–KCl. Устойчивость магнетоплюмбита Sr1 – x[ ]xFe12 – xCuxO19 (x = 0.4), где [ ] – вакантные позиции с предполагаемыми заселяющими атомами в расплаве LiCl–KCl, изучали при температуре 450°C и выдержке в течение 3 ч.
Рентгенограммы магнетоплюмбита Sr1 – x[ ]xFe12 – xCuxO19 (x = 0.4) до и после выдержки в расплаве приведены на рис. 1.
Рис. 1.
Данные РФА: Sr1– x[ ]xFe12– xCuxO19 (x = 0.4) до (1) и после (2) выдержки в расплаве LiCl–KCl.
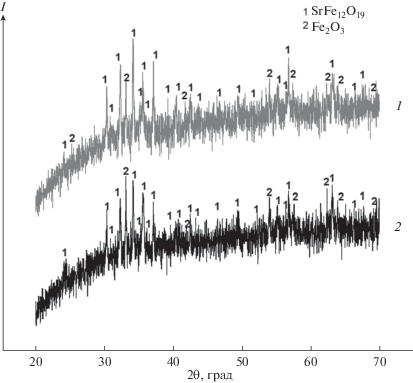
По данным РФА установили, что состав исследуемого образца не изменился. Образец до и после выдержки в расплаве представлял собой смесь фазы, изоструктурной фазе магнетоплюмбита SrFe12O19, и фазы Fe2O3.
Влияние концентрации циркония в расплаве электролита LiCl–KCl на извлекаемость Nd и Zr. В результате экспериментов установили, что при прочих одинаковых условиях содержание Nd уменьшилось по сравнению с начальным на 35.4% в присутствии 0.1% Zr, на 33.4% в присутствии 1% Zr, на 54% в присутствии 10% Zr. Содержание циркония в расплаве заметно уменьшилось: до 0.02% для расплава с 0.1% Zr, до 0.05% – с 1% Zr и до 1.34% – с 10% Zr, что, в соответствии с данными РФА, было связано с образованием оксида циркония ZrO2 и других Zr-содержащих соединений.
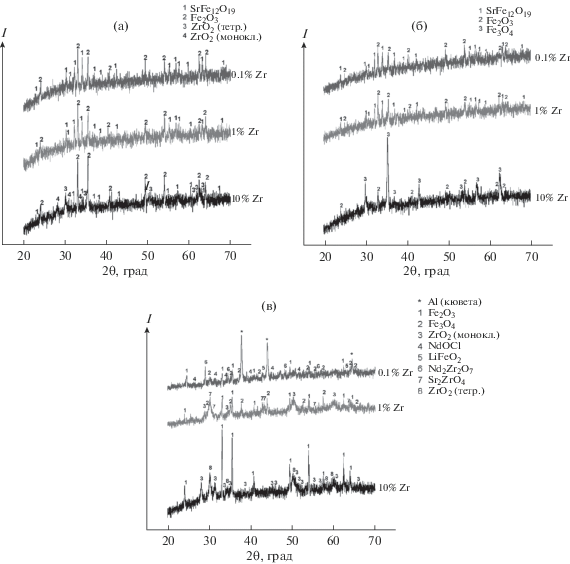
Рентгенограммы нерастворимых фаз, полученных в результате экспериментов, представлены на рис. 2. Как следует из приведенных данных, рентгенограммы магнитных фаз, извлеченных из систем с содержанием циркония 0.1 и 1 мас. % (рис. 2а), и магнитных фаз, оставшихся в расплаве (рис. 2б), сходны между собой. Во всех случаях порошки представляли собой смесь фазы, изоструктурной фазе гексаферрита стронция SrFe12O19, и оксида железа Fe2O3. При содержании в электролите 10 мас. % циркония извлеченный порошок представлял собой смесь магнетита Fe3O4 и оксида железа Fe2O3, а магнитная фаза, оставшаяся в расплаве, состояла из смеси фазы, изоструктурной гексаферриту стронция SrFe12O19, Fe2O3, а также ZrO2. Немагнитная фаза, оставшаяся в расплаве с концентрацией Zr 0.10 мас. %, состояла из Nd-содержащих фаз: оксихлорида NdOCl и цирконата Nd2Zr2O7 (рис. 2в). В немагнитных фазах, оставшихся в расплаве с содержанием Zr 0.1, 1 и 10 мас. %, присутствовала фаза Fe2O3, а также Zr-содержащие фазы: цирконаты Nd2Zr2O7, Sr2ZrO4 и ZrO2.
Рис. 2.
Данные РФА: магнитной фазы, извлекаемой из расплава (а), магнитной фазы, оставшейся в расплаве (б), немагнитной фазы при содержании Zr 0.1, 1 и 10 мас. %.
Элементный состав магнитных фаз, извлеченных и оставшихся в расплаве, приведен в табл. 1.
Таблица 1.
Элементный состав магнитных фаз: оставшейся (1) и извлеченной из расплава (2)
| Условия | Фаза | С, мас. % | |||||
|---|---|---|---|---|---|---|---|
| Sr | Ba | Cu | Fe | Nd | Zr | ||
| 0.1 мас. % Zr, 450°C, 3 ч | 1 | 4.01 | 0.013 | 0.11 | 73.02 | 0.39 | 0.048 |
| 2 | 4.65 | 0.016 | 0.024 | 72.57 | 0.67 | 0.16 | |
| 1 мас. % Zr, 450°C, 3 ч | 1 | 3.09 | 0.07 | 0.029 | 62.79 | 0.42 | 0.37 |
| 2 | 3.45 | 0.064 | 0.016 | 64.63 | 0.8 | 0.73 | |
| 10 мас. % Zr, 450°C, 3 ч | 1 | 0.69 | 0.007 | 0.009 | 73.57 | 1.08 | 9.45 |
| 2 | 0.37 | 0.003 | 0.009 | 73.35 | 1.99 | 4.84 | |
| 1 мас. % Zr, 400°C, 3 ч | 1 | 3.88 | 0.009 | 0.019 | 67.51 | 0.017 | 0.31 |
| 2 | 3.62 | 0.003 | 0.015 | 68.09 | 1.96 | 0.35 | |
| 1 мас. % Zr, 450°C, 6 ч | 1 | 3.13 | 0.004 | 0.025 | 63.19 | 1.14 | 0.93 |
| 2 | 3.56 | 0.006 | 0.016 | 64.01 | 1.23 | 0.87 | |
Из элементного анализа твердых фаз (табл. 1) следует, что фаза, извлекаемая из расплава с помощью магнита, и магнитная фаза, оставшаяся в расплаве, практически не отличались друг от друга.
Распределение Nd и Zr между исследуемыми фазами представлено в табл. 2. Видно, что при исходном содержании циркония 0.1 и 1% основная часть неодима оставалась в расплаве (65–67%). При 10% Zr количество неодима в расплаве сокращалось примерно в 1.5 раза (до 46%).
Таблица 2.
Распределение Nd и Zr между фазами: 1 – извлеченная фаза, 2 – магнитная фаза, оставшаяся в расплаве, 3 – немагнитная фаза, 4 – расплав
| Условия | Распределение Nd, % | Распределение Zr, % | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | |
| 0.1 мас. % Zr, 450°C, 3 ч | 10.7 | 12.1 | 12.6 | 64.6 | 25.6 | 14.9 | 59.3 | 0.2 |
| 1 мас. % Zr, 450°C, 3 ч | 11 | 12.1 | 10.3 | 66.6 | 10 | 10.7 | 79.25 | 0.05 |
| 10 мас. % Zr, 450°C, 3 ч | 15.2 | 17.8 | 21 | 46 | 3.7 | 15.6 | 67.3 | 13.4 |
| 1 мас. % Zr, 400°C, 3 ч | 8.4 | 9.6 | 14.6 | 67.4 | 1.5 | 17.58 | 80.9 | 0.02 |
| 1 мас. % Zr, 450°C, 6 ч | 15.5 | 17.7 | 19.4 | 47.4 | 10.94 | 14.48 | 74.57 | 0.01 |
Следует также отметить, что при 0.1 и 1% Zr содержание неодима в магнитных фазах более чем в 2 раза превышало его содержание в немагнитной фазе, при 10% Zr – более чем в 1.5 раза. Количество Zr, включаемое в магнитные фазы, уменьшалось при увеличении его исходной концентрации в расплаве.
Влияние температуры процесса. В результате экспериментов содержание Nd в расплаве сократилось по сравнению с начальным на 32.6% при проведении процесса при t = 400°C и на 33.4% при t = 450°C. Содержание Zr в сравнении с начальным сократилось не менее чем на 99.9%.
Рентгенограммы нерастворимых фаз, полученных при t = 400°C, представлены на рис. 3. Рентгенограммы отобранной и оставшейся в расплаве с содержанием циркония 1 мас. % магнитных фаз после эксперимента при 400°C сходны между собой. Порошки представляли собой смесь фазы, изоструктурной гексаферриту стронция SrFe12O19, и Fe2O3. Немагнитная фаза, оставшаяся в расплаве, являлась смесью ZrO2, Fe2O3 и LiFe5O8.
Рис. 3.
Данные РФА: магнитной фазы, извлекаемой из расплава (1), магнитной фазы, оставшейся в расплаве (2), немагнитной фазы (3) после выдержки при t = 400°C.
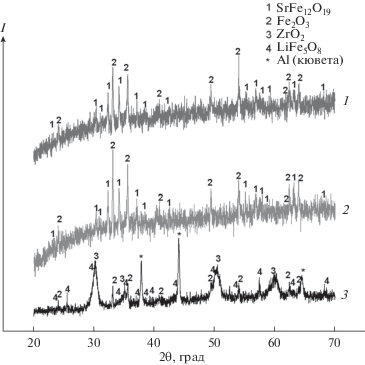
Из анализа распределения Nd и Zr между фазами (табл. 2) следует, что основная часть неодима остается в расплаве (66–67%) независимо от температуры процесса. При температуре 450°C содержание неодима в магнитных фазах более чем в 2 раза превышало его содержание в немагнитной фазе, а при 400°C их распределение было примерно одинаковым. Распределение циркония мало зависело от температуры – его бóльшая часть (79–80%) содержалась в немагнитной фазе в обоих случаях.
Влияние времени выдержки. В результате экспериментов при разных временах выдержки – 3 и 6 ч – содержание Nd в расплаве сократилось по сравнению с начальным: на 33.4% при 3 ч и на 52.6% при 6 ч. Содержание Zr сократилось не менее чем на 99.9%.
Рентгенограммы нерастворимых фаз, полученных при времени выдержки сорбента в расплаве 6 ч, представлены на рис. 4. Из их анализа следует, что фазовые составы отобранной пробы и магнитной фазы, оставшейся в расплаве с содержанием циркония 1 мас. %, сходны между собой. В обоих случаях порошки представляли собой смесь фазы, изоструктурной гексаферриту стронция SrFe12O19, и Fe2O3. Немагнитная фаза, оставшаяся в расплаве, представляла собой смесь ZrO2 и Fe2O3.
Рис. 4.
Данные РФА: магнитной фазы, извлекаемой из расплава (1), магнитной фазы, оставшейся в расплаве (2), немагнитной фазы (3) после выдержки при 450°С в течение 6 ч.
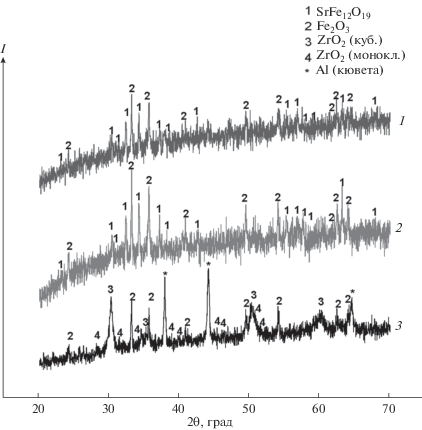
Анализ распределения Nd и Zr между фазами (табл. 2) показал, что основная часть неодима осталась в расплаве (47–67%). При более длительной выдержке (6 ч) содержание неодима в магнитных и немагнитной фазах значительно увеличивалось по сравнению с 3-часовой выдержкой. Большая часть циркония содержалась в немагнитной фазе (75–80%). Его распределение мало зависело от времени выдержки.
ЗАКЛЮЧЕНИЕ
Изучена устойчивость магнетоплюмбита Sr1 – x[ ]xFe12 – xCuxO19 (x = 0.4) в расплаве LiCl–KCl.
Исследовано влияние концентрации циркония (0.1, 1, 10 мас. %) в расплаве LiCl–KCl (55.7 и 44.3 мол. % соответственно), содержащем хлориды Cs (0.5 мас. %), Sr (01 мас. %), Ba (0.3 мас. %), Nd (1 мас. %), температуры и длительности процесса на образование Nd- и Zr-содержащих фаз на основе ферритов со структурой магнетоплюмбита.
Исследуемый магнетоплюмбит показал наибольшую эффективность по отношению к неодиму и цирконию при 450°C и продолжительности его контакта с электролитом 6 ч.
Возможно магнитное извлечение Nd- и Zr-содержащих фаз из электролита.
Список литературы
Орлова А.И. Высокотемпературное концентрирование компонентов топливного цикла с включением в кристаллические матрицы двойных солей: Автореф. дис. … докт. хим. наук. Ленинград. 1988. 48 с.
Lukinykh A.N., Lavrinovich Yu.G. et al. High-Level Waste Composition, Properties and Preparation for Long-Term Storage after Pyroelectrochemical Reprocessing of Irradiated Oxide Uranium-Plutonium Fuel // The 5th Int. Conf. on Recycling, Conditioning and Disposal RECOD98. (October 25–28). 1998. Nice. 1998. V. 3. P. 814–821.
Volkovich V.A., Griffiths T.R., Thied R.C. Formation of Lanthanide Phosphates in Molten Salts and Evaluation for Nuclear Waste Treatment // Phys. Chem. Chem. Phys. 2003. V. 5. № 14. P. 3053–3060.
Лизин А.А., Томилин С.В., Чистяков В.М. Исследования в ОАО “ГНЦ НИИАР” по обращению с высокоактивными отходами пирохимических процессов // Вопросы атомной науки и техники. Сер.: материаловедение и новые материалы. 2014. № 3. С. 96–114.
Мальцев Д.С., Волкович В.А., Васин Б.Д. Коэффициенты диффузии ионов урана(III) и (IV) в эвтектическом расплаве LiCl–KCl–CsCl // Расплавы. 2016. № 3. С. 226–237.
Мальцев Д.С., Волкович В.А., Васин Б.Д. Окислительно-восстановительные потенциалы урана в расплаве эвтектической смеси хлоридов лития, калия и цезия // Расплавы. 2016. № 3. С. 238–244.
Казаковцева Н.А., Майков М.А., Никитина Е.В. Исследование коррозии стали 12Х18Н10Т в расплаве LiCl–KCl–nNdCl3 // Расплавы. 2018. № 3. С. 344–349.
Amamoto I., Kofuji H., Myochin M. et al. Phosphates Behavior in Conversion of FP Chlorides // J. Nucl. Mater. 2009. V. 389. № 1. P. 142–148.
Cho Y.Z., Lee T.K., Choi J.H. et al. Eutectic (LiCl–KCl) Waste Salt Treatment by Sequencial Separation Process // Nucl. Eng. Technol. 2013. V. 45. № 5. P. 675–682.
Harrison M.T., Simms H.E., Jackson A. et al. Salt Waste Treatment from a LiCl–KCl Based Pyrochemical Spent Fuel Treatment Process // Radiochim. Acta. 2008. V. 96. № 4–5. P. 295–301.
Koyama T., Johnson T.R., Fischer D.F. Distribution of Actinides in Molten Chloride Salt/Cadmium Metal System // J. Alloys Compd. 1992. V. 189. № 1. P. 37–44.
Hébant P., Picard G.S. Equilibrium Reaction between Molecular and Ionic Species in Pure LiCl and in LiCl–MCl (M = Na, K, Rb) Melts Investigated by Computational Chemistry // J. Mol. Struct. 1995. V. 358. № 1–3. P. 39–50.
Roy J.J., Grantham L.F., Grimmet D.L. et al. Thermodynamic Properties of U, Np, Pu, and Am in Molten LiCl–KCl Eutectic and Liquid Cadmium // J. Electrochem. Soc. 1996. V. 143. № 8. P. 2487–2492.
Shirai O., Iwai T., Suzuki Y. et al. Electrochemical Behavior of Actinide Ions in LiCl–KCl Eutectic Melts // J. Alloys Compd. 1998. V. 271–273. P. 685–688.
Lexa D. On the Reactive Occlusion of the (Uranium Trichloride + Lithium Chloride + Potassium Chloride) Eutectic Salt in Zeolite 4A // J. Nucl. Mater. 1999. V. 279. № 1. P. 57–64.
Iizuka M., Uozumi K., Inoue T. et al. Behavior of Plutonium and Americium at Liquid Cadmium Cathode in Molten LiCl–KCl Electrolyte // J. Nucl. Mater. 2001. V. 299. № 1. P. 32–42.
Simpson M.F., Gougar M.L.D. Two-Site Equilibrium Model for Ion Exchange between Monovalent Cations and Zeolite-A in a Molten Salt // Ind. Eng. Chem. Res. 2003. V. 42. № 18. P. 4208–4212.
Serp J., Konings R.J.M., Malmbeck R. et al. Electrochemical Behavior of Plutonium Ion in LiCl–KCl Eutectic Melts // J. Electroanal. Chem. 2004. V. 561. P. 143–148.
Kuznetsov S.A., Hayashi H., Minato K. et al. Electrochemical Behavior and Some Thermodynamic Properties of UCl4 and UCl3 Dissolved in a LiCl–KCl Eutectic Melt // J. Electrochem. Soc. 2005. V. 152. № 4. P. 203–212.
Kim T.J., Jung Y., Shim J.B. et al. Study on Physicochemical Properties of U3+ in LiCl–KCl Eutectic Media at 773 K // J. Radioanal. Nucl. 2011. V. 287. № 1. P. 347–350.
Park H.-S., Kim I.-T., Cho Y.-J. et al. Removal Behavior of Cs from Molten Salt by Using Zeolitic Materials // J. Radioanal. Nucl. Chem. 2010. V. 283. № 2. P. 267–272.
Wasnik M., Carlson K., Simpson M.F. Waste Minimization of Electrorefiner Waste Salt via Dechlorination: A New Approach // Trans. Am. Nucl. Soc. 2017. V. 117. P. 281–282.
Liu K., Liu Y.-L., Chai Z.-F. et al. Evaluation of the Electroextractions of Ce and Nd from LiCl–KCl Molten Salt Using Liquid Ga Electrode // J. Electrochem. Soc. 2017. V. 164. № 4. P. 169–178.
Волкович В.А., Васин Б.Д., Мальцев Д.С., Александров Д.Е. Способ очистки облученного ядерного топлива: Патент России № 2499306. 2013 // Б.И. № 32.
Volkovich V.A, Ivanov A.B., Sobolev A.A., Vasin B.D., Griffiths T.R. An Electrochemical and Spectroelectrochemical Study of Ln(II) (Ln = Sm, Eu, Yb) Species in NaCl–2CsCl Melt // ECS Trans. 2014. V. 64. № 4. P. 617–634.
Pollert E. Crystal Chemistry of Magnetic Oxides Part 2: Hexagonal Ferrites // Prog. Cryst. Growth Charact. Mater. 1985. № 11. P. 155–205.
Yamamoto H., Obara G. Magnetic Properties of Anisotropic Sintered Magnets Using Sr–La–Co System Powders by Mechanical Compounding Method // J. Jpn. Soc. Powder Powder Metall. 2000. V. 47. P. 796–800.
Yamomoto H., Obara G. Effect of La2O3 and Co3O4 Additives on Magnetic Properties of Sr-M Ferrite by Mechanical Compounding Method // J. Jpn. Soc. Powder Powder Metall. 2000. V. 47. № 2. P. 160–164.
Башкиров Л.А., Красовская Л.И., Великанова И.А., Полыко Д.Д. Кристаллическая структура и магнитные свойства ферритов системы Sr1 – xLaxFe12 – xCuxO19 // Тр. БГТУ. Химия и технология неорганических веществ. 2011. № 3. С. 43–50.
Taguchi H., Takeishi T., Suwa K. High Energy Ferrite Magnets // J. Phys. IV. 1997. № 7(C1). P. C1-311–C1-312.
Mocuta H., Morel A. Structural and Magnetic Properties of Hydrothermally Synthesised Sr1– xNdxFe12O19 Hexagonal Ferrites // J. Alloys. Compd. 2004. V. 364. № 1. P. 48–52.
Lechevallier L., Le Breton J.M., Morel A., Tenaud P. Influence of the Presence of Co on the Rare Earth Solubility in M-Type Hexaferrite Powders // J. Magn. Magn. Mater. 2007. V. 316. № 2. P. 109–111.
Lechevallier L., Le Breton J.M. On the Solubility of Rare Earths in M-type SrFe12O19 Hexaferrite Compounds // J. Phys. Condens. Matter. 2008. № 20. P. 175203–175212.
Ze W., Bashkirov L.A., Trukhanov S.V. et al. Crystal Structure and Magnetic Properties of Sr1 –xSmxFe12 –xCoxO19 Solid Solutions // Inorg. Mater. 2014. V. 50. № 3. P. 290–295.
Полыко Д.Д., Башкиров Л.А., Лобановский Л.С., Труханов С.В. Кристаллическая структура и магнит-ные свойства высококоэрцитивных ферритов Sr1 – xNdxFe12 – xZnxO19, (Sr0.85Ca0.15)1 – xNdxFe12 – xZnxO19 при температурах 6–300 K в магнитных полях до 14 Тл // Тр. БГТУ. Химия и технология неорга-нических веществ. 2009. № 3. C. 83–84.
Полыко Д.Д., Башкиров Л.А., Труханов С.В. и др. Кристаллическая структура и магнитные свойства высококоэрцитивныхтвердых растворов Sr1 –xPrxFe12 –xZnxO19 // Неорган. материалы. 2011. T. 47. № 1. C. 81–86.
Morishita H., Amano A., Ueda H. et al. Single Crystal Growth of Strontium Ferrite with Magnetoplumbite Structure Using the Traveling Solvent Floating Zone Method // J. Jpn. Soc. Powder Powder Metall. 2014. V. 61. № S1. P. S64–S66.
Mathew D.S., Juang R.S. An Overview of the Structure and Magnetism of Spinel Ferrite Nanoparticles and Their Synthesis in Microemulsions // Chem. Eng. J. 2007. V. 129. P. 51–65.
Ngomsik A.F., Bee A., Draye M. et al. Magnetic Nano- and Microparticles for Metal Removal and Environmental Applications: A Review // C. R. Chim. 2005. V. 8. P. 963–970.
Gao Z., Cui F., Zeng S. et al. A High Surface Area Superparamagnetic Mesoporous Spinel Ferrite Synthesized by a Template-Free Approach and Its Adsorptive Property // Microporous Mesoporous Mater. 2010. V. 132. № 1–2. P. 188–195.
Tu Y.J., You C.F., Chang C.K. Kinetics and Thermodynamics of Adsorption for Cd on Green Manufactured Nano-Particles // J. Hazard. Mater. 2012. V. 235–236. P. 116–122.
Harikishore K.R.D., Yun Y.S. Spinel Ferrite Magnetic Adsorbents: Alternative Future Materials for Water Purification? // Coord. Chem. Rev. 2016. V. 315. P. 90–111.
Kefeni K.K., Mamba B.B., Msagati T.A.M. Application of Spinel Ferrite Nanoparticles in Water and Wastewater Treatment: A Review // Sep. Purif. Technol. 2017. V. 188. P. 399–422.
Krauskopf K.B. Thorium and Rare-Earth Metals as Analogs for Actinide Elements // Chem. Geol. 1986. V. 55. P. 323–335.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


