Неорганические материалы, 2020, T. 56, № 6, стр. 630-637
Теплоемкость соединений системы Bi2O3–TiO2
Л. Т. Денисова 1, *, Ю. Ф. Каргин 2, Л. Г. Чумилина 1, Н. В. Белоусова 1, В. М. Денисов 1
1 Институт цветных металлов и материаловедения Сибирского федерального университета
660041 Красноярск, Свободный пр., 79, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 25.11.2019
После доработки 19.01.2020
Принята к публикации 20.01.2020
Аннотация
Титанаты висмута Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11 получены методом твердофазных реакций при многоступенчатом обжиге на воздухе при температурах 1003–1273 K (Bi12TiO20 – до 1123 K) соответствующих стехиометрических смесей исходных оксидов. Методом дифференциальной сканирующей калориметрии выполнено измерение теплоемкости поликристаллических образцов синтезированных соединений в интервале температур 330–1050 К. Для Bi4Ti3O12 и Bi2Ti4O11 на зависимостях Cp = f(T) установлено наличие экстремумов при температурах 943 и 509 K соответственно, обусловленных сегнетоэлектрическими фазовыми переходами. Рассчитаны изменения энтальпии, энтропии и приведенной энергии Гиббса полученных титанатов висмута.
ВВЕДЕНИЕ
Начиная с публикации о фазовых равновесиях в системе Bi2O3–TiO2 [1] интерес к ней исследователей не прекращается [2–11]. В первую очередь это связано с разнообразием физико-химических свойств образующихся в этой системе оксидных соединений [5, 8, 11–15]. Имеющиеся в литературе данные о количестве и составе образующихся титанатов висмута противоречивы. Подробно это обстоятельство проанализировано в работе [5]. В системе Bi2O3–TiO2 образуются четыре соединения: Bi12TiO20, Bi4Ti3O12, Bi2Ti2O7 и Bi2Ti4O11. Если существование титанатов висмута Bi4Ti3O12 и Bi2Ti4O11 подтверждено всеми авторами, изучавшими систему Bi2O3–TiO2, то для соединений Bi12TiO20 и Bi2Ti2O7, как отмечено в [8], не все так однозначно. В области Bi2O3 состав фазы со структурой типа силленита записан как Bi8TiO14 (4 : 1) [1, 16, 17], а состав данной фазы при исследовании в области концентраций 2–22 в мол. % TiO2 отвечает Bi12TiO20 (6 : 1) [18]. Изучению свойств этого соединения посвящен ряд работ [2, 19–22]. Кроме того, проведенные исследования фазовых соотношений в богатой Bi2O3 области бинарной системы Bi2O3–TiO2 с использованием ДТА и РФА показали, что образуются только Bi12TiO20 и Bi4Ti3O12 (соединение состава Bi8TiO14 не обнаружено) [7].
Согласно [5], Bi2Ti2O7 со структурой пирохлора разлагается в твердом состоянии при T > 923 K с образованием Bi4Ti3O12 и Bi2Ti4O11. Образование титаната висмута со структурой пирохлора в работах [1, 18] не подтверждено, хотя в [5, 14, 23–27] приведены сведения о получении и исследовании свойств Bi2Ti2O7. Причинами термической нестойкости стехиометрической фазы Bi2Ti2O7 являются особенности ее кристаллического строения [3, 15, 24–26]. Рядом авторов для термической стабилизации титаната висмута со структурой пирохлора проводят замещение висмута катионами других элементов с меньшими ионными радиусами [28–35]. Если возможность синтеза Bi2Ti2O7 (который может быть получен в виде дисперсного порошка методами “мокрой химии” [8]) со структурой пирохлора твердофазным методом ставится под сомнение [9, 15], то для получения замещенного титаната висмута твердофазный синтез часто используется (см., например, [15]).
Для термодинамического моделирования фазовой диаграммы Bi2O3–TiO2 необходимы данные о термодинамических свойствах фаз, образующихся при взаимодействии Bi2O3 с TiO2. Такие сведения весьма ограничены. В работе [7] прогнозирование фазовых равновесий в системе Bi2O3–TiO2 проведено с использованием модифицированной квазихимической модели жидкой фазы, предложенной А.Д. Пелтоном и М. Бландером [36]. При этом использовали только данные по теплоемкости Bi2O3 и TiO2, полагая, что для четырех промежуточных фаз термодинамических данных нет.
Экспериментальные данные по теплоемкости Bi12TiO20 и Bi4Ti3O12 получены Г.С. Сулейменовой и В.М. Скориковым в работах [37] и [38] соответственно. Измерения выполнены на монокристаллах, выращенных из раствора-расплава на основе Bi2O3 (все четыре соединения в системе Bi2O3–TiO2 имеют инконгруэнтный характер плавления [8]). По данным [11], выращенные этим методом монокристаллы Bi12Ti0.9O19.8 (которые использованы для измерения теплоемкости [37]) содержат включения δ*-Bi2O3, Bi4Ti3O12 и Pt. Можно ожидать, что выращенные таким же методом монокристаллы Bi4Ti3O12 также содержат примесные фазы, поскольку основным недостатком метода получения монокристаллов из раствора-расплава является возможность захвата растворителя в кристалл [39]. Данные по теплоемкости Bi2Ti2O7 имеются только для низких температур (до 100 K) [13], а для Bi2Ti4O11 таких сведений в литературе нет.
Известно, что компьютерное моделирование позволяет существенно снизить материальные затраты на проведение эксперимента, но при этом нужно учитывать, что для такого расчета должны быть достоверные исходные величины, которые могут быть получены только в результате прецизионных измерений термодинамических свойств, в частности теплоемкости.
В настоящей работе измерены температурные зависимости теплоемкости образующихся в системе Bi2O3–TiO2 оксидных соединений и выполнен анализ имеющихся в литературе данных и полученных новых результатов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Титанаты висмута Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11 получены твердофазным синтезом с использованием в качестве исходных компонентов оксидов Bi2O3 и TiO2 квалификации “ос. ч.”. Стехиометрические смеси предварительно прокаленных оксидов (Bi2O3 – 973 K, TiO2 – 1173 K) перемешивали в агатовой ступке, прессовали в таблетки, которые обжигали при 1003–1273 К. Полноту взаимодействия компонентов при синтезе соединений контролировали рентгенофазовым анализом. Съемку дифрактограмм полученных образцов проводили при помощи дифрактометра X´Pert Pro MPD PANalytical (Нидерланды) в CuKα-излучении. Регистрация выполнялась высокоскоростным детектором PIXcel с графитовым монохроматором в угловом интервале 2θ = 10°–90° с шагом 0.013°. Расчетные профили рентгенограмм и параметры кристаллических решеток полученных титанатов висмута определяли путем полнопрофильного уточнения методом минимизации производной разности [40]. Выбор первоначальной температуры обжига 1003 K (в течение 20 ч) обусловлен тем, что при этой температуре происходит полиморфное превращение α-Bi2O3 → δ-Bi2O3 [2], при котором скорость твердофазного взаимодействия увеличивается (эффект Хэдвала [41]). Установлено, что в этих условиях образцы являются неоднофазными и содержат (мас. %): Bi12TiO20 – 47.5 Bi2O3, 51.0 Bi12TiO20, 1.5 Bi4Ti3O12; Bi4Ti3O12 – 51.5 Bi12TiO20, 44.5 Bi4Ti3O12, 4 TiO2; Bi2Ti4O11 – 13.0 Bi12TiO20, 48 Bi4Ti3O12, 13.5 Bi2Ti4O11, 25.5 TiO2. С учетом этого последовательно увеличивали температуру и время твердофазного синтеза: 1023, 1073, 1123, 1173, 1223 по 20 ч и 1273 – 40 ч (для Bi12TiO20 максимальная температура синтеза составляла 1123 K). Для достижения полноты протекания твердофазных реакций через каждые 20 ч проводили измельчение спеченных образцов и прессование в таблетки.
Получение Bi2Ti2O7 твердофазным способом не привело к успеху. Синтез при температуре 873 K (учитывая его разложение при T > 923 K [1, 8]) в течение 20 ч показал, что в полученном образце содержится (мас. %) 29.5 Bi12TiO20, 57.0 Bi4Ti3O12, 6.0 Bi2Ti4O11, 7.5 TiO2. Дальнейший обжиг (по 20 ч) при температурах 1003 и 1023 K показал, что содержание Bi4Ti3O12 и Bi2Ti4O11 увеличивается, но в полученных спеках Bi2Ti2O7 не обнаруживается. Учитывая его термическую нестабильность [5], а также сложности получения этого соединения методом твердофазного синтеза [9, 15], дальнейшие попытки получения этим методом были прекращены. Отметим, что на ДТА-кривой образца, отвечающего составу Bi2Ti2O7, при температуре 950 K наблюдается четкий экстремум. Это подтверждает его термическую нестойкость.
Измерение теплоемкости Cp титанатов Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11 выполняли методом дифференциальной сканирующей калориметрии (ДСК) в интервале температур 330–1050 К, методика подробно изложена в [42, 43]. Ошибка измерений не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дифрактограммы синтезированных поликристаллических образцов титанатов Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11 приведены на рис. 1. Параметры кубической элементарной ячейки Bi12TiO20 равны: пр. гр. I23, a = 10.1718(1) Å, V = 1052.13(2) Å3, Z = 2. Эти данные достаточно близки к имеющимся в литературе: 10.174 Å [2], 10.169 Å [8], 10.170–10.176 Å [11], 10.186(3) Å [37].
Рис. 1.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограмм Bi12TiO20 (а), Bi4Ti3O12 (б) и Bi2Ti4O11 (в) (штрихи указывают расчетные положения рефлексов).
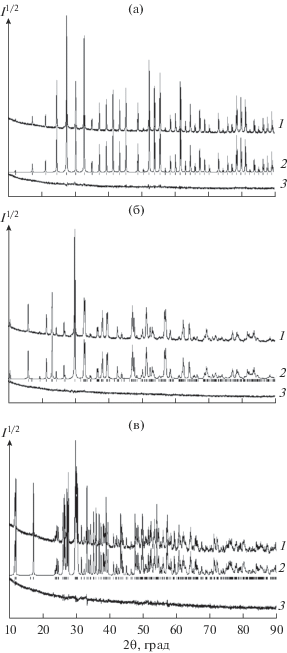
Полученные нами рентгенометрические характеристики для Bi4Ti3O12 в сравнении с данными других авторов приведены в табл. 1. Видно, что наблюдается достаточно хорошее совпадение параметров решетки полученных нами образцов с литературными значениями (данные [46] получены для нанодисперсного порошка Bi4Ti3O12). Представленные в табл. 2 рентгенометрические характеристики фазы Bi2Ti4O11 показывают, что и в этом случае полученные нами экспериментальные величины согласуются с результатами, представленными в литературе [47–50].
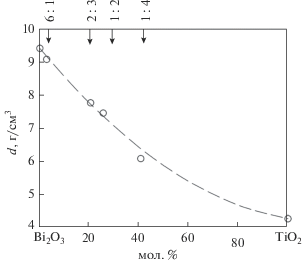
На рис. 2 показано изменение плотности образующихся в системе Bi2O3–TiO2 оксидных соединений от состава. Видно, что с увеличением концентрации TiO2 рассчитанные значения d закономерно уменьшаются. Полученные данные могут быть описаны эмпирическим уравнением
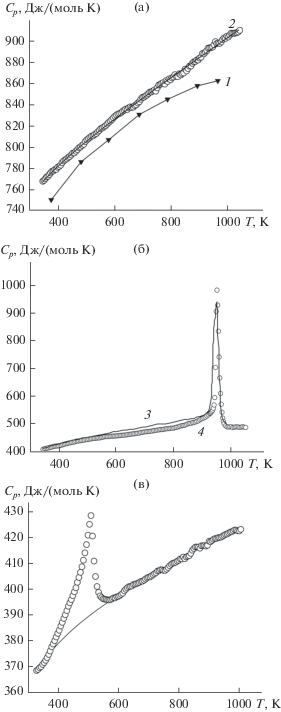
где xi – массовая доля, di – плотность соответствующего оксида, k = 5.78. Значения плотности Bi2O3 взяты из работы [2], TiO2 – из [51]. Наши значения плотности Bi12TiO20 совпадают с данными [2], а Bi4Ti3O12 – с [46]. Для Bi2Ti2O7 величины d заимствованы из [25].Влияние температуры на теплоемкость Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11 показано на рис. 3. Видно, что для Bi12TiO20 наши результаты несколько отличаются от данных [37]. По-видимому, это может быть связано с различием отклонения от стехиометрического состава полученных нами поликристаллических образцов и используемых в [37] монокристаллов, а также с содержанием примесных фаз (об этом сказано выше).
На зависимости Cp = f(T) для Bi4Ti3O12 в области сегнетоэлектрического фазового перехода при 943 K [8, 9] наблюдается четкий экстремум (рис. 3б). Сравнение наших результатов по теплоемкости Bi4Ti3O12 с данными [38] показывает, что они хорошо согласуются между собой (рис. 3б). На полученной нами ДТА-кривой нагревания образцов также наблюдается экстремум – начало при 941 K, Тmax = 948 K. Величины энтропии (∆SФП) и энтальпии (∆HФП) фазового перехода равны соответственно 9.95 Дж/(моль K) и 9.43 кДж/моль, что достаточно близко к данным [38] (11.66 Дж/(моль K) и 10.90 кДж/моль).
Если данные по теплоемкости титанатов Bi12TiO20 и Bi4Ti3O12 имеются в литературе, то для Bi2Ti4O11 их нет. Поэтому рассмотрим полученные нами результаты более подробно. Для Bi2Ti4O11 на кривой Cp = f(T) так же, как и для Bi4Ti3O12, наблюдается экстремум (максимум при 509 K, на ДТА-кривой – 503 K). Он соответствует фазовому переходу сегнетоэлектрик–параэлектрик: α‑Bi2Ti4O11 (пр. гр. C2/c) → β-Bi2Ti4O11 (пр. гр. C2/m) [47, 50]. Непрерывное изменение теплоемкости Bi4Ti3O12 в области перехода говорит о переходе второго рода [52–54]. Достаточно выраженная λ-форма пика свидетельствует о влиянии термодинамических флуктуаций на теплоемкость этого титаната висмута в области фазового перехода. Величина скачка Cp в этой области составляет ∆Cp(Tmax) ~ 38 Дж/(моль K), а ширина перехода ~194 K. Наблюдаемое значение ∆T достаточно велико и также свидетельствует о переходе второго рода (для переходов первого рода пик узкий и его ширина, как правило, менее 10 K [54]). Согласно [54], большая ширина пика может быть связана с заторможенной кинетикой перехода. В то же время было предположено, что размытость пика отражает изменение ближнего порядка, которое происходит вблизи температуры фазового перехода. Для Bi2Ti4O11 ∆HФП = 1.98 кДж/моль, а ∆SФП = 3.88 Дж/(моль K). Последняя величина меньше значения Rln2 = 5.76 Дж/(моль K), предсказываемого для перехода порядок–беспорядок [55], что, по-видимому, указывает на механизм сегнетоэлектрического фазового перехода в Bi2Ti4O11 типа смещения или смешанной природы между типом смещения и типом порядок–беспорядок. Можно отметить, что для Bi4Ti3O12 ∆SФП больше значения Rln2.
Полученные данные по теплоемкости Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11 могут быть описаны уравнением Майера–Келли [56]
параметры которого приведены в табл. 3. Расчет теплоемкости по уравнению (2) для Bi2Ti4O11 проводился по базисной линии, которая определялась экстраполяцией теплоемкости из области, лежащей выше фазового перехода (563‒1000 K), в низкотемпературную область, лежащую ниже перехода (333–369 K) подобно [57, 58].
Таблица 3.
Коэффициенты уравнения (2) для Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11
| Соединение | T, K | a | b | c | r |
|---|---|---|---|---|---|
| Bi12TiO20 | 350–1050 | 723.7 ± 1.42 | 181.9 ± 1.40 | 23.70 ± 1.57 | 0.9994 |
| Bi4Ti3O12 | 343–800 | 409.9 ± 1.77 | 105.0 ± 2.10 | 39.20 ± 1.53 | 0.9983 |
| Bi2Ti4O11 | 333–1000 | 370.9 ± 0.63 | 55.10 ± 0.07 | 21.87 ± 0.75 | 0.9988 |
С использованием полученных зависимостей Cp = f(T) для титанатов висмута по известным термодинамическим уравнениям рассчитаны термодинамические функции (изменения энтальпии, энтропии и приведенной энергии Гиббса). Эти результаты приведены в табл. 4.
Таблица 4.
Термодинамические свойства Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11
| T, K | Cp, Дж/(моль К) |
H°(T) – H°(350 K), кДж/моль |
S°(T) – S°(350 K), Дж/(моль К) |
Ф°(Т) – Ф° (350 К), Дж/(моль К) |
|---|---|---|---|---|
| Bi12TiO20 | ||||
| 350 | 768.1 | – | – | – |
| 400 | 781.7 | 38.75 | 103.5 | 6.59 |
| 450 | 805.2 | 118.1 | 280.5 | 44.24 |
| 500 | 815.9 | 158.6 | 357.7 | 69.28 |
| 550 | 826.3 | 199.7 | 429.2 | 96.33 |
| 600 650 700 750 800 850 900 950 1000 |
836.3 846.2 855.9 865.5 875.0 884.5 893.9 903.2 912.5 |
241.3 283.3 325.9 368.9 412.4 456.4 500.9 545.8 591.2 |
495.7 558.1 616.8 672.3 725.1 775.3 823.4 869.5 913.8 |
124.5 153.3 182.3 211.1 239.8 268.2 296.2 323.7 350.6 |
| Bi4Ti3O12 | ||||
| 350 | 414.7 | – | – | – |
| 400 | 427.4 | 21.06 | 56.23 | 3.57 |
| 450 | 446.7 | 64.82 | 153.8 | 24.15 |
| 500 | 454.7 | 87.36 | 196.7 | 37.92 |
| 550 | 462.0 | 110.3 | 236.6 | 52.84 |
| 600 | 468.9 | 133.5 | 273.9 | 68.42 |
| 650 | 475.4 | 157.2 | 308.9 | 84.36 |
| 700 750 800 850 900 950 1000 |
481.7 487.8 493.7 499.6 505.3 511.0 516.6 |
181.1 205.3 229.9 254.7 279.8 305.2 330.9 |
341.9 373.2 402.9 431.3 458.5 484.5 509.6 |
100.4 116.5 132.5 148.3 163.9 179.3 194.4 |
| Bi2Ti4O11 | ||||
| 350 | 372.3 | – | – | – |
| 550 | 397.9 | 96.66 | 207.8 | 46.69 |
| 600 | 401.5 | 116.6 | 239.8 | 60.32 |
| 650 | 405.0 | 136.8 | 269.7 | 74.22 |
| 700 | 408.3 | 157.1 | 297.7 | 88.20 |
| 750 800 850 900 950 1000 |
411.5 414.7 417.8 420.8 423.8 426.7 |
177.6 198.3 219.1 240.1 261.2 282.4 |
324.2 349.2 373.0 395.7 417.3 438.1 |
102.1 115.9 129.6 143.0 156.1 169.1 |
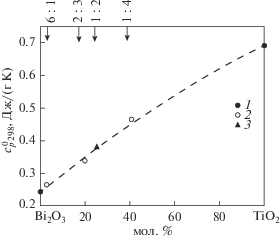
Ранее была установлена корреляция между величиной теплоемкости и составом соединений в системе CdO–V2O5 [59]. Для системы Bi2O3–TiO2 на рис. 4 приведена аналогичная зависимость, которая характеризуется незначительным положительным отклонением от значений, соответсвующих аддитивной прямой. Это позволяет оценить значение $C_{p}^{^\circ }$ при Т = 298 K для Bi2Ti4O11, которое оказалось равным 0.32 Дж/(г K).
Рис. 4.
Зависимость удельной теплоемкости соединений системы Bi2O3–TiO2 от состава: 1 – [60], 2 – эксперимент, 3 – оценка.
ЗАКЛЮЧЕНИЕ
Твердофазным синтезом в интервале температур 1003–1273 K получены поликристаллические образцы титанатов висмута Bi12TiO20, Bi4Ti3O12 и Bi2Ti4O11. Методом ДСК выполнены измерения теплоемкости синтезированных образцов в области температур 330–1050 К. Установлено, что на зависимостях Cp = f(T) при температурах 943 и 509 K имеются экстремумы, обусловленные сегнетоэлектрическими фазовыми переходами в Bi4Ti3O12 и Bi2Ti4O11 соответственно. Для Bi4Ti3O12 величины энтропии (∆SФП) и энтальпии (∆HФП) фазового перехода при температуре 943 K равны соответственно 9.95 Дж/(моль K) и 9.43 кДж/моль, для фазового перехода в Bi2Ti4O11 при 509 K – ∆HФП = 1.98 кДж/моль, а ∆SФП = 3.88 Дж/(моль K). По экспериментальным данным рассчитаны основные термодинамические функции (изменения энтальпии, энтропии и приведенной энергии Гиббса) полученных титанатов висмута. Показано, что увеличение удельной теплоемкости образцов коррелирует с увеличением отношения компонентов Bi2O3 : TiO2 в ряду титанатов висмута.
Список литературы
Сперанская Е.И., Рез И.С., Козлова Л.В. и др. Система окись висмута–двуокись титана // Изв. АН СССР. Неорган. материалы. 1965. Т. 1. № 2. С. 232–235.
Каргин Ю.Ф., Бурков В.И., Марьин А.А., Егорышева А.В. Кристаллы Bi12MxO20 ± δ со структурой силленита. Синтез, строение, свойства. М.: Азбука, 2004. 316 с.
Hector A.L., Wiggin S.B. Synthesis and Structural Study of Stoichiometric Bi2Ti2O7 Pyrochlore // J. Solid State Chem. 2004. V. 177. P. 139–145. https://doi.org/10.1016/S0022-4596(03)00378-5
Harjuija J., Väyrynen S., Putkonen M. et al. Crystallization of Bismuth Titanate and Bismuth Silicate Grown as Thin Films by Atomic Layer Deposition // J. Cryst. Growth. 2006. V. 286. P. 376–383. https://doi.org/10.1016/j.jcrysgro.2005.10.020
Roberto Esquivel-Elizondo J., Hinojosa B.B., Nino J.C. Bi2Ti2O7: it is not what you Have Read // Chem. Mater. 2011. V. 23. № 22. P. 4965–4974. https://doi.org/10.1021/cm202154c
Kahlenberg V., Böhm H. Investigation of the α-β Transition in Bi2Ti4O11 // J. Phys.: Condens. Matter. 1994. V. 6. P. 6221–6228.
Lopez-Martinez J., Romero-Serrano A., Hernandez-Ramirez A. et al. Thermal Analysis and Prediction of Phase Equilibria in the TiO2–Bi2O3 System // Thermochim. Acta. 2011. V. 516. P. 35–39. https://doi.org/10.1016/j.tca.2011.01.008
Каргин Ю.Ф., Ивичева С.Н., Волков В.В. Фазовые взаимоотношения в системе Bi2O3–TiO2 // Журн. неорган. химии. 2015. Т. 60. № 5. С. 691–697. https://doi.org/10.7868/S0044457X15050086
Ивичева С.Н., Каргин Ю.Ф., Куцев С.В., Ашмарин А.А. Синтез титанатов висмута различного состава и упорядоченных Bi–Ti–O нанокомпозитов на основе опаловых матриц // Журн. неорган. химии. 2015. Т. 60. № 11. С. 1439–1451. https://doi.org/10.7868/S0044457X15110082
Mijazawa S., Tabata T. Bi2O3–TiO2 Bynary Phase Diagram Study for TSSG Pulling of Bi12TiO20 Single Crystals // J. Cryst. Growth. 1998. V. 191. P. 512–516.
Skorikov V.M., Katgin Yu.F., Egorysheva A.V. et al. Growth of Sillenite-Structure Single Crystals // Inorg. Mater. 2005. V. 41. Suppl. 1. P. S24–S46.
Shulman H.S., Testorf M., Damjanovic D., Setter N. Microstructure, Electrical Conductivity, and Piezoelectric Properties of Bismuth Titanate // J. Am. Ceram. Soc. 1996. V. 79. № 12. P. 3124–3128.
Long C., Chang Q., Fan H. Differences in Nature of Electrical Conductions among Bi4Ti3O12-based Ferroelectric Polycrystalline Ceramics // Sci. Rep. 2017. P. 1–15. www.nature.com/scientific reports. https://doi.org/10.1038/s41598-017-03266-y
Turner C.G., Esquivel-Elizondo J.R., Nino J.C. Dielectric Properties and Relaxation of Bi2Ti2O7 // J. Am. Ceram. 2014. V. 97. № 6. P. 1763–1768. https://doi.org/10.1111/jace.12803
Краснов А.Г., Шеин И.Р., Пийр И.В. Экспериментальное исследование и ab inito расчет свойств Sc-, In-допированных титанатов висмута со структурой пирохлора // Физика твердого тела. 2017. Т. 59. № 3. С. 483–490.
Hua Z.-Z., Kimura T., Yamaguchi T. Formation of Bi4Ti3O12 from Bi2O3–TiO2 Mixtures // J. Ceram. Soc. Jpn. 1983. V. 91. № 9. P. 420–423.
Тарабанов Г.А. Синтез керамического TiO2 с добавкой Bi2O3 // Неорган. материалы. 1992. Т. 28. № 8. С. 1792–1795.
Brutton T.M. Study of the Liquidus in the System Bi2O3–TiO2 // J. Solid State Chem. 1974. V. 9. № 2. P. 173–175.
Miyazawa S. P-Doping Growth of Photorefractive Bi12TiO20 Crystals // Opt. Mater. 1995. V. 4. P. 192–196.
Efendiev Sh.M. Raman Spectra in Bi12TiO20 Single Crystals // Phys. Status Solidi. 1984. V. 123. P. K105–K108.
Леонов Е.И., Семенов А.Е., Щербаков А.Г. Совместный анализ колебательных спектров кристаллов Bi12SiO20, Bi12GeO20 и Bi12TiO20 // Физика твердого тела. 1986. Т. 28. № 5. С. 1590–1593.
Скориков В.М., Захаров И.С., Волков В.В., Спирин Е.А. Спектральные характеристики пропускания и поглощения монокристаллов Bi12GeO20, Bi12SiO20 и Bi12TiO20 // Неорган. материалы. 2002. Т. 38. № 2. С. 226–232.
Melot B.C., Tackett R., O’Brien J. et al. Large Low-Temperature Specific Heat in Pirochlore Bi12TiO20 // Phys. Rev. B. 2009. V. 79. P. 224111-1–224111-5. https://doi.org/098-0121/2009/79(22)/224111(5)
Subramanian M.A., Aravamudan G., Rao G.V.S. Oxide Pyrochlores – a Review // Prog. Solid State Chem. 1983. V. 15. P. 55–143.
Radosavljevic I., Evans J.S.O., Sleight A.W. Synthesis and Structure of Pyrochlore-Type Bismuth Titanate // J. Solid State Chem. 1998. V. 136. P. 63–66.
Hinojosa B.B., Nino J.C., Asthagiri A. Fist-Principles Study of Cubic Bi Pyrochlores // Phys. Rev. B. 2008. V. 77. P. 104123-1–104123-14. https://doi.org/10.1103/PhysRevB.77.104123
Merka O., Bahnemann D.W., Wark M. Photocatalytic Hydrogen Production with non-Stoichiometric Pyrochlore Bismuth Titanate // Catal. Today. 2014. V. 225. P. 102–110. https://doi.org/10.1016/j.cattod.2013.09.009
Пийр И.В., Королева М.С., Секушин Н.А. и др. Синтез, структура и импеданс-спектры железосодержащих титанатов висмута // Электрохимия. 2013. Т. 49. № 8. С. 909–914. https://doi.org/10.7868/S0424857017080114
Piir I.V., Koroleva M.S., Ryabkov Yu.I. et al. Bismuth Iron Titanate Pyrochlores: Thermostability, Structure, Properties // J. Solid State Chem. 2013. V. 204. P. 245–250. https://doi.org/10.1016/j.jssc.2013.05.031
Королева М.С., Пийр И.В., Рябков Ю.И. и др. Синтез и свойства хромсодержащих титанатов висмута со структурой типа пирохлора // Изв. АН. Сер. хим. 2013. № 2. С. 410–413.
Kunej Š., Škapin S.D., Suvorov D. Phase Relations in the Pyrochlore-Rich Part of the Bi2O3–TiO2–Nd2O3 System // J. Am. Ceram. Soc. 2009. V. 92. № 10. P. 2373–2377. https://doi.org/10.1111/j.1551-2916.2009.03207.x
Kunej Š., Suvorov D. Dielectric Properties of the Bi(1.6 – 0.8x)YxTi2O(6.4 – 0.3x) (0.03 < x < 2) Pyrochlore Solid Solution // J. Am. Ceram. Soc. 2009. V. 92. P. 959–961. https://doi.org/10.1111/j.1551-2916.2009.02995.x
Li F., Liu X., Zhao J. et al. Red-orange Photoluminescence and Dielectric Relation of Eu3+-doped Bi2Ti2O7 Pyrochlore Structure Thin Films // Mater. Chem. Phys. 2015. V. 162. P. 801–806. https://doi.org/10.1016/j.matchemphys.2015.07.006
Mayfield C.L., Huda M.N. Free Energy Landscape Approach to Aid Pure Phase Synthesis of Transition Metal (X = Cr, Mn and Fe) Doped Bismuth Titanate (Bi2Ti2O7) // J. Cryst. Growth. 2016. V. 444. P. 46–54. https://doi.org/0.1016/j.jcrysgro.2016.03.038
Lelievre J., Marchet P. Structure and Properties of Bi2Ti2O7 Pyrochlore Type Phase Stabilized by Lithium // J. Alloys Compd. 2018. V. 732. P. 178–186. https://doi.org/10.1016/j.jallcom.2017.10.128
Pelton A.D., Blander M. Thermodynamic Analysis of Ordered Liquid Solutions by a Modified Quasichemical Approach–Application to Silicate Slags // Metall. Trans. B. 1986. V. 17. P. 805–815.
Suleimenova G.S., Skorikov V.M. Thermochemical Study of Gamma Bismuth Oxide Based Single Crystals // Thermochoim. Acta. 1992. V. 196. P. 203–211.
Suleimenova G.S., Skorikov V.M. Thermochemical Studies of Bi4Ge3O12 and Bi4Ti3O12 Single Crystals // J. Therm. Anal. 1992. V. 38. № 5. P. 1251–1256.
Шаскольская М.П. Кристаллография. М.: Высш. школа, 1984. 376 с.
Solovyov L.A. Full-Profile Refinement by Derivative Difference Minimization // J. Appl. Crystallogr. 2004. V. 37. P. 743–749. https://doi.org/10.1107/S0021889804015638
Третьяков Ю.Д. Твердофазные реакции. М.: Химия, 1978. 360 с.
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Синтез и исследование высокотемпературной теплоемкости Sm2Ge2O7 и Eu2Ge2O7 // Неорган. материалы. 2018. Т. 54. № 2. С. 193–196. https://doi.org/10.7868/S0002337X18020100
Денисов В.М., Денисова Л.Т., Иртюго Л.А., Биронт В.С. Теплофизические свойства монокристаллов Bi4Ge3O12 // Физика твердого тела. 2010. Т. 52. № 7. С. 1274–1277.
Pineda-Flores J.L., Chavira E., Reyes-Gasga J. et al. Synthesis and Dielectric Characteristiecs of the Layered Structure Bi4– xRxTi3O12 (Rx = Pr, Nd, Gd, Dy) // J. Eur. Ceram. Soc. 2003. V. 23. P. 839–850.
Hervoches C.H., Lightfoot P. A Variable-Temperature Powder Neutron Diffraction Study of Ferroelectric Bi4Ti3O12 // Chem. Mater. 1999. V. 11. P. 3359–3364.
Ломанова Н.А., Томкович М.В., Уголков В.Л., Гусаров В.В. Формирование и термические свойства нанокристаллического Bi4Ti3O12 // Журн. прикл. химии. 2017. Т. 90. № 6. С. 673–679.
Акимов А.И., Савчук Г.К. Синтез соединения Bi2Ti4O11 и спекание керамических материалов на его основе // Неорган. материалы. 2004. Т. 40. № 7. С. 820–825.
Kidchob T., Malfatti L., Marongiu D. et al. Sol-Gel Processing of Bi2Ti2O7 and Bi2Ti4O11 Films with Photocatalytic Activity // J. Am. Ceram. Soc. 2010. V. 93. № 9. P. 2897–2902. https://doi.org/10.1111/j.1551-2916.2010.03796.x
Zhang Y., Zhang Y., Fu B. et al. Permittivity of Citrate Sol-Gel Derived Bi2Ti4O11 Dielectric Ceramics // Ceram. Int. 2015. V. 41. P. 10243–10249. https://doi.org/10.1016/j.ceramint.2015.04.137
Kahlenberg V., Böhm H. Investigations of the α-β Transition in Bi2Ti4O11 // J. Phys.: Condens. Matter. 1994. V. 6. P. 6221–6228.
Самсонов Г.В., Борисова А.Л., Жидкова Е.Г. и др. Физико-химические свойства окислов. Справочник. М.: Металлургия, 1978. 472 с.
Вонсовский С.В. Магнетизм. М.: Наука, 1971. 1032 с.
Поташинский А.З., Покровский В.Л. Флуктуационная теория фазовых переходов. М.: Наука, 1982. 382 с.
Гусев А.И. Нестехиометрия, беспорядок, ближний и дальний порядок в твердом теле. М.: Физматлит, 2007. 856 с.
Струков Б.А., Леванюк А.П. Физические основы сегнетоэлектрических явлений в кристаллах. М.: Физматлит, 1995. 305 с.
Maier C.G., Kelley K.K. An Equation for the Representation of High Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243–3246.
Денисов В.М., Денисова Л.Т., Иртюго Л.А. и др. Высокотемпературная теплоемкость BaFe12O19 и BaSc0.5Fe11.5O19 // Физика твердого тела. 2012. Т. 54. № 12. С. 2229–2231.
Буш А.А., Попова Е.А. Теплоемкость сегнетоэлектрических кристаллов системы Pb5(Ge1 – xSix)3O11 // Физика твердого тела. 2004. Т. 46. № 5. С. 875–880.
Денисова Л.Т., Чумилина Л.Г., Белоусова Н.В. и др. Высокотемпературная теплоемкость оксидов системы CdO–V2O5 // Физика твердого тела. 2017. Т. 59. № 12. С. 2490–2494.
Leitner J., Chuchvalec P., Sedmidubcký D. et al. Estimation of Heat Capacities of Solid Mixed Oxides // Thermochim. Acta. 2003. V. 395. P. 27–46.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы