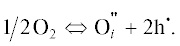Неорганические материалы, 2021, T. 57, № 1, стр. 63-70
Проводимость новых сложных оксидов BaLaIn0.9M0.1O3.95 (M = Mg, Zn) со структурой Раддлесдена–Поппера
Н. А. Тарасова 1, *, А. О. Галишева 1, И. Е. Анимица 1, 2, **
1 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург,
ул. Мира, 19, Россия
2 Институт высокотемпературной электрохимии УрО Российской академии наук
620137 Екатеринбург, ул. С. Ковалевской, 22, Россия
* E-mail: Natalia.Tarasova@urfu.ru
** E-mail: Irina.Animitsa@urfu.ru
Поступила в редакцию 15.07.2020
После доработки 17.08.2020
Принята к публикации 20.08.2020
Аннотация
В работе для фазы BaLaInO4 со структурой Раддлесдена–Поппера проведен анализ влияния акцепторного допирования (Zn2+, Mg2+) в подрешетке индия на транспортные свойства. Установлено, что допирование приводит к росту кислородно-ионной и протонной проводимости. Наибольшими значениями кислородно-ионной и протонной проводимости характеризуется образец BaLaIn0.9Mg0.1O3.95.
ВВЕДЕНИЕ
Одной из главных проблем XXI века является изменение климата и загрязнение воздуха из-за высокого потребления ископаемого топлива [1]. Огромное количество продуктов сгорания углеводородов, включая CO2, попадающих в окружающую среду каждый день, приводит к обострению таких глобальных проблем, как парниковый эффект и истощение озонового слоя [2, 3]. Кроме того, токсичность продуктов сгорания оказывает прямое и сильное влияние на распространенность неинфекционных заболеваний [1]. В то же время, истощение основных ископаемых источников энергии на Земле ожидается в ближайшем будущем [4], поэтому необходим переход на использование источников чистой энергии. Соответственно, разработка высокоэффективных альтернативных источников энергии является актуальной задачей. Одним из возможных путей достижения этой цели является развитие водородных энергетических систем [5–8]. Такие системы включают различные электрохимические устройства, в том числе, протонпроводящие топливные элементы и протон-керамические электролизеры. Использование этих устройств для производства альтернативных источников энергии (водорода), а также в качестве систем преобразования энергии является перспективной технологией, способной сочетать высокую эффективность, гибкость в различных условиях работы и высокую производительность [9, 10].
Протонпроводящие электролиты на основе сложных оксидов способны демонстрировать высокую протонную проводимость в диапазоне температур 300–700°C благодаря высоким значениям как концентрации протонов, так и их подвижности. Наиболее исследованные протонные проводники характеризуются структурой перовскита (например, допированные BaCeO3, BaZrO3, BaCeO3–BaZrO3) [11–13] или производной от нее (например, допированный браунмиллерит Ba2In2O5) [14, 15]. Дальнейшее развитие протонных проводников предполагает исследование материалов с новыми типами структур, включая блочные или слоистые структуры.
Как представитель нового класса кислородно-ионных проводников недавно была описана фаза BaNdInO4 со структурой Раддлесдена-Поппера (РП) [16–18]. В качестве протонных проводников фазы со структурой РП впервые описаны в работах [19–21]. В таких системах степень гидратации может достигать больших значений и определяется размером солевого блока, а не только концентрацией кислородных вакансий. Однако фундаментальные закономерности переноса протонов для этих систем еще не установлены.
В настоящей работе мы продолжили изучение влияния допирования на транспортные свойства соединения BaLaInO4 со структурой РП. Фаза BaLaInO4 состоит из чередующихся слоев [Ba,LaO] и перовскитных блоков [Ba¾La¼InO3] и кристаллизуется в ромбической структуре с пр. гр. Pbca (a = 12.933 (3), b = 5.911 (1), c = 5.905 (1) Å) [22]. Ранее было показано, что акцепторное допирование в подрешетке лантана BaLa0.9M0.1InO3.95 (M = = Ca2+, Sr2+, Ba2+) [20], а также донорное допирование в подрешетке индия BaLaIn0.9M0.1O4.05 (M = = Ti4+, Zr4+) [21] позволяют увеличить протонную проводимость, однако влияние акцепторного допирования подрешетки индия на протонный транспорт не изучалось.
Цель настоящей работы – исследование структуры, процессов гидратации и протонного транспорта, а также влияния допирования на транспортные свойства новых сложных оксидов BaLaIn0.9M0.1O3.95 (M = Mg, Zn).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы BaLaInO4, BaLaIn0.9Mg0.1O3.95 и BaLaIn0.9Zn0.1O3.95 были получены методом твердофазного синтеза из предварительно осушенных BaCO3, La2O3, In2O3, MgO, ZnO. Синтез проводили на воздухе при ступенчатом повышении температуры (800−1300°С) и многократных перетираниях в агатовой ступке в среде этилового спирта. Время отжига составляло 24 ч на каждой стадии.
Рентгенографический анализ был выполнен на дифрактометре Bruker Advance D8 в СuKα-излучении при напряжении на трубке 40 кВ и токе 40 мА. Съемка проводилась в интервале 2θ = = 20°–80° с шагом 0.05° и экспозицией 1 с на точку. Параметры решетки рассчитывали с помощью программы FullProf Suite.
Термический анализ проводили на приборе NETZSCH STA 409 PC в комплекте с квадрупольным масс-спектрометром QMS 403C Aëolos (NETZSCH), позволяющем одновременно выполнять термогравиметрические (ТГ) измерения и анализ отходящих газов (масс-спектрометрия (МС)), в интервале температур 25−1000°С со скоростью нагрева 10°С/мин. Во всех МС-экспериментах одновременно контролировались M/Z = = 18, 32, и 44. Перед измерениями образцы подвергались термической обработке во влажной атмосфере (р(Н2О) = 2 × 10−2 атм) путем медленного охлаждения от 1000 до 200°C со скоростью 1°С/мин с целью получения гидратированных форм.
Электропроводность исследуемых фаз изучалась в атмосферах различной влажности. Влажную атмосферу получали циркуляцией газа при комнатной температуре последовательно через дистиллированную воду и насыщенный раствор бромида калия KBr (p(H2O) = 2 × 10−2 атм). Сухую атмосферу задавали циркуляцией газа через порошкообразный оксид фосфора P2O5 (p(H2O) = = 3.5 × 10−5 атм). Кроме того, для предотвращения возможной карбонизации керамики проводилось предварительное удаление СО2 из воздуха: для влажной атмосферы с помощью 20%-ного раствора NaOH, для сухой – с использованием реактива “Аскарит”. Влажность газов контролировали измерителем влажности газов ИВГ-1 МК-С.
Для измерений электрических свойств образцы в виде таблеток спекали при температуре 1300°С в течение 24 ч. Вжигание платиновых электродов проводили при температуре 900°С в течение 3 ч.
Электропроводность изучали методом электрохимического импеданса в частотном диапазоне 1 Гц–1 МГц с амплитудой сигнала 15 мВ с использованием измерителя параметров импеданса Elins Z-1000P. Все электрохимические измерения были выполнены в условиях равновесия (t, p(H2O), p(O2)). Расчет объемного сопротивления проводили с использованием программного обеспечения Zview software fitting.
Для расчетов подвижности протонов были определены концентрации протонов при заданной температуре с использованием данных термогравиметрии, полученных на термогравиметрическом анализаторе Pyris 1 TGA Perkin-Elmer в режиме охлаждения во влажной атмосфере (р(Н2О) = 2 × 10−2 атм).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
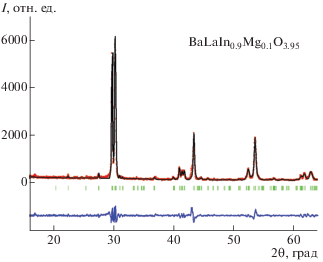
Методом рентгенофазового анализа установлено, что образцы BaLaInO4, BaLaIn0.9Mg0.1O3.95 и BaLaIn0.9Zn0.1O3.95 являются однофазными и характеризуются ромбической симметрией (пр. гр. Pbca). Значения параметров решетки, полученные для BaLaInO4, хорошо согласуются с описанными ранее [22]. Введение магния и цинка в подрешетку индия приводит к уменьшению параметров и объема элементарной ячейки (табл. 1), что обусловлено меньшими ионными радиусами металлов-допантов (${{r}_{{{\text{M}}{{{\text{g}}}^{{2 + }}}}}}$ = 0.72 Å, ${{r}_{{{\text{Z}}{{{\text{n}}}^{{2 + }}}}}}$ = 0.74 Å, ${{r}_{{{\text{I}}{{{\text{n}}}^{{3 + }}}}}}$ = = 0.80 Å [23]) относительно радиуса замещаемого металла. Гидратация как недопированного, так и допированных образцов приводила к изменению их симметрии с ромбической на моноклинную (P2/m). Значения объема элементарной ячейки гидратированных и безводных допированных образцов близки между собой и ниже значения для недопированного образца (табл. 1). В качестве примера обработки полученных в работе рентгенографических данных методом полнопрофильного анализа Ритвельда на рис. 1 приведена рентгенограмма для безводного образца BaLaIn0.9Mg0.1O3.95.
Таблица 1.
Параметры и объем элементарных ячеек
| Образец | a, Å | b, Å | c, Å | β, град | Объем, Å3 |
|---|---|---|---|---|---|
| BaLaInO4 | 12.932(3) | 5.906(1) | 5.894(2) | 90 | 450.195(8) |
| BaLaIn0.9Mg0.1O3.95 | 12.931(4) | 5.890(7) | 5.888(2) | 90 | 448.533(6) |
| BaLaIn0.9Zn0.1O3.95 | 12.928(3) | 5.891(2) | 5.871(3) | 90 | 447.177(0) |
| BaLaInO4 ∙ nH2O | 12.683(6) | 14.708(1) | 7.169(9) | 92.81(9) | 1335(9) |
| BaLaIn0.9Mg0.1O3.95 ∙ nH2O | 12.596(5) | 14.706(8) | 7.165(1) | 92.72(5) | 1325(8) |
| BaLaIn0.9Zn0.1O3.95 ∙ nH2O | 12.586(3) | 14.702(1) | 7.161(9) | 92.61(5) | 1323(8) |
Рис. 1.
Рентгенограмма безводного образца BaLaIn0.9Mg0.1O3.95 (показаны экспериментальные (точки), расчетные (линия), разностные (внизу) данные и угловые положения рефлексов (штрихи)).
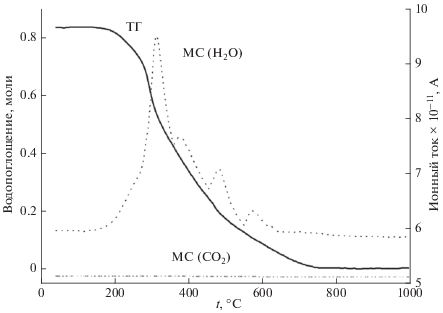
Для определения возможности диссоциативного поглощения воды из газовой фазы для предварительно гидратированных образцов BaLaInO4 ∙ nH2О, BaLaIn0.9Mg0.1O3.95 ∙ nH2О и BaLaIn0.9Zn0.1O3.95 ∙ nH2О были проведены ТГ- и МС-исследования. По убыли массы гидратированных составов была определена степень гидратации. Для удобства сравнения данные приведены в пересчете на число молей воды на формульную единицу сложного оксида. На рис. 2 представлены результаты ТГ и МС для состава BaLaIn0.9Mg0.1O3.95 ∙ nH2О. Основная потеря массы наблюдается в температурном интервале 200−700°С, что, согласно результатам МС-анализа, обусловлено удалением H2O. Выделение других возможных летучих веществ с M/Z = 44 (СО2) и 32 (О2) не обнаружено.
Необходимо отметить, что вид ТГ- и МС-кривых для образцов BaLaInO4 ∙ nH2О и BaLaIn0.9Zn0.1O3.95 ∙ · nH2О был схож с видом данных кривых для BaLaIn0.9Mg0.1O3.95 ∙ nH2О. При этом значения степени гидратации для допированных образцов близки (~0.78 моля для BaLaIn0.9Zn0.1O3.95 и ~0.83 моля для BaLaIn0.9Mg0.1O3.95) и выше, чем значение для недопированного BaLaInO4 (~0.62 моля).
Таким образом, было установлено, что допированные образцы BaLaIn0.9M0.1O3.95 (M = Mg, Zn), как и недопированный BaLaInO4, способны к диссоциативному поглощению воды из газовой фазы и, как следствие, для них может быть реализована протонная проводимость, поэтому исследования электрических свойств проводились в атмосферах с контролируемой влажностью.
На рис. 3 на примере образца BaLaIn0.9Mg0.1O3.95 приведена температурная эволюция годографов импеданса в сухом воздухе. Для всех образцов спектры импеданса представлены полуокружностью, выходящей из начала координат и отвечающей сопротивлению объема зерен образца (Соб ~ 10−11 Ф). Результаты исследования электрических свойств в атмосфере сухого воздуха и сухого аргона (p(H2O) = 3.5 × 10−5 атм) представлены на рис. 4а. Как видно, политермы проводимости допированных образцов аналогичны зависимостям, полученным для BaLaInO4. Для выявления вклада электронной составляющей проводимости были выполнены измерения в атмосфере сухого аргона (т.е. при пониженном значении p(О2), в условиях доминирования кислородно-ионной проводимости). Для образцов BaLaInO4 и BaLaIn0.9Mg0.1O3.95 значения электропроводности, полученные в аргоне (светлые знаки на рис. 4а), были ниже значений, полученных на воздухе (темные знаки рис. 4а), во всем температурном интервале. Повышение электропроводности на воздухе обусловлено наличием электронного вклада проводимости вследствие образования дырочных носителей согласно квазихимическим уравнениям
(1)
$V_{{\text{O}}}^{{\centerdot \centerdot }} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{O}}_{{\text{2}}}^{{}} \Leftrightarrow {\text{O}}_{{\text{O}}}^{ \times } + {\text{2h}}_{{}}^{\centerdot },$Рис. 3.
Эволюция годографов импеданса для образца состава BaLaIn0.9Mg0.1O3.95 в сухой атмосфере при различных температурах.
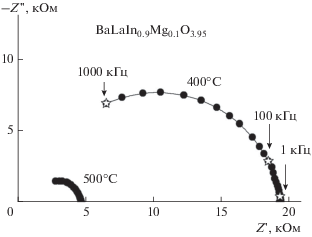
Рис. 4.
Температурные зависимости электропроводности в сухой (а) и влажной (б) атмосферах (темные знаки − воздух, светлые знаки − аргон) для BaLaInO4, BaLaIn0.9Zn0.1O3.95 и BaLaIn0.9Mg0.1O3.95.
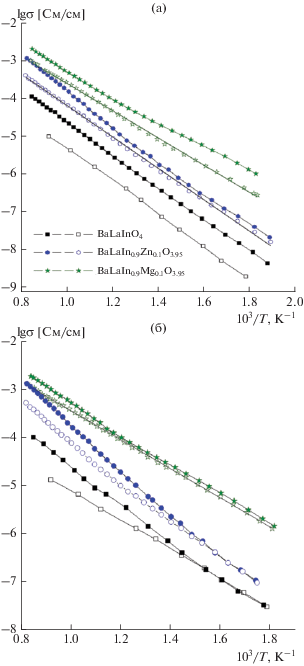
Это позволяет говорить о том, что образцы BaLaInO4 и BaLaIn0.9Mg0.1O3.95 в атмосфере сухого воздуха являются ионно-электронными проводниками. Образец BaLaIn0.9Zn0.1O3.95 при температурах ниже 500°С, напротив, демонстрирует преимущественно кислородно-ионный характер проводимости, так как значения электропроводности, полученные в аргоне и на воздухе, сопоставимы.
Из сравнения проводимостей исследуемых фаз в сухом аргоне (т.е. при доминирующем ионном типе проводимости (рис. 4а)) видно, что кислородно-ионные проводимости допированных фаз выше по сравнению с BaLaInO4, т.е. допирование приводит к росту ионной проводимости вследствие образования в структуре вакансий кислорода:
(3)
${\text{2MO}}\xrightarrow{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}{\text{2M}}_{{{\text{I}}n}}^{'} + 2{\text{O}}_{{\text{O}}}^{ \times } + V_{{\text{O}}}^{{\centerdot \centerdot }}.$Следует отметить значимое увеличение ионной проводимости для Mg-допированного образца, различия по сравнению с BaLaInO4 составили 2 порядка величины.
Для допированных образцов номинальная концентрация вакансий кислорода одинакова, поэтому увеличение электропроводности для BaLaIn0.9Mg0.1O3.95 относительно BaLaIn0.9Zn0.1O3.95 обусловлено, вероятно, влиянием природы металла-допанта на подвижность кислорода. Как известно, подвижность вакансий кислорода во многом зависит от эффектов их взаимодействия с акцептором-допантом, имеющим противоположный знак [24]. Необходимо отметить, что рост кислородно-ионной проводимости сопровождается уменьшением энергии активации, которая составила для Zn- и Mg-допированных образцов 0.83 и 0.72 эВ соответственно.
Измерения, выполненные в атмосфере влажного воздуха и влажного азота (темные и светлые знаки на рис. 4б соответственно), показывают, что для образцов BaLaInO4, BaLaIn0.9Zn0.1O3.95 при температурах ниже 500°С и для BaLaIn0.9Mg0.1O3.95 ниже 700°С проводимости во влажных атмосферах сопоставимы, т.е. не зависят от р(О2). Это свидетельствует о доминирующем ионном характере проводимости и отсутствии дырочного вклада во влажной атмосфере. Такая ситуация типична для протонных проводников на основе сложных оксидов. Как известно, при варьировании р(Н2О) и появлении протонных дефектов меняются концентрации основных дефектов [25, 26]. Так, при увеличении влажности уменьшаются концентрации вакансий кислорода и дырок в соответствии с уравнениями
(4)
${{{\text{H}}}_{{\text{2}}}}{\text{O}} + V_{{\text{O}}}^{ \times } + {\text{O}}_{{\text{O}}}^{ \times } \Leftrightarrow 2{\text{(OH)}}_{{\text{O}}}^{\centerdot },$(5)
${{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{2O}}_{{\text{O}}}^{ \times } + 2{{h}^{\centerdot }} \Leftrightarrow 2{\text{(OH)}}_{{\text{O}}}^{\centerdot } + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{{\text{2}}}}.$Таким образом, полученные данные по проводимости в атмосферах с высокой влажностью свидетельствуют о появлении протонного вклада и хорошо согласуются с многочисленными исследованиями протонных проводников [27].
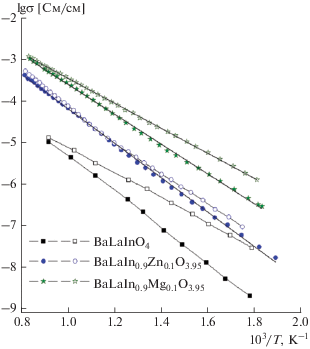
Для анализа природы ионной проводимости во влажной атмосфере проведем сопоставление данных по проводимости в атмосфере аргона с разной влажностью. На рис. 5 представлены температурные зависимости электропроводности, полученные в атмосфере сухого (темные знаки) и влажного (светлые знаки) аргона (ионная проводимость). Как видно, в области средних и низких температур значения электропроводности во влажной атмосфере выше, чем в сухой, что позволяет говорить о появлении протонного переноса в данных образцах. Поскольку для исследуемых систем может реализоваться не только вакансионное, но и межузельное разупорядочение, инкорпорирование воды из газовой фазы может происходить как в соответствии с квазихимической реакцией (4), так и в соответствии с уравнением
(6)
${\text{O}}_{{\text{O}}}^{ \times } + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \Leftrightarrow {\text{(OH)}}_{{\text{O}}}^{\centerdot } + {\text{(OH)}}_{i}^{'}.$Рис. 5.
Температурные зависимости электропроводности в атмосфере аргона (темные знаки − сухой аргон, светлые знаки − влажный аргон) для BaLaInO4, BaLaIn0.9Zn0.1O3.95 и BaLaIn0.9Mg0.1O3.95.
Поскольку во влажном аргоне ионная электропроводность исследуемых фаз определяется суммой кислородно-ионной и протонной составляющих проводимости
(7)
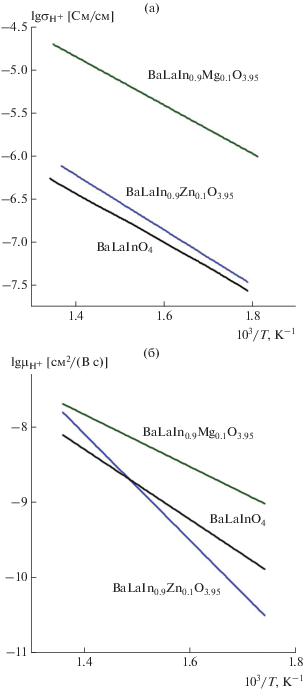
${{({{\sigma }_{{{\text{ион}}}}})}^{{{\text{вл}}}}} = {{\sigma }_{{{{{\text{О}}}^{{{\text{2}} - }}}}}} + {{\sigma }_{{{{{\text{H}}}^{ + }}}}},$то оценить величину протонной проводимости ${{\sigma }_{{{\text{H}}_{{}}^{ + }}}}$ можно как разность значений электропроводности в атмосферах влажного и сухого аргона (в предположении постоянства кислородно-ионной проводимости). Такие расчеты приводят к занижению величины протонной проводимости в пределах 10% [28], но позволяют выявить основные закономерности и провести сравнение исследуемых фаз. Температурные зависимости ${{\sigma }_{{{\text{H}}_{{}}^{ + }}}}$ представлены на рис. 6 а. Как видно, допирование приводит к значимому росту значений протонной проводимости (вплоть до ~1.5 порядка величины для BaLaIn0.9Mg0.1O3.95 посравнению с BaLaInO4).
Как известно, величина электропроводности определяется соотношением концентрации проводящих частиц и их подвижности
(8)
${{\sigma }_{{{{{\text{H}}}^{ + }}}}} = Ze{{C}_{{{\text{H}}_{{}}^{ + }}}}{{\mu }_{{{\text{H}}_{{}}^{ + }}}},$Поскольку значения степени гидратации для недопированного и допированных образцов различаются не столь значительно (в среднем на ~0.2 моля), т.е. концентрации протонов в структуре гидратированных образцов близки, можно говорить о том, что величина протонной проводимости определяется в большей степени величиной протонной подвижности, что подтверждает анализ температурных зависимостей подвижности протонов (рис. 6 б). Как видно, наибольшие значения протонной проводимости и подвижности протонов реализуются у образца BaLaIn0.9Mg0.1O3.95. Как известно, основным фактором, определяющим подвижность протонов, является динамика кислородной подрешетки, поскольку перескок протона происходит на фоне колебаний системы атомов кислорода [29]. Вероятно, для Mg-допированного образца, для которого также установлено наибольшее значение кислородно-ионной проводимости, этот фактор является основным. Однако существуют и другие причины, влияющие на подвижность протонов. В частности, нельзя игнорировать возможные эффекты взаимодействия протонных дефектов с акцепторной примесью [30]. Можно предполагать, что для образца BaLaIn0.9Zn0.1O3.95 уменьшение подвижности протонов может быть обусловлено взаимодействием между дефектами и образованием кластеров
(10)
${\text{Zn}}_{{{\text{In}}}}^{'} + {\text{(OH)}}_{{\text{O}}}^{\centerdot } \to {{({\text{Zn}}_{{{\text{In}}}}^{'} \cdot {\text{(OH)}}_{{\text{O}}}^{\centerdot })}^{ \times }}.$Вероятно, в случае допирования магнием концентрация аналогичных дефектов меньше, что обуславливает высокие значения протонной проводимости и подвижности для образца BaLaIn0.9Mg0.1O3.95. Иными словами, акцепторный дефект ${\text{Zn}}_{{{\text{In}}}}^{'}$ является сильной ловушкой для протонов по сравнению с ${\text{Mg}}_{{{\text{In}}}}^{'}.$ Подтверждением этого предположения являются бóльшие энергии активации проводимости образца BaLaIn0.9Zn0.1O3.95 – 0.7 эВ (атмосфера влажного аргона) по сравнению с BaLaIn0.9Mg0.1O3.95 – 0.6 эВ.
ЗАКЛЮЧЕНИЕ
Методом твердофазного синтеза получены сложные оксиды BaLaInO4, BaLaIn0.9Mg0.1O3.95 и BaLaIn0.9Zn0.1O3.95 со структурой Р-П, рентгенографически подтверждена их однофазность. Установлено, что образцы способны к диссоциативному поглощению воды из газовой фазы и проявлению протонного переноса. Акцепторное допирование подрешетки индия приводит к росту кислородно-ионной и протонной проводимости. Наибольшими значениями кислородно-ионной и протонной проводимости характеризуется образец BaLaIn0.9Mg0.1O3.95.
Список литературы
Campbell-Lendrum D., Prüss-Ustün A. Climate Change, Air Pollution and Noncommunicable Diseases // Bull. W. H. O. 2019. V. 97. P. 160−161. https://doi.org/10.2471/BLT.18.224295
Akadiri S.S., Alola A.A., Olasehinde-William G., Etokakpan M.U. The Role of Electricity Consumption, Globalization and Economic Growth in Carbon Dioxide Emissions and Its Implications for Environmental Sustainability Targets // Sci. Total Environ. 2020. V. 708. 134653. https://doi.org/10.1016/j.scitotenv.2019.134653
Davis S.J., Caldeira K., Matthew H.D. Future CO2 Emissions and Climate Change from Existing Energy Infrastructure // Science. 2010. V. 329. P. 1330−1333. https://doi.org/10.1126/science.1188566
Höök M., Tang X. Depletion of Fossil Fuels and Anthropogenic Climate Change − A Review // Energy Policy. 2013. V. 52. P. 797−809. https://doi.org/10.1016/j.enpol.2012.10.046
Veziroğlu T.N., Şahin S. 21st Century’s Energy: Hydrogen Energy System // Energy Convers. Manage. 2008. V. 49. P. 1820–1831. https://doi.org/10.1016/j.enconman.2007.08.015
Balat M. Potential Importance of Hydrogen as a Future Solution to Environmental and Transportation Problems // Int. J. Hydrogen Energy. 2008. V. 33. P. 4013−4029. https://doi.org/10.1016/j.ijhydene.2008.05.047
Momirlan M., Veziroğl T.N. The Properties of Hydrogen as Fuel Tomorrow in Sustainable Energy System for a Cleaner planet // Int. J. Hydrogen Energy. 2005. V. 30. P. 795−802. https://doi.org/10.1016/j.ijhydene.2004.10.011
Guangyao M., Wany L., Dingkun P. New Solid State Fuel Cells – Green Power Source for 21st Century // Ionics. 1998. V. 4. P. 451−462. https://doi.org/10.1007/BF02375890
Fabbri E., Bi L., Pergolesi D., Traversa E. Towards the Next Generation of Solid Oxide Fuel Cells Operating below 600°C with Chemically Stable Proton-conducting Electrolytes // Adv. Mater. 2002. V. 24. P. 195−208. https://doi.org/10.1002/adma.201103102
Medvedev D. Trends in Research and Development of Protonic Ceramic Electrolysis Cells // Int. J. Hydrogen Energy. 2019. V. 44. 27711. https://doi.org/10.1016/j.ijhydene.2019.08.130
Dai H., Kou H., Wang H., Bi. L. Electrochemical Performance of Protonic Ceramic Fuel Cells with Stable BaZrO3-Based Electrolyte: A Mini-Review // Electrochem. Commun. 2018. V. 96. P. 11−15. https://doi.org/10.1016/j.elecom.2018.09.001
Loureiro F.J.A., Nasani N., Reddy G.S., Munirathnam N.R., Fagg D.P. A Review on Sintering Technology of Proton Conducting BaCeO3–BaZrO3 Perovskite Oxide Materials for Protonic Ceramic Fuel Cells // J. Power Sources. 2019. V. 438. 226991. https://doi.org/10.1016/j.jpowsour.2019.226991
Choi S.M., An H., Yoon K.J., Kim B., Lee H.W., Son J.W. Electrochemical Analysis of High-performance Protonic Ceramic Fuel Cells Based on a Columnar-Structured Thin Electrolyte // Appl. Energy. 2019. V. 233–234. P. 29−36. https://doi.org/10.1016/j.apenergy.2018.10.043
Hideshima N., Hashizume K. Effect of Partial Substitution of In by Zr, Ti and Hf on Protonic Conductivity of BaInO2.5 // Solid State Ionics. 2010. V. 181. P.1659−1664. https://doi.org/10.1016/j.ssi.2010.09.029
Tarasova N., Animitsa I. The Influence of Anionic Heterovalent Doping on Transport Properties and Chemical Stability of F-, Cl-doped Brownmillerite Ba2In2O5 // J. Alloys Compd. 2018. V. 739. P. 353−359. https://doi.org/10.1016/j.jallcom.2017.12.317
Fujii K., Shiraiwa M., Esaki Y., Yashima M., Kim S.J., Lee S. Improved Oxide-Ion Conductivity of NdBaInO4 by Sr Doping // J. Mater. Chem. A. 2015. V. 3. 11985. https://doi.org/10.1039/C5TA01336D
Yang X., Liu S., Lu F., Xu J., Kuang X. Acceptor Doping and Oxygen Vacancy Migration in Layered Perovskite NdBaInO4-based Mixed Conductors // J. Phys. Chem. C. 2016. V. 120. P. 6416–6426. https://doi.org/10.1021/acs.jpcc.6b01530
Shiraiwa M., Fujii K., Esaki Y., Kim S.J., Lee S., Yashima M. Crystal Structure and Oxide-Ion Conductivity of Ba1 + xNd1 − xInO4 − x/2 // J. Electrochem. Soc. 2017. V. 164. P. F1392–F1399. https://doi.org/10.1149/2.0411713jes
Tarasova N., Animitsa I. Protonic Transport in Oxyfluorides Ba2InO3F and Ba3In2O5F2 with Ruddlesden-Popper Structure // Solid State Ionics. 2015. V. 275. P. 53−57. https://doi.org/10.1016/j.ssi.2015.03.025
Tarasova N., Animitsa I., Galisheva A., Korona D. Incorporation and Conduction of Protons in Ca, Sr, Ba-Doped BaLaInO4 with Ruddlesden-Popper Structure // Materials. 2019. V. 12. 1668. https://doi.org/10.3390/ma12101668
Tarasova N., Animitsa I., Galisheva A., Pryakhina V. Protonic Transport in the New Phases BaLaIn0.9M0.1O4.05 (M = Ti, Zr) with Ruddlesden-Popper Structure // Solid State Sci. 2020. V. 101. 106121. https://doi.org/10.1016/j.solidstatesciences.2020.106121
Titov Yu.A., Belyavina N.M., Markiv V.Ya. Synthesis and Crystal Structure of BaLaInO4 and SrLnInO4 (Ln−La, Pr) // Rep. Nat. Acad. Sci. Ukr. 2009. V. 10. P. 160−166.
Shannon R.D. Ionic Radii // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751–767. https://doi.org/10.1107/S0567739476001551
Kharton V.V., Marques F.M.B., Atkinson A. Transport Properties of Solid Oxide Electrolyte Ceramics: A Brief Review // Solid State Ionics. 2004. V. 174. P. 135−149. https://doi.org/10.1016/j.ssi.2004.06.015
Grimaud A., Bassat J.M., Mauvy F., Simon P., Canizares A., Rousseau B., Marrony M., Grenier J.C. Transport Properties and in-situ Raman Spectroscopy Study of BaCe0.9Y0.1O3−δ as a Function of Water Partial Pressures // Solid State Ionics. 2011. V. 191. P. 24–31. https://doi.org/10.1016/j.ssi.2011.03.020
Poetzsch D., Merkle R., Maier J. Proton Conductivity in Mixed-Conducting BSFZ Perovskite from Thermogravimetric Relaxation // Phys. Chem. Chem. Phys. 2014. V. 16. 16446. https://doi.org/10.1039/C4CP00459K
Kochetova N., Animitsa I., Medvedev D., Demin A., Tsiakaras P. Recent Activity in the Development of Proton-Conducting Oxides for High-Temperature Applications // RSC Adv. 2014. V. 6. P. 73222–73268. https://doi.org/10.1039/c6ra13347a
Кочетова Н.А., Анимица И.Е., Нейман А.Я. Электрические свойства твердых растворов на основе танталата стронция с перовскитоподобной структурой. Протонная проводимость // Электрохимия. 2010. Т. 46. С. 177–182. https://doi.org/10.1134/S1023193510020072
Kreuer K.D. Proton-Conducting Oxides // Ann. Rev. Mater. Res. 2003. V. 33. P. 333–359. https://doi.org/10.1146/annurev.matsci.33.022802.091825
Haugsrud R. High Temperature Proton Conductors – Fundamentals and Functionalities // Diffus. Found. 2016. V. 8. P. 31–79. https://doi.org/10.4028/www.scientific.net/DF.8.31
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы