Неорганические материалы, 2021, T. 57, № 10, стр. 1063-1072
Синтез и термоокислительная устойчивость наноразмерного диборида ниобия
С. Е. Кравченко 1, Д. Ю. Ковалев 2, А. А. Винокуров 1, Н. Н. Дремова 1, А. В. Иванов 1, С. П. Шилкин 1, *
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. академика Семенова, 1, Россия
2 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова
Российской академии наук
142432 Московская обл., Черноголовка, ул. академика Осипьяна, 8, Россия
* E-mail: ssp@icp.ac.ru
Поступила в редакцию 16.04.2021
После доработки 28.05.2021
Принята к публикации 03.06.2021
Аннотация
Разработан метод синтеза нанокристаллического порошка NbB2 со средним размером частиц 65 нм. Материал получен в ионных расплавах Na2B4O7, КСl и KBr при взаимодействии предварительно обработанных водородом и активированных в высокоэнергетической планетарной мельнице в течение 40 мин порошков Nb и аморфного В в соотношении 1 : 2. Синтез проводили в течение 32 ч при 800°С в среде аргона при давлении 4 МПа. Показано, что независимо от состава и природы расплава происходит образование наночастиц диборида ниобия, кристаллизующихся в гексагональной сингонии, пр. гр. P6/mmm. Параметры элементарной ячейки NbB2 составили: a = 0.3100–0.3108 нм, c = = 0.3278–0.3298 нм. Методами термического анализа, рентгенографии, сканирующей электронной микроскопии, рентгеновского энергодисперсионного анализа, рентгеновской фотоэлектронной спектроскопии, ИК-спектроскопии неполного внутреннего отражения и элементного анализа исследованы продукты окисления наночастиц NbB2 кислородом воздуха в политермическом (до 1000°С) режиме и в изотермических условиях при 400, 450, 500, 550 и 600°С. При этих температурах определены константы скорости окисления наночастиц NbB2 – 0.0013, 0.045, 0.47, 2.61, 8.83 ч–1 соответственно. Начало окисления зафиксировано при 310°С. Оцененная из температурной зависимости констант скоростей эффективная энергия активации реакции окисления наночастиц NbB2 составила 220 ± 8 кДж/моль.
ВВЕДЕНИЕ
Диборид ниобия NbB2 обладает высокой температурой плавления, термодинамической стабильностью, высокими значениями твердости, прочности, износоустойчивости, тепло- и электропроводности, химической и коррозионной инертностью, в силу чего находит применение в различных областях промышленности [1–4]. Интерес к боридам металлов IV–VI групп заметно возрос в связи с созданием на их основе материалов с наноразмерной структурой, физико-химические и механические свойства которых существенно отличаются от таковых для микрокристаллических аналогов [5].
Для синтеза наночастиц металлов V группы обычно используют методики, разработанные для получения диборидов переходных металлов IV группы: высокотемпературный твердофазный синтез из элементов, боротермическое восстановление различных оксидов и солей металлов, карботермическое восстановление оксидов металлов и бора или восстановление оксидов металлов и бора магнием, механохимический синтез, химическое осаждение из паровой фазы (CVD), термолиз соответствующих боргидридов металлов или их комплексных производных, взаимодействие хлоридов переходных металлов с боргидридами щелочных металлов без стадии выделения боргидридных производных переходных металлов при повышенных температурах и давлениях [6–18].
Высокотемпературное твердофазное взаимодействие порошков ниобия и аморфного бора позволяет получать NbB2 с высокой скоростью [6]. Однако в работе [6] не приводятся данные о чистоте и размере частиц полученного диборида ниобия. В [7, 8] установлено, что при взаимодействии оксидов ниобия с бором при повышенных температурах в инертной атмосфере образуются наноразмерные частицы NbB2. Так, при 1300°C в атмосфере аргона NbO2 реагирует с бором с образованием агломерированных наностержней NbB2 диаметром 40 и длиной 800 нм. Ультрадисперсные частицы диборида ниобия (~50 нм) могут быть получены при 1650°C карботермическим восстановлением оксидов ниобия углеродом [9]. В [10] получены наностержни NbB2 диаметром 50–60 и длиной до 600 нм при взаимодействии NbCl5 с NaBH4 в автоклаве в атмосфере аргона при температуре 550–650°C по реакции
(1)
$\begin{gathered} 2{\text{NbC}}{{{\text{l}}}_{5}}~ + {\text{ }}4{\text{NaB}}{{{\text{H}}}_{4}}~ \to 2{\text{Nb}}{{{\text{B}}}_{2}} + \\ + \,\,6{\text{HCl}} + 4{\text{NaCl}} + 5{{{\text{H}}}_{2}}. \\ \end{gathered} $Наноразмерный диборид ниобия с размером частиц ~30 нм был получен при температуре 650°C взаимодействием Mg, Nb2O5 и H3BO3 в расплаве смеси безводных солей NaCl и MgCl2 [11]. Нанокристаллический диборид ниобия образуется при взаимодействии NbCl5 с порошками бора и олова при температуре 700°C в атмосфере азота [12]. Наночастицы NbB2 могут быть получены в интервале температур 500–900°C взаимодействием NbCl5 с избытком NaBH4 в атмосфере аргона в эвтектической смеси LiCl + KCl [13]. Порошок NbB2 с размером частиц ~100 нм получали [14] при 800°C по реакции
(2)
$3{\text{Mg}} + {{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {\text{Nb}} \to 3{\text{MgO}} + {\text{Nb}}{{{\text{B}}}_{2}}.$Предварительно смесь порошков магния и ниобия с оксидом бора активировали механохимическим способом. Для выделения чистого NbB2 полученный в реакции (2) продукт, содержащий оксид магния и диборид ниобия, последовательно обрабатывали соляной кислотой, водой и этиловым спиртом [14]. Достаточно крупнозернистый порошок NbB2 с размером частиц ~200 нм может быть получен магнийтермическим восстановлением смеси оксидов ниобия и бора [15].
Диборид ниобия получали также осаждением из газовой фазы, содержащей NbCl5, BCl3 и H2, на кварцевую подложку в виде гомогенной пленки при 950–1050°C и кристаллов при 1050–1200°C [16]. По данным просвечивающей электронной микроскопии наноразмерный NbB2 с размером частиц ~37.8 нм получен при взаимодействии Nb2O5 c порошком Mg и Na2B4O7 ⋅ 10H2O в автоклаве при 800°C [17].
Каждая из перечисленных методик имеет свои преимущества и недостатки. Одни из них обеспечивают высокую производительность, другие позволяют получать наночастицы диборида ниобия стехиометрического состава, высокой чистоты или определенного размера при невысоких температурах, но требуют сложного аппаратурного оформления.
В качестве альтернативного способа получения наночастиц NbB2 в настоящей работе рассматривается т.н. “бестоковый” метод [19]. В его основу положено явление “бестокового” переноса бора на металл в ионных расплавах различного химического состава и строения, например безводного тетраборнокислого натрия, хлорида или бромида калия. Это явление было успешно использовано ранее при разработке методик синтеза наночастиц VB2 и TiB2 [20, 21]. Кроме того, применение ионных расплавов в качестве реакционной среды при синтезе наночастиц боридов металлов IV–VI групп, в силу особенностей их строения и свойств, создает условия для получения боридов металлов в виде наноразмерных порошков. Настоящая работа является непосредственным продолжением [22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные реагенты. Порошок ниобия с размером частиц 10–15 мкм получали следующим образом: товарный порошок ниобия c размером частиц ~45 мкм нагревали при 900°C в вакууме 0.13 Па, а затем подвергали 5 циклам гидрирование–дегидрирование по методике [23]. Остаточное содержание водорода в порошке не превышало 1.0 × 10–3 мас. %, кислорода – 3.0 × 10–3 мас. %. Источником водорода с чистотой не менее 99.999% служил автономный лабораторный генератор водорода [23, 24], содержащий в качестве рабочего материала гидридные фазы на основе интерметаллидов TiFe и LaNi5. В работе использовали хлориды и бромиды калия квалификации “х. ч.”, аргон высокой чистоты – 99.998% (ТУ 2114-005-0024760-99). Товарный аморфный бор марки Б 99А (ТУ 1-92-154-90) с размером частиц 10–20 мкм, хлорид и бромид калия непосредственно перед синтезом вакуумировали до остаточного давления 0.13 Па при температуре 300°C. Безводный тетраборнокислый натрий получали вакуумированием товарного Na2B4O7 ⋅ 5H2O квалификации “х. ч.” в вакууме 0.13 Па при температуре 350°C.
Методы анализа. Рентгенофазовый анализ (РФА) синтезированного порошка проводили на дифрактометре PANalytical AERIS и на дифрактометре ДРОН-3 с монохроматором на вторичном пучке. Регистрацию рентгенограмм вели в режиме пошагового сканирования на излучении CuKα в интервале углов 2θ 20°–110° с шагом съемки 0.02° и экспозицией 4 с в точке. Профильный анализ дифрактограмм осуществляли в программном пакете “Буревестник”. Расчет метрики ячейки и параметров тонкой структуры проводили по 12 рефлексам. Инструментальное уширение учитывали по уширению линий эталона – LaB6 (SRM 660b). Для расчета размера кристаллитов – областей когерентного рассеяния (ОКР) – использовали метод вторых моментов. Термодинамические расчеты состояния системы Nb–B–O проводили в программе АСТРА 4 [25, 26].
Термические исследования выполняли методом синхронного термического анализа с масс-спектрометрическим анализом продуктов разложения на термоанализаторе Netzch STA 409 PC Luxx и масс-спектрометре QVS 403 C Aeolos при линейном нагреве навески образца со скоростью 10°С/мин в потоке аргона высокой чистоты или воздуха в интервале температур от 20 до 1000°С. Контроль состава воздуха осуществляли масс-спектрометром МИ-1201В.
Электронно-микроскопические исследования и энергодисперсионный анализ (ЭДА) осуществляли на комплексе приборов, состоящем из сканирующего автоэмиссионного электронного микроскопа Zeiss Supra 25 и рентгеноспектральной установки INCA Х-sight. Электронно-микроскопические изображения получали при низких ускоряющих напряжениях электронного пучка (~4 кВ). При таких ускоряющих напряжениях вклад в регистрируемый сигнал от подложки минимален либо отсутствует вовсе. ЭДА проводили при ускоряющем напряжении ~8 кВ.
ИК-спектры неполного внутреннего отражения (НПВО) в диапазоне от 500 до 4000 см–1 получены с использованием Фурье-спектрометра Perkin Elmer Spectrum 100 и спектрометра Vertex 70V, оборудованных приставками для съемки спектров отражения.
Рентгеновские фотоэлектронные спектры (РФЭС) регистрировали на спектрометре фирмы Specs с анализатором. Спектры возбуждали излучением MgKα (hν = 1253.6 эВ). При съемке спектров вакуум в камере спектрометра составлял 4 × × 10–7 Па. Мощность источника – 225 Вт.
Удельную поверхность образцов (Sуд) находили при температуре жидкого азота с использованием анализатора Quadrasorb SI. Из данных измерения Sуд проводили оценку диаметра частиц NbB2 в предположении их сферической формы по известной формуле dx = 6(γSуд), где dx – размер частиц, γ – рентгеновская плотность NbB2, равная 6.93 г/см3.
Содержание водорода и кислорода определяли на CHNS/O – элементном анализаторе Vario Micro cube, содержание хлорид- и бромид-ионов, бора и ниобия – по стандартным аналитическим методикам, а также методом ЭДА.
Методика эксперимента. Порошок Nb и аморфный В в мольном отношении 1 : 2 смешивали в планетарной мельнице Pulverisette 6 (шары из ZrO2 диаметром 10 мм, шаровая загрузка 1 : 10, скорость вращения 400 об./мин, время обработки 40 мин) в атмосфере аргона при комнатной температуре.
Полученную смесь порошков Nb (9.21 г) и B (2.16 г) вместе с Na2B4O7, KCl или KBr (по 14.0 г) загружали в кварцевую ампулу, которую помещали в реактор–автоклав из нержавеющей стали. Реактор вакуумировали до остаточного давления 0.13 Па, далее заполняли аргоном под давлением 4 МПа. Изотермический отжиг проводили при 800°C в течение 32 ч. Температуру синтеза выбирали исходя из температур плавления KCl (776°C), KBr (734°C) и Na2B4O7 (742°C). Полученный спек после охлаждения измельчали и последовательно обрабатывали дистиллированной водой, этиловым спиртом, ацетоном и вакуумировали до остаточного давления 0.13 Па при температуре 50°C. Далее полученный порошок помещали в реактор, вакуумировали, а затем обрабатывали водородом в проточном режиме под давлением 5 МПа при температуре 100°C в течение 4 ч. Выгрузку порошка после охлаждения реактора проводи в атмосфере аргона.
Окисление наночастиц NbB2 кислородом воздуха в изотермическом режиме при температурах 400, 450, 500, 550, 600 и 700°С проводили в трубчатом кварцевом реакторе диаметром 20 и длиной 300 мм (зона нагрева 150 мм), нагреваемом стандартной разъемной лабораторной электропечью. Образцы помещали в лодочку из платиновой фольги. Температуру в реакторе поддерживали с помощью терморегулятора ПТ200 с точностью ±2°С, датчиком служила хромель-алюмелевая термопара. Максимальное время выдержки образцов при заданных температурах составляло 6 ч. Скорость потока воздуха через реактор – 30 мл/мин. Степень превращения α – реальное увеличение массы образца NbB2 за данный период времени, отнесенное к максимально возможному, расcчитаному исходя из реакции окисления NbB2:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
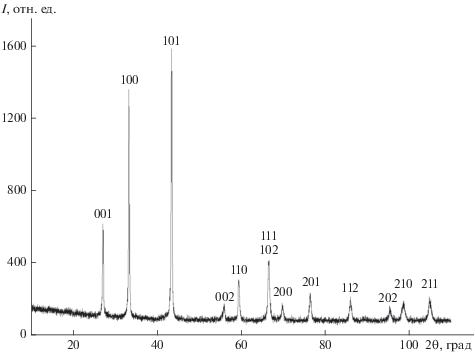
В табл. 1 представлены результаты исследования химического и фазового состава материала, полученного в ионных расплавах Na2B4O7, КСl и KBr. По данным химического анализa и ЭДА, синтезированный продукт независимо от используемого ионного расплава имеет состав NbB1.97–2.02O0.01–0.03. Типичная дифрактограмма порошка (рис. 1) показывает, что продукт синтеза является однофазным и содержит кристаллическую фазу NbB2 (гексагональная сингония, пр. гр. P6/mmm). Значимого количества примесных фаз не обнаружено. Параметры элементарной ячейки NbB2 (табл. 1) согласуются с литературными данными [27] и соответствуют дифракционной базе данных ICDD (PDF–2, card 000-35-0742).
Таблица 1.
Состав и параметры ячейки NbB2, полученного в ионных расплавах Na2B4O7, КСl и KBr
| Ионный расплав | Химический состав продукта* |
a, нм | с, нм |
|---|---|---|---|
| Na2B4O7 | NbB1.97 O0.02 | 0.3100 | 0.3278 |
| КСl | NbB2.01O0.01 | 0.3104 | 0.3295 |
| KBr | NbB2.02O0.03 | 0.3108 | 0.3298 |
* По данным РФЭС кислород находится в поверхностных слоях наночастиц NbB2 в виде оксидов ниобия (V) и бора [22].
По данным сканирующей электронной микроскопии (СЭМ), наночастицы NbB2, полученные в ионных расплавах, имеют различную форму, в основном сферическую. Средний размер частиц составил 64–67 нм (рис. 2, табл. 2). Частицы агломерированы.
Таблица 2.
Средний размер частиц NbB2, полученных в ионных расплавах Na2B4O7, КСl и KBr
| Ионный расплав | Средний размер частиц, нм (СЭМ) | Размер ОКР, нм | Средний размер частиц по данным Sуд, нм |
|---|---|---|---|
| Na2B4O7 | 65 | 60 | 67 (Sуд = 13.0 м2/г) |
| КСl | 64 | 59 | 67 (Sуд = 13.0 м2/г) |
| KBr | 67 | 57 | 62 (Sуд = 14.0 м2/г) |
В табл. 2 сопоставлены средний размер частиц NbB2, оцененный по данным СЭМ, профильного анализа дифрактограмм и измерения удельной поверхности. Результаты, полученные разными методами, показывают, что независимо от природы ионного расплава средний размер частиц NbB2 составляет 65 нм (табл. 2). В атмосфере аргона в температурном интервале 20–1000°С NbB2 не испытывает превращений, связанных с выделением, поглощением тепла или изменениями массы.
Наблюдаемое явление переноса B на Nb в ионных расплавах Na2B4O7, KCl или KBr, согласно [19–21], можно объяснить образованием ионов низшей валентности B2+ по реакции
(4)
${\text{B}} + 2{\text{B}}_{{{\text{расплав}}}}^{{3 + }} \to 3{\text{B}}_{{{\text{расплав}}}}^{{2 + }}$и затем их взаимодействием с ниобием с образованием NbB2 по реакции:
(5)
$3{\text{B}}_{{{\text{расплав}}}}^{{2 + }}~ + {\text{Nb}} \to B_{{{\text{расплав}}}}^{{3 + }} + {\text{Nb}}{{{\text{B}}}_{2}}.$Окисление наночастиц NbB2. Для изучения реакции окисления наночастиц NbB2 были проведены термодинамические расчеты состояния системы с исходным мольным составом Nb : B : O = = 1 : 2 : 5.5 (реакция (3)) в температурном интервале 300–1000°С и атмосферном давлении. Для расчета использовали термодинамические данные NbB2 [28]. Согласно расчетам, практически единственными равновесными продуктами в конденсированной фазе являются B2O3 и Nb2O5. Равновесные концентрации низших оксидов бора и ниобия пренебрежимо малы.
На рис. 3 приведены результаты термического анализа реакции окисления наночастиц NbB2 в политермическом режиме в диапазоне 20–1000°С. Температура начала окисления наночастиц NbB2 составила 310°С. За температуру начала окисления NbB2 была принята температура, при которой масса образца увеличивалась на 0.1 мас. %. На кривой ДТА наблюдается экзотермический эффект при 574°С, связанный с образованием Nb2O5 и B2О3 по реакции (3). По данным РФА, в продуктах окисления NbB2 обнаружен только оксид ниобия Nb2O5 (рис. 4ж).
Рис. 3.
Результаты термического анализа окисления наночастиц NbB2, полученных в ионном расплаве KBr.
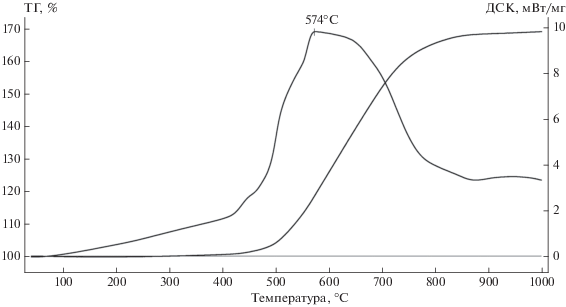
Рис. 4.
Дифрактограммы продуктов окисления в потоке воздуха наночастиц NbB2, полученных в ионном расплаве KBr, в изотермическом режиме при температурах 400 (а), 450 (б), 500 (в), 550 (г), 600 (д), 700°С (е) и в политермическом режиме после нагрева до 1000°С (ж).
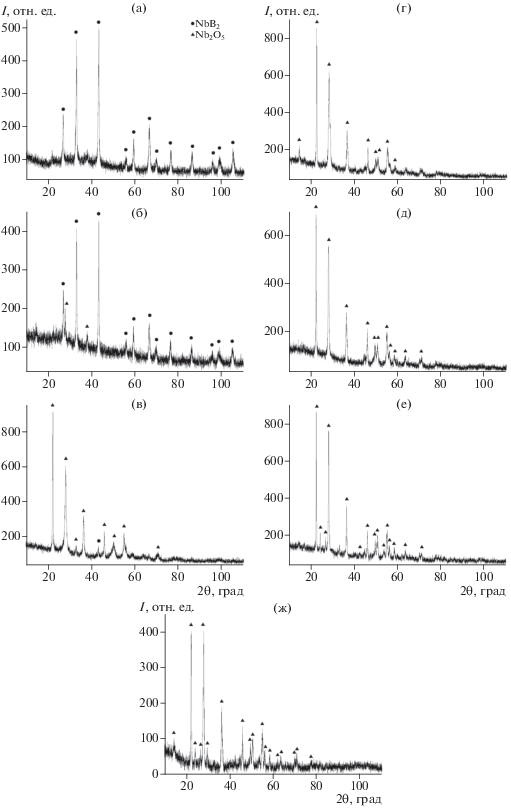
На рис. 4а–4ж приведены дифрактограммы продуктов окисления наночастиц NbB2, полученного в ионном расплаве KBr, при температурах 400, 450, 500, 550, 600, 700°С (изотермический режим) и 1000°С (политермический режим). В исследованном интервале температур на дифрактограммах фиксируются только фазы Nb2O5 и NbB2. Образующаяся по реакции (3) фаза B2O3, вероятно, является аморфной. При 400°С изменения фазового состава порошка не наблюдается, хотя и происходит некоторое увеличение массы (рис. 4а). Рефлексы фазы Nb2O5 появляются на дифрактограммах при 450°С (рис. 4б). При температуре выше 550°С (рис. 4г–4ж) порошок содержит только оксидную фазу – рефлексы NbB2 отсутствуют.
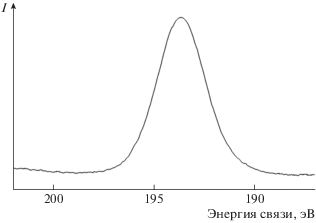
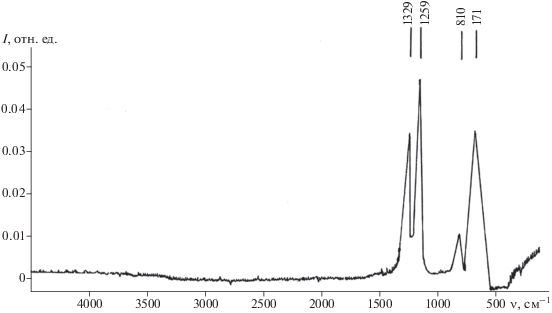
На рис. 5 представлен РФЭС уровня B1s продуктов окисления наночастиц NbB2 после изотермического отжига при 700oС. Положение пика B1s (194.0 эВ) указывает на присутствие в продуктах окисления борного ангидрида или борной кислоты [29, 30]. Результаты ИК-спектроскопии НПВО (рис. 6) свидетельствуют в пользу первого предположения. ИК-спектр продуктов окисления наночастиц NbB2 практически идентичен спектру борного ангидрида [31], и в нем отсутствуют колебания, характерные для H3BO3 (3200, 1450 и 1196 см–1) [32].
Морфология продуктов окисления наночастиц NbB2 при разной температуре приведена на рис. 7. По сравнению с исходным порошком (рис. 2) заметно изменение морфологии наночастиц в зависимости от температуры нагрева в потоке воздуха. По данным РФА, ЭДА и химического анализа, в продуктах окисления азотсодержащие производные ниобия и бора отсутствуют.
Рис. 7.
Морфология наночастиц, полученных в ионном расплаве KBr и окисленных при температурах 400 (а), 450 (б), 500 (в), 550 (г), 600 (д) и 700°С (е).

При полном окислении NbB2 по реакции (3) расчетное увеличение массы образцов составляет 76.86%. В политермическом режиме изменение массы образцов было значительно меньше (рис. 3). Это может быть связано как с диффузионным торможением окисления продуктами реакции, так и с летучестью оксида бора, температуры плавления и кипения которого составляют ~450 и ~2250°С соответственно. В выделяющейся газовой фазе, по данным масс-спектрометрии, заметное количество В2О3 обнаруживается при температурах более 700°С.
На рис. 8 представлены кинетические кривые реакции окисления наночастиц NbB2 при различных температурах. Кинетические кривые описываются уравнением Авраами–Ерофеева
Рис. 8.
Зависимости степени превращения α от времени окисления наночастиц NbB2 при температурах 400 (1), 450 (2), 500 (3), 550 (4), 600 (5) и 700°С (6).
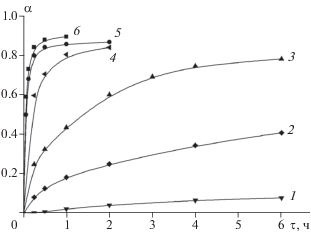
На величину рассчитанной степени превращения при температурах более 600°С заметное влияние оказывает испарение образовавшегося B2O3. После 1–2 ч выдержки масса образца определяется одновременным образованием продуктов реакции окисления (рост массы) и испарением B2O3 (уменьшение массы). Последний процесс начинает преобладать с ростом температуры и времени и приводит к кажущемуся снижению расчетной степени превращения. Поэтому константы скорости реакции окисления наночастиц NbB2 определяли по наклону начальных участков кинетических кривых. При температурах 400, 450, 500, 550, 600°С константы скорости реакции окисления NbB2 составили 0.0013, 0.045, 0.47, 2.61, 8.83 ч–1 соответственно. Оцененная из температурной зависимости констант скоростей в температурном диапазоне 400–600°С эффективная энергия активации реакции окисления NbB2 составила 220 ± 8 кДж/моль.
ЗАКЛЮЧЕНИЕ
Исследовано взаимодействие предварительно обработанных водородом и активированных в высокоэнергетической планетарной мельнице в течение 40 мин порошков Nb и В (1 : 2) при температуре 800°С, давлении аргона 4 МПа и времени взаимодействия 32 ч в ионных расплавах Na2B4O7, КСl и KBr. Показано, что независимо от состава и природы расплава происходит образование однофазного наноразмерного NbB2 со средним размером частиц ~65 нм. Полученный NbB2 имеет гексагональную сингонию, пр. гр. P6/mmm, с параметрами элементарной ячейки: a = 0.3100–0.3108 нм и c = 0.3278–0.3298 нм.
Методами физико-химического анализа исследованы продукты окисления наночастиц NbB2 кислородом воздуха в политермическом (до 1000°С) режиме и в изотермических условиях при 400, 450, 500, 550 и 600°С. При этих температурах определены константы скорости окисления наночастиц NbB2: 0.0013, 0.045, 0.47, 2.61, 8.83 ч–1 соответственно. Начало окисления зафиксировано при 310°С. Оцененная из температурной зависимости констант скоростей окисления эффективная энергия активации реакции окисления наночастиц NbB2 в температурном интервале 400–600°С составила 220 ± 8 кДж/моль.
Список литературы
Серебрякова Т.И., Неронов В.А., Пешев П.Д. Высокотемпературные бориды. Челябинск: Металлургия, 1991. 368 с.
Carenco S., Portehault D., Boissiere C., Mezailles N., Sanchez C. Nanoscaled Metal Borides and Phosphides: Recent Developments and Perspectives // Chem. Rev. 2013. V. 113. № 10. P. 7981–8065.https://doi.org/10.1021/cr400020d
Андриевский Р.А., Спивак И.И. Прочность тугоплавких соединений и материалов на их основе. Справочник. Челябинск: Металлургия, 1989. 367 с.
Прохоров А.М., Лякишев Н.П., Бурханов Г.С., Дементьев В.А. Высокочистые бориды переходных металлов – перспективные материалы современной техники // Неорган. материалы. 1996. Т. 32. № 11. С. 1365–1371.
Andrievski R.A., Khatchoyan A.V. Nanomaterials in Extreme Environments, Fundamentals and Applications. Berlin: Springer, 2016. 107 p. https://doi.org/10.1007/978 –3–319–2533 –2
Matsudaira T., Itoh H., Naka S. Synthesis of Niobium Boride Powder by Solid – State Reaction between Niobium and Amorphous Boron // J. Less-Common Met. 1989. V. 155. № 2. P. 207–214. https://doi.org/10.1016/0022-5088(89)90229-4
Peshev P., Leyarovska L., Bliznakov G. On the Borothermic Preparation of Some Vanadium, Niobium and Tantalum Borides // J. Less-Common Met. 1968. V. 15. P. 259–267.
Jha M., Ramanujachary K.V., Lofland S.T., Gupta G., Ganguli. Novel Borothermal Process for the Synthesis of Nanocrystalline Oxides and Borides of Niobium // J. Dalton Trans. 2011. V. 40. P. 7879–7888.https://doi.org/10.1039/c1dt10468c
Maeda H., Yoshikawa T., KusakabeK., Morooka S. Synthesis of Ultrafine NbB2 Powder by Rapid Carbothermal Reduc tion in a Vertical Tubular Reactor // J. Alloys Compd. 1994. V. 215. P. 127–334. https://doi.org/10.1016/0925-8388(94)90829-X
Gai P., Yang Z., Shi L., Chen L., Zhao A., Gu Y., Qian Y. Low Temperature Synthesis of NbB2 Nanorods by a Solid – State Reaction Route // Mater. Lett. 2005. V. 59. P 3550–3552.https://doi.org/10.1016/j.matlet.2005.07.051
Ma J., Du Y., Wu M., Li G., Feng Z., Guo M., Sun Y., Song W., Lin M., Guo X. A Simple Inorganic – Solvent Route to Nanocrystalline Niobium Diboride // J. Alloys Compd. 2009. V. 468. P. 473–476.https://doi.org/10.1016/j.jallcom.2008.01.021
Palani R. Jothi, Kunio Yubuta, Boniface P.T. Fokwa. A Simple, General Synthetic Route toward Nanoscale Transition Metal Borides // Adv. Mater. 2018. V. 30. № 14. P. 1704181-1–1704181-6. https://doi.org/10.1002/adma.201704181
Portehaut D., Devis S., Beaunier P., Gervais C., Giordano C., Sanchez C., Antonietti M. A General Solution Route toward Metal Boride Nanocrystals // Angew. Chem. 2011. V. 50. P. 3262–3265.https://doi.org/10.1002/ange.201006810
Jafari M., Tajizadegan H.,Golabgir M.H., Chami A., Torabio O. Investigation on Mechanochemical Behavior of Al/Mg–B2O3–Nb System Reactive Mixtures to Synthesize Niobium Diboride // J. Refract. Met. Hard Mater. 2015. V. 50. P. 86–92.https://doi.org/10.1016/j.ijrmhm.2014.10.017
Balci Ö., Aĝaoĝullari D., Övecoĝlu M.L., Duman I. Synthesis of Niobium Borides by Powder Metallurgy Methods using Nb2O5, B2O3 and Mg Blends // Trans. Nonferrous Met. Soc. China. 2016. V. 26. P. 747–758.https://doi.org/10.1016/S1003-6326(16)64165-1
Motojima S., Sugiyama K., Takahashi Y. Chemical Vapor Deposition of Niobium Diborie (NbB2) // Journal of Crystal Growth. 1975. V. 30. P. 233–239. https://doi.org/10.1016/0022-0248(75)90094-9
Кравченко С.Е., Торбов В.И., Шилкин С.П. Наноразмерный диборид циркония: синтез, свойства // Журн. неорган. Химии. 2011. Т. 56. № 4. С. 546–549.https://doi.org/10.1134/S0036023611040164
Gupta A., Singhal V., Pandey O.P. Facile in- situ Synthesis of NbB2 Nanoparticles at Low Temperature // J. Alloys Compd. 2018. V. 736. P. 306–313. https://doi.org/10.1016/j.jallcom.2017.10.257
Илющенко Н.Г., Анфиногенов А.И., Шуров Н.И. Взаимодействие металлов в ионных расплавах. М.: Наука, 1991. 176 с.
Кравченко С.Е., Домашнев И.А., Дремова Н.Н., Винокуров А.А., Шилкин С.П. Cинтез наночастиц диборида ванадия взаимодействием аморфного бора с ванадием в ионных расплавах KCl и Na2B4O7 // Неорган. материалы. 2019. Т. 55. № 5. С. 481–485.https://doi.org/10.1134/S002016851905011X
Волкова Л.С., Шульга Ю.М., Шилкин С.П. Синтез наноразмерного диборида титана в расплаве безводного тетраборнокислого натрия // Журн. общ. химии. 2012. Т. 82. Вып. 5. С. 709–712. https://doi.org/10.1134/S1070363212050027
Кравченко С.Е., Винокуров А.А., Дремова Н.Н., Надхина С.Е., Шилкин С.П. Синтез наночастиц диборида ниобия взаимодействием аморфного бора с ниобием в ионных расплавах KCl и Na2B4O7 // Журн. общ. химии. 2021. Т. 91. № 2. С. 326–328. https://doi.org/10.31857/S0044460X21020153
Фокин В.Н., Фокина Э.Э., Шилкин С.П. Синтез гидридов некоторых металлов в крупнокристаллическом состоянии // Журн. общ. химии. 1996. Т. 66. В. 8. С. 1249–1252.
Fokin V.N., Fokina E.E., Tarasov B.P., Shilkin S.P. Synthesis of the Tetragonal Titanium Dihydride in Ultradispersed State // Int. J. Hydrogen Energy. 1999. V. 24. № 2–3. P. 111–114. https://doi.org/10.1016/S0360-3199(98)00070-6
Трусов Б.Г. Термодинамический метод анализа высокотемпературных состояний и процессов и его практическая реализация: Дис… докт. техн. наук. М.: МГТУ, 1984. 292 с.
Синярев Г.Б., Васолин Н.А., Трусов Б.Г., Моисеев Г.К. Применение ЭВМ для термодинамических расчетов металлургических процессов. М.: Наука, 1982. 263 с.
Диаграммы состояния двойных металлических систем: Справочник / Под общ. ред. Лякишева Н.П. Т. 1. М.: Машиностроение, 1996. 992 с.
Болгар А.С., Сербова М.И., Фесенко В.В., Серебрякова Т.И., Исаева Л.П. Высокотемпературная энтальпия и теплоемкость диборида ниобия // Теплофизика высоких температур. 1980. Т. 18. № 6. С. 1180–1183.
Joyner D.J., Hercules D.M. Chemical Bonding and Electronic Structure of B2O3, H3BO3, and BN: ESCA, Auger, SIMS and SXS Study // J. Chem. Phys. 1980. V. 72. № 2. P. 1095–1108.https://doi.org/10.1063/1.439251
Ong C.W., Huang H., Zheng B., Kwok R.W.M., Hui Y.Y., Lau W.M. X-ray Photoemission Spectroscopy of Nonmetallic Materials: Electronic Structures of Boron and BxOy // J. Appl. Phys. 2004. V. 95. № 7. P. 3527–3534.https://doi.org/10.1063/1.1651321
Сидоров Т.А., Соболев Н.Н. Инфракрасный и комбинационный спектры борного ангидрида. III. Интерпретация колебательного спектра борного ангидрида и расчет изотопического эффекта // Оптика и спектроскопия. 1958. Т. 4. Вып. 1. С. 9–16.
Bethell D.E., Sheppard N. The Infrared Spectrum and Structure of Boric Oxide // Trans. Faraday Soc. 1955. V. 51. P. 9–15.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы