Неорганические материалы, 2021, T. 57, № 12, стр. 1337-1343
Исследование фазовых равновесий в трехкомпонентной взаимной системе K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$
Е. Г. Данилушкина 1, *, И. К. Гаркушин 1, Н. С. Тарасова 1
1 Самарский государственный технический университет, главный корпус
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: e_danilu@mail.ru
Поступила в редакцию 21.06.2021
После доработки 05.08.2021
Принята к публикации 18.08.2021
Аннотация
С использованием термодинамического метода проведено разбиение трехкомпонентной взаимной системы K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ на стабильные симплексы, определены стабильные секущие системы, рассчитан тепловой эффект реакции обмена в точке конверсии. Описаны фазовые равновесия, химическое взаимодействие в системе и разграничены поля кристаллизации фаз. С целью подтверждения теоретического разбиения проведено экспериментальное исследование двух стабильных секущих и трех стабильных элементов трехкомпонентной взаимной системы K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ методом дифференциального термического анализа. В результате экспериментальных исследований установлено, что система относится к сингулярной необратимо-взаимной с эвтектическим типом плавления. Система разбивается стабильными секущими диагоналями на четыре стабильных фазовых треугольника KBr–D2–K2MoO4, KBr–D2–BaMoO4, KBr–D1–BaMoO4, BaBr2–D1–BaMoO4 (где D1 = 2KBr⋅BaBr2, D2 = K2MoO4⋅BaMoO4). Данные разбиения подтверждены РФА. На стабильных секущих выявлены перевальные квазидвойные эвтектические точки: e7 (727°C) и e6 (608°C). Определены координаты (температура плавления, состав) трех тройных эвтектических точек: E1 (597°C), E2 (606°C), E3 (602°C) и тройной перитектической точки Р1 (613°C). Максимальное поле кристаллизации на квадрате составов отвечает тугоплавкому молибдату бария.
ВВЕДЕНИЕ
Композиции из неорганических солей находят применение в качестве функциональных материалов в большом количестве технологических процессов. В первую очередь это электролиты различного назначения, рабочие тела тепловых аккумуляторов, работающих при высоких температурах, флюсы для сварки и пайки, а также среды для проведения химических реакций [1–5]. Ионные расплавы щелочных полимолибдатов используют для синтеза и выращивания многих монокристаллов целевого назначения [6, 7]. Среди неорганических солей наиболее востребованы в технологическом отношении соли галогенидов, молибдатов, сульфатов s-элементов [8–14]. Выбор солевой смеси с требуемыми характеристиками неразрывно связан с изучением многокомпонентных систем [15].
Цель данной работы – исследование трехкомпонентной взаимной системы из бромидов и молибдатов калия и бария (K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$). Данные по исходным соединениям приведены в табл. 1 [16, 17].
Таблица 1.
| Вещество | Δf$H_{{298}}^{^\circ }$, кДж/моль | Δf$G_{{298}}^{^\circ }$, кДж/моль | tпл, °C | Температура полиморфных переходов |
|---|---|---|---|---|
| KBr (кI, куб.) | –393.480 | –380.108 | 734 ± 1 | – |
| BaBr2 (к, ромб.) | –756.490 | –732.263 | 857 ± 2 | – |
| K2MoO4 (кIV, монокл.) | –1498.457 | –1381.481 | 926 ± 1 | 476 ± 10 (β/α) 450 ± 5 (β/γ) 316 ± 10 (δ/γ) |
| BaMoO4 (к, тетр.) | –1533.372 | –1427.709 | 1458 ± 3 | – |
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
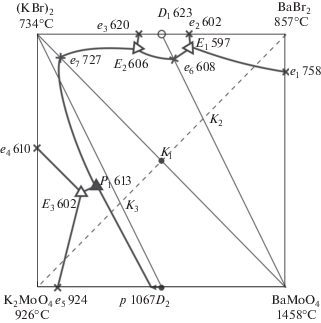
Исследование трехкомпонентной взаимной системы K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ проведено с целью установления фазовых равновесий и нахождения нонвариантных составов. Трехкомпонентная взаимная система включает четыре составляющих соли (рис. 1), образующие четыре двухкомпонентные системы, которые исследованы ранее [18–21].
Рис. 1.
Расположение политермических разрезов в тройной взаимной системе K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}.$
Система KBr–K2MoO4 характеризуется образованием эвтектики (e9) с координатами 610°С, 55.4% KBr, 44.6 K2MoO4 (трехфазное равновесие Же4$ \rightleftarrows $ KBr + K2MoO4 [18, 19])11.
В системе K2MoO4–BaMoO4 образуются соединение инконгруэнтного плавления K2MoO4⋅ ·BaMoO4 (D2) при температуре 1067°С и 51% K2MoO4, 49% BaMoO4, а также эвтектика (e5) при температуре 924°С и 95% K2MoO4, 5% BaMoO4. При 3 экв. % BaMoO4 и температуре плавления смеси 936°С в ликвидусе отмечается максимум, отвечающий граничному твердому раствору на основе α-K2MoO4 [20].
В системе BaBr2–BaMoO4 температура плавления эвтектики 758°С (e1), состав 85% BaBr2, 15% BaMoO4. Эвтектическому составу соответствует нонвариантное равновесие ж $ \rightleftarrows $ BaBr2 + BaMoO4 [20, 21].
Система KBr–BaBr2 характеризуется образованием конгруэнтного соединения 2KBr⋅BaBr2 (D1) при температуре 623°С и 50% KBr, 50% BaBr2, эвтектики (e2) при температуре 602°С и 31% KBr, 69% BaBr2, эвтектики (e3) при температуре 620°С и 61% KBr, 39% BaBr2 [18].
На первом этапе было проведено теоретическое разбиение системы на симплексы. Для подтверждения варианта разбиения проведен термодинамический расчет ΔrH° и ΔrG° реакции в точке конверсии по данным ΔfH° и ΔfG° исходных веществ [16, 17].
В точке K2 (рис. 1) протекает реакция обмена
(1)
${\text{BaB}}{{{\text{r}}}_{2}} + {{{\text{K}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{4}} \rightleftarrows 2{\text{KBr}} + {\text{BaMo}}{{{\text{O}}}_{4}},$для состава которой рассчитаны тепловой эффект и энергия Гиббса реакции в точке конверсии (ΔrH° = –63.01 кДж; ΔrG° = –110.30 кДж). Система относится к сингулярной необратимо-взаимной по классификации Бергмана [22–25] со стабильной диагональю KBr–BaMoO4.
Наличие соединений конгруэнтного плавления 2KBr⋅BaBr2 (D1) и инконгруэнтного плавления K2MoO4⋅BaMoO4 (D2) с учетом стабильной диагонали КBr–BaMoO4 позволяет провести разбиение системы K, Ba||Br, MoO4 на четыре симплекса: KBr–D2–K2MoO4, KBr–D2–BaMoO4, KBr–D1–BaMoO4, BaBr2–D1–BaMoO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили методом дифференциального термического анализа (ДТА), датчик температуры – комбинированная Pt–Pt/Rh(10% Rh)-термопара, индифферентное вещество – свежепрокаленный Al2O3. Исходные реактивы квалификаций “х. ч.” (KBr, BaBr2, K2MoO4, BaMoO4) были предварительно обезвожены. Температуры плавления веществ KBr, BaBr2, K2MoO4 соответствовали справочным данным. Температура плавления BaMoO4 принята равной 1458°C [16, 17]. Исследования проводили в платиновых микротиглях. Масса навесок составляла 0.4 г.
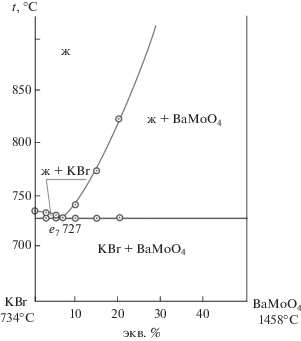
Для экспериментального подтверждения выбранного варианта разбиения трехкомпонентной взаимной системы K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ системы на симплексы проведено исследование методом ДТА квазибинарной системы KBr–BaMoO4. t–х-диаграмма стабильной диагонали KBr–BaMoO4 представлена на рис. 2. Ветви первичной кристаллизации бромида калия и молибдата калия сходятся в квазидвойной эвтектической точке е7: 727°С, 7% BaMoO4 (же7$ \rightleftarrows $ KBr + BaMoO4).. Таким образом, квазибинарная система KBr–BaMoO4 является стабильной диагональю трехкомпонентной взаимной системы, разбиение выполнено верно.
Проведен рентгенофазовый анализ образца смеси, отвечающего точке конверсии K2. Для этого образец, содержащий смесь 50% BaBr2 + 50% K2MoO4, нагрели до температуры 525–540°C, выдержали 30 мин, а затем закалили в лед. По результатам РФА, в образце кристаллизуются две фазы – KBr и BaMoO4, что также подтверждает теоретический вариант разбиения системы термодинамическим методом.
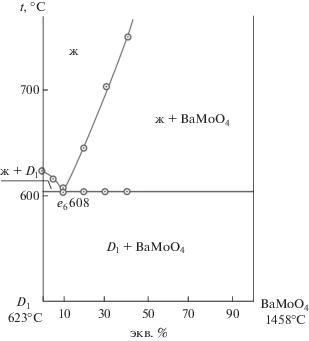
Также для подтверждения разбиения системы с помощью ДТА изучена стабильная секущая, являющаяся квазибинарной системой D1–BaMoO4 (рис. 3).
Ветви первичной кристаллизации соединения конгруэнтного типа плавления и молибдата бария сходятся в квазидвойной эвтектической перевальной точке е6 (608°С, 10% BaMoO4) с трехфазным равновесием же6$ \rightleftarrows $ D1 + BaMoO4.
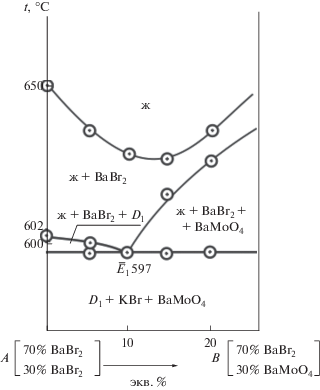
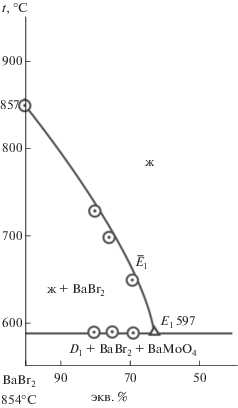
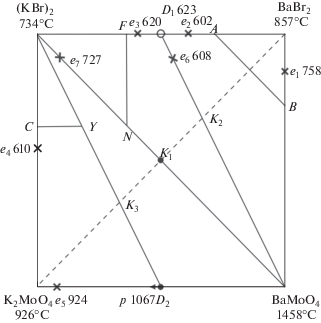
Для экспериментального изучения тройной взаимной системы проекционно-термографическим методом [25] рассмотрены политермические разрезы AB, NF, CY. В стабильном треугольнике D1–BaBr2–BaMoO4 (рис. 1) выбран и исследован политермический разрез AB в поле кристаллизации бромида бария. t–х-диаграмма разреза представлена на рис. 4. Установлено наличие третичной кристаллизации с тройной эвтектикой Е1 (tЕ1 = = 597°C). Пересечением ветвей вторичной кристаллизации бромида калия, молибдата бария и эвтектической прямой в точке ${{\bar {E}}_{1}}$ определили проекцию тройной эвтектики на плоскость разреза АВ с постоянным соотношением компонентов KBr и BaMoO4. На разрезе BaBr2–${{\bar {E}}_{1}}$–E1 (рис. 5), исходящем из вершины BaBr2, определены координаты тройной эвтектической точки E1: 597°С, 65% BaBr2, 32% KBr, 3% BaMoO4.
Ликвидус квазитройной системы D1–BaBr2–BaMoO4 представлен пятью полями кристаллизации компонентов BaBr2, 2KBr⋅BaBr2 (D1) и BaMoO4. Наибольшее поле принадлежит молибдату бария.
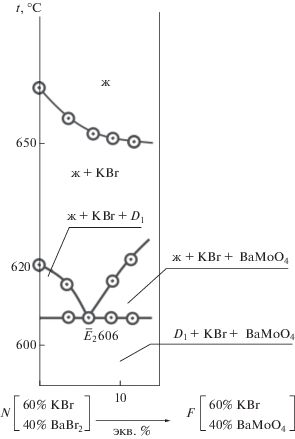
Для нахождения нонвариантной точки в симплексе KBr–D1–BaMoO4 (рис. 1) экспериментально изучен политермический разрез NF, расположенный в поле кристаллизации бромида калия. По экспериментальным данным политермического сечения (рис. 6) определена температура плавления эвтектической точки и соотношение в ней компонентов BaBr2 и BaMoO4.
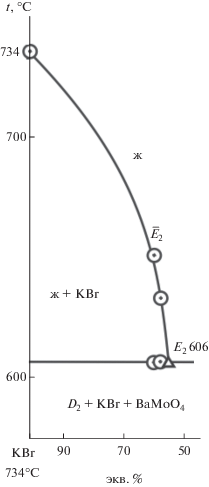
Изучением нонвариантного разреза KBr–${{\bar {E}}_{2}}$–Е2, исходящего из вершины бромида калия, через найденное направление ${{\bar {E}}_{2}}$ определены координаты тройной эвтектической точки Е2: 606°С, 57% KBr, 40.5% BaBr2, 2.5% BaMoO4 (рис. 7). Ликвидус квазитройной системы KBr–D1–BaMoO4 представлен тремя полями кристаллизации компонентов D1 = 2KBr⋅BaBr2, KBr и BaMoO4. Наибольшее поле принадлежит бромиду калия.
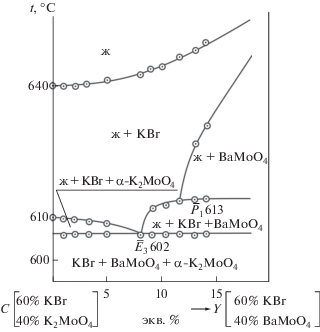
Аналогичное исследование провели и в симплексе KBr–K2MoO4–BaMoO4 (рис. 1), в котором изучен политермический разрез CY (C – 60% KBr, 40% K2MoO4; Y – 60% KBr, 40% BaMoO4), расположенный в поле кристаллизации бромида калия (рис. 8).
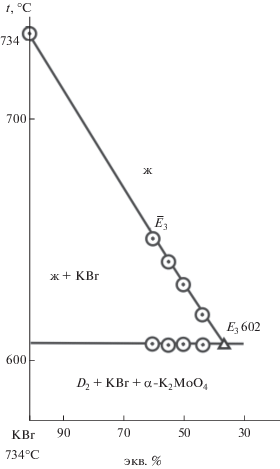
На разрезе CY были определены температуры плавления тройных эвтектики (Е3) и перитектики (Р) и соотношение в них компонентов KBr и BaMoO4 (${{\bar {E}}_{3}}$ и ${{\bar {P}}_{1}}$). Составы эвтектики Е3 и перитектики Р выявлены при исследовании разрезов KBr–${{\bar {E}}_{3}}$–Е3 (рис. 9) и KBr–$\bar {P}$–P соответственно:
Е3 – 602°С, 36% KBr, 60% К2MoO4, 4% BaMoO4. Для тройного эвтектического состава экспериментально определена энтальпия плавления: ∆Hm(Е3) = = 24.48 кДж/кг.
Все найденные нонвариантные точки нанесены на квадрат составов системы K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ (рис. 10).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам экспериментальных исследований установлено, что трехкомпонентная взаимная система K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ разбивается тремя стабильными секущими KBr–BaMoO4, D1–BaMoO4, D2–KBr на четыре стабильных фазовых треугольника: KBr–D2–K2MoO4, KBr–D2–BaMoO4, KBr–D1–BaMoO4, BaBr2–D1–BaMoO4 (D1 = 2KBr⋅BaBr2, D2 = К2MoO4⋅BaMoO4). Данные разбиения подтверждены РФА. Максимальное поле кристаллизации на квадрате составов отвечает тугоплавкому молибдату бария, оттесняющему поля кристаллизации остальных фаз.
Фазовые равновесные состояния для различных элементов квадрата составов приведены в табл. 2.
Таблица 2.
Фазовые равновесные состояния для различных элементов квадрата составов
| Элемент диаграммы | Фазовое равновесие |
|---|---|
| Дивариантные равновесия | |
| Поле e1E1e2 | ж ⇄ BaBr2 |
| Поле e2E1e6E2e3 | ж ⇄ D1 |
| Поле e3E2e7P1E3e4 | ж ⇄ KBr |
| Поле e4E3e5 | ж ⇄ α-K2MoO4 |
| Поле e5E3P1p2 | ж ⇄ D2 |
| Поле p2P1e7E2e6E1e1 | ж ⇄ BaMoO4 |
| Моновариантные равновесия | |
| Линия e1–E1 | ж ⇄ BaBr2 + BaMoO4 |
| Линия e2–E1 | ж ⇄ D1 + BaBr2 |
| Линия e6–E1 | ж ⇄ D1 + BaMoO4 |
| Линия e6–E2 | ж ⇄ D1 + BaMoO4 |
| Линия e3–E2 | ж ⇄ D1 + KBr |
| Линия e7–E2 | ж ⇄ BaMoO4 + KBr |
| Линия e7–P1 | ж ⇄ BaMoO4 + KBr |
| Линия p1–P1 | ж ⇄ BaMoO4 + D2 |
| Линия E3–P1 | ж ⇄ KBr + D2 |
| Линия e4–E3 | ж ⇄ KBr + α-K2MoO4 |
| Линия e5–E3 | ж ⇄ D2 + α-K2MoO4 |
| Нонвариантные равновесия | |
| Точка Е1 | ж ⇄ D1 + BaBr2 + BaMoO4 |
| Точка Е2 | ж ⇄ D1 + BaMoO4 + KBr |
| Точка Е3 | ж ⇄ KBr + D2 + α-K2MoO4 |
| Точка P1 | ж ⇄ D2 + BaMoO4 + α-K2MoO4 |
В системе, кроме реакций обмена в точке K1, протекают и реакции образования двойных соединений 2KBr⋅BaBr2 (K2BaBr4, D1) и K2MoO4⋅ BaMoO4 (K2BaMoO4, D2):
(2)
$\begin{gathered} {{{\text{K}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{4}} + 2{\text{BaB}}{{{\text{r}}}_{2}} = \\ = \,\,{{{\text{K}}}_{{\text{2}}}}{\text{BaB}}{{{\text{r}}}_{4}} + {\text{BaMo}}{{{\text{O}}}_{{\text{4}}}}{\text{(точка}}\,\,{{K}_{2}}), \\ \end{gathered} $(3)
$\begin{gathered} {\text{2}}{{{\text{K}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{4}} + {\text{BaB}}{{{\text{r}}}_{2}} = \\ = {{{\text{K}}}_{{\text{2}}}}{\text{Ba}}{{\left( {{\text{Mo}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} + 2{\text{KBr }}({\text{точка}}\,\,\,{{K}_{3}}). \\ \end{gathered} $Для составов, расположенных на участке диагонали BaBr2–K2, из приведенных реакций реализуется реакция (2) – образование соединения K2BaBr4, которое с BaBr2 и BaMoO4 образует симплекс K2BaBr4–BaBr2–BaMoO4. Составы на нестабильной диагонали между точками K2 и K1 характеризуются протеканием реакций (2) и (1), в результате которых из расплава кристаллизуются три фазы: KBr, K2BaBr4 и BaMoO4. Составы между точками K1 и K3 характеризуются протеканием реакций (1) и (3), в результате которых после кристаллизации из расплава образуются три твердые фазы стабильного треугольника KBr–BaMoO4–K2Ba(MoO4)2 (D2). А на последнем участке диагонали К3–BaMoO4 в смесях после расплавления и кристаллизации образуются три твердые фазы: KBr, K2MoO4 и K2Ba(MoO4)2, т.е. протекает только реакция (3).
Список литературы
Губанова Т.В., Афанасьева А.Д., Бузгон Е.А., Гаркушин И.К. Трехкомпонентные системы NaГ–NaVO3–Na2CrO4 (Г = Cl, Br) // Журн. неорган. химии. 2018. Т. 63. № 2. С. 257–260. https://doi.org/10.7868/S0044457X1802019
Данилова В.П., Фролова Е.А., Кондаков Д.Ф., Свешникова Л.Б. Применение физико-химического анализа при разработке и исследовании противогололедных реагентов // Журн. неорган. химии. 2019. Т. 64. № 9. С. 984–987.
Гаркушин И.К., Дворянова Е.М., Губанова Т.В., Фролов Е.И., Истомова М.А., Гаркушин А.И. Функциональные материалы на основе многокомпонентных солевых систем // Журн. неорган. химии. 2015. Т. 60. № 3. С. 374–391. https://doi.org/10.7868/S0044457X14120095
Вердиев Н.Н., Гаркушин И.К., Бурчаков А.В., Вердиева З.Н., Алхасов А.Б., Мусаева П.А., Кондратюк И.М., Егорова Е.М. Фазовые равновесия в системе NaF–NaCl–NaBr–Na2CrO4 // Неорган. материалы. 2020. Т. 56. № 11. С. 1243–1251. https://doi.org/10.31857/S0002337X20110159
Гаркушин И.К., Егорцев Г.Е., Истомова М.А. Поиск электролитов для химических источников тока на основе древ фаз (древ кристаллизации) солевых систем // Электрохимическая энергетика. 2009. Т. 9. № 2. С. 95–109.
Дробашева Т.И., Снежков В.И., Расторопов С.Б. Ионные расплавы полифольфраматов, молибдатов щелочных металлов и их применение для выращивания кристаллов целевого назначения // Современные наукоемкие технологии. 2011. № 5. С. 69–70.
Базарова Ж.Г., Логвинова А.В., Базаров Б.Г. Фазообразование в системах Rb2MoO4–R2(MoO4)3–Zr2(MoO4)2 (R – Al, Fe, Cr, Y) // Неорганические материалы. 2020. Т. 56. № 12. С. 1350–1355. https://doi.org/10.31857/S0002337X20120040
Фролов Е.И., Губанова Т.В. Многокомпонентные системы LiCl–LiBr–Li2SO4 и LiCl–LiBr–Li2SO4–Li2MoO4 // Журн. неорган. химии. 2017. Т. 62. №11. С. 1521–1524. https://doi.org/10.1134/S0036023617110079
Гаркушин И.К., Рагрина М.С., Сухаренко М.А. Исследование стабильного тетраэдра четырехкомпонентной взаимной системы Na, K, Cs||F, Cl // Журн. неорган. химии. 2018. Т. 63. № 1. С. 94–98. https://doi.org/10.7868/S0044457X18010130
Ushak S., Fernández A.G., Grageda M. Using Molten Salts and Other Liquid Sensible Storage Media in Thermal Energy Storage (TES) Systems // Advances in Thermal Energy Storage Systems. 2015. P. 49–63.
Егорова Е.М., Игнатьева Е.О., Гаркушин И.К., Кондратюк И.М. Изучение фазовых равновесий в трехкомпонентной взаимной системе Na, K||I, MoO4 // Журн. неорган. химии. 2018. Т. 63. № 5. С. 645–649. https://doi.org/10.7868/S0044457X18050185
Вердиев Н.Н., Бабаев Б.Д., Гасаналиев А.М. Фазовые равновесия в системах Li, Na, Ba||MoO4 и Li, Сa, Ba||MoO4 // Журн. неорган. химии. 1996. Т. 41. № 2. С. 309–312.
Химические источники тока: справочник / Под ред. Коровина Н.В., Скундина А.М. М.: Изд-во МЭИ, 2003. 740 с.
Быстров В.П., Ливчак А.В. Теплоаккумуляторы с использованием фазового перехода // Вопросы экономии теплоэнергетич. ресурсов в системах вентиляции и теплоснабжения. Сб. науч. тр. М.: Изд. ЦНИИЭПИО, 1984.
Гаркушин И.К., Кондратюк И.М., Егорцев Г.Е., Истомова М.А. Теоретические и экспериментальные методы исследования многокомпонентных систем: уч. пособие. Самара: СамГТУ, 2012. 125 с.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. X. Ч. 1. 300 с.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. Х. Ч. 2. 440 с.
Посыпайко В.И., Алексеева Е.А., Васина Н.А. Диаграммы плавкости солевых систем: Ч. III. Двойные системы с общим катионом. Справочник. М.: Металлургия, 1979. 78 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И. и др. Справочник по плавкости систем из безводных неорганических солей. М.: Изд-во АН СССР, 1961. Т. 1. 845 с.
Гасаналиев А.М., Трунин А.С., Дибиров М.А. Система K2MoO4–CaMoO4–BaMoO4 // Журн. неорган. химии. 1979. Т. 24. № 6. С. 1716–1718.
Данилушкина Е.Г., Гаркушин И.К., Рыжкова Д.С. Исследование трехкомпонентной взаимной системы Na, Ba||Br, MoO4 // Журн. неорган. химии. 2019. Т. 64. № 8. С. 881–888. https://doi.org/10.1134/S0044457X19080038
Бергман А.Г., Бухалова Г.А. Термодинамические взаимоотношения в тройных взаимных системах с комплексообразованием // Изв. сектора физ.-хим. анализа. 1952. Т. 21. С. 228–249.
Васина Н.А., Грызлова Е.С., Шапошникова С.Г. Теплофизические свойства многокомпонентных солевых систем. М.: Химия, 1984. 99 с.
Лупейко Т.Г., Тарасов Н.И., Зяблин В.Н., Петров М.П. Новые возможности расчетов термодинамических характеристик солевых систем на основе их диаграмм плавкости. М. 2012. С. 90–94.
Космынин А.С., Трунин А.С. Проекционно-термографический метод исследования гетерогенных равновесий в конденсированных многокомпонентных системах // Тр. Самар. науч. школы по физ.-хим. анализу многокомпонентных систем. Т. 9. Самара: Самар. гос. техн. ун-т, 2006. 183 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы