Неорганические материалы, 2021, T. 57, № 2, стр. 189-196
Твердофазный синтез нанокристаллического цирконата гадолиния с применением механоактивации
А. М. Калинкин 1, *, В. Ю. Виноградов 1, Е. В. Калинкина 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение ФИЦ “Кольский научный центр Российской академии наук”
184209 Мурманская обл., Апатиты, Академгородок, 26а, Россия
* E-mail: kalinkin@ksc.ru
Поступила в редакцию 11.04.2020
После доработки 18.09.2020
Принята к публикации 22.09.2020
Аннотация
Твердофазным способом с применением механоактивации стехиометрической смеси Gd2O3 и ZrО2 синтезирован нанокристаллический цирконат гадолиния Gd2Zr2O7. Механоактивация проводилась в центробежно-планетарной мельнице АГО-2 в течение 10 мин. С помощью рентгенофазового анализа, ИК-спектроскопии и комплексного термического анализа исследованы процессы, протекающие при нагревании механоактивированной смеси оксидов гадолиния и циркония. Определенные по формуле Шеррера средние размеры кристаллитов цирконата гадолиния, полученного прокаливанием механоактивированной смеси оксидов при 1100 и 1200°С в течение 3 ч, составили 29 и 68 нм соответственно.
ВВЕДЕНИЕ
Цирконаты редкоземельных элементов (РЗЭ) с общей формулой Ln2Zr2O7 благодаря особенностям структуры и уникальным физико-химическим характеристикам привлекают повышенное внимание как перспективные материалы для получения термобарьерных покрытий, катализаторов, сенсоров, ионных проводников, а также как матрицы для иммобилизации радиоактивных отходов [1–6]. Наибольший интерес из указанного ряда соединений в последние годы вызывает цирконат гадолиния Gd2Zr2O7, характеризующийся большой термической, радиационной и химической устойчивостью, высокой температурой плавления (2570°C [7]), значительной кислород-ионной проводимостью при повышенных температурах (>1 × 10–3 См/см при 800°С) [8], низкой теплопроводностью (1.5–2.0 Вт/(м К)) [9, 10] и большим коэффициентом термического расширения (11.09 × 10–6 K–1) [11].
По своим структурно-химическим характеристикам Gd2Zr2O7 занимает особое положение в ряду цирконатов РЗЭ. Соответствующее ему отношение радиусов катионов РЗЭ и циркония (RGd/RZr = 1.462) фактически разграничивает две области стабильности: при RLn/RZr ≥ 1.46 устойчива структура пирохлора (пр. гр. Fd$\bar {3}$m), а при RLn/RZr < 1.46 – структура разупорядоченного флюорита (пр. гр. Fm$\bar {3}$m) [12]. При комнатной температуре для цирконата гадолиния стабильной является пирохлоровая фаза (Р-Gd2Zr2O7), которая при ~1550°C переходит в разупорядоченную флюоритовую модификацию (F-Gd2Zr2O7). Вместе с тем, вследствие небольшой энергетической разницы между этими фазами флюоритоподобный цирконат гадолиния может существовать при обычных условиях, чему способствуют определенные условия его синтеза [10].
Усилия многих исследователей в последнее время направлены на совершенствование способов получения наноразмерной керамики на основе цирконатов РЗЭ, которая обладает повышенной устойчивостью к радиации, пониженной теплопроводностью и более высокой кислород-ионной проводимостью по сравнению с микрокристаллической керамикой [13–16]. Для получения нанокристаллических порошков цирконатов РЗЭ, в том числе цирконата Gd, обычно применяют различные методы “мокрой химии”: гидротермальный, золь–гель-метод, сольвотермический, метод соосаждения гидроксидов и др. [1, 4, 15–22].
Твердофазный синтез Gd2Zr2O7, в отличие от указанных способов, значительно проще в осуществлении, не требует дорогих реагентов и практически безотходен. Однако в традиционном варианте из-за низкой скорости реакции вследствие диффузионных ограничений его необходимо проводить при высоких температурах (1400–1650°С) в течение длительного времени (от 10 ч до 15 сут) с промежуточными операциями размола спека, прессования и прокаливания [23–29]. Такие условия синтеза приводят к росту зерен цирконата и не позволяют получить нанокристаллические образцы.
Эффективным инструментом, позволяющим интенсифицировать твердофазные реакции, зарекомендовал себя механохимический подход [30–34]. Он применяется в двух основных вариантах: 1) механохимический синтез, в ходе которого соединение количественно образуется непосредственно при механической обработке реагентов в мельнице-активаторе; 2) двухстадийный процесс, включающий в себя механоактивацию (МА) исходной смеси при относительно небольших энергетических затратах и последующую термообработку. Авторами [35, 36] показано, что однофазные нанокристаллические цирконаты РЗЭ, включая Gd2Zr2O7, могут быть получены методом механохимического синтеза в результате обработки смеси Ln2O3 и ZrO2 в центробежно-планетарной мельнице в воздушной среде в течение 18–30 ч (скорость вращения водила – 350 об./мин). К недостаткам механохимического синтеза Gd2Zr2O7 относится большая продолжительность процесса механической обработки. Кроме того, поскольку при механических воздействиях оксиды РЗЭ активно взаимодействуют с влагой и углекислым газом воздуха [37], в результате их гидратации и карбонизации в продукте синтеза возможно присутствие примесей.
Более рациональным, по-видимому, является второй механохимический подход. В работе [38] он был применен для синтеза цирконата гадолиния с целью получения на его основе высокоплотной нанокристаллической керамики методом горячего прессования. В качестве исходных веществ использовались порошки оксидов Gd и Zr различной крупности: нанодисперсные и микрокристаллические. Синтез Gd2Zr2O7 включал несколько этапов: 1) предварительное холодное прессование смеси оксидов (сначала одноосное при 20 МПа, затем изостатическое при 120 МПа) с последующим прокаливанием таблетки при 1300°С в течение 12 ч; 2) МА прокаленного продукта в планетарной мельнице продолжительностью 2 ч (скорость вращения водила – 350 об./мин); 3) термообработка механоактивированной смеси при 1300°С в течение 12 ч. Циклы МА и прокаливания (второй и третий этапы) проводились от 1 до 3 раз. Показано, что для проведения полного синтеза Gd2Zr2O7, даже с использованием нанопорошков исходных оксидов, необходим по крайней мере 1 цикл МА и прокаливания при 1300°С в дополнение к предварительной термообработке прессованной смеси оксидов при этих же условиях. В случае микрокристаллических исходных оксидов для 100%-ного выхода цирконата Gd требовалось проведение трех указанных циклов. Таким образом, авторы [38] за счет проведения МА (в течение 2–6 ч) снизили температуру твердофазного синтеза Gd2Zr2O7 до 1300°С, однако время прокаливания при такой достаточно высокой температуре весьма велико (24–48 ч), что препятствует получению нанокристаллического соединения.
Целью данной работы является синтез нанокристаллического Gd2Zr2O7 твердофазным способом при пониженных температурах за счет применения МА. В этой связи нами изучены процессы, протекающие при МА смеси оксидов гадолиния и циркония, а также при последующем отжиге МА-порошка для определения условий формирования однофазного продукта в нанокристаллическом состоянии. С учетом ранее проведенных исследований [39–42] в качестве аппарата МА выбрана центробежно-планетарная мельница АГО-2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза Gd2Zr2O7 использовались ZrO2 (моноклинной модификации) и Gd2O3 (кубической модификации) классификации “х. ч.”, прокаленные в течение 12 ч при 600 и 1000°С соответственно. Удельные поверхности диоксида циркония и сесквиоксида гадолиния равнялись 31.5 и 9.60 м2/г соответственно. По данным об удельной поверхности и плотности ZrO2 (5.85 г/см3 [43]) и Gd2O3 (7.618 г/см3 [44]) был оценен средний размер их частиц DS (нм) по формуле
(1)
${{D}_{S}} = {{6000} \mathord{\left/ {\vphantom {{6000} {\left( {\rho {{S}_{{{\text{уд}}}}}} \right)}}} \right. \kern-0em} {\left( {\rho {{S}_{{{\text{уд}}}}}} \right)}},$МА проводили в лабораторной центробежно-планетарной мельнице АГО-2 [33] в воздушной среде с использованием стальных барабанов и стальных шаров диаметром 8 мм. Для минимизации загрязнения порошков материалом барабанов и шаров проводилась предварительная футеровка рабочей поверхности мельницы обрабатываемым материалом [45]. Исходную стехиометрическую смесь оксидов, как и при синтезе цирконата лантана [42], готовили механической обработкой в мельнице АГО-2 соответствующих количеств ZrO2 и Gd2O3 в течение 30 с при центробежном факторе 20 g. В барабан загружали 200 г шаров и 10 г смеси оксидов. Исходную смесь подвергали МА при центробежном факторе 40 g при том же соотношении шары : загрузка. С учетом проведенного ранее твердофазного синтеза La2Zr2O7 с применением МА [42] продолжительность обработки в мельнице при центробежном факторе 40 g составила 10 мин. С целью обеспечения макрооднородности порошков через каждые 60 с МА мельницу выключали и перемешивали содержимое барабанов металлическим шпателем [45]. Прокаливание исходной и МА-смеси выполняли на воздухе в электропечи SNOL 6,7/1300 в диапазоне температур от 600 до 1200°C в течение 3 ч.
Рентгенофазовый анализ (РФА) проводили на дифрактометре Shimadzu XRD 6000 (СuKα-излучение). Съемка рентгенограмм осуществлялась с шагом 0.02°(2θ), время накопления сигнала в каждой точке 1 с. Комплексный термический анализ выполняли на установке NETZSCH STA 409 PC/PG в интервале 20–1300°С. Результаты получены в режиме нагрева образца со скоростью 10°C/мин в корундовом тигле в атмосфере аргона. ИК-спектры снимались на Фурье-ИК-спектрометре Nicolet 6700 FT-IR в таблетках с бромидом калия. Исследования методом сканирующей электронной микроскопии (СЭМ) выполнены с помощью микроскопа LEO-1450. Удельную поверхность определяли методом низкотемпературной адсорбции азота с помощью анализатора Flow-Sorb II 2300 (Micromeritics).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
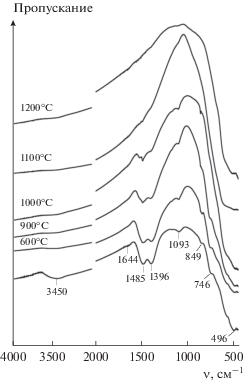
Механическая обработка смеси оксидов в мельнице в течение 10 мин приводит к практически полной их аморфизации (рис. 1). В ИК-спектре МА-смеси (рис. 2) двойная полоса поглощения с максимумами при 1485 и 1396 см–1 (валентные колебания ${\text{СО}}_{3}^{{2 - }}$-группы), а также полосы при 3450 и 1644 см–1 (валентные и деформационные колебания гидроксильных групп соответственно) свидетельствуют о карбонизации и гидратации вследствие поглощения атмосферных влаги и СО2 оксидом гадолиния [37]. Положения максимумов и форма этих и других полос в области 4000–700 см–1 позволяют предположить присутствие в МА-смеси аморфного основного карбоната гадолиния состава Gd2(OH)2(3 – x)(CO3)x ⋅ Н2О (x ≈ 1–2) [46–48]. Полосы в области 600–400 см–1 характерны для оксидов гадолиния и циркония [47, 49].
Рис. 1.
Рентгенограммы МА-смеси оксидов гадолиния и циркония без и после термической обработки в течение 3 ч при различных температурах.
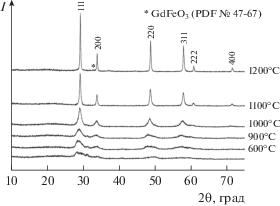
Рис. 2.
ИК-спектры МА-смеси оксидов гадолиния и циркония без и после термической обработки в течение 3 ч при различных температурах.
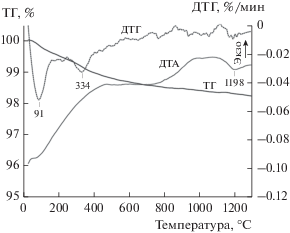
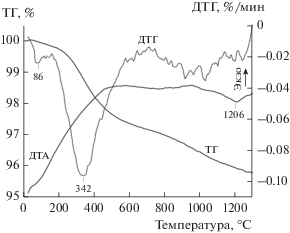
Кривые ДТА, ТГ и ДТГ исходной смеси оксидов и МА-смеси представлены на рис. 3 и 4 соответственно. Суммарные потери массы для смесей составили 1.77 и 4.22 мас. % соответственно. Пики на кривых ДТГ при 91°С (рис. 3) и 86°С (рис. 4) отвечают удалению адсорбированной воды. Пики при 334°С (рис. 3) и 342°С (рис. 4) на этих же кривых, вероятно, относятся к удалению структурной воды. При дальнейшем повышении температуры происходит разложение карбонатных групп с выделением углекислого газа [37, 42].
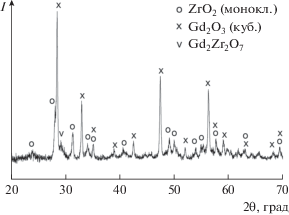
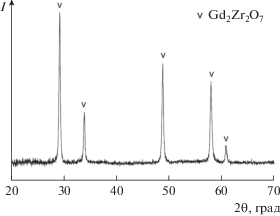
На кривой ДТА исходной смеси Gd2O3 и ZrO2 (рис. 3) присутствует эндоэффект при 1198°С, наблюдающийся при практически полном удалении летучих компонентов. Он может быть отнесен к двум обратимым полиморфным превращениям, протекающим в этой области температур: Gd2O3(куб.) → Gd2O3(монокл.) (1150–1200°С [50, 51]) и ZrO2(монокл.) → ZrO2(тетр.) (1170°С [52]). Это предположение согласуется с данными РФА исходной смеси оксидов после термического анализа (рис. 5), согласно которым основу этого образца составляют Gd2O3(куб.) (PDF № 12-0797) и ZrO2(монокл.) (PDF № 37-1484). На рентгенограмме МА-смеси оксидов после термического анализа (рис. 6) в отличие от исходной смеси (рис. 5) присутствуют только рефлексы цирконата гадолиния, что свидетельствует о полном протекании синтеза Gd2Zr2O3.
Влияние МА, по-видимому, сводится к действию следующих факторов. При обработке в центробежно-планетарной мельнице происходит не только диспергирование частиц реагентов и их механическое смешение с образованием точек контакта. Вследствие пластического течения твердых тел под действием импульсов давления точечные контакты увеличиваются до контактов по некоторой межфазной поверхности. Это приводит к уменьшению толщины слоя продукта при прокаливании МА-смеси и, следовательно, снижает диффузионные затруднения при синтезе. Кроме того, при интенсивной механической обработке накапливается избыточная энергия реагентами за счет различного рода структурных нарушений [33]. Все это способствует существенному ускорению твердофазной реакции образования цирконата гадолиния по сравнению с ее традиционным вариантом (без применения МА).
Кривая ТГ МА-смеси в области температур 1100–1300°С (рис. 4), в отличие от кривой исходной смеси реагентов (рис. 3), имеет значительный наклон, что свидетельствует о заметном удалении летучих компонентов (СО2) в этом интервале температур. Следует отметить, что при аналогичном синтезе цирконата лантана полное удаление воды и углекислого газа из МА-смеси оксидов La и Zr с выходом кривой ТГ на горизонтальный участок (при таких же условиях термического анализа) происходило при 1200°С [42]. Объяснить это различие можно на основе следующих термодинамических оценок. С повышением температуры, по мере разложения основных карбонатов РЗЭ в МА-смесях, оксиды лантана и гадолиния взаимодействуют с ZrO2 с образованием соответствующих цирконатов по реакциям:
(2)
${\text{L}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{гекс}}{\text{.}}} \right) + 2{\text{Zr}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{монокл}}{\text{.}}} \right) = {\text{L}}{{{\text{a}}}_{{\text{2}}}}{\text{Z}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}},$(3)
${\text{G}}{{{\text{d}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{куб}}{\text{.}}} \right) + 2{\text{Zr}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{монокл}}{\text{.}}} \right) = {\text{G}}{{{\text{d}}}_{{\text{2}}}}{\text{Z}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}.$Энергии Гиббса реакций (2) и (3), вычисленные с использованием данных по стандартным энтальпиям этих реакций [53, 54] и стандартным энтропиям реагентов и цирконатов (пирохлорные модификации) [51, 52, 55, 56], составили ${{\Delta }_{r}}G_{{298}}^{^\circ }$(2) = –(109 ± 12) кДж/моль и ${{\Delta }_{r}}G_{{298}}^{^\circ }$(3) = = –(56 ± 5) кДж/моль. Следовательно, синтез цирконата лантана из оксидов – энергетически значительно более выигрышный процесс в сравнении с цирконатом гадолиния, что согласуется с большей основностью La по отношению к Gd. Поэтому можно ожидать, что при непрерывном повышении температуры МА-смесей в ходе термического анализа образование La2Zr2O7 при температурах выше 1100°С уже практически завершится [42], а образование Gd2Zr2O7 будет идти достаточно активно одновременно с разложением карбонатных групп. В этой связи вид кривой ДТА МА-смеси в области 1100–1300°С (рис. 4), по-видимому, определяется наложением эндотермического процесса удаления СО2 и экзотермического образования цирконата гадолиния, что согласуется с данными РФА (рис. 6). При изотермической термообработке МА-смеси полное разложение карбонатных групп происходит, по данным ИК-спектроскопии, после прокаливания при 1100°С в течение 3 ч (рис. 2).
Повышение температуры термообработки МА-смеси оксидов приводит к росту интенсивности и сужению пиков цирконата Gd на рентгенограммах, причем выше 1000°С эти процессы заметно ускоряются (рис. 1). Отсутствие на рентгенограммах в области углов 2θ 14°–15° и 37°–38° характерных для Р-Gd2Zr2O7 (PDF № 79-1146) рефлексов 111 и 331 свидетельствует об образовании флюоритоподобного цирконата гадолиния (PDF № 80-0471). Следует упомянуть, что формирование упорядоченной пирохлорной фазы может происходить на уровне нанодоменов, обнаружение которых находится за границами возможности стандартного РФА. Для идентификации Р-Gd2Zr2O7 в этом случае необходимо использовать КР-спектроскопию и рентгеновские локально-чувствительные методы структурного анализа с применением синхротронного излучения [19, 36].
По данным химического анализа, в МА-смеси содержался ∼1% металлического железа за счет самоистирания шаров и барабана мельницы (намола), что привело при термообработке к образованию примесной фазы GdFeO3 (рис. 1). Для предотвращения загрязнения продукта синтеза целесообразно проводить МА с использованием шаров из металлического циркония и стальных барабанов, футерованных цирконием. Намол (металлический Zr) при прокаливании на воздухе будет окисляться до диоксида циркония.
По уширению рентгеновских пиков (рис. 1) методом Шеррера [57] были оценены средние размеры кристаллитов цирконата гадолиния, полученного прокаливанием МА-смеси при температурах 900, 1000, 1100 и 1200°С в течение 3 ч, которые составили 6, 9, 29 и 68 нм соответственно. При этом необходимо учитывать, что термообработка при 900 и 1000°С, по данным ИК-спектроскопии (рис. 2), не позволяет полностью удалить летучие компоненты из-за неполного разложения карбонатных групп.
На рис. 7 приведено СЭМ-изображение образца Gd2Zr2O7, полученного термообработкой МА-смеси при 1100°С. Порошок цирконата гадолиния в основном состоит из частиц субмикронного размера, которые объединены в агрегаты размером до нескольких микрон. Удельная поверхность этого образца равна 1.30 м2/г. С использованием значений Sуд и плотности цирконата гадолиния (ρ = 6.993 г/см3 [58]) по формуле (1) определили средний размер частиц, который составил 660 нм, что в целом согласуется с данными СЭМ (рис. 7).
ЗАКЛЮЧЕНИЕ
Впервые показано, что нанокристаллический Gd2Zr2O7 может быть синтезирован твердофазным способом: нагреванием при температуре 1100–1200°С в течение 3 ч предварительно МА-смеси оксидов гадолиния и циркония.
Значительное снижение температуры прокаливания (на 300–500°С) и его длительности (более чем на порядок) по сравнению с традиционным твердофазным синтезом достигается за счет гомогенизации смеси реагентов, увеличения площади контакта между ними и существенного повышения их реакционной способности в результате структурных нарушений при интенсивной механообработке в центробежно-планетарной мельнице АГО-2 в течение 10 мин.
МА смеси Gd2О3 и ZrO2 сопровождается поглощением атмосферной влаги и углекислого газа с образованием основного карбоната гадолиния. Полное протекание синтеза цирконата гадолиния с удалением всех летучих примесей (Н2О и СО2) происходит при нагревании МА-смеси в течение 3 ч при 1100°С.
Рассчитанные по методу Шеррера размеры кристаллитов Gd2Zr2O7 составили 6, 9, 29 и 68 нм для образцов, полученных термообработкой МА-смеси оксидов при 900, 1000, 1100 и 1200°С соответственно.
Список литературы
Duarte W., Vardelle M., Rossignol S. Effect of the Precursor Nature and Preparation Mode on the Coarsening of La2Zr2O7 Compounds // Ceram. Int. 2016. V. 42. P. 1197–1209. https://doi.org/10.1016/j.ceramint.2015.09.051
Xu C., Wang L., Bai B., Peng L., Cai S. Rapid Synthesis of Gd2Zr2O7 Ceramics by Flash Sintering and Its Aqueous Durability // Eur. Ceram. Soc. 2020. V. 40. P. 1620–1625. https://doi.org/10.1016/j.jeurceramsoc.2019.11.060
Sivakumar S., Praveen K., Shanmugavelayutham G. Preparation and Thermophysical Properties of Plasma Sprayed Lanthanum Zirconate // Mater. Chem. Phys. 2018. V. 204. P. 67–71. https://doi.org/10.1016/j.matchemphys.2017.10.031
Zinatloo-Ajabshir S., Salavati-Niasari M., Sobhari A., Zinatloo-Ajabshir Z. Rare Earth Zirconate Nanostructures: Recent Development on Preparation and Photocatalytic Applications // J. Alloys Compd. 2018. V. 767. P. 1164–1185. https://doi.org/10.1016/j.jallcom.2018.07.198
Ewing R.C., Weber W.J., Lian J. Nuclear Waste Disposal-pyrochlore (A2B2O7): Nuclear Waste Form for the Immobilization of Plutonium and “Minor” Actinides // J. Appl. Phys. 2004. V. 95. P. 5949–5971. https://doi.org/10.1063/1.1707213
Zhou D., Mack D.E., Bakan E., Mauer G., Sebold D., Guillon O., Vaßen R. Thermal Cycling Performances of Multilayered Yttria-stabilized Zirconia/Gadolinium Zirconate Thermal Barrier Coatings // J. Am. Ceram. Soc. 2020. V. 103. P. 2048–2061. https://doi.org/10.1111/jace.16862
Караулов А.Г., Зоз Е.И., Шляхова Т.М. Структура и свойства огнеупоров на основе диоксида циркония, стабилизированного оксидом гадолиния // Огнеупоры и техническая керамика. 1996. № 3. С. 12–16.
Diaz-Guillen J.A., Fuentes A.F., Diaz-Guillen M.R., Almanza J.M., Santamaria J., Leon C. The Effect of Homovalent A-Site Substitutions on the Ionic Conductivity of Pyrochlore-type Gd2Zr2O7 // J. Power. Sources 2009. V. 186. P. 349−352. https://doi.org/10.1016/j.jpowsour.2008.09.106
Pan W., Phillpot S.R., Wan C.L., Chernatynskiy A., Qu Z.X. Low Thermal Conductivity Oxides // Mater. Res. Bull. 2012. V. 37. P. 917–922. https://doi.org/10.1557/mrs.2012.234
Diaz-Guillen J.A., Dura O.J., Diaz-Guillen M.R., Bauer E., Lopez de la Torre M.A., Fuentes A.F. Thermophysical Properties of Gd2Zr2O7 Powders Prepared by Mechanical Milling: Effect of Homovalent Gd3+ Substitution // J. Alloys Compd. 2015. V. 649. P. 1145−1150. https://doi.org/10.1016/j.jallcom.2015.07.146
Wang C., Guo L., Zhang Y., Zhao X., Ye F. Enhanced Thermal Expansion and Fracture Toughness of Sc2O3-Doped Gd2Zr2O7 Ceramics // Ceram. Int. 2015. V. 41. P. 10730–10735. https://doi.org/10.1016/j.ceramint.2015.05.008
Subramanian M., Aravamudan G., Subba Rao G.V. Oxide Pyrochlores – a Review // Prog. Solid State Chem. 1983. V. 15. № 2. P. 55–143. https://doi.org/10.1016/0079-6786(83)90001-8
Kong S.L., Karatchevtseva I., Gregg D.J., Blackford M.G., Holmes R., Triani G. Gd2Zr2O7 and Nd2Zr2O7 Pyrochlore Prepared by Aqueous Chemical Synthesis // J. Eur. Ceram. Soc. 2013. V. 33. P. 3273–3285. https://doi.org/10.1016/j.jeurceramsoc.2013.05.011
Kaliyaperumal C., Sankarakumar A., Paramasivam T. Grain Size Effect on the Electrical Properties of Nanocrystalline Gd2Zr2O7 Ceramics // J. Alloys Compd. 2020. V. 813. 152221. https://doi.org/10.1016/j.jallcom.2019.152221
Li W., Zhang K., Xie D., Deng T., Luo B., Zhang H., Huang X. Characterizations of Vacuum Sintered Gd2Zr2O7 Transparent Ceramics Using Combustion Synthesized Nanopowder // J. Eur. Ceram. Soc. 2020. V. 40. P. 1665–1670. https://doi.org/10.1016/j.jeurceramsoc.2019.12.007
Yang Y., Huang Z., Shi C., Duan J. Cheng G., Wang H., Wu D., Qi J., Lu T. Liquid-Solid-Solution Synthesis of Ultrafine Gd2Zr2O7 Nanoparticles with Yield Enhancement // Ceram. Int. 2020. V. 46. P. 1216–1219. https://doi.org/10.1016/j.ceramint.2019.08.254
Zhong F., Zhao J., Shi L., Xiao Y., Cai G., Zheng Y., Long J. Alkaline-Earth Metals-Doped Pyrochlore Gd2Zr2O7 as Oxygen Conductors for Improved NO2 Sensing Performance // Sci. Rep. 2017. V. 7. 4684. https://doi.org/10.1038/s41598-017-04920-1
Sevastyanov V.G., Simonenko E.P., Simonenko N.P., Sakharov K.A., Kuznetsov N.T. Synthesis of Finely Dispersed La2Zr2O7, La2Hf2O7, Gd2Zr2O7 and Gd2Hf2O7 Oxides // Mendeleev Commun. 2013. V. 23. P. 17–18. doi: m.2013.01.005https://doi.org/10.1016/j.menco
Попов В.В., Зубавичус Я.В., Менушенков А.П., Ярославцев А.А., Кулик Э.С., Петрунин В.Ф., Коровин С.А., Трофимова Н.Н. Баланс ближнего и дальнего порядка в нанокристаллических порошках Gd2Zr2O7 с флюорито-пирохлорной структурой // Журн. неорган. химии. 2014. Т. 59. № 4. С. 431–438. https://doi.org/10.7868/S0044457X1404014X
Jiang L., Wang C., Wang J., Liu F., You R., Lv S., Zeng G., Zijie Yang, He J., Liu A. Yan X., Sun P., Zheng J., Lu G. Pyrochlore Ca-Doped Gd2Zr2O7 Solid State Electrolyte Type Sensor Coupled with ZnO Sensing Electrode for Sensitive Detection of HCHO // Sens. Actuators, B. 2020. V. 309. 127768. https://doi.org/10.1016/j.snb.2020.127768
Tang Z., Huang Z., Qi J., Guo X., Han W., Zhou M., Penga S., Lu T. Synthesis and Characterization of Gd2Zr2O7 Defect-Fluorite Oxide Nanoparticles via a Homogeneous Precipitation-solvothermal Method // RSC Adv. 2017. V. 7. P. 54980–54985. https://doi.org/10.1039/C7RA11019G
Liu S., Jiang K., Zhang H., Liu Y., Zhang L., Su B., Liu Y. Nano-nano Composite Powders of Lanthanum-Gadolinium Zirconate and Gadolinia-Stabilized Zirconia Prepared by Spray Pyrolysis // Surf. Coat. Technol. 2013. V. 232. P. 419–424. https://doi.org/10.1016/j.surfcoat.2013.05.044
Mandal B.P., Tyagi A.K. Preparation and High Temperature-XRD Studies on a Pyrochlore Series with the General Composition Gd2 –xNdxZr2O7 // J. Alloys Compd. 2007. V. 437. P. 260–263. https://doi.org/10.1016/j.jallcom.2006.07.093
Liu Z.G., Ouyang J.H., Zhou Y., Xia X.L. Effect of Ti Substitution for Zr on the Thermal Expansion Property of Fluorite-Type Gd2Zr2O7 // Mater. Des. 2009. V. 30. P. 3784–3788. https://doi.org/10.1016/j.matdes.2009.01.030
Yang J., Shu X., Luo F., Wang L., Gu Y., Wu J., Liu X. Solubility of Sr2+ in the Gd2Zr2O7 Ceramics via Appropriate Occupation Designs // J. Alloys Compd. 2019. V. 808. 151563. https://doi.org/10.1016/j.jallcom.2019.07.275
Patwe S.J., Tyagi A.K. Solubility of Ce4+ and Sr2+ in the Pyrochlore Lattice of Gd2Zr2O7 for Simulation of Pu and Alkaline Earth Metal // Ceram. Int. 2006. V. 32. P. 545–548. https://doi.org/10.1016/j.ceramint.2005.04.009
Kennedy B.J., Zhou Q., Avdeev M. Neutron Diffraction Studies of Gd2Zr2O7 Pyrochlore // J. Solid State Chem. 2011. V. 184. P. 1695–1698. https://doi.org/10.1016/j.jssc.2011.04.003
Sattonnay G., Moll S., Thome L., Decorse C., Legros C., Simon P., Jagielski J., Jozwik I., Monnet I. Phase Transformations Induced by High Electronic Excitation in Ion-Irradiated Gd2(ZrxTi1 –x)2O7 Pyrochlores // J. Appl. Phys. 2010. V. 108. 103512. https://doi.org/10.1063/1.3503452
Hu Q., Zeng J., Wang L., Shu X., Shao D., Zhang H., Lu X. Helium Ion Irradiation Effects on Nd and Ce Co-Doped Gd2Zr2O7 Pyrochlore Ceramic // J. Rare Earth. 2018. V. 36. P. 398–403. https://doi.org/10.1016/j.jre.2017.11.005
Хайнике Г. Трибохимия. М.: Мир, 1987. 584 с.
Болдырев В.В. Механохимия и механическая активация твердых веществ // Успехи химии. 2006. Т. 75. № 3. С. 203–216.
Фундаментальные основы механической активации, механосинтеза и механохимических технологий / Под ред. Аввакумова Е.Г. Новосибирск: Изд. СО РАН, 2009. 342 с.
Аввакумов Е.Г. Механические методы активации химических процессов. Новосибирск: Наука, 1986. 305 с.
Бутягин П.Ю. Проблемы и перспективы развития механохимии // Успехи химии. 1994. Т. 63. № 12. С. 1031–1043.
Moreno K.J., Fuentes A.F., García-Barriocanal J., León C., Santamaría J. Mechanochemical Synthesis and Ionic Conductivity in Gd2(Sn1 –yZry)2O7 (0 ≤ y ≤ 1) Solid Solution // J. Solid State Chem. 2006. V. 179. P. 323–330. https://doi.org/10.1016/j.jssc.2005.09.036
Fuentes A.F., Montemayor S.M., Maczka M., Lang M., Ewing R.C., Amador U. Critical Review of Existing Criteria for the Prediction of Pyrochlore Formation and Stability // Inorg. Chem. 2018. V. 57. P. 12093–12105. https://doi.org/10.1021/acs.inorgchem.8b01665
Калинкин А.М., Калинкина Е.В., Залкинд О.А., Васильева Т.Н. Влияние механической активации на реакционную способность оксидов редкоземельных элементов и иттрия // Журн. прикл. химии. 2004. Т. 77. № 10. С. 1610–1617.
Brykała U., Diduszko R., Jach K., Jagielski J. Hot Pressing of Gadolinium Zirconate Pyrochlore // Ceram. Int. 2015. V. 41. P. 2015–2021. doi: int.2014.09.114https://doi.org/10.1016/j.ceram
Kalinkin A.M., Nevedomskii V.N., Kalinkina E.V., Balyakin K.V. Milling Assisted Synthesis of Calcium Zirconate CaZrO3 // Solid State. Sci. 2014. V. 34. P. 91–96. https://doi.org/10.1016/j.solidstatesciences.2014.06.002
Калинкин А.М., Балякин К.В., Калинкина Е.В., Неведомский В.Н. Твердофазный синтез нанокристаллического цирконата стронция с применением механоактивации // Журн. общ. химии. 2016. Т. 86. № 4. С. 596–602.
Калинкин А.М., Балякин К.В., Калинкина Е.В., Неведомский В.Н. Твердофазный синтез нанокристаллического BaZrO3 с применением механоактивации // Неорган. материалы. 2017. Т. 53. № 5. С. 498–504. https://doi.org/10.7868/S0002337X17050116
Калинкин А.М., Усольцев А.В., Калинкина Е.В., Неведомский В.Н., Залкинд О.А. Твердофазный синтез нанокристаллического цирконата лантана с применением механоактивации // Журн. общ. химии. 2017. Т. 87. № 10. С. 1597–1604.
Химическая энциклопедия. Т. 1 / Гл. ред. Кнунянц И.Л. М.: Сов. энциклопедия, 1988. С. 450.
Химическая энциклопедия. Т. 5 / Гл. ред. Зефиров Н.С. М.: Сов. энциклопедия, 1998. С. 387.
Зырянов В.В. Механохимический синтез сложных оксидов // Успехи химии. 2008. Т. 77. № 8. С. 107–137.
Dassuncao L.M., Giolito I., Ionashiro M. Thermal Decomposition of the Hydrated Basic Carbonates of Lanthanides and Yttrium // Thermochim. Acta. 1989. V. 137. P. 319–330. https://doi.org/10.1016/0040-6031(89)87224-7
Gaspar R.D.L., Mazali I.O., Sigoli F.A. Particle Size Tailoring and Luminescence of Eeuropium(III)-doped Gadolinium Oxide Obtained by the Modified Homogeneous Precipitation Method: Dielectric Constant and Counter Anion Effects // Colloids Surf., A. 2010. V. 367. P. 155–160. https://doi.org/10.1016/j.colsurfa.2010.07.003
Caro P., Lemaitre-Blasse M. Hydroxycarbonates de Terres Rares Ln2(CO3)x(OH)2(3 – x)CO3 ∙ nH2O (Ln = = Terres Rares) // C. R. Acad. Sci. 1969. № 269. P. 687–619.
Phillippi C.M., Mazdiyasni K.S. Infrared and Raman Spectra of Zirconia Polymorphs // J. Am. Ceram. Soc. 1971. V. 54. P. 254–258. https://doi.org/10.1111/j.1151-2916.1971.tb12283.x
Adachi G., Imanaka N. The Binary Rare Earth Oxides // Chem. Rev. 1998. V. 98. P. 1479–1514. https://doi.org/10.1021/cr940055h
Zinkevich M. Thermodynamics of Rare Earth Sesquioxides // Prog. Mater. Sci. 2007. V. 52. P. 597–647. https://doi.org/10.1016/j.pmatsci.2006.09.002
Belov G.V., Iorish V.S., Yungman V.S. IVTANTHERMO for Windows–Database on Thermodynamic Properties and Related Software // Calphad. 1999. V. 23. № 2. P. 173–180. https://doi.org/10.1016/S0364-5916(99)00023-1
Корнеев В.Р., Глушкова В.Б., Келер Э.К. Теплоты образования цирконатов редкоземельных элементов // Неорган. материалы. 1971. Т. 7. № 5. С. 886–887.
Helean K.B., Begg B.D., Navrotsky A., Ebbinghaus B., Weber W.J., Ewing R.C. Enthalpies of Formation of Gd2(Ti2 –xZrx)O7 Pyrochlores // MRS Proc. 2000. V. 663. P. 691–697. https://doi.org/10.1557/PROC-663-691
Bolech M., Cordfunke E.H.P., van Genderen A.C.G., van der Laan R.R., Janssen F.J.J.G., van Miltenburg J.C. The Heat Capacity and Derived Thermodynamic Functions of La2Zr2O7 and Ce2Zr2O7 from 4 to 1000 K // J. Phys. Chem. Solids. 1997. V. 58. P. 433–439. https://doi.org/10.1016/S0022-3697(06)00137-5
Lutique S., Javorsky P., Konings R.J.M., Krupa J.-C., van Gendern A.C.G., van Miltenburg J.C., Wastin F. The Low-temperature Heat Capacity of Some Lantanide Zirconates // J. Chem. Thermodyn. 2004. V. 36. P. 609–618. https://doi.org/10.1016/j.jct.2004.03.017
Дорофеев Г.А., Стрелецкий А.Н., Повстугар И.В., Протасов А.В., Елсуков Е.П. Определение размеров наночастиц методами рентгеновской дифракции // Коллоид. журн. 2012. Т. 74. № 6. С. 710–720.
Lehmann H., Pitzer D., Pracht G., Vassen R., Stöver D. Thermal Conductivity and Thermal Expansion Coefficients of the Lanthanum Rare-Earth-element Zirconate System // J. Am. Ceram. Soc. 2003. V. 86. P. 1338–1344.https://doi.org/10.1111/j.1151-2916.2003.tb034 73.x
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы