Неорганические материалы, 2021, T. 57, № 5, стр. 528-535
Синтез и физико-химические свойства наноструктурированного TiO2 с повышенной фотокаталитической активностью
И. Б. Дорошева 1, 2, 3, *, А. А. Валеева 1, 2, А. А. Ремпель 1, 2, 3, М. А. Тресцова 2, И. А. Утепова 2, 4, О. Н. Чупахин 2, 4
1 Институт химии твердого тела УрО Российской академии наук
620990 Екатеринбург, ул. Первомайская, 91, ГСП, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
3 Институт металлургии УрО Российской академии наук
620016 Екатеринбург, ул. Амундсена, 101, Россия
4 Институт органического синтеза им. И.Я. Постовского УрО Российской академии наук
620137 Екатеринбург, ул. С. Ковалевской, 22/20, Россия
* E-mail: i.b.dorosheva@urfu.ru
Поступила в редакцию 22.04.2020
После доработки 11.11.2020
Принята к публикации 17.12.2020
Аннотация
Золь–гель-методом при значении рН исходного спиртового раствора тетрабутоксититана, равным шести, синтезирован наноструктурированный диоксид титана (TiO2) с размером областей когерентного рассеяния (ОКР) от 10 до 85 нм, фотокаталитически активный в органических реакциях под воздействием видимого света. Рентгенофазовый анализ показал, что синтезированный образец имеет аморфную структуру, отжиг в среде водорода в течение 1 ч при 400°C приводит к образованию фазы анатаза, а в интервале температур от 600 до 800°C происходит переход анатаз–рутил. Размер ОКР увеличивается от 10 до 75 нм при повышении температуры отжига от 400 до 1000°C при выдержке в печи в течение 1 ч и от 60 до 85 нм с увеличением продолжительности отжига от 30 до 240 мин при температуре 800°C. Спектры диффузного отражения показывают уменьшение ширины запрещенной зоны от 3.3 до 2.6 эВ при повышении температуры отжига от 200 до 1000°C. Определение удельной площади поверхности методом БЭТ показало, что минимальная площадь наблюдается для образцов, отожженных при максимальной температуре (1000°C) – значения уменьшаются от 307 до 1 м2/г. Протестированная эффективность полученного TiO2 как фотокатализатора в реакции окислительного $S_{{\text{N}}}^{{\text{H}}}$-кросс-сочетания акридина с индолом показала увеличение выхода продукта от 35 до 80% при повышении температуры отжига до 800°C. Продолжительность отжига при 800°С от 30 до 180 мин не влияет на выход продукта реакции, который находится в диапазоне 70–80%.
ВВЕДЕНИЕ
В настоящее время кристаллические модификации наноразмерного диоксида титана (TiO2) представляют большой интерес в связи с перспективой их использования в качестве функциональных материалов для возобновляемых источников энергии [1], неорганических сорбентов [2], элементов резистивной памяти [3], применения в нанобиомедицине в составе сложных гибридных конструкций для целенаправленной доставки лекарств [4], а также в фотокаталитических реакциях [5]. Поскольку TiO2 является недорогим и нетоксичным поликристаллическим фотокатализатором, он широко и эффективно используется как в газовых, так и в жидких системах в реакциях окисления органических веществ до их полного разложения [6–8]. Кроме того, в последнее десятилетие некоторые среднезонные полупроводники, в частности TiO2 [9, 10], стали широко применяться в органическом фотосинтезе [11], поскольку они, обладая достаточно широкой запрещенной зоной, являются как сильными окислителями, так и сильными восстановителями. Использование энергии солнечного излучения и гетерогенные катализаторы для применения в фотохимических процессах органического синтеза упоминаются еще в 1912 г. [12], однако данное направление стало развиваться на практике спустя несколько десятилетий [11–14].
Для получения наночастиц TiO2 используются разные методы, такие как сольвотермальный [15], гидротермальный [16], анодное окисление [17], химическое осаждение из паровой фазы [18], электроосаждение [19], сонохимический [20] и микроволновой методы [21]. Перечисленные методы требуют специального оборудования и особых условий, что усложняет процесс синтеза TiO2 и делает его дорогостоящим. Золь–гель-метод синтеза TiO2 [22, 23] является недорогим и достаточно простым в исполнении.
В настоящее время нет четкого и всестороннего понимания механизма зарождения наночастиц TiO2 различных модификаций (аморфная, анатаз, рутил и брукит) и их фотокаталитической активности в реакциях органического синтеза, в частности в реакциях дегидрогенативного кросс-сочетания. Две аллотропные формы TiO2 (анатаз и рутил) в одинаковых условиях дают различные результаты по выходу продукта реакции и селективности в зависимости от природы гетероароматического субстрата [24–26].
Ранее для оценки эффективности полученных катализаторов в качестве простой и удобной модели было выбрано окислительное аэробное $S_{{\text{N}}}^{{\text{H}}}$-кросс-сочетание акридина с индолом [27]. В этом превращении используется наиболее доступный окислитель – кислород воздуха, побочным продуктом является вода, что соответствует требованиям зеленой химии. Полученный TiO2 дает выход продукта реакции около 50%. Сравнимую величину выхода имеют промышленные порошки Degussa P25 и Hombifine. Стоит отметить, что при проведении эксперимента в темноте реакция не была зарегистрирована [27]. Кроме того, ранее [28, 29] было показано, что окислительные системы: кислород воздуха–наноразмерный TiO2–облучение УФ-светом и кислород воздуха–композитный материал CdS/TiO2–облучение светом видимого диапазона позволяют в мягких условиях проводить окислительные сочетания нуклеофильных реагентов с широким набором азиновых субстратов. Разработанный метод позволяет получать с высокими выходами и селективностью би(гетеро)арилы, которые представляют интерес для биотестирования [30–34]. Производные таких соединений обладают противоопухолевой, противогрибковой и антимикробной активностями [35–37].
Несмотря на большой объем экспериментальных данных в области окислительных $S_{{\text{N}}}^{{\text{H}}}$-кросс-сочетаний, роль катализаторов окисления, особенно гетерогенных, изучена очень слабо [28, 30, 31].
Целью данной работы является установление влияния температуры и продолжительности дополнительного отжига в потоке водорода аморфного TiO2 на его физико-химические свойства для повышения его фотокаталитической эффективности в реакции дегидрогенативного кросс-сочетания гетероароматических нуклеофилов с азинами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Золь–гель-методом синтезировано 11 образцов наноразмерного TiO2 при значении pH исходного раствора ≈6. В качестве исходных реагентов использовались тетрабутоксититан Ti(C4H9O)4 (ОСЧ 7-5), этиловый спирт C2H5OH (95%) и дистиллированная вода H2O в объемном отношении 1 : 1 : 4. Синтез TiO2 проводили следующим образом. Тетрабутоксититан смешивали с этиловым спиртом до однородного состояния в перемешивающем устройстве ПЭ-6300 М в течение 10 мин, после чего добавляли дистиллированную воду и перемешивали еще 10 мин. Температура золя при перемешивании поддерживалась на уровне 50°С. Частота вращения перемешивающего устройства на всех этапах была одинакова и составляла около 26 об./мин. Полученный гель подвергался сушке на воздухе в течение 10 ч. После этого полученные порошки TiO2 отжигали в трубчатой печи МПТ-2МР в атмосфере водорода при температурах 200, 400, 600, 800 и 1000°С в течение 60 мин и при 800°C в течение 30, 90, 120, 180 и 240 мин. Водород во время отжига поступал в систему из генератора ГВЧ-12А.
Синтезированный золь–гель-методом TiO2 до и после отжига в водороде исследовали с помощью рентгенофазового анализа, используя ${\text{Cu}}{{K}_{{{{{{\alpha }}}_{{{\text{1}},{\text{2}}}}}}}}$-излучение, на дифрактометре Shimadzu XRD-7000 с геометрией Брэгга–Брентано. Рентгенограммы снимались в режиме пошагового сканирования с шагом Δ(2θ) = 0.02° в диапазоне 2θ от 10° до 100° с высокой статистикой в каждой точке. Периоды кристаллических решеток анатаза и рутила определялись по методу Ритвельда. Размеры областей когерентного рассеяния (ОКР) TiO2 рассчитывали по формуле: $D = \frac{1}{{\beta *}},$ где β* – приведенное уширение, рассчитанное по формуле β*(2θ) = $\frac{{\beta (2\theta )\cos \theta }}{\lambda },$ а уширение дифракционных рефлексов определяли как β = $\sqrt {{\text{FWHM}}_{{obs}}^{2} - {\text{FWHM}}_{R}^{2}} ,$ где FWHMobs – полная ширина рефлекса на половине высоты, FWHMR – полная ширина пика инструментальной функции дифрактометра. Размерный и деформационный вклады в уширение рефлексов определяли методом Вильямсона–Холла. Относительная погрешность расчетов D составила 10%.
Спектры диффузного отражения образцов были записаны на FS-5-спектрофотометре в ультрафиолетовой и видимой областях. Для определения ширины запрещенной зоны по спектрам диффузного отражения использовалась функция Кубелки–Мунка: ${{(h\nu F(R))}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$ где R – коэффициент отражения, h – постоянная Планка, ν – частота и $F(R) = \frac{{{{{(1 - R)}}^{2}}}}{{2R}}.$
Удельную поверхность определяли методом БЭТ с помощью анализатора Gemini VII 2390. Предварительная дегазация образцов проводилась в течение 2 ч при температуре 200°С.
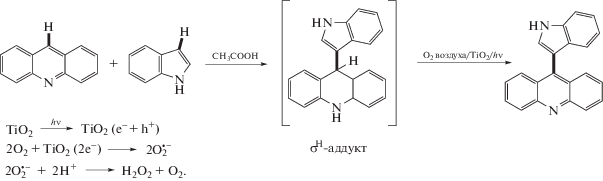
Все образцы наноразмерного TiO2 были протестированы в окислительном $S_{{\text{N}}}^{{\text{H}}}$-кросс-сочетании акридина с индолом в одинаковых экспериментальных условиях [27]. Ниже приведена схема образования супероксидных анион-радикалов на поверхности TiO2:
Кварцевую колбу, содержащую раствор акридина (0.56 ммоль), индола (0.56 ммоль) в уксусной кислоте (10 мл) и катализатор TiO2 (10 мас. %), обрабатывали ультразвуком в течение 5 мин для получения суспензии. Полученную смесь облучали натриевой лампой (150 Вт, 50 клк) при барботаже воздухом и комнатной температуре (20°C). Реакцию завершали через 5 ч. Реакционную массу концентрировали при пониженном давлении. Полученный остаток обрабатывали 15%-ным водным раствором аммиака до образования осадка, отфильтровывали, промывали водой и сушили на воздухе. Высушенный осадок подвергали препаративной колоночной хроматографии на SiO2.
Спектры ЯМР 1H (400 МГц) записывали на спектрометре Bruker-400 AVANCE II в ДМСО-d6, химические сдвиги приведены в шкале δ относительно Me4Si.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгенофазовый анализ порошков TiO2 (рис. 1) показал, что синтезированные образцы и образцы после отжига в потоке водорода в течение 1 ч при температуре 200°C обладают аморфной структурой: на рентгенограмме при 2θ $ \simeq {\kern 1pt} 30^\circ $ и $ \simeq {\kern 1pt} 45^\circ $ наблюдается гало, а дифракционные пики полностью отсутствуют. Отжиг при температуре 400°C приводит к образованию фазы анатаза, о чем свидетельствуют рефлексы в области углов 2θ – 25°, 37°, 48°, 55° и 62°. Низкая интенсивность этих рефлексов говорит о том, что кристаллическая модификация занимает только часть объема образца, в образце сохраняется аморфная фаза. При температуре отжига 600°С происходит полная кристаллизация фазы анатаза, поскольку рефлексы в указанных областях 2θ становятся более интенсивными, а также становятся выраженными при 2θ $ \simeq $ 25°, 37°, 48°, 55° и 62°. Отжиг при температуре 800°С приводит к переходу анатаз–рутил, о чем свидетельствует появление пиков в областях 2θ = 27°, 36°, 39°, 41°, 44°, 54° и 69°. Новая кристаллическая модификация продолжает формироваться при 1000°С. Изменение постоянных кристаллических решеток анатаза и рутила при изменении температуры и времени (табл. 1) отжига происходит в пределах ошибки эксперимента, что не дает возможности судить об изменении стехиометрии образцов.
Рис. 1.
Рентгенограммы порошков TiO2, отожженных в потоке водорода при различных температурах в течение 1 ч (а), при 800°C и разной продолжительности (б).
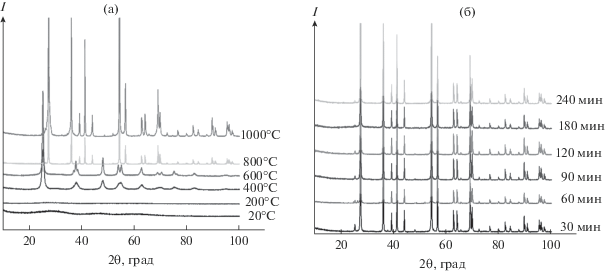
Таблица 1.
Характеристики порошков диоксида титана, полученных при различных температурах отжига в атмосфере водорода в течение 1 ч
| tотж, °С | 200 | 400 | 600 | 800 | 1000 |
| Структура | Аморфная | Аморфная + анатаз | Анатаз | Рутил | Рутил |
| a, пм c, пм |
– | 379 ± 0.1 950 ± 0.1 |
378 ± 0.1 949 ± 0.1 |
459 ± 0.1 296 ± 0.1 |
459 ± 0.1 296 ± 0.1 |
| Eg, эВ | 3.2 ± 0.2 | 3.1 ± 0.2 | 3.2 ± 0.2 | 2.6 ± 0.2 | 2.6 ± 0.2 |
| D, нм | – | 10 ± 2 | 15 ± 2 | 60 ± 3 | 75 ± 5 |
| Seff, м2/г | 307 ± 13 | 120 ± 2 | 38 ± 1 | 2.0 ± 0.1 | 1.0 ± 0.1 |
Поскольку образец TiO2, который был отожжен в потоке водорода при температуре 800°C, показал фотокаталитическую активность выше остальных образцов, были проведены дополнительные эксперименты, в которых образцы отжигались при 800°C в течение 30, 90, 120, 180 и 240 мин. Это было сделано для наблюдения за изменением свойств образцов при изменении продолжительности отжига. Рентгенофазовый анализ отожженных порошков показал, что все они представляют собой рутил, рефлексы на рентгенограммах соответствуют одним и тем же углам, но интенсивность рефлексов немного увеличивается с течением времени (рис. 1).
Выполненный расчет размеров ОКР наноструктурного TiO2 показал, что с повышением температуры отжига от 400 до 1000°C размер ОКР увеличивается от 10 до 75 нм. Увеличение продолжительности отжига при температуре 800°C повышает размер ОКР от 60 до 85 нм.
Полученный золь–гель-методом TiO2 представлял собой белый порошок, который с повышением температуры отжига до 1000°C изменял цвет до темно-серого, при этом увеличение продолжительности отжига при 800°C от 30 до 240 мин не оказывало видимого влияния на внешний вид образцов. Для изучения его оптических свойств были записаны спектры диффузного отражения и рассчитаны значения ширины запрещенной зоны. На рис. 2 показаны спектры поглощения, построенные по методу Тауца с использованием функции Кубелки–Мунка. Выполненный анализ спектров диффузного отражения позволил определить значения ширины запрещенной зоны TiO2. Абсолютная погрешность измерений составляет 5%. Установлено, что при повышении температуры отжига ширина запрещенной зоны уменьшается от 3.3 до 2.6 эВ. Переход диоксида титана из аморфного состояния в кристаллическое (анатаз, а затем рутил) приводит к уменьшению ширины запрещенной зоны (рис. 2а). Увеличение продолжительности отжига от 30 до 240 мин при 800°C незначительно изменяет значение – в пределах погрешности, т.е. продолжительность отжига при данной температуре не влияет на ширину запрещенной зоны TiO2 (рис. 2б). Вероятнее всего, в процессе отжига в атмосфере водорода в кристаллической решетке образуются структурные дефекты, которые создают дополнительные энергетические уровни в запрещенной зоне, в результате чего происходит поглощение видимого света с длиной волны около 450 нм.
Рис. 2.
Спектры диффузного отражения для порошков TiO2, отожженных в потоке водорода при различных температурах в течение 1 ч (а), при 800°C и разной продолжительности (б).
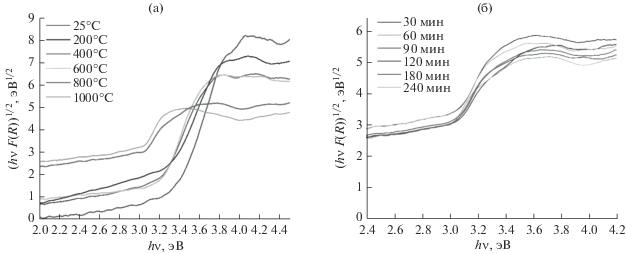
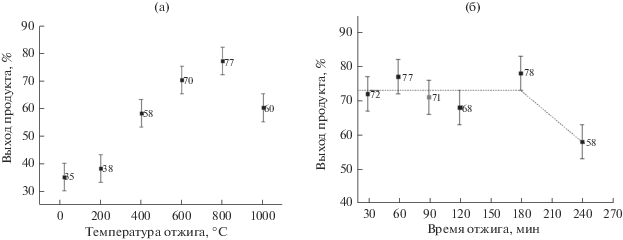
Рис. 3.
Влияние температуры отжига (1 ч) (а) и продолжительности отжига при 800°C (б) на выход продукта реакции.
Определение удельной площади поверхности (Seff) методом БЭТ (табл. 1) показало, что минимальная площадь наблюдается для образцов, отожженных при максимальной температуре: значения уменьшаются от 307 до 1 м2/г. Продолжительность отжига от 30 до 240 мин при температуре 800°С не повлияла на значение удельной площади поверхности.
Образцы наноразмерного TiO2 были проанализированы в реакции окислительного $S_{{\text{N}}}^{{\text{H}}}$-кросс-сочетания акридина с индолом, в результате которой образуется 9-(индол-3-ил)акридин (схема (1) ). Исходя из предполагаемого механизма при сочетании акридина с индолом в кислой среде образуется σH-аддукт, который ароматизуется благодаря окислительной системе O2/TiO2. На поверхности TiO2 при облучении генерируется пара e–/h+. Далее электроны способствуют образованию супероксидного радикала ${\text{O}}_{2}^{{ \cdot - }},$ который и является окислителем в реакции. Для идентификации выделенного при помощи колоночной хроматографии 9-(индол-3-ил)акридина были использованы методы спектроскопии ЯМР 1H и данные элементного анализа. Выход продукта реакции при участии всех синтезированных образцов TiO2 был в диапазоне от 35 до 78%.
Стоит отметить, что высокое значение площади поверхности не гарантирует более эффективную фотоактивность при гетерогенном фотокатализе [42], что подтверждается и в проведенных в настоящей работе экспериментах, а именно: даже малые значения площади поверхности дают высокий процент выхода продукта реакции. Это связано с тем, что образцы с небольшой площадью поверхности (1–2 м2/г) находятся в фазе рутила, а образцы с наибольшим значением площади (38–120 м2/г) – в фазе анатаза. Рутил отличается от анатаза активностью каталитических центров на поверхности частиц, а также обладает более низким значением ширины запрещенной зоны, следовательно, может поглощать большее количество света видимого диапазона при облучении [43]. Для рутила значение ширины запрещенной зоны на полученных образцах составляет 2.6 эВ, что соответствует энергии поглощения в области длин волн 450–480 нм, используемых при облучении лампой. Таким образом, для TiO2 со структурой рутила, несмотря на низкую удельную площадь поверхности, выход продукта оказался высоким, поскольку данные образцы, обладая более низким значением ширины запрещенной зоны, поглощают большее количество энергии видимого света, что в свою очередь позволяет генерировать большее количество пар электрон–дырка, влияющих на эффективность фотокатализатора. Также можно предположить, что скорость регенерации таких пар в рутиле ниже, чем в анатазе. Данные аргументы позволяют объяснить высокую фотокаталитическую активность образцов со структурой рутила с очень маленькой удельной площадью поверхности. Стоит отметить, что авторы [42, 44, 45] также наблюдали более высокую фотоактивность рутила по сравнению с анатазом, однако никак не объяснили выявленный эффект.
При повышении температуры отжига до 800°С фотокаталитическая активность TiO2 (рис. 3а) увеличивалась до 77%, однако дальнейшее увеличение до 1000°С понижало выход продукта до 60%. Изменение продолжительности отжига самого эффективного фотокатализатора от 30 до 180 мин при температуре 800°C незначительно влияет на выход продукта (рис. 3б), вызывая его повышение от 68 до 78% (т.е. в пределах погрешности). Увеличение продолжительности отжига до 240 мин приводит к уменьшению эффективности TiO2 в тестируемой реакции до 58%, при этом абсолютная погрешность измерений составляет не более 10%.
Ранее нами проводилось исследование TiO2 в реакциях дегидрогенативного кросс-сочетания (гетеро)аренов [27], который отжигался на воздухе при 350°C и имел структуру анатаза. В тех экспериментах выход продукта реакции варьировался от 50 до 62%. В данной работе удалось увеличить эффективность фотокатализатора до 78% путем смены атмосферы во время отжига, подбором температуры и продолжительности процесса, а также уменьшением ширины запрещенной зоны для наибольшего поглощения света используемого источника излучения.
ЗАКЛЮЧЕНИЕ
Установлено влияние температуры отжига в потоке водорода на кристаллическую структуру, размер ОКР и фотокаталитическую активность диоксида титана, синтезированного золь–гель-методом. Рентгенофазовый анализ показал образование аморфной структуры при синтезе и ее сохранение вплоть до температуры отжига 200°C. Кристаллическая структура анатаза формируется при температуре отжига 400 и сохраняется до 600°C, увеличение температуры отжига до 800°C приводит к фазовому переходу анатаз–рутил. Фаза рутила сохраняется в процессе отжига и при 1000°C. Размер ОКР в образцах TiO2 увеличивается от 10 до 75 нм при повышении температуры отжига от 400 до 1000°C. При отжиге от 30 до 240 мин при 800°C размер ОКР находится в диапазоне от 60 до 85 нм. Изменение продолжительности отжига при 800°C от 30 до 240 мин не влияет на тип кристаллической структуры TiO2, но влияет на степень ее дефектности, т.е. на увеличение содержания вакансий в кислородной подрешетке, о чем свидетельствуют спектры диффузного отражения.
Спектры диффузного отражения показали, что при увеличении температуры отжига ширина запрещенной зоны TiO2 уменьшается от 3.3 до 2.6 эВ, в то же время продолжительность отжига от 30 до 240 мин при температуре 800°C не оказывает существенного влияния на его оптические свойства.
Использование TiO2 в реакции сочетания акридина с индолом в уксусной кислоте при облучении видимым светом позволяет синтезировать продукт 9-(индол-3-ил)акридин с выходом до 80%. Протестированные ранее [27] коммерческие образцы TiO2 – Degussa P25 и Hombifine N – показали выход продукта реакции, равный 32 и 60% соответственно.
Таким образом, в данной работе был модифицирован способ получения наноструктурного TiO2 и изучены его свойства для применения в качестве эффективного фотокатализатора окисления для $S_{{\text{N}}}^{{\text{H}}}$-кросс-сочетаний азинов с (гетеро)ароматическими нуклеофилами.
Список литературы
Natarajan T.S., Natarajan K., Bajaj H.C., Tayade R.J. Energy Efficient Uv-Led Source and TiO2 Nanotube Array-Based Reactor for Photocatalytic Application // Ind. Eng. Chem. Res. 2011. V. 50. № 13. P. 7753–7762.
Volkov A.V., Polyanskaya V.V., Moskvina M.A., Zezin S.B., Dement’ev A.I., Volynskii A.L., Bakeev N.F. Structure and Properties of Hybrid PP/TiO2 Nanocomposites and Mesoporous TiO2 Prepared via Solvent Crazing // Nanotechnol. Russ. 2012. V. 7. № 7. P. 377–384.
Vokhmintsev A.S., Weinstein I.A., Kamalov R.V., Dorosheva I.B. Memristive Effect in a Nanotubular Layer of Anodized Titanium Dioxide // Bull. Russ. Acad. Sci.: Phys. 2014. V. 78. № 9. P. 932–935.
Ремпель А.А., Валеева А.А. Наноструктурированный диоксид титана для медицинской химии // Изв. РАН. Сер. хим. 2019. № 12. С. 2163–2171.
Li W., Bak T., Atanacio A., Nowotny J. Photocatalytic Properties of TiO2: Effect of Niobium and Oxygen Activity on Partial Water Oxidation // Appl. Catal., A. 2016. № 198. P. 243–253.
Addamo M., Augugliaro V., Coluccia S., Faga M.G., Garc’ıa-L’opez E., Loddo V., Marc`ı G., Martra G., Palmisano L. Photocatalytic Oxidation of Acetonitrile in Gas–Solid and Liquid–Solid Regimes // J. Catal. 2005. V. 235. P. 209–220.
Augugliaro V., Caronna T., Paola A., Marcì G., Pagliaro M., Palmisano G., Palmisano L. TiO2-Based Photocatalysis for Organic Synthesis // Environ. Benign Photocatal.2010. P. 623–645.
Maldotti A., Molinari A., Amadelli R. Photocatalysis with Organized Systems for the Oxofunctionalization of Hydrocarbons by O2 // Chem. Rev. 2002. V. 102. P. 3811–3836.
Valeeva A.A., Dorosheva I.B., Kozlova E.A., Kamalov R.V., Vokhmintsev A.S., Selishchev D.S., Saraev A.A., Gerasimov E.Yu., Weinstein I.A., Rempel A.A. Influence of Calcination on Photocatalytic Properties of Nonstoichiometric Titanium Dioxide Nanotubes // J. Alloys Compd. 2019. V. 796. P. 293–299.
Hashimoto K., Irie H., Fujishima A. TiO2 Photocatalysis: a Historical Overview and Future Prospects // J. Appl. Phys. 2005. V. 44. P. 8269–8285.
Gambarotti C., Melone L., Punta C. Semiconductors in Organic Photosynthesis // Artif. Photosynth. 2012. P. 79–114.
Ciamician G. The Photochemistry of the Future // Science. 1912. V. 36. № 926. P. 385–394.
Wang C.M., Mallouk T.E. New Photochemical Method for Selective fluorination of Organic Molecules // J. Am. Chem. Soc. 1990. V. 112. P. 2016–2018
Palmisano G. Influence of the Substituent on Selective Photocatalytic Oxidation of Aromatic Compounds in Aqueous TiO2 Suspensions // Chem. Commun. 2006. P. 1012–1014.
Nam W.S., Han G.Y. Characterization and Photocatalytic Performance of Nanosize TiO2 Powders Prepared by the Solvothermal Method // Korean J. Chem. Eng. 2003. V. 20. № 6. P. 1149–1153.
Najafi M., Kermanpur A., Rahimipour M.R., Najafizadeh A. Effect of TiO2 Morphology on Structure of TiO2-Graphene Oxide Nanocomposite Synthesized via a One-Step Hydrothermal Method // J. Alloys Compd. 2017. № 722. P. 272–277.
Valeeva A., Kozlova E., Vokhmintsev A., Kamalov R., Dorosheva I., Saraev A., Weinstein I., Rempel A. Nonstoichiometric Titanium Dioxide Nanotubes with Enhanced Catalytical Activity under Visible Light // Sci. Rep. 2018. V. 8. P. 9607–9617.
Sotelo-Vazquez C., Quesada-Cabrera R., Darr J.A., Parkin I.P. Single-Step Synthesis of Doped TiO2 Stratified Thin-Films by Atmospheric-Pressure Chemical Vapour Deposition // J. Mater. Chem. A. 2014. V. 2. № 19. P. 7082–7087.
Baran E., YazIcI B. Effect of Different Nano-Structured Ag Doped TiO2-NTs Fabricated by Electrodeposition on the Electrocatalytic Hydrogen Production // Int. J. Hydrogen Energy. 2016. V. 41. № 4. P. 2498–2511.
Ibrahim A., Mekprasart W., Pecharapa W. Anatase/Rutile TiO2 Composite Prepared via Sonochemical Process and Their Photocatalytic Activity // Mater. Today: Proc. 2017. V. 4. № 5. P. 6159–6165.
Maragatha J., Rajendran S., Endo T., Karuppuchamy S. Microwave Synthesis of Metal Doped TiO2 for Photocatalytic Applications // J. Mater. Sci. – Mater. Electron. 2017. V. 28. № 7. P. 5281–5287.
Romero-Arcos M., Garnica-Romo M.G., Martínez-Flores H.E. Electrochemical Study and Characterization of an Amperometric Biosensor Based on the Immobilization of Laccase in a Nanostructure of TiO2 Synthesized by the Sol-Gel Method // Materials. 2016. V. 9. № 7. P. 543.
Dorosheva I.B., Valeeva A.A., Rempel A.A. Sol-Gel Synthesis of Nanosized Titanium Dioxide at Various pH of the Initial Solution // AIP Conf. Proc. 2017. V. 1886. P. 020006.
Caronna T., Gambarotti C., Palmisano L., Punta C., Recupero F. Sunlight-induced Reactions of Some Heterocyclic Bases with Ethers in the Presence of TiO2 – a Green Route for the Synthesis of Heterocyclic Aldehydes // J. Photochem. Photobiol., A. 2005. V. 171. P. 237–242.
Caronna T., Gambarotti C., Palmisano L., Punta C., Recupero F. Sunlight Induced Functionalisation of Some Heterocyclic Bases in the Presence of Polycrystalline TiO2 // Chem. Commun. 2003. P. 2350–2351.
Boonstra A.H., Mutsaers C.A.H.A. Adsorption of Hydrogen Peroxide on the Surface of Titanium Dioxide // J. Phys. Chem. 1975. V. 79. P. 1940–1943.
Дорошева И.Б., Ремпель А.А., Тресцова М.А., Утепова И.А., Чупахин О.Н. Синтез TiO2-фотокатализатора дегидрогенизирующего кросс-сочетания (гетеро)аренов // Неорган. материалы. 2019. Т. 55. № 2. С. 175–181.
Utepova I.A., Trestsova M.A., Chupakhin O.N., Charushin V.N., Rempel A.A. Aerobic Oxidative C–H/C–H Coupling of Azaaromatics with Indoles and Pyrroles in the Presence of TiO2 as a Photocatalyst // Green Chem. 2015. V. 17. P. 4401–4410.
Utepova I.A., Chupakhin O.N., Trestsova M.A., Musikhina A.A., Kucheryavaya D.A., Charushin V.N., Rempel A.A., Kozhevnikova N.S., Valeeva A.A., Mikhaleva A.I., Trofimov B.A. Direct Functionalization of the C–H Bond in (Hetero)Arenes: Aerobic Photoinduced Oxidative Coupling of Azines with Aromatic Nucleophiles ($S_{{\text{N}}}^{{\text{H}}}$-reactions) in the Presence of a CdS/TiO2 Photocatalyst // Russ. Chem. Bull., Int. Ed. 2016. V. 65. P. 445–450.
Chupakhin O.N., Charushin V.N. Nucleophilic C–H Functionalization of Arenes: a New Logic of Organic Synthesis // Pure Appl. Chem. 2017. V. 89. P. 1195–1208.
Chupakhin O.N., Shchepochkin A.V., Charushin V.N. Atom- and Step-Economical Nucleophilic Arylation of Azaaromatics via Electrochemical Oxidative Cross C–C Coupling Reactions // Green Chem. 2017. V. 19. P. 2931–2935.
Akue-Gedu R., Debiton E., Ferandin Y., Meijer L., Prudhomme M., Anizon F., Moreau P. Synthesis and Biological Activities of Aminopyrimidyl-Indoles Structurally Related to Meridianins // Bioorg. Med. Chem. 2009. V. 17. P. 4420–4424.
Imperatore C., Aiello A., D’Aniello F., Senese M., Menna M. Alkaloids from Marine Invertebrates as Important Leads for Anticancer Drugs Discovery and Development // Molecules. 2014. V. 19. P. 20391–20423.
Zhang H., Wu W., Feng C., Liu Z., Bai E., Wang X., Lei M., Cheng H., Feng H., Shi J., Wang J., Zhang Z., Jin T., Chen S., Hu S., Zhu Y. Design, Synthesis, SAR Discussion, in Vitro and in Vivo Evaluation of Novel Selective EGFR Modulator to Inhibit L858R/T790M Double Mutants // Eur. J. Med. Chem. 2017. V. 135. P. 12–23.
Madadi N.R., Penthala N.R., Janganati V., Crooks P.A. Synthesis and Anti-Proliferative Activity of Aromatic Substituted 5-((1-benzyl-1H-indol-3-yl)methylene)-1,3-dimethylpyrimidine-2,4,6(1H,3H,5H)-trione Analogs against Human Tumor Cell Lines // Bioorg. Med. Chem. Lett. 2014. V. 24. P. 601–603.
Raju P.A.G., Mallikarjunarao R., Gopal K.V., Sreeramulu J., Reddy D.M., Krishnamurthi K.P., Reddy S.R. Synthesis and Biological Activity of Some New Indole Derivatives Containing Pyrazole Moiety // J. Chem. Pharm. Res. 2013. V. 5. P. 21–27.
Swarnkar D., Ameta R., Vyas R. Microwave-assisted Synthesis, Characterization and Biological Activity of Some Pyrazole Derivatives // Int. Res. J. Pharm. 2014. V. 5. P. 459–462.
Ремпель А.А. Гибридные наночастицы на основе сульфидов, карбидов, оксидов // Изв. РАН. Сер. хим. 2013. № 4. С. 857–869.
Sasikala R., Sudarsan V., Sudakar C., Naik R., Panicker L., Bharadwaj S.R. Modification of the Photocatalytic Properties of Self Doped TiO2 Nanoparticles for Hydrogen Generation Using Sunlight Type Radiation // Int. J. Hydrogen Energy. 2009. V. 34. P. 6105–6113.
Tryba B., Tygielska M., Colbeau-Justin C., Kusiak-Nejman E., Kapica-Kozar J., Wróbel1 R., Żołnierkiewicz G., Guskos N. Influence of pH of Sol-Gel Solution on Phase Composition and Photocatalytic Activity of TiO2 under UV and Visible Light // Mater. Res. Bull. № 84. P. 152–161.
Ganesan N.M., Senthil T.S., Muthukumarasamy N., Balasundaraprabhu R. The Role of pH on the Structural Properties and Photocatalytic Applications of TiO2 Nanocrystals Prepared by Simple Sol-Gel Method // Int. J. ChemTech Res. 2014. V. 6. № 5. P. 3078–3082.
Caronna T., Gambarotti C., Palmisano L., Punta C., Pierini M., Recupero F. Sunlight-Induced Functionalisation Reactions of Heteroaromatic Bases with Aldehydes in the Presence of TiO2: A Hypothesis on the Mechanism // J. Photochem. Photobiol., A. 2007. V. 189. P. 322–328.
Jain A., Vaya D. Photocatalytic Activity of TiO2 Nanomaterial // J. Chil. Chem. Soc. 2017. V. 62. № 4. P. 3683–3690.
Yin H., Wada Y., Kitamura T., Kambe S., Murasawa S., Mori H., Sakata T., Yanagida S. Hydrothermal Synthesis of Nanosized Anatase and Rutile TiO2 Using Amorphous Phase TiO2 // J. Mater. Chem. 2001. V. 11. P. 1694.
Yurdakal S., Palmisano G., Loddo V., Alagöz O., Augugliaro V., Palmisano L. Selective Photocatalytic Oxidation of 4-substituted Aromatic Alcohols in Water with Rutile TiO2 Prepared at Room Temperature // Green Chem. 2009. V. 11. P. 510.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы