Неорганические материалы, 2021, T. 57, № 9, стр. 949-953
Коэффициенты распределения оксидов редкоземельных элементов при кристаллизации расплава диоксида циркония
П. П. Федоров 1, *, Е. В. Чернова 1
1 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 25.03.2021
После доработки 28.04.2021
Принята к публикации 30.04.2021
Аннотация
Методом модифицированной криоскопии из фазовых диаграмм систем ZrO2–R2O3 (R – редкоземельные элементы) рассчитаны коэффициенты распределения k оксидов РЗЭ при кристаллизации расплава диоксида циркония: k > 1 для R = Gd–Lu, Sc, Y, что соответствует образованию максимумов на кривых плавления твердых растворов. Зависимость коэффициентов распределения от ионных радиусов R3+ описывается гауссианом k(r) = 2.92exp[–21.48(r – 0.84)2], где r – ионные радиусы по системе Шеннона для к.ч. 8.
Диоксид циркония (ZrO2) является одним из наиболее тугоплавких оксидов металлов. Низкотемпературная моноклинная модификация при нагревании до 1443 К переходит в тетрагональную, которая в свою очередь переходит в высокотемпературную кубическую типа флюорита (пр. гр. Fm$\bar {3}$m, Z = 4) при ~2643 К. В системах ZrO2–R2O3 (R – редкоземельные элементы, РЗЭ) образуются широкие области кубических твердых растворов Zr1 – хRхO2 – 0.5х на основе высокотемпературной модификации ZrO2 [1], существовующих при низких температурах. В ряде систем образование таких твердых растворов сопровождается появлением максимумов на кривых плавления, т.е. высокотемпературной стабилизацией.
Монокристаллы твердых растворов на основе высокотемпературных флюоритовых модификаций диоксида циркония, легированных оксидами РЗЭ, широко известны как фианиты, которые применяются в ювелирном деле в качестве имитации алмазов благодаря высокому показателю преломления и дисперсии, а также являются материалами квантовой электроники [2–5]. Частично стабилизированный двухфазный диоксид циркония с небольшой концентрацией стабилизирующей добавки представляет собой материал с очень высокой трещинностойкостью [3, 4, 6]. Твердые растворы на основе ZrO2 со структурой флюорита характеризуются высокой кислородной электропроводностью, что делает эти материалы рабочим телом для твердооксидных топливных элементов [7, 8]. Высокая ионная проводимость коррелирует с низкой теплопроводностью [9, 10], и пленки твердых растворов на основе ZrO2 используются для создания теплоизолирующих (термобарьерных) покрытий, сочетающих термостойкость, очень низкую теплопроводность и высокую прочность [11].
Знание коэффициентов распределения примесей при кристаллизации расплавов необходимо для контролируемого получения материала заданного состава с высокой однородностью, в т. ч. получения оптических материалов высокого качества. Эта информация важна и при получении керамики, т. к. оттеснение компонентов к границам зерен оказывает существенное влияние на электропроводность материалов.
До настоящего времени информация о коэффициентах распределения в этих системах недостаточна [3, 12].
Величины равновесных термодинамических коэффициентов распределения k могут быть рассчитаны из фазовых диаграмм [13].
Целью данной работы является расчет коэффициентов распределения оксидов РЗЭ при кристаллизации расплава диоксида циркония методом модифицированной криоскопии. Ранее аналогичные расчеты были проведены для систем НfO2–R2О3 [14].
Основой метода модифицированной криоскопии является предельное уравнение Вант-Гоффа
(1)
$m = [{{RT_{0}^{2}} \mathord{\left/ {\vphantom {{RT_{0}^{2}} {\Delta H}}} \right. \kern-0em} {\Delta H}}](k - {\text{1}}),$В методе модифицированной криоскопии величину m определяют не из прецизионных измерений малых величин температурной депрессии при введении малых концентраций примеси, а путем аппроксимации кривых ликвидуса в широком интервале концентраций с последующим дифференцированием аналитических выражений. Соответствующие расчеты были проведены для систем MF2–RF3 [13] и для ряда систем на основе фторидов кадмия и свинца [15, 16].
Корректное использование уравнения (1) для расчетов коэффициентов распределения предполагает наличие достоверных экспериментальных данных по фазовым диаграммам, конкретно – по кривым ликвидуса. Поскольку системы ZrO2–R2O3 относятся к наиболее тугоплавким оксидным системам, их исследование – сложная задача. Решение было найдено с использованием солнечных печей для нагрева и оптических пирометров для регистрации сигнала [17–19]. Наиболее детальные систематические исследования фазовых равновесий в системах ZrO2–R2O3 на воздухе выполнены в работе [18], данные которой и были использованы в настоящей работе.
Точки кривых ликвидуса в широком концентрационном интервале обрабатывали методом наименьших квадратов в виде полинома 3-го порядка. При этом температура плавления ZrO2 (2983 К) фиксировалась путем придания этой точке десятикратного веса. Первичные данные получены оцифровкой графиков, приведенных в работах [18, 19]. Использована также таблица экспериментальных данных, приведенная в работе [17].
Данные для систем ZrO2–R2O3 хорошо описываются уравнениями
где x – мольная доля R2O3. Коэффициенты m, a, b и коэффициент корреляции представлены в табл. 1.Таблица 1.
Аппроксимация кривых ликвидуса флюоритовых твердых растворов в системах ZrO2–R2O3 по уравнению (2)
| R3+ | m, К/моль | а, К/моль2 | b, К/моль3 | Область аппроксимации, х | Коэффициент корреляции, R2 | Источник |
|---|---|---|---|---|---|---|
| La | –731 | –25 560 | 89 708 | 0–0.24 | 0.9995 | [18] |
| Pr | –1860 | 3116 | –2382 | 0–0.35 | 0.9997 | [18] |
| Nd | –1100 | 583 | 391 | 0–0.35 | 0.998 | [18] |
| Sm | –101.7 | –2362 | 2706 | 0–0.35 | 0.998 | [18] |
| Gd | 28.5 | –434 | –485 | 0–0.75 | 0.9993 | [18] |
| Dy | 353 | –1182 | 61.3 | 0–0.80 | 0.9985 | [18] |
| Ho | 626 | –1743 | 462 | 0–0.82 | 0.9991 | [18] |
| Er | 763 | –1965 | 604 | 0–0.82 | 0.9989 | [18] |
| Yb | 845 | –1775 | 383 | 0–0.80 | 0.9976 | [18] |
| Sc | 2020 | –12 886 | 20 353 | 0–0.30 | 0.9982 | [19] |
| Y | 917 | –2367 | 927 | 0–0.83 | 0.9988 | [18] |
| 312 | –719 | –367 | 0–0.70 | 0.972 | [17] |
Путем дифференцирования полученных уравнений для х = 0 получены значения тангенса наклона ликвидуса (депрессии) при бесконечно малом содержании примеси (dT/dx)x= 0 = m. Температура плавления Т0 ZrO2 принята равной 2983 K [18, 20]. Заметим, что для РЗЭ иттриевой группы аппроксимация проводилась для полной кривой ликвидуса, включая большой интервал концентраций (см. табл. 1). Для РЗЭ цериевой группы ситуация сложнее: в этом случае в системах ZrO2–R2O3 имеет место выход упорядоченной фазы со структурой пирохлора на плавление, с прорывом кривых ликвидуса и солидуса. Этот процесс отвечает бифуркации типа Б1VII [21, 22]. Ситуация в системе ZrO2–Pr2O3 близка к переходному состоянию. При этом на кривых ликвидуса фазовых диаграмм с R = Pr, Nd, Sm возникают точки перегиба, что резко ограничивает концентрационный интервал, где приемлемо описание кривой ликвидуса полиномом третьего порядка.
Для энтальпии плавления ΔН ZrO2 в литературе имеются два значения: 87.15 кДж/моль [23] и 68.72 кДж/моль [20]. Мы приняли более позднюю величину 68.72 кДж/моль [20], т.е. ΔS = = 23.05 Дж/(моль К). Низкая энтропия плавления типична для соединений со структурой флюорита [13]. Разница между величинами ΔН в 20% характеризует точность величин k, получаемых в результате расчета.
Расчетные величины коэффициентов распределения приведены в табл. 2. Необходимо отметить, что для систем с оксидами празеодима и неодима получены физически бессмысленные результаты – отрицательные значения k. По-видимому, это связано со сложным поведением кривых ликвидуса в рассматриваемых системах и недостаточной изученностью температурной депрессии при малых содержаниях R2О3 (первые исследованные в [18] точки соответствуют содержанию 5 мол. % R2О3). Для системы ZrO2–Y2O3 получены существенно различные значения k при использовании данных [17, 18]. Причины расхождения неясны.
Таблица 2.
Расчетные значения коэффициентов распределения оксидов РЗЭ при кристаллизации расплава ZrO2
| R3+ | r, Å [24] | k1 (расчет из фазовой диаграммы ZrO2–R2O3) | ±Δk1 | k2 (расчет по ур-ю (3)) |
|---|---|---|---|---|
| La | 1.16 | 0.32 | 0.24 | 0.32 |
| Pr | 1.126 | * | 0.50 | |
| Nd | 1.135 | * | 0.62 | |
| Sm | 1.079 | 0.91 | 0.03 | 0.85 |
| Eu | 1.066 | 0.97 | ||
| Gd | 1.053 | 1.03 | 0.01 | 1.10 |
| Tb | 1.040 | 1.23 | ||
| Dy | 1.027 | 1.33 | 0.12 | 1.38 |
| Ho | 1.015 | 1.58 | 0.20 | 1.51 |
| Er | 1.004 | 1.70 | 0.25 | 1.64 |
| Tm | 0.994 | 1.75 | ||
| Yb | 0.985 | 1.78 | 0.27 | 1.86 |
| Lu | 0.977 | 1.95 | ||
| Sc | 0.87 | 2.87 | 0.66 | 2.86 |
| Y | 1.019 | 1.85 [18] | 0.30 | 1.46 |
| 1.29 [17] | 0.10 |
Погрешность расчета по уравнению (1) включает в себя погрешности определения величин Т0, ΔН и m. Из-за высокой температуры плавления диоксида циркония, которая к тому же существенно зависит от парциального давления кислорода, эта величина известна с точностью около 3% [1, 20]. Наибольшая погрешность расчета связана с величиной энтальпии плавления (см. выше). Погрешность расчета m оценить трудно. В целом мы оцениваем погрешность расчета величины (k – 1) в 35%. Соответствующие величины Δk1 приведены в табл. 2.
Зависимость коэффициентов распределения от ионного радиуса РЗЭ хорошо описывается гауссианом (рис. 1)
(3)
$k(r) = {\text{2}}{\text{.92exp}}[--{\text{21}}{\text{.48}}{{(r--{\text{0}}{\text{.84}})}^{{\text{2}}}}]{\text{,}}$Рис. 1.
Зависимость расчетных коэффициентов распределения оксидов РЗЭ при кристаллизации диоксида циркония от ионных радиусов R3+ [24] (кривая – уравнение (3)).
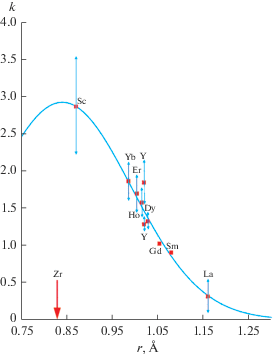
Такой вид зависимости имеет определенный физический смысл, вытекающий из энергетической теории изоморфизма [15]. Согласно полученному уравнению, ионный радиус, отвечающий максимуму зависимости k(r) (т.е. оптимальному захвату изоморфной примеси при кристаллизации матрицы), совпадает с ионным радиусом Zr4+r = = 0.84 Å. Для гетеровалентных твердых растворов с переменным числом ионов в элементарной ячейке это не характерно [13, 15, 16]. Небольшое изменение этой величины не влияет существенно на величину коэффициента корреляции уравнения (3).
Системы с k > 1 (R = Tb–Lu, Sc, Y) характеризуются образованием максимумов на кривых плавления твердых растворов. Это признак твердых растворов с переменным числом ионов в элементарной ячейке [25, 26].
Для R = Gd величина коэффициента распределения при бесконечном разбавлении близка к единице. Это соответствует совпадению точки максимума с чистым компонентом (тангенциальный экстремум, точка бифуркации B [21]). В этой точке система характеризуется горизонтальной касательной к кривым и ликвидуса, и солидуса при х = 0.
Заметим, что с рассчитанными величинами k нельзя сравнивать данные Рёмера и др. [12]: эти авторы определяли коэффициенты распределения примесей Nd3+, Sm3+, Er3+ при кристаллизации не чистого ZrO2, а стабилизированного диоксида циркония состава (мол. %): 88ZrO2–12Y2O3.
Составы, соответствующие точке максимума на кривых плавления твердых растворов в бинарных системах, плавятся конгруэнтно, т.е. в этой точке k = 1. Зная положение точки максимума, рассчитанные значения k при х = 0 (см. табл. 2), а также коэффициент распределения при максимальной концентрации твердого раствора, соответствующей эвтектической температуре, можно оценить концентрационное поведение k в соответствующих системах (k = хS/xL, где хS и xL – концентрации второго компонента в твердой и жидкой фазах) [27, 28].
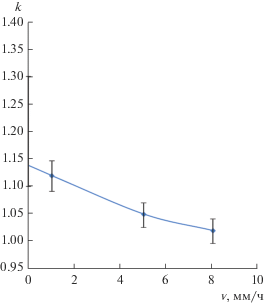
Заметим, что принятый состав стабилизированного диоксида циркония (фианита) в системе ZrO2–Y2O3 не совпадает с составом максимума на кривых плавления, т.е. твердый раствор, содержащий 8–10% оксида иттрия, кристаллизуется не вполне конгруэнтно. Для положения максимума в системе ZrO2–Y2O3 массивы данных, полученных в [17, 18], дают положение точки максимума на кривой ликвидуса при х = 0.20 ± 0.02. Интерполированное равновесное значение коэффициента распределения иттрия для х = 0.1 равно 1.1–1.3 в зависимости от того, каким данным – Ногучи и др. [17] или Руане [18] отдать предпочтение. Это обстоятельство при получении кристаллов компенсируется тем, что при реальных скоростях кристаллизации эффективные коэффициенты распределения ближе к единице, чем равновесные. На рис. 2 представлена зависимость от скорости кристаллизации эффективного коэффициента распределения для состава (мол. %): 90ZrO2–10Y2O3 по данным [3].
Рис. 2.
Зависимость эффективного коэффициента распределения иттрия от скорости кристаллизации для состава Zr0.9Y0.1O1.95 по данным Ломоновой [3].
Заметим, что рассчитанные нами величины k (табл. 2) относятся к кристаллизации расплавов ZrO2 в окислительной атмосфере. Фазовые равновесия в системах ZrO2–R2O3 существенно зависят от парциального давления кислорода. Восстановительная атмосфера приводит к образованию широкой области твердого раствора ZrO2 – x и стабилизирует кубическую модификацию как вверх, так и вниз по температуре (максимум на кривой плавления при 3073 К и эвтектоидное равновесие 1733 К для состава ZrO1.86) [20].
Список литературы
Андриевская Е.Р. Фазовые равновесия в системах оксидов гафния, циркония, иттрия с оксидами редкоземельных элементов. Киев: Наукова думка, 2010.
Кузьминов Ю.С, Осико В.В. Фианиты. М.: Наука, 2001. 280 с.
Кузьминов Ю.С., Ломонова Е.Г., Осико В.В. Тугоплавкие материалы из холодного тигля. М.: Наука, 2004. 372 с.
Osiko V.V., Borik M.A., Lomonova E.E. Synthesis of Refractory Materials by Skull Melting // Springer Handbook of Crystal Growth. N.Y: Springer, 2010. P. 433–477.
Artemov S.A., Borik M.A., Volkova T.V., Gerasimov M.V., Kulebyakin A.V., Lomonova E.E., Milovich F.O., Myzina V.A., Ryabochkina P.A., Tabachkova N.Y. Influence of Growth and Heat Treatment Conditions on Lasing Properties of ZrO2–Y2O3–Ho2O3 Crystals // Opt. Mater. 2020. 109611. https://doi.org/10.1016/j.optmat.2019.109611
Borik M.A., Lomonova E.E., Osiko V.V., Panov V.A., Porodnikov O.E., Vishnyakova M.A., Voron’ko Yu. K. Voronov V.V. Partially Stabilized Zirconia Single Crystals: Growth from the Melt and Investigation of the Properties // J. Cryst. Growth. 2005. V. 275. P. e2173–e2179.
Yashima M., Kakihana M., Yoshimura M. Metastable-Stable Phase Diagrams in the Zirconia-Containing Systems Utilized in Solid-Oxide Fuel Cell Application // Solid State Ionics. 1996. V. 86. P. 1131–1149.
Kendall K. Progress in Solid Oxide Fuel Cell Materials // Int. Mater. Rev. 2005. V. 50. P. 257–264.
Федоров П.П., Попов П.А. Принцип эквивалентности источников беспорядка и теплопроводность твердых тел // Наносистемы: физика, химия, математика. 2013. Т. 4. № 1. С. 148–159.
Борик М.А., Волкова Т.В., Кулебякин А.В., Курицына И.Е., Ломонова Е.Е., Мызина В.А., Милович Ф.О., Рябочкина П.А., Табачкова Н.Ю., Зенцова А.И., Попов П.А. Теплопроводность кубических монокристаллов ZrO2, стабилизированных оксидом иттрия // ФТТ. 2020. Т. 62. № 1. С. 191–195.
Жигачев А.О., Головин Ю.И., Умрихин А.В., Коренков В.В., Тюрин А.И., Родаев В.В., Дьячек Т.А. Керамические материалы на основе диоксида циркония / Под общ. ред. Головина Ю.И. М.: Техносфера, 2018. 357 с.
Römer H., Luther K.-D., Assmus. The Distribution Coefficients of Rare Earth Ions in Cubic Zirconium Dioxide // J. Cryst. Growth. 1994. V. 141. P. 159–164.
Федоров П.П., Туркина Т.М., Лямина О.И., Тарасова Е.В., Зибров И.П., Соболев Б.П. Расчет коэффициентов распределения примеси из кривых ликвидуса бинарных систем MF2–RF3 // Высокочистые вещества. 1990. № 6. С. 67–72.
Федоров П.П., Шевченко А.В., Лопато Л.М., Панасова Н.А., Арбенина В.В. Коэффициенты распределения оксидов редкоземельных элементов при кристаллизации оксида гафния // X Нац. конф. по росту кристаллов. М., 2002. С. 227.
Иванов С.П., Бучинская И.И., Федоров П.П. Коэффициенты распределения примесей во фториде кадмия // Неорган. материалы. 2000. Т. 36. № 4. С. 484.
Бучинская И.И., Федоров П.П. Дифторид свинца и его взаимодействие с другими неорганическими фторидами // Успехи химии. 2004. Т. 73. № 4. С. 404–434.
Noguchi T., Mizuno M., Yamada T. The Liquidus Curve of the ZrO2–Y2O3 System As Measured by a Solar Furnace // Bull. Chem. Soc. Jpn. 1970. V. 43. P. 2614–2616.
Rouanet A. Contribution a l’etude des systems zircon-oxydes des lanthanides au voisinage fe la fusion // Rev. Int. Hautes Temp. Refract. 1971. V. 8. P. 161–180.
Шевченко А.В., Майстер И.М., Лопато Л.М. Взаимодействие в системах HfO2–Sc2O3 и ZrO2–Sc2O3 при высоких температурах // Неорган. материалы. 1987. Т. 23. С. 1320–1324.
Chen M., Hallstedt D., Gauckler J. Thermodynamic Modeling of the System ZrO2–YO1.5 // Solid State Ionics. 2004. V. 170. P. 255–274.
Федоров П.П. Трансформации фазовых T-х диаграмм конденсированного состояния бинарных систем. II. Равновесие фаз с дополнительно наложенными условиями // Журн. физ. химии. 1999. Т. 73. № 9. С. 1551–1556.
Федоров П.П. Бифуркации Т-х фазовых диаграмм конденсированного состояния бинарных систем. Фазовые диаграммы с упорядоченными фазами // Журн. неорган. химии. 2021. Т. 66. № 4. С. 510–518.
Chase M.W., Davies C.A., Downey J.R. et al. JANAF Thermochemical Tables // J. Phys. Chem. Ref. Data. 1985. V. 14. Suppl. 1. P. 1691.
Shannon R.D. Revised Effective Ionic Radii and Systematic Studies of Interatomic Distances in Halides and Chalcogenides // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751–767.
Fedorov P.P. Heterovalent Isomorphism and Solid Solutions with a Variable Number of Ions in the Unit Cell // Russ. J. Inorg. Chem. 2000. V. 45. P. S268–S291.
Федоров П.П., Соболев Б.П. Об условиях образования максимумов на кривых плавления твердых растворов в солевых системах // Журн. неорган. химии. 1979. Т. 24. № 4. С. 1038–1040.
Туркина Т.М., Федоров П.П., Соболев Б.П. Устойчивость плоского фронта кристаллизации при выращивании монокристаллов твердых растворов M1 – xRxF2 + x (где M = Ca, Sr, Ba; R – редкоземельный элемент) из расплава // Кристаллография. 1986. Т. 31. № 1. С. 146–152.
Kuznetsov S.V., Fedorov P.P. Morphological Stability of Solid-Liquid Interface during Melt Crystallization of Solid Solutions M1 –xRxF2 +x // Inorg. Mater. 2008. V. 44(13). P. 1434–145. https://doi.org/10.1134/S0020168508130037
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


