Неорганические материалы, 2021, T. 57, № 9, стр. 999-1007
Формирование гранул фосфаты кальция/хитозан
О. А. Голованова *
Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр. Мира, 55-А, Россия
* E-mail: golovanoa2000@mail.ru
Поступила в редакцию 07.02.2021
После доработки 13.04.2021
Принята к публикации 19.04.2021
Аннотация
В работе осуществлен синтез гранул брушита и гидроксиапатита (ГА) в матрице хитозана. Установлено, что поверхность гранул обладает пористой шероховатой структурой. По данным ситового анализа получено, что преобладают гранулы с размером 2 мм. При исследовании термических характеристик гранул выявлено, что карбонизация хитозана происходит при t = 400°С, масса гранул ГА/хитозан больше массы гранул брушит/хитозан в интервале температур 400–800°С. При изучении биоактивности гранул выявлено, что начальная скорость растворения гранул ГА/хитозан больше, чем брушит/хитозан. Таким образом, при использовании синтезированных материалов в медицине для быстрой доставки ионов кальция на начальном этапе растворения предложено использовать гранулы ГА/хитозан, а для создания биокерамики из полученных материалов лучше использовать гранулы брушит/хитозан.
ВВЕДЕНИЕ
В последнее время активно ведутся исследования по созданию и применению материалов медико-биологического назначения [1–3]. Важное место среди биоматериалов занимают металлы, неорганические и углеродные соединения [2], но значительные успехи в области медицинских биоматериалов стимулировали разработку новых веществ, основным компонентом которых являются полимеры [3, 4].
Известно, что биомедицинские имплантаты улучшают качество жизни, увеличивая функциональность основных систем организма. Широко используются имплантаты в области регенерации костной ткани, они находят применение в качестве фрагментов, замещающих разрушенные или удаленные части костей; конструктивных элементов искусственных суставов, крепежей, соединяющих костные разломы [5–7].
Для их изготовления применяют полимеры и композиты с неорганическими наполнителями, в частности гидроксиапатитом (ГА) [8, 9]. В качестве полимеров чаще всего используют многочисленные природные соединения: белки, нуклеиновые кислоты, целлюлозу, крахмал, каучук и другие органические вещества, а также искусственно синтезированные полимеры [10, 11].
При этом биопололимеры медицинского назначения не должны оказывать раздражающего, токсичного, канцерогенного воздействия на живые организмы, а также должны выдерживать стерилизующую обработку различными методами и средствами. Именно имплантаты на полимерной основе имеют огромную значимость для современной медицины.
Наибольший интерес в качестве неорганического компонента вызывают ГА (наименее растворимый из фосфатов кальция) и брушит (наиболее растворимый из фосфатов кальция) [11–13].
Деацетилированное производное хитина – хитозан – представляет значительный интерес в практическом и научном аспекте. Преимуществами хитозана являются: биосовместимость, биоактивность, нетоксичность и легкость в производстве химически модифицированных форм [8, 14]. Особые свойства позволяют использовать данный полисахарид в медицине как биокомпозит для создания лекарственных средств [15, 16]. В костной инженерии использование хитозана эффективно в виде композита с ГА или брушитом [17, 18].
Композиционные материалы ГА/хитозан и брушит/хитозан характеризуются высокой биосовмсетимостью и биоактивностью, остеоиндуктивностью [17], резорбируемостью [19–21]. Кроме того, данные композиты используются в качестве биологически активного слоя некоторых материалов, из которых состоят имплантаты, таких как нержавеющая сталь, хром-кобальтовые сплавы, титан и т.д. [22].
Целью данной работы является синтез и получение гранул, исследование и сравнение физико-химических свойств композитов на основе фосфатов кальция (ГА, брушит) с добавкой хитозана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза брушита готовили растворы гидрофосфата аммония и нитрата кальция при Т = = 298 К объемом 500 мл каждый. Растворы сливали (общий объем раствора составлял 1000 мл) и с помощью магнитной мешалки перемешивали в течение 15 мин. Значение рН поддерживали равным 5.5 ± 0.5, добавляя 15%-ную HNO3. Уравнение реакции осаждения брушита может быть представлено схемой
(1)
${\text{С}}{{{\text{а}}}^{{2 + }}} + {\text{НРО}}_{4}^{{2 - }} + 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to {\text{СаНР}}{{{\text{О}}}_{4}} \cdot 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}}.$Синтез ГА (Са/Р = 1.67) проводили аналогично, но рН системы поддерживали на уровне 12.0 ± ± 0.5 добавлением концентрированного раствора аммиака. Взаимодействие реагентов происходило по реакции
(2)
$\begin{gathered} 10{\text{C}}{{{\text{a}}}^{{2 + }}} + 6{\text{HPO}}_{4}^{{2 - }} + 10{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{{\text{(Р}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{(OН}})}_{2}} + 8{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }}. \\ \end{gathered} $При смешивании растворов происходило образование осадков белого цвета. После выдерживания каждого раствора в течение 72 ч осадок отфильтровывали и сушили в сушильной камере при Т = 353 К до полного удаления воды. Полученные твердые образцы исследовали физико-химическими методами [19, 20].
Разработка методики получения гранул брушита и ГА в полимерной матрице хитозана проводилась методом подбора следующих параметров: концентрация геля на основе хитозана, соотношение твердой фазы и объема геля для смешивания, размер капилляра, раствор для диспергирования суспензии и образования гранул.
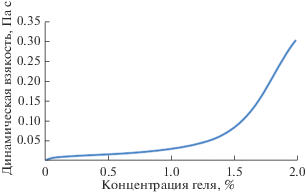
Первоначально был получен гель на основе хитозана разной концентрации (0.2, 0.8, 1.4, 2%) (рис. 1).
Видно, что динамическая вязкость гелей возрастает с увеличением концентрации хитозана. Для получения гранул использовали 2%-ный гель хитозана с наибольшей вязкостью – 0.3050 Па с. При подборе соотношения масса фосфата кальция (ГА или брушит) : объем геля хитозана было выяснено, что для гранул на основе брушита оптимальным соотношением является 1 г : 7.5 мл, а для гранул на основе ГА – 1 г : 10 мл. При указанных соотношениях полученные гранулы обладают более качественными характеристиками (сферической формой, механической прочностью). Размер капилляра подбирался таким образом, чтобы достичь оптимальных условий получения гранул. Установлено, что размер капилляра, равный 2 мм, наиболее полно соответствует предъявляемым требованиям.
В качестве раствора для диспергирования суспензии фосфат кальция/гель хитозана был выбран 5%-ный раствор NaOH. При растворении хитозана в уксусной кислоте происходит протонирование его аминогруппы и трансформация его цепей
(3)
$R{\kern 1pt} {\text{ - N}}{{{\text{H}}}_{2}} + {{{\text{H}}}^{ + }} \to R{\text{ - NH}}_{3}^{ + }.$При взаимодействии геля хитозана с ГА кристаллы ГА встраиваются между волокнами хитозана через взаимодействие протонированой аминогруппы хитозана с OH–- и ${\text{РО}}_{4}^{{3 - }}$-группами ГА. В результате образуются гранулы сферической формы с регулируемым размером и высокой пористостью.
Для получения гранул брушита в матрице хитозана 1 г брушита смешивали с 7.5 мл 2%-ного геля на основе хитозана. Полученную суспензию брушита в геле хитозана диспергировали шприцом определенного размера в 5%-ный раствор NaOH. Под действием сил поверхностного натяжения образовывались гранулы сферической формы, которые извлекали из щелочного раствора и высушивали на воздухе.
Рентгенофазовый анализ гранул проводился на рентгеновском дифрактометре ДРОН-3. Дифрактограммы получали методом порошка в интервале 2θ 10°–60°. Качественный анализ фазового состава образца проводился по данным PDF-2. Предел обнаружения методики составляет 5%.
ИК-спектры получали на спектрофотометре ФСМ 2202 (“Инфраспек”, Россия). Регистрацию спектров проводили в области от 400 до 4000 см–1 с разрешением 4 см–1, общее число сканирований 50. Обработку данных осуществляли с использованием программы OriginPro8.0. Предел обнаружения составлял 5%. Изучение морфологии, определение формы гранул проводили методом оптической микроcкопии c помощью микроcкопa серии xsp-140, расчет размеров кристаллов проводили с помощью программы toup view.
Синтезированные гранулы помещали в сухие, предварительно взвешенные керамические тигли, затем переносили в муфельную печь на 2 ч. Температура прокаливания составляла 473–873 К. После прокаливания тигли охлаждали до Т = 298 К, а затем взвешивали на аналитических весах, содержимое переносили в специально маркированные контейнеры.
Для изучения кинетических параметров пассивной фазы резорбции гранулы помещали в 100 мл 0.9%-ного NaCl при Т = 298 К и перемешивали с постоянной скоростью. Значения pCa и pH (рН 150 MI, ООО “Измерительная техника”, Россия) фиксировались через регулярные промежутки времени до выхода аналитического сигнала на плато. Кинетические кривые были обработаны в соответствии с алгоритмами [19]. Математическую обработку всех данных осуществляли с использованием статистических программ Static2 и Statistica.10 из пакета StatSoft.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При диспергировании полученной суспензии в 5%-ный щелочной раствор под действием сил поверхностного натяжения образуется капля (рис. 2а). При этом структура хитозана превращается в компактную конформацию “случайный клубок” и осаждается
(4)
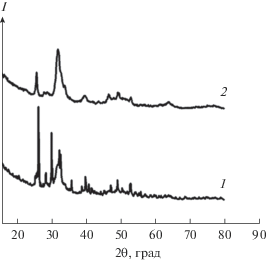
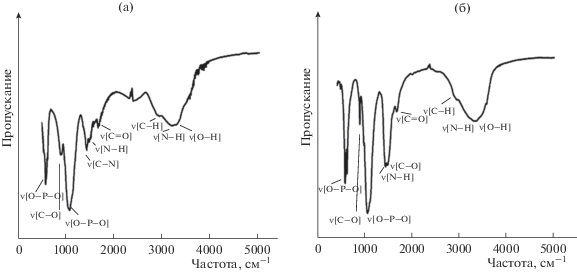
$R{\text{ - NH}}_{3}^{ + } + {\text{O}}{{{\text{H}}}^{ - }} \to R{\text{ - N}}{{{\text{H}}}_{2}}{\kern 1pt} \downarrow + {\text{ }}{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$После извлечения образовавшихся гранул из щелочного раствора их оставляли на воздухе при комнатной температуре для высушивания, при удалении воды в гранулах образовывались поры (рис. 2б). На рис. 3 представлены дифрактограммы, характеризующие фазовый состав гранулированных брушита и ГА в матрице хитозана. Основной минеральной составляющей гранул брушит/хитозан является брушит (2θ = 25.7°, 28.0°, 30.2°, 32.9°, 35.8°, 40.0°). Как видно из дифрактограммы 2, состав образца представлен фазой ГА (2θ = 25.8°, 31.9°, 39.7°, 46.5°, 49.5°, 53.1°). Методом ИК-Фурье-спектроскопии установлено, что для гранул брушит/хитозан характерны полосы поглощения, свойственные брушиту и хитозану (рис. 4а). Так, для брушита наблюдаются полосы поглощения, характерные для гидрофосфат-иона, выраженные деформационными колебаниями О–Р–О при 560, 573 см–1 и валентными колебаниями при 996, 1053 и 1109 см–1. Для хитозана пик 3295 см–1 соответствует валентным колебаниям ОН-групп, пик 3182 см–1 можно отнести к валентным колебаниям –NH2-групп. Пик 2857 см–1 соответствует валентным колебаниям связи С–Н в группах –CH2 и –CH3. Поглощение на частоте 1673 см–1 соответствует валентным колебаниям (–C=O)-связей в группе CONHR, на частоте 1490 см–1 – деформационным колебаниям аминогруппы –NH2. Поглощение на частоте 1405 см–1 соответствует валентным колебаниям связи С–N. В составе гранул ГА/хитозан проявляются полосы, обусловленные колебаниями связей О–Р–О в тетраэдрах ${\text{РО}}_{4}^{{3 - }}$ (рис. 4б). Пики с ν = 1025 и 1109 см–1 вызваны антисимметричными валентными колебаниями связи О–Р–О. Интенсивности с максимумами поглощения при 545, 602 и 616 см–1 обусловлены валентными колебаниями О–Р–О. Интенсивные пики с частотами 884 и 1476 см–1 относятся к колебаниям ${\text{СО}}_{3}^{{2 - }}$-групп. Для хитозана наблюдается слабовыраженный пик с частотой 3548 см–1, вызванный колебаниями связи О–Н. При частоте 3337 см–1 проявляется валентное колебание группы –NH2. Поглощение на частоте 1658 см–1 соответствует валентным колебаниям (–C=O)-связей в группе CONHR, на частоте 1405 см–1 – деформационным колебаниям аминогруппы –NH2.
Методом оптической микроскопии получены изображения поверхности гранулированного брушита и ГА в полимерной матрице хитозана (рис. 5). Видно, что поверхность гранул имеет пористую шероховатую структуру.
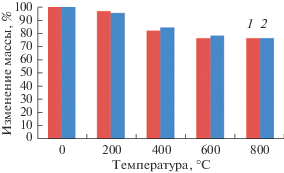
Термогравиметрический анализ гранул проводили в диапозоне температур 200–800°С с шагом 200°С (рис. 6). При 200°С образец брушит/хитозан изменяет массу на 3.95%, а образец ГА/хитозан – на 5.36%, что может быть вызвано удалением кристаллизационной и адсорбционной воды. При температуре 400°С масса гранулированного брушита в матрице хитозана меняется на 18.74% по сравнению с исходной, что свидетельствует о преобразовании брушита в монетит, а также деструкции хитозана. Для композита ГА/хитозан при t = 400°С изменение массы составило 16.10%. Значительных изменений с ГА при данной температуре не происходит, изменение массы связано с деструкцией хитозана. При температуре 600°С масса гранулированного композита брушит/хитозан составляет 75.70% от массы гранул до термообработки, а ГА/хитозан – 77.8%. В данных условиях брушит переходит в монетит, а затем в пирофосфат кальция, а для ГА характерно удаление из структуры карбонат-ионов. При 800°С продолжаются процессы, характерные для температуры 600°С, при этом масса образца брушит/хитозан составляет 75.72%, а ГА/хитозан – 75.74%.
Рис. 6.
Изменение массы гранулированного брушита (1) и ГА (2) в матрице хитозана после термообработки при различных тепловых режимах.
В процессе термообработки при каждой температуре фиксировали цвет гранул и изменение сферической формы. Установлено, что гранулы брушит/хитозан и ГА/хитозан сохраняют сферическую форму при всех температурных режимах термообработки. При 400°С гранулы брушит/хитозан приобретают коричневый цвет, а ГА/хитозан – черный. Данное изменение указывает на карбонизацию хитозана. Изменения, вызванные термообработкой материала, фиксировали методом ИК-Фурье спектроскопии (рис. 7). В спектре гранулированного брушита в матрице хитозана при 200°С наблюдается значительное уменьшение интенсивности пика, характерного для связи О–Н в составе кристаллизационной воды (рис. 7а). При 400°С исчезают пики, характерные для валентных колебаний –ОН- и –NH2-групп, а также уменьшается интенсивность пиков, характерных для колебаний связи С–Н (рис. 7б). При 600°С наблюдается исчезновение полос поглощения для связей С–Н, –C=O в группе CONHR, а также полосы поглощения, соответствующей колебаниям аминогруппы –NH2. Полученные данные подтверждают завершение разложения хитозана и переход брушита в пирофосфат кальция (рис. 7в). При 800°С в спектрах присутствуют пики, характерные для пирофосфата кальция (колебания связи О–Р–О с частотой 587, 616, 1039, 1095, 1180 см–1 и С–О с частотой 743 см–1).
Рис. 7.
ИК-спектры гранул брушит/хитозан (а–г) и ГА/хитозан (д–з) после термообработки при 200 (а, д), 400 (б, е), 600 (в, ж), 800°С (г, з).
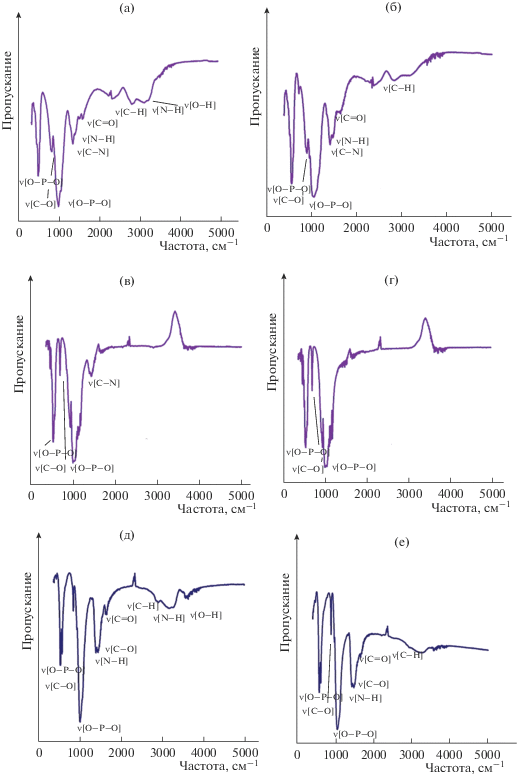
Рис. 7.
Окончание.
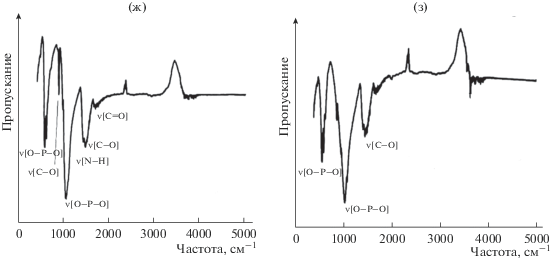
В ИК-спектрах гранулированного ГА в матрице хитозана при 200°С происходит уменьшение интенсивности пика, характерного для колебаний связи О–Н (рис. 7д). При 400°С в ИК-спектрах наблюдается исчезновение пика ОН-группы, уменьшается интенсивность пика, соответствующего колебаниям связи С–Н и С=О. После обработки гранул ГА/хитозан при 600°С происходит исчезновение пика, соответствующего СН2- и СН3-группам в структуре хитозана, а также становится слабовыраженным пик колебаний связи С=О. При 800°С присутствуют пики, характерные только для пирофосфата кальция (колебания связей О–Р–О и С–О) (рис. 7з).
По результатам ситового анализа получено, что доля гранул с размером 2 мм больше, чем доля гранул с размером 1 мм.
Растворение гранул брушит/хитозан и ГА/хитозан исследовали в изотоническом растворе в течение 2 ч. При этом фиксировали изменение концентрации ионов кальция в растворе. На рис. 8 представлены зависимости показателя ионов кальция от времени растворения гранул. Полученные кинетические кривые были обработаны, установлено, что экспоненциальная зависимость соответствует кинетике реакции первого порядка, поэтому в качестве количественной меры можно рассматривать начальную скорость растворения (табл. 1), определенную как тангенс угла наклона линейного участка прямой, построенной в координатах pCa–f(τ) (рис. 8).
Рис. 8.
Зависимости рСа гранулированного брушита (1) и ГА (2) от времени растворения в 0.9%-ном NаCl.
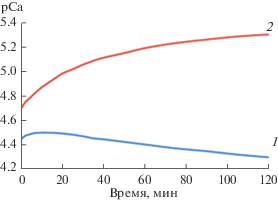
Таблица 1.
Значения начальных скоростей растворения гранул ГА/хитозан и брушит/хитозан в изотоническом растворе
| Кинетическое уравнение | Скорость, мин–1 | ||
|---|---|---|---|
| ГА/хитозан | брушит/хитозан | ГА/хитозан | брушит/хитозан |
| y = 0.0168x + 4.7134 | y = 0.0048x + 4.4645 | 0.0168 | 0.0048 |
Из данных зависимостей следует, что концентрация ионов кальция в растворе больше для гранулированного брушита в матрице хитозана по сравнению с гранулированным ГА/хитозан.
Из табл. 1 следует, что начальная скорость растворения композита ГА/хитозан выше, чем брушит/хитозан.
Известно, что хитозан представляет собой катионный полиэлектролит с ионизирующимися аминогруппами, который может образовывать труднорастворимое соединение посредством электростатического притяжения между протонированной аминогруппой хитозана и поливалентной гидрофосфатной группой брушита.
Для композита ГА/хитозан начальная скорость растворения возрастает с увеличением концентрации хитозана, так как в его составе преобладает более растворимый компонент – хитозан.
Проведено растворение синтезированных гранул в изотоническом растворе в течение 6 суток (рис. 9). Видно, что для гранул ГА/хитозан в первые сутки растворения наблюдается максимум рСа на зависимости рСа–f(τ). Переход ионов кальция из ГА в раствор происходил в течение 5 суток, затем наступило насыщение и концентрация ионов кальция на 6 сутки практически не изменилась. Для гранулированного брушита в матрице хитозана в первые 3 суток наблюдается значительное увеличение концентрации ионов кальция, выделившихся в изотонический раствор, а затем происходит насыщение и кривая выходит на плато.
Рис. 9.
Зависимости рСа от времени растворения гранул ГА/хитозан (1) и брушит/хитозан (2) в изотоническом растворе в течение 6 суток.
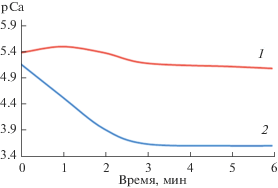
Таким образом, при использовании гранул в медицинских целях для быстрой доставки ионов кальция на начальном этапе растворения лучше использовать гранулированный ГА в матрице хитозана, а для медленного высвобождения ионов кальция – гранулы брушит/хитозан. При этом более интенсивная биорезорбция характерна для гранул брушит/хитозан.
ЗАКЛЮЧЕНИЕ
При исследовании морфологии гранул установлено, что их поверхность представлена пористой шероховатой структурой, при использованных режимах преобладает доля гранул с размером 2 мм.
При исследовании термических характеристик гранул установлено, что масса гранул ГА/хитозан после термообработки больше массы гранул брушит/хитозан в интеравале температур 400–800°С, карбонизация хитозана происходит при 400°С.
При исследовании растворимости гранул определено, что начальная скорость растворения композита ГА/хитозан больше, чем брушит/хитозан.
Показано, что при использовании синтезированных материалов в медицине для быстрой доставки ионов кальция на начальном этапе растворения лучше использовать гранулы ГА/хитозан.
Список литературы
Иорданский А.Л., Бычкова А.В., Сорокина О.Н. Биоразлагаемые магнитоанизотропные композиты на основе поли(3гидроксибутирата) и хитозана для контролируемого высвобождения лекарственных веществ // Докл. Академии наук. 2014. Т. 457. № 1. С. 61–63.
Chandrasekar A., Sagadevan S., Dakshnamoorthy A. Synthesis and Characterization of Nanohydroxyapatite (n-HAP) Using the Wet Chemical Technique // Int. J. Phys. Sci. 2013. № 8 (32). P. 1639–1645.
Tas Cuneyt A.J. Transformation of Brushite (CaHPO4 · · 2H2O) to Whitlockite (Ca9Mg(HPO4)(PO4)6) or other CaPs in Physiologically Relevant Solutions // J. Am. Ceram. Soc. 2016. V. 99. № 4. P. 1200–1206.
Teo A.J.T., Abhinay Mishra, Inkyu Park. Polymeric Biomaterials for Medical Implants and Devices // J. ACS Biomater. Sci. Eng. 2016. V. 2. № 4. P. 454–472.
Федотов А.Ю., Баринов С.М., Тетерина А.Ю., Фадеева И.В., Комлев В.С. Композиционный костный цемент в системе фосфаты кальция–хитозан // Докл. Академии наук. 2013. Т. 448. № 4. С. 430–432.
Cen Chen1, Sumi Bang, Younghak Cho, Sahnghoon Lee, Inseop Lee1, Sheng Min Zhang, Insup Noh. Research Trends in Biomimetic Medical Materials for Tissue Engineering: 3D Bioprinting, Surface Modification, Nano/Micro-Technology and Clinical Aspects in Tissue Engineering of Cartilage and Bone // Biomater. Res. 2016. V. 20. https://doi.org/10.1186/s40824-016-0057-3
Черняков Д.Д., Петрова В.А. Разработка нанокомпозитных материалов на основе природных полисахаридов для тканевой инженерии. // Инновации в здоровье нации. 2015. С. 481–485.
Тетерина А.Ю., Федотов А.Ю., Егоров А.А., Баринов С.М., Комлев В.С. Формирование микроструктуры пористых костных цементов системы фосфаты кальция–хитозан // Неорган. материалы. 2015. Т. 51. № 4. С. 449–452.
Сафронова Т.В., Садилов И.С., Чайкун К.В., Шаталова Т.Б., Филиппов Я.Ю. Синтез монетита из гидроксиапатиата кальция и монокальцийфосфата моногидрата в условиях механической активации // Журн. неорган. химии. 2019. Т. 64. № 9. С. 916–922.
Safronova T.V., Putlyayev V.I., Knotko A.V., Filippov Ya.Yu., Klimashina E.S., Ryzhov A.P., Saidzhonov B.M. Powder Mixtures Based on Calcium Hydroxyapatite and Sodium Salts // Inorg. Mater. 2018. V. 9. № 4. P. 726–731.
Ezhova Zh.A., Koval E.M., Zakharov N.A., Kalinnikov V.T. Synthesis and Physicochemical characterization of nanocrystalline chitosan_containing calcium carbonate apatites // Russ. J. Inorg. Chem. 2011. V. 56. № 6. P. 841–846.
Tsyganova A.A., Golovanova O.A. Synthesis of a Composite Material Based on a Mixture of Calcium Phosphates and Sodium Alginate // Inorg. Mater. 2019. V. 55. № 11. P. 1156–1161.
Izmailov R.R., Golovanova O.A., Tserikh Y.V., Drozdov V.A., Leont’eva N.N. Crystallization Specifics of Carbonate-Hydroxylapatite in the Presence of Strontium-Containing Agents // Russ. J. Inorg. Chem. 2016. V. 61. № 7. P. 817–821.
Федотов А.Ю., Баринов С.М., Фадеева И.В., Егоров А.А., Петракова Н.В., Усачев М.А., Комлев В.С. Синтез фосфатов кальция на макромолекулах хитозана в присутствии аминокислот // Докл. Академии наук. 2013. Т. 451. С. 533–538.
Jiang L. et al. Preparation and Properties of Nanohydroxyapatite/Chitosan/Carboxymethyl Cellulose Composite Scaffold //Carbohydrate Polym. 2008. V. 74. №. 3. P. 680–684.
Islam S., Rahman Bhuiyan M.A., Islam M.N. Chitin And Chitosan: Structure, Properties and Applications in Biomedical Engineering // J. Polym. Environ. 2017. № 25. P. 854–866.
Камская В.Е. Хитозан: структура, свойства и использование // Научное обозрение. Биологические науки. 2016. № 6. С. 36–42.
Тетерина А.Ю., Егоров А.А., Федотов А.Ю., Баринов С.М., Комлев В.С. Модифицирование костных цементов в системе фосфаты кальция–хитозан керамическими и альгинатными гранулами // Докл. Академии наук. 2015. Т. 461. С. 546–554.
Malikova T.V., Golovanova O.A., Chikanova E.S. Physicochemical Properties of Calcium Phosphate-Chitosan Composites and Scaffolds // Inorg. Mater. 2018. V. 54. № 9. P. 957–964.
Fadeeva T.V., Golovanova O.A. Physicochemical Properties of Brushite and Hydroxyapatite Prepared in the Presence of Chitin and Chitosan // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 847–856.
Бакунова Н.В., Баринов С.М., Комлев В.С., Смиронов В.В., Федотов А.Ю. Пористые хитозановые матриксы, армированными биоактивными соединениями кальция для восстановления костной ткани // Журн. Научные ведомости. Сер.: математика, физика. 2011. № 11 (106). 5 с.
Golovanova O.A., Zaits A.V. Biomimetic Coating of a Titanium Substrate with Silicon-Substituted Hydroxyapatite // Inorg. Mater. 2018. V. 54. № 11. P. 1124–1130.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы