Неорганические материалы, 2022, T. 58, № 1, стр. 69-75
Фазообразование и ионная проводимость фосфатов Na1 + 2xZnxZr2 – x(PO4)3
В. Ю. Бедин 1, О. В. Казачинер 1, Е. А. Асабина 1, *, В. И. Петьков 1, И. А. Стенина 2, А. М. Ковальский 3, А. Б. Ярославцев 2
1 Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, 23, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
3 Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: elena.asabina@inbox.ru
Поступила в редакцию 27.08.2021
После доработки 29.09.2021
Принята к публикации 30.09.2021
- EDN: BTKFUP
- DOI: 10.31857/S0002337X22010043
Аннотация
Фосфаты состава Na1 + 2xZnxZr2 –x(PO4)3 синтезированы золь–гель-методом с последующей термообработкой. В изученной системе получен ограниченный твердый раствор (0 ≤ x ≤ 0.4) структурного типа NASICON. Уточнение кристаллической структуры Na1.8Zn0.4Zr1.6(PO4)3 методом Ритвельда показало, что основу составляет смешанный каркас из соединенных вершинами (Zr/Zn)O6-октаэдров и РО4-тетраэдров. Ионы Na+ частично занимают полости двух типов. Методом импедансной спектроскопии исследована натрий-ионная проводимость фосфатов Na1 + 2xZnxZr2– x(PO4)3. Показано, что она увеличивается с ростом концентрации носителей заряда и для Na1.8Zn0.4Zr1.6(PO4)3 достигает 2.7 × 10–4 Cм/см при 723 К. Показано, что с ростом степени замещения циркония меняется механизм дефектообразования в исследуемых материалах от собственной разупорядоченности при х = 0 до примесной при х > 0.2. Проведены оценки энтальпии собственной разупорядоченности ионов натрия (72 кДж/моль) и энергии активации его миграции (61 кДж/моль).
ВВЕДЕНИЕ
Сложные фосфаты структурного типа NASICON (Na Super Ionic CONductor) [1–6] – аналоги минерала коснарита KZr2(PO4)3 [7] – зарекомендовали себя как вещества, имеющие высокую химическую и термическую устойчивость и обладающие важными для практических применений свойствами: ионпроводящими, теплофизическими, каталитическими и др. Целенаправленно менять свойства фосфатов AxB2(PO4)3 позволяет высокая вариативность состава, благодаря которой можно использовать в позиции А широкий набор одно- и двухзарядных, а в позиции В целый ряд трех- и четырехвалентных катионов [8, 9].
Прежде всего, фосфаты семейства NASICON представляют интерес как твердые электролиты [10, 11]. Во многом это определяется интересом к получению полностью твердотельных литий- и натрий-ионных аккумуляторов [12–18]. Их высокую ионную проводимость обуславливают наличие в кристаллической структуре протяженных каналов проводимости и тот факт, что число структурно и энергетически эквивалентных кристаллографических позиций обычно превышает количество подвижных катионов. Поэтому представляет интерес изучение зависимости электропроводности насиконоподобных фосфатов различного состава от степени заселенности их структурных полостей. Повышения проводимости, в частности, удается достичь за счет гетеровалентного замещения фосфора на кремний [19, 20] или четырехвалентного катиона в позиции В на трех- или пятивалентный [21–30]. Существенно меньше изучены материалы, в которых заряд катиона В и допанта различается более чем на единицу. В настоящей работе в качестве элемента, замещающего Zr4+ в составе NaZr2(PO4)3, выбран Zn2+, имеющий близкий к цирконию радиус. Целью настоящего исследования являются синтез, комплексная характеристика состава и строения, а также изучение электропроводности фосфатов Na1 + 2xZnxZr2 –x(PO4)3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения фосфатов Na1 + 2xZnxZr2 –x(PO4)3 использовали золь–гель-метод. Исходными реагентами служили реактивы квалификации “х. ч.”: Zn(CH3COO)2∙2H2O, ZrOCl2, NaNO3 и NH4H2PO4. При синтезе стехиометрические количества водных растворов солей металлов сливали при перемешивании, затем медленно добавляли раствор дигидрофосфата аммония. Полученные смеси высушивали при 363 K и подвергали ступенчатой термообработке при температурах 873 и 923 К до завершения синтеза. Поэтапный нагрев чередовали с диспергированием на каждой стадии.
Фазовый состав синтезированных образцов определяли методом рентгенофазового анализа на дифрактометре Shimadzu XRD–6000 в CuKα-фильтрованном излучении (λ = 1.54178 Å), в диапазоне углов 2θ 10°–60° с шагом сканирования 0.02°. Съемки для расчета параметров элементарных ячеек проводили со скоростью 0.5°/мин.
Рентгенограмму Na1.8Zn0.4Zr1.6(PO4)3 (х = 0.4) для структурных исследований снимали в интервале углов 2θ 10°–100° с шагом сканирования 0.02° и экспозицией 12 с в точке. Обработку рентгенограммы и уточнение структуры фосфата проводили методом Ритвельда [31] с использованием программы Rietan-97 [32]. Исходное положение катионных позиций для уточнения задавали исходя из известных литературных данных по аналогу NaZr2(PO4)3 (пр. гр. $R\bar {3}c$) [33]. Уточнение кристаллической структуры проводили путем постепенного добавления уточняемых параметров при постоянном графическом моделировании фона до стабилизации значений R-факторов.
ИК-спектры записывали на спектрофотометре FTIR-8400S в диапазоне волновых чисел 400–1500 см–1. Образцы для съемки были приготовлены прессованием с KBr.
Для подтверждения химического состава и однородности образцов их исследовали на сканирующем электронном микроскопе (СЭМ) JEOL JSM-7600F с энергодисперсионным спектрометром OXFORD X-Max 80 (Premium). Образцы были предварительно запрессованы в шашки из полимерного материала с последующей полировкой поверхности. Для расчета составов использовали алгоритм РАР-коррекции. Точность определения элементного состава образцов составляла 0.5–2.5 мол. %.
Электропроводность фосфатов измеряли методом импедансной спектроскопии с использованием платиновых электродов с помощью моста переменного тока ИПУ-62 в диапазоне частот 10 Гц–2 MГц в интервале температур 323–1033 K. Скорость нагрева составляла 2 К/мин. Величину проводимости рассчитывали экстраполяцией полуокружности объемной составляющей проводимости на ось активных сопротивлений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фазовый состав фосфатов Na1 + 2xZnxZr2 –x(PO4)3. Рентгенограммы всех образцов Na1 + 2xZnxZr2– x(PO4)3 с 0 ≤ х ≤ 0.4 (рис. 1а) подобны по положению и интенсивности рефлексов и типичны для фосфатов семейства NASICON. Фазовый состав фосфатов зависел от температуры отжига, при этом наиболее высокая кристалличность наблюдалась у образцов, отожженных при 923 К. Образцы были термически стабильны до температур от 1173 К (х = 0.4) до 1373 К (х = 0). Образцы с 0.5 ≤ х ≤ 2.0, по данным рентгенофазового анализа, помимо основной фазы, содержали примеси фосфатов натрия и цинка.
Рис. 1.
Рентгенограммы (а), параметры ячеек (б) и фрагменты ИК-спектров в области 1500–400 см–1 (в) фосфатов Na1 + 2xZnxZr2 –x(PO4)3; СЭМ-изображение поверхности образца Na1.8Zn0.4Zr1.6P3O12 (г).
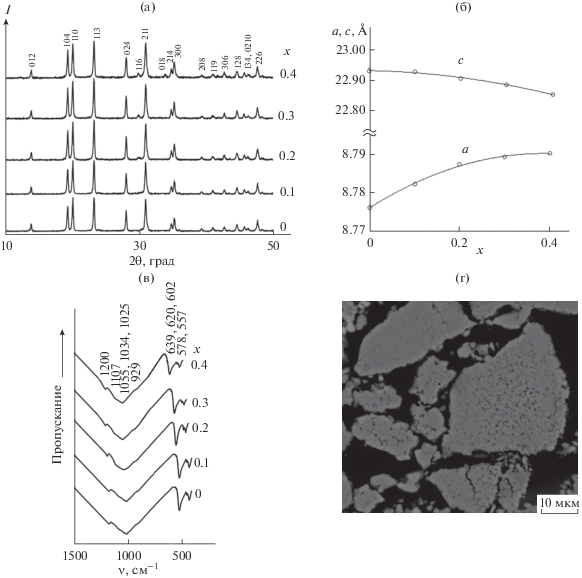
Концентрационные зависимости параметров гексагональных ячеек образцов приведены на рис. 1б. Для фосфатов этого ряда с ростом х увеличивается заселенность полостей структуры, расположенных между колонками каркасобразующих полиэдров. В результате наблюдается рост параметра а ячейки. При этом из-за поворота полиэдров каркаса одновременно уменьшается параметр с [34].
ИК-спектры однофазных образцов типичны для фосфатов структурного типа NASICON (рис. 1в) [35] и не содержат полос поглощения примесных аморфных фаз конденсированных фосфатов (в частности, пирофосфатов). В ИК-спектрах исследуемых фосфатов наблюдаются колебания РО4-группировок в области валентных асимметричных (1250–1000 см–1), симметричных (1000–900 см–1) и деформационных асимметричных колебаний (650–400 см–1). Деформационные симметричные колебания обычно проявляются ниже 400 см–1. В ИК-спектрах изученных образцов наблюдалось частичное наложение близко расположенных полос колебаний, что типично для фосфатов такого строения.
Однородность полученных образцов подтверждена данными электронной микроскопии (рис. 1г). Химический состав по данным рентгеноспектрального микроанализа соответствовал заданному в ходе синтеза. Так, например, для образца состава Na1.8Zn0.4Zr1.6P3O12 содержание натрия, цинка, циркония и фосфора составило соответственно 1.80(2), 0.40(3), 1.61(4) и 2.97(2) на формульную единицу.
Кристаллическая структура фосфата Na1.8Zn0.4Zr1.6(PO4)3 (х = 0.4). Для выявления особенностей распределения катионов в решетке исследованных тройных фосфатов проведено уточнение кристаллической структуры Na1.8Zn0.4Zr1.6(PO4)3 методом Ритвельда (рис. 2а). Данный материал кристаллизуется в структуре типа NASICON с пр. гр. $R\bar {3}c.$ Условия съемки, параметры кристаллической решетки и основные данные по уточнению структуры приведены в табл. 1.
Рис. 2.
Рентгенограммы фосфата Na1.8Zn0.4Zr1.6(PO4)3 (а): 1 – экспериментальная, 2 – вычисленная, 3 – разностная, 4 – положения брэгговских рефлексов; фрагмент кристаллической структуры (б).
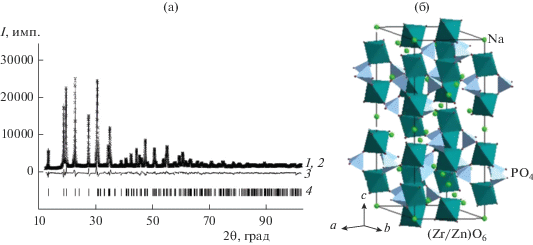
Таблица 1.
Условия съемки и результаты уточнения кристаллической структуры Na1.8Zn0.4Zr1.6(PO4)3
| Пр. гр. | $R\bar {3}c$ (No. 167) |
| Z | 6 |
| 2θ, град | 10.00−100.00 |
| a, Å | 8.7958(4) |
| c, Å | 22.8577(10) |
| V, Å3 | 1531.48(12) |
| Число отражений | 992 |
| Число уточняемых параметров | 25 + 13 |
| Факторы достоверности, %: | |
| Rwp; Rp | 6.16; 4.20 |
| S | 3.15 |
Согласно полученным результатам, основу структуры фосфата Na1.8Zn0.4Zr1.6(PO4)3 составляет каркас из (Zr/Zn)O6-октаэдров и РО4-тетраэдров, соединенных вершинами (рис. 2б). При этом катионы Zr4+ и Zn2+ статистически распределяются в каркасобразующих структурных позициях 12с (табл. 2). Основными структурными элементами каркаса являются фрагменты из двух октаэдров и трех тетраэдров, формирующие колонки вдоль кристаллографической оси с. Эти колонки связаны между собой посредством общих РО4-тетраэдров. Каркас структуры содержит полости двух типов: октаэдрически координированные полости внутри колонок полиэдров (позиции 6a, табл. 2) и полости, расположенные между колонками, с координационным числом 8 (позиции 18e). Первые из них полностью, а вторые частично заняты катионами Na+. Оба вида полостей соединены между собой в каналы, по которым способны перемещаться подвижные ионы.
Таблица 2.
Координаты и изотропные тепловые параметры атомов в структуре фосфата Na1.8Zn0.4Zr1.6(PO4)3
| Атом | Позиция | x | y | z | B, Å2 |
|---|---|---|---|---|---|
| Na(1) | 6a | 0.0 | 0.0 | 0.0 | 3.2(2) |
| Na(2)* | 18e | –0.4035(19) | 0.0 | 0.25 | 3.4(3) |
| Zr/Zn** | 12c | 0.0 | 0.0 | 0.1463(2) | 0.26(7) |
| P(1) | 18e | 0.2954(8) | 0.0 | 0.25 | 1.85(14) |
| O(1) | 36f | 0.1807(7) | –0.0280(8) | 0.1948(3) | 2.53(19) |
| O(2) | 36f | 0.1934(5) | 0.1713(7) | 0.0843(3) | 1.25(17) |
Средние межатомные расстояния Na–O в восьмикоординированных полостях (2.63 Å) превышают значение аналогичной длины связи для ионов натрия, занимающих октаэдрически координированные полости (2.51 Å), в соответствии с увеличением табличного значения ионного радиуса Na+ (от 1.02 до 1.18 Å) с ростом координационного числа. В целом, полученные значения длин связей в координационных полиэдрах, формирующих структуру Na1.8Zn0.4Zr1.6(PO4)3 (табл. 3), хорошо согласуются с известными аналогичными данными для фосфатов структурного типа NASICON [35].
Таблица 3.
Основные межатомные расстояния в полиэдрах, образующих структуру Na1.8Zn0.4Zr1.6(PO4)3
| Межатомные расстояния | d, Å |
|---|---|
| Na(1)–O(2) (×6) Na(2)–O(2) (×2) Na(2)–O(2) (×2) Na(2)–O(1) (×2) Na(2)–O(1) (×2) |
2.513(8) 2.181(18) 2.488(9) 2.725(7) 3.126(17) |
| Zr/Zn–O(1) (×3) Zr/Zn–O(2) (×3) |
2.052(5) 2.146(6) |
| P(1)–O(2) (×2) P(1)–O(1) (×2) |
1.515(7) 1.541(7) |
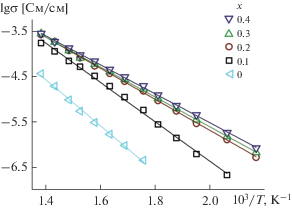
Ионная проводимость керамик. Ионная проводимость твердого раствора Na1 + 2xZnxZr2 –x(PO4)3 в изученной области температур изменяется в соответствии с законом Аррениуса (рис. 3), при этом прослеживается четкая тенденция роста электропроводности с ростом степени замещения циркония и содержания натрия (x). Это обусловлено ростом концентрации носителей заряда, в роли которых в исследуемых материалах выступают ионы натрия, локализованные в междоузлиях кристаллической решетки (частично заселенных позициях 18e). Для фосфата Na1.8Zn0.4Zr1.6(PO4)3 ионная проводимость достигает 2.7 × 10–4 Cм/см при 723 К. Стоит отметить и уменьшение энергии активации проводимости с ростом х. Существенное понижение для образцов с х = 0.1 и 0.2 практически сходит на нет при дальнейшем замещении ионов циркония на цинк (табл. 4). Этот эффект не может быть связан с увеличением размера каналов проводимости в исследуемых материалах в связи с различием ионных радиусов цинка и циркония, поскольку оно составляет всего 0.02 Å. Об этом же свидетельствует и немонотонность изменения энергии активации с ростом х. Этот эффект однозначно обусловлен изменением механизма дефектообразования в исследуемых образцах. Для недопированного образца с х = 0 концентрация дефектов определяется собственной термически активированной разупорядоченностью. В то же время при х > 0.2 концентрация дефектов определяется степенью замещения циркония, которая задает концентрацию ионов натрия в позициях 18e. Полученные данные позволяют оценить энтальпию собственной разупорядоченности и энергию активации миграции ионов натрия по структуре, которые составляют 72 и 61 кДж/моль соответственно.
ЗАКЛЮЧЕНИЕ
Фосфаты ряда Na1 + 2xZnxZr2– x(PO4)3 синтезированы золь–гель-методом и охарактеризованы методами рентгенофазового и рентгеноспектрального анализа, ИК-спектроскопии и электронной микроскопии. Полученные образцы кристаллизовались в структурном типе NASICON с пр. гр. $R\bar {3}c$ в пределах 0 ≤ x ≤ 0.4.
Проведено уточнение кристаллической структуры Na1.8Zn0.4Zr1.6(PO4)3 (х = 0.4) методом Ритвельда. Показано, что каркас структуры образован (Zr/Zn)O6-октаэдрами и РО4-тетраэдрами, а ионы Na+ занимают два типа структурных полостей с координационными числами 6 и 8.
Изучена ионная проводимость твердых растворов Na1 + 2xZnxZr2 –x(PO4)3, которая повышается с ростом концентрации носителей заряда.
Список литературы
Naqash S., Ma Q., Tietz F., Guillon O. Na3Zr2(SiO4)2(PO4) Prepared by a Solution-Assisted Solid State Reaction // Solid State Ion. 2017. V. 302. P. 83–91. https://doi.org/10.1016/j.ssi.2016.11.004
Park H., Jung K., Nezafati M., Kim C.S., Kang B. Sodium Ion Diffusion in Nasicon (Na3Zr2Si2PO12) Solid Electrolytes: Effects of Excess Sodium // ACS Appl. Mater. Interfaces. 2016. V. 8. № 41. P. 27814–27824. https://doi.org/10.1021/acsami.6b09992
Goodenough J.B., Hong H.Y.-P., Kafalas J.A. Fast Na+-Ion Transport in Skeleton Structures // Mater. Res Bull. 1976. V. 11. P. 203–220. https://doi.org/10.1016/0025-5408(76)90077-5
Петьков В.И., Шипилов А.С., Боровикова Е.Ю., Стенина И.А., Ярославцев А.Б. Cинтез и ионная проводимость NaZr2(AsO4)x(PO4)3 –x // Электрохимия. 2019. Т. 55. № 10. С. 1276–1280.
Суханов М.В., Ермилова М.М., Орехова Н.В., Петьков В.И., Терещенко Г.Ф. Каталитические свойства фосфата циркония и двойных фосфатов циркония и щелочных металлов со структурой NaZr2(PO4)3 // Журн. прикл. химии. 2006. Т. 79. № 4. С. 622–626.
Петьков В.И., Асабина Е.А. Теплофизические свойства NZP-керамики (обзор) // Стекло и керамика. 2004. Т. 61. № 7. С. 23–29.
Pilonen P.C., Friis H., Rowe R., Poirier G. Crystal Structure Determination of Kosnarite, KZr2(PO4)3, from the Mario Pinto Mine, Jenipapo District, Itinga, Brazil // Can. Mineral. 2020. V. 58. P. 1–16. https://doi.org/10.3749/canmin.2000044
Schlem R., Till P., Weiss M., Krauskopf T., Culver S.P., Zeier W.G. Ionic Conductivity of the NASICON-Related Thiophosphate Na1 +xTi2 –xGax(PS4)3 // Chem. – Eur. J. 2019. V. 25. P. 4143–4148. https://doi.org/10.1002/chem.201805569
Das A., Krishna P.S.R., Goswami M., Krishnan M. Structural Analysis of Al and Si Substituted Lithium Germanium Phosphate Glass-Ceramics Using Neutron and X-Ray Diffraction // J. Solid State Chem. 2019. V. 271. P. 74–80. https://doi.org/10.1016/j.jssc.2018.12.038
Ярославцев А.Б. Основные направления разработки и исследования твердых электролитов // Успехи химии. 2016. Т. 85. № 11. С. 1255–1276.
Tiliakos A., Iordache M., Marinoiu A. Ionic Conductivity and Dielectric Relaxation of NASICON Superionic Conductors at the Near-Cryogenic Regime // Appl. Sci. 2021. V. 11. 8432. https://doi.org/10.3390/app11188432
Noguchi Y., Kobayashi E., Plashnitsa L.S., Okada S., Yamaki J.I. Fabrication and Performances of All Solid-State Symmetric Sodium Battery Based on NASICON-Related Compounds // Electrochim. Acta. 2013. V. 101. P. 59–65. https://doi.org/10.1016/j.electacta.2012.11.038
Lalère F., Leriche J.B., Courty M., Boulineau S., Viallet V., Masquelier C., Seznec V. An All-Solid State NASICON Sodium Battery Operating at 200°C // J. Power Sources. 2014. V. 247. P. 975–980. https://doi.org/10.1016/j.jpowsour.2013.09.051
Stenina I.A., Yaroslavtsev A.B. Nanomaterials for Lithium-Ion Batteries and Hydrogen Energy // Pure Appl. Chem. 2017. V. 89. № 8. P. 1185–1194. https://doi.org/10.1515/pac-2016-1204
Новикова С.А., Ларкович Р.В., Чеканников А.А., Кулова Т.Л., Скундин А.М., Ярославцев А.Б. Проводимость и электрохимические характеристики материалов на основе Na3V2(PO4)3 со структурой NASICON // Неорган. материалы. 2018. Т. 54. № 8. С. 839–849.
Zhao C., Liu L., Qi X., Lu Y., Wu F., Zhao J., Yu Y., Hu Y.S., Chen L. Solid-State Sodium Batteries // Adv. Energy Mater. 2018. V. 8. 1703012. https://doi.org/10.1002/aenm.201703012
Ruan Y., Guo F., Liu J., Song S., Jiang N., Cheng B. Optimization of Na3Zr2Si2PO12 Ceramic Electrolyte and Interface for High Performance Solid-State Sodium Battery // Ceram. Int. 2019. V. 45. P. 1770–1776. https://doi.org/10.1016/j.ceramint.2018.10.062
Wang Y., Song S., Xu C., Hu N., Molenda J., Lu L. Development of Solid-State Electrolytes for Sodium-Ion Battery–A Short Review // Nano Mater. Sci. 2019. V. 1. P. 91–100. https://doi.org/10.1016/j.nanoms.2019.02.007
Guin M., Tietz F., Guillon O. New Promising NASICON Material as Solid Electrolyte for Sodium-Ion Batteries: Correlation between Composition, Crystal Structure and Ionic Conductivity of Na3 +xSc2SixP3 –xO12 // Solid State Ionics. 2016. V. 293. P. 18–26. https://doi.org/10.1016/j.ssi.2016.06.005
Naqash S., Tietz F., Yazhenskikh E., Müller M., Guillon O. Impact of Sodium Excess on Electrical Conductivity of Na3Zr2Si2PO12 + xNa2O Ceramics // Solid State Ionics. 2019. V. 336. P. 57–66. https://doi.org/10.1016/j.ssi.2019.03.017
Arbi K., Jimenez R., Šalkus T., Orliukas A.F., Sanz J. On the Influence of the Cation Vacancy on Lithium Conductivity of Li1 +xRxTi2 –x(PO4)3 Nasicon Type Materials // Solid State Ionics. 2015. V. 271. P. 28–33. https://doi.org/10.1016/j.ssi.2014.10.016
Losilla E.R., Bruque S., Aranda M.A.G., Moreno-Real L., Morin E., Quarton M. NASICON to Scandium Wolframate Transition in Li1 +xMxHf2 –x(PO4)3 (M = Cr, Fe): Structure and Ionic Conductivity // Solid State Ionics. 1998. V. 112. № 1–2. P. 53–62. https://doi.org/10.1016/S0167-2738(98)00207-0
Moon S.-H., Kim Y.H., Cho D.-Ch., Shin E.-Ch., Lee D., Im W.B., Lee J.-S. Sodium Ion Transport in Polymorphic Scandium NASICON Analog Na3Sc2(PO4)3 with New Dielectric Spectroscopy Approach for Current-Constriction Effects // Solid State Ionics. 2016. V. 289. P. 55–71. https://doi.org/10.1016/j.ssi.2016.02.017
Zheng Q., Yi H., Li X., Zhang H. Progress and Prospect for NASICON-Type Na3V2(PO4)3 for Electrochemical Energy Storage // J. Energy Chem. 2018. V. 27. № 6. P. 1597–1617. https://doi.org/10.1016/j.jechem.2018.05.001
Qiu Sh., Wu X., Wang M., Lucero M., Wang Y., Wang J., Yang Zh., Xu W., Wang Q., Gu M., Wen J., Huang Y., Xu Zh. J., Feng Zh. NASICON-Type Na3Fe2(PO4)3 as a Low-Cost and High-Rate Anode Material for Aqueous Sodium-Ion Batteries // Nano Energy. 2019. V. 64. 103941. https://doi.org/10.1016/j.nanoen.2019.103941
Pershina S.V., Pankratov A.A., Vovkotrub E.G., Antonov B.D. Promising High-Conductivity Li1.5Al0.5Ge1.5(PO4)3 Solid Electrolytes: the Effect of Crystallization Temperature on the Microstructure and Transport Properties // Ionics. 2019. V. 25. № 10. P. 4713–4725. https://doi.org/10.1007/s11581-019-03021-5
Yen P.-Y., Lee M.-L., Gregory D.H., Liu W.-R. Optimization of Sintering Process on Li1 +xAlxTi2 –x(PO4)3 Solid Electrolytes for All-Solid-State Lithium-Ion Batteries // Ceram. Int. 2020. V. 46. P. 20529–20536. https://doi.org/10.1016/j.ceramint.2020.05.162
Dias J.A., Santagneli S.H., Messaddeq Y. Methods for Lithium Ion NASICON Preparation: From Solid-State Synthesis to Highly Conductive Glass-Ceramics // J. Phys. Chem. C. 2020. V. 124. № 49. P. 26518–26539. https://doi.org/10.1021/acs.jpcc.0c07385
Pershina S.V., Il’ina E.A., Druzhinin K.V., Farlenkov A.S. Effect of Li2O–Al2O3–GeO2–P2O5 Glass Crystallization on Stability Versus Molten Lithium // J. Non-Cryst. Solids. 2020. V. 527. 119708. https://doi.org/10.1016/j.jnoncrysol.2019.119708
Курзина Е.А., Стенина И.А., Dalvi A., Ярославцев А.Б. Синтез и ионная проводимость твердых электролитов на основе фосфата лития-титана // Неорган. материалы. 2021. Т. 57. № 10. С. 1094–1101.
Rietveld H.M. Line Profiles of Neutron Powder-Diffraction Peaks for Structure Refinement // Acta Crystallogr. 1967. V. 22. P. 151–152.
Kim Y.I., Izumi F. Structure Refinements with a New Version of the Rietveld-Refinement Program RIETAN // J. Ceram. Soc. Jpn. 1994. V. 102. P. 401–404.
Hagman L.O., Kierkegaard P. Acta Chem. Scand. 1968. V. 22. № 6. P. 1822–1832.
Stenina I.A., Zhizhin M.G., Lazoryak B.I., Yaroslavtsev A.B. Phase Transitions, Structure and Ion Conductivity of Zirconium Hydrogen Phosphates, H1+/–xZr2 –xMx(PO4)3· ·H2O (M = Nb, Y) // Mater. Res. Bull. 2009. V. 44. № 7. P. 1608–1612. https://doi.org/10.1016/j.materresbull.2009.01.011
Asabina E., Pet’kov V., Maiorov P., Lavrenov D., Shchelokov I., Kovalsky A. Synthesis, Structure and Thermal Expansion of the Phosphates M0.5 +x${\text{M}}_{x}^{'}$Zr2 –x(PO4)3 (M, M' – Metals in Oxidation State +2) // Pure Appl. Chem. 2017. V. 89. № 4. P. 523–534. https://doi.org/10.1515/pac-2016-100510.1515/pac-2016-1005
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы