Неорганические материалы, 2022, T. 58, № 10, стр. 1094-1100
Моделирование процесса охлаждения расплава Bi2O3·SiO2 и продуктов его затвердевания в различных условиях
Т. В. Бермешев 1, *, В. П. Жереб 1, 2, М. П. Бундин 1, А. Н. Залога 1, А. С. Ясинский 1, 3, О. В. Юшкова 1, Д. С. Ворошилов 1, Е. Ю. Подшибякина 1, И. Ю. Губанов 1, Е. В. Мазурова 4, А. Б. Набиулин 5, В. П. Ченцов 6, В. В. Рябов 6, О. В. Якивьюк 1
1 Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
2 Сибирский университет науки и технологий им. академика М.Ф. Решетнёва
660037 Красноярск, пр. им. газеты “Красноярский рабочий”, 31, Россия
3 IME, Institute for Process Metallurgy and Metal Recycling,
RWTH Aachen University
52056 Aachen, Intzestraße, 3, Germany
4 Институт химии и химической технологии СО Российской академии наук
660036 Красноярск,
Академгородок, 50, стр. 24, Россия
5 ООО “Красноярский котельный завод”
660013 Красноярск, ул. Кишинёвская, 16, Россия
6 Институт металлургии УрО Российской академии наук
620016 Екатеринбург,
ул. Амундсена, 101, Россия
* E-mail: irbis_btv@mail.ru
Поступила в редакцию 10.02.2022
После доработки 15.08.2022
Принята к публикации 19.08.2022
- EDN: KAYJHA
- DOI: 10.31857/S0002337X22100025
Аннотация
Выполнено компьютерное моделирование процесса охлаждения расплава состава Bi2O3·SiO2 и метастабильной фазы Bi2SiO5 в разных условиях охлаждения с помощью программного комплекса ProCAST. С использованием взятых из литературы (теплопроводность, теплоемкость, плотность) и экспериментально определенных (коэффициент температуропрводности метастабильного соединения Bi2SiO5 в интервале температур 299–700°С) теплофизических характеристик расплава и метастабильной фазы, рассчитаны величины скоростей охлаждения, которые показали хорошую сходимость с определенными экспериментально значениями, что подтверждает адекватность допущений, принятых при моделировании.
ВВЕДЕНИЕ
Метастабильный силикат висмута Bi2SiO5 со слоистой кристаллической структурой типа Ауривиллиуса является не содержащим свинца экологически приемлемым сегнетоэлектриком и ионным проводником. Как сам по себе, так и в составе гетероструктур, нанокомпозитов это весьма перспективный фотокатализатор для дезактивации различных органических загрязнителей (родамин В, метиленовый синий, тетрациклин, фенол, малахитовый зеленый, фуксин, метилоранж, конго красный, Cr (VI)) [1–6], а также для восстановления СО2 до СО [7] и в синтезе бензальдегида из бензилового спирта [8]. Кроме того, он является перспективным катализатором для окислительной димеризации метана [9], а в составе нанокомпозитов – для окислительной конверсии н-бутана в бутадиен, этилен/пропилен или синтез-газ [10]. В составе нанокомпозитов его используют в качестве материала, в котором возможно сосуществование ферромагнетизма и сверхпроводимости [11], и для обнаружения сжиженного нефтяного газа [12]. В некоторых работах Bi2SiO5 используется для получения высокотемпературной диэлектрической керамики [13] и материалов (в составе метакомпозитов) с регулируемыми отрицательными диэлектрическими дисперсионными свойствами [14]. В работе [15] наносферы Bi2SiO5, легированные Nd3+, позиционируются как многообещающие температурные зонды для люминесцентной нанотермометрии.
Система Bi2O3–SiO2 представлена стабильной диаграммой состояния и двумя метастабильными. В состоянии стабильного равновесия в ней образуется конгруэнтно плавящийся силикат висмута Bi12SiO20 с кристаллической структурой силленита и инконгруэнтно плавящаяся фаза Bi4Si3O12 с кристаллической структурой эвлитина. В состоянии метастабильного равновесия образуются широкие области твердых растворов на основе δ*-Bi2O3 и метастабильного силиката висмута Bi2SiO5.
На фазовой диаграмме стабильного равновесия системы Bi2O3–SiО2 в области жидкого состояния можно выделить три интервала температур, соответствующих трем температурным зонам расплава – А, В и С, в которых состояние расплава отличается не только характером температурных зависимостей свойств, но и фазовым составом кристаллов, образующихся при кристаллизации медленно охлаждаемых (5–10°С/мин) расплавов от температур, относящихся к разным температурным зонам (рис. 1, 2) [16, 17]. При закалке с тиглем в воду от температур зоны С (1180 и 1100°C), благодаря обнаруженному в системе расслаиванию, будет образовываться трехслойный материал, состоящий из слоя черного стекла (затвердевший расплав, который контактировал с дном и стенками тигля) и слоя желтого стекла (затвердевший расплав, который контактировал с воздухом), между которыми будет образовываться широкая область поликристаллического δ*-Bi2O3; закалка же от температур зоны В (1040°C) будет приводить к получению аморфного материала (желтое стекло). Более медленное охлаждение на воздухе из температурных зон С и В приводит к получению частично аморфных (желтое стекло – там, где расплав контактировал с воздухом) и частично поликристаллического (Bi2SiO5 + δ*-Bi2O3 – там, где расплав контактировал с дном и стенками тигля) образцов. И только медленное охлаждение с печью позволяет получить соединение Bi2SiO5 [18].
Рис. 1.
Границы температурных зон A, B и C (1), построенные по результатам нагревания в области расплава на фазовой диаграмме стабильного равновесия (2) системы Bi2O3–SiO2 [16], 3 – температуры начала охлаждения расплава.
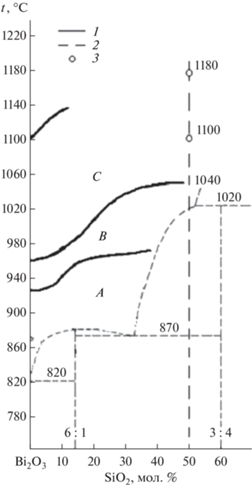
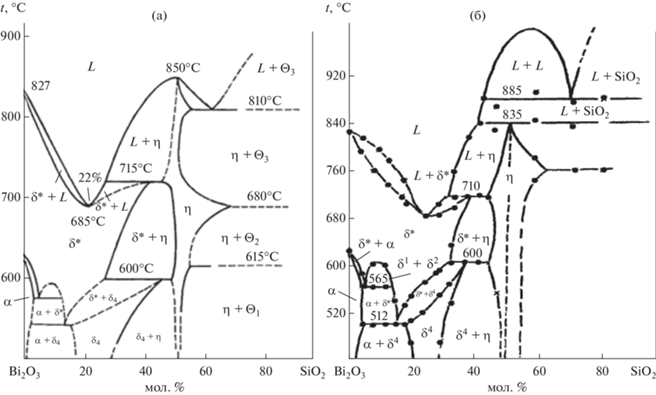
Рис. 2.
Фазовые диаграммы метастабильных равновесий системы Bi2O3–SiO2, построенные по результатам охлаждения расплава от температур, лежащих в зонах В (а) и С (б) [17].
К настоящему времени существует множество способов синтеза Bi2SiO5 (гидротермальный, из расплава солей, сольвотермический, золь–гель, метод металлического органического разложения, магнетронное распыление, химический, метод ионного обмена, механическая активация, лазерная абляция, комбинированные методы), которые при всех своих достоинствах все же имеют и серьезные недостатки, такие как длительность, высокая трудоемкость, требование дополнительного оборудования, значительные затраты. В [18] показано, что получение метастабильных фаз кристаллизацией расплава является не только простым, удобным, но и наиболее продуктивным способом синтеза метастабильного соединения Bi2SiO5. Однако ограниченная устойчивость метастабильного состояния расплава требует осторожного обращения и плохо совмещается с использованием термопар или других датчиков, необходимых для оптимизации условий охлаждения.
Поэтому цель исследования состояла в изучении возможности надежной оценки характеристик процесса нагрева и охлаждения расплава состава Bi2O3·SiO2 и метастабильной фазы Bi2SiO5 с использованием программного комплекса ProCAST, а также сопоставление их с результатами экспериментов. На первом этапе решалась задача получения надежных теплофизических характеристик расплава и метастабильной фазы, необходимых для моделирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Плотность кристаллов Bi2SiO5 определялась методом гидростатического взвешивания при комнатной температуре с помощью аналитических автоматических весов Vibra HT и далее принималась за константу вплоть до температуры солидуса. Значение плотности расплава, содержащего 35 мол. % SiO2, при температуре 1097°С было взято из работы [19] и принималось за константу вплоть до температуры ликвидуса.
Температуры ликвидуса и солидуса определяли по диаграммам метастабильного равновесия. В зависимости от температуры начала охлаждения они составили 885 и 835°С для зоны С и 850°С для зоны В.
Зависимость теплоемкости от температуры в диапазоне 400–985°С была взята из работы [20] и представлена полиномиальным уравнением третьей степени, описывающим линию тренда до температуры 1200°С,
где х – температура нагрева.Коэффициент температуропроводности измеряли на установке LFA 457 MicroFlash (компания Netzsch). Коэффициент теплопроводности (λ) рассчитывали по формуле
где α – коэффициент температуропроводности, Ср – теплоемкость, ρ – плотность материала.Плотность рассчитывалась по формуле
где m – масса, V – объем образца (пористость вещества не учитывали).Ввиду отсутствия сведений о температурной зависимости теплопроводности расплава состава Bi2O3 : SiO2 = 1 : 1, для предварительных расчетов использовали характеристики теплопроводности расплава состава Bi2O3 : GeO2 = 2 : 3, соответствующие составу ближайшего стабильного соединения Bi4Ge3O12 аналогичной германатной системы (табл. 1) [21].
Таблица 1.
Зависимости теплофизических свойств Bi2SiO5 от температуры
| t, °С | Ср, Дж/(моль К) | t, °С | ρ, г/см3 | t, °С | λ, Вт/(м К) |
|---|---|---|---|---|---|
| 400 | 0.409 [21] | 20 | 7.0555 | 401 | 1.55 |
| 500 | 0.425 [21] | 1097 | 7.6 [20] | 499 | 1.56 |
| 600 | 0.435 [21] | 600 | 1.57 | ||
| 700 | 0.444 [21] | 700 | 2.30 | ||
| 800 | 0.451 [21] | 1067 | 0.20 [21]** | ||
| 900 | 0.458 [21] | ||||
| 985 | 0.463 [21] | ||||
| 1000 | 0.562* | ||||
| 1050 | 0.578* | ||||
| 1100 | 0.596* | ||||
| 1150 | 0.615* | ||||
| 1200 | 0.637* | ||||
| * Получено с помощью математического прогнозирования.** Значения теплопроводности расплава стабильного соединения Bi4Ge3O12 схожей германатной системы. | |||||
Материал тигля – чистая платина. Геометрия изделия соответствует изделию № 100-10 по ГОСТ 6563-75. Масса навески для плавки 10 г. Толщина закристаллизовавшегося расплава 1.97–2.4 мм. Теплофизические характеристики материала тигля (чистой платины) были взяты из работы [22].
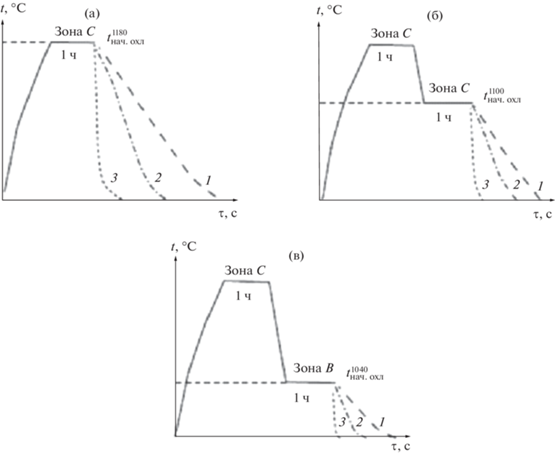
Моделирование проводили с использованием профессионального программного комплекса ProCAST. Режимы охлаждения аналогичны 9 режимам охлаждения, представленным для германатной системы в работе [18], но имеют несколько иные температуры начала охлаждения: 1180, 1100 и 1040°C (рис. 3). Поскольку теплопроводность и теплоемкость слабо зависят от структуры материала, для первичных расчетов по всем девяти режимам охлаждения (рис. 3) основные теплофизические характеристики соответствовали соединению Bi2SiO5. Расслаивание расплава в расчет не принимали.
Рис. 3.
Схема режимов термообработки расплава при различных температурах начала охлаждения (tнач.охл), относящихся к различным температурным зонам: верхняя часть зоны С (а), нижняя часть зоны С (б) и зона В (в): 1 – охлаждение с печью, 2 – охлаждение на воздухе, 3 – охлаждение тигля в воде.
Параметры моделирования тепловой задачи были следующими: температура окружающей среды 20°C, температура воды 15°C, температура ликвидуса платины 1768°C. Коэффициенты теплопередачи составляли (Вт/(м2 К)): расплав–тигель – 10000, тигель–вода – 5000, тигель–шамотный кирпич – 300.
Реальное время кристаллизации определяли во время закалки с тиглем в воду и охлаждения на воздухе от температур верхней части зоны С (1180°C). Из-за невозможности определения реального времени кристаллизации метастабильного расплава контактными методами (например, вискозиметрией, т. к. это может привести к зародышеобразованию и росту стабильных фаз), проводили измерение по видеозаписи. Процесс кристаллизации фиксировали на видеокамеру Sony HDR-PJ620. Во время охлаждения с печью (режим 3, рис. 3а), учитывая низкую контролируемую скорость охлаждения – 4°С/мин (сопоставимую с равновесной), практическое время кристаллизации выбирали согласно диаграммам метастабильных равновесий (рис. 3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Температурные зависимости теплофизических свойств (Ср – теплоемкость, ρ – плотность и λ – теплопроводность) Bi2SiO5 представлены в табл. 1.
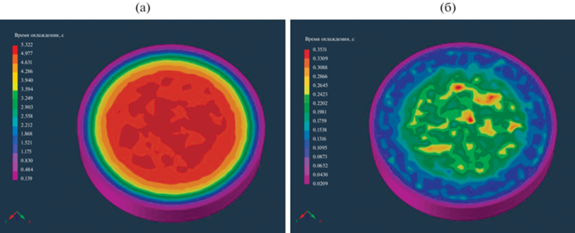
На рис. 4а показан пример распределения времени охлаждения по сечению материала в тигле при закалке расплава в тигле в воду из зоны С (режим 3, рис. 3а). Аналогичное распределение при охлаждении расплава от ликвидуса до солидуса показано на рис. 4б.
Рис. 4.
Распределение времени охлаждения по сечению образца (расплава) в тигле при закалке из нижней части зоны С (tнач.охл = 1100°С): а – охлаждение до полной кристаллизации, б – охлаждение от температуры ликвидуса до температуры солидуса.
Изменения температуры во времени при охлаждении расплава до комнатной температуры по разным режимам (рис. 3) представлены в табл. 2. Видно, что полученные расчетные значения для времени как кристаллизации, так и полного охлаждения хорошо коррелируют между собой.
Таблица 2.
Экспериментальные и рассчитанные значения времен кристаллизации расплава состава Bi2O3 : SiO2 = = 1 : 1 и полного охлаждения продуктов его затвердевания при различных режимах
| tнач.охл, °С | Режим охлаждения тигля с расплавом | Расчетное время кристаллизации*, с | Реальное (практическое) время кристаллизации, с | Температура полного охлаждения*, °С (контроль по центру тигля) |
Время полного охлаждения*, с |
|---|---|---|---|---|---|
| 1180 | Закалка в воду | 6 | 5–6 | 34 | 28 |
| Охлаждение на воздухе | 38 | 43 | 34 | 571 | |
| Охлаждение с печью | 5328 | 5175 | 380 | 12 761 | |
| 1100 | Закалка в воду | 3 | 43 | 25 | |
| Охлаждение на воздухе | 28 | 43 | 391 | ||
| Охлаждение с печью | 3910 | 380 | 10 921 | ||
| 1040 | Закалка в воду | 5 | 30 | 28 | |
| Охлаждение на воздухе | 22 | 43 | 411 | ||
| Охлаждение с печью | 3513 | 380 | 11 771 |
В качестве примера на рис. 5 приведена зависимость температуры от времени при закалке расплава с тиглем в воду (режим 3, рис. 3а). Из данных расчетов видно, что значения скорости охлаждения расплава в центральной части тигля и на расстоянии 1/2 R практически одинаковы и отличаются только на периферии – у стенок тигля и дна, где происходит наиболее быстрый теплоотвод. На этот факт также будут оказывать влияние количество расплава и геометрия самого тигля. При охлаждении на воздухе скорость охлаждения расплава по сечению в тигле будет отличаться меньше, чем при закалке в воду. При охлаждении с печью материал будет иметь минимальный градиент температур между слоями.
Рис. 5.
Изменение температуры во времени при закалке из зоны С (tнач.охл = 1180°С) в центральной части тигля (синий цвет), на расстоянии 1/2 R (оранжевый цвет) и 0.9 R (серый цвет).
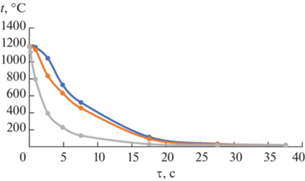
Сопоставление расчетного времени охлаждения с реальным (табл. 2) указывает на хорошую сходимость результатов компьютерного моделирования с экспериментальными значениями.
ЗАКЛЮЧЕНИЕ
Выполненное моделирование процессов охлаждения метастабильного соединения Bi2SiO5 с кристаллической структурой типа Ауривиллиуса при помощи программного комплекса ProCAST показывает хорошую сходимость расчетных значений с реальными скоростями охлаждения расплавов и может применяться для моделирования процессов нагрева и охлаждения метастабильных соединений в системе Bi2O3–SiO2.
Список литературы
Zhang Q., Ravindra, Xia H., Zhang L., Zeng K., Xu Y., Xin C. Microwave Hydrothermal Synthesis of a Bi2SiO5/Bi12SiO20 Heterojunction with Oxygen Vacancies and Multiple Charge Transfer for Enhanced Photocatalytic Activity // Appl. Surf. Sci. 2022. V. 581. № 152337. https://doi.org/10.1016/j.apsusc.2021.152337
Dou L., Li J., Long N., Lai C., Zhong J., Li J., Huang S. Fabrication of 3D Flower-Like OVs-Bi2SiO5 Hierarchical Microstructures for Visible Light-Driven Removal of Tetracycline // Surf. Interfaces. 2022. V. 29. № 101787. https://doi.org/10.1016/j.surfin.2022.101787
Xie Y., Zhang H., Lv J., Zhao J., Jiang D., Zhan Q. Synthesis and Characterization of Bi2SiO5-Coated Ag/AgBr Photocatalyst with Highly Efficient Decontamination of Organic Pollutants // Appl. Surf. Sci. 2022. V. 578. № 152074. https://doi.org/10.1016/j.apsusc.2021.152074
Belik Y.A., Vodyankin A.A., Fakhrutdinova E.D., Svetlichnyi V.A., Vodyankina O.V. Photoactive Bismuth Silicate Catalysts: Role of Preparation Method // J. Photochem. Photobiol., A. 2022. V. 425. № 113670. https://doi.org/10.1016/j.jphotochem.2021.113670
Shafafi S., Habibi-Yangjeh A., Feizpoor S., Chand H., Krishnan V., Wang C. Impressive Visible-Light Photocatalytic Performance of TiO2 by Integration with Bi2SiO5 Nanoparticles: Binary TiO2/Bi2SiO5 Photocatalysts with n-n Heterojunction // Colloids Surf., A. 2021. V. 629. № 127392. https://doi.org/10.1016/j.colsurfa.2021.127392
Dou L., Zhong J., Li J., Pandian R., Burda C. In-Situ Construction of 3D Nanoflower-Like BiOI/Bi2SiO5 Heterojunctions with Enhanced Photocatalytic Performance for Removal of Decontaminants Originated from a Step-Scheme Mechanism // Appl. Surf. Sci. 2021. V. 544. № 148883. https://doi.org/10.1016/j.apsusc.2020.148883
Guan X., Zhang X., Zhang C., Li R., Liu J., Wang Y., Wang Y., Fan C., Li Z. In Situ Hydrothermal Synthesis of Metallic Bi Self-Deposited Bi2SiO5 with Enhanced Photocatalytic CO2 Reduction Performance // Sol. RRL. 2022. № 2200346. https://doi.org/10.1002/solr.202200346
Sarkar D., Paliwal K.S., Ganguli S., Praveen A.E., Saha D., Mahalingam V. Engineering of Oxygen Vacancy as Defect Sites in Silicates for Removal of Diverse Organic Pollutants and Enhanced Aromatic Alcohol Oxidation // J. Environ. Chem. Eng. 2021. V. 9. № 105134. https://doi.org/10.1016/j.jece.2021.105134
Жереб В.П. Метастабильные состояния в оксидных висмутсодержащих системах. М.: МАКС Пресс, 2003. 162 с.
Qureshi Z.S., Tanimu G., Aitani A.M., Asaoka S. Alasiri H. Production of Butadiene and Lower Olefins via Oxidative Conversion of n-Butane Over Ni-Bi-O/Zeolite Catalysts // Mol. Catal. 2022. V. 522. № 112224. https://doi.org/10.1016/j.mcat.2022.112224
Haldar T., Ravi Kanth Kumar V.V. Coexistence of Ferromagnetism and Superconductivity in MWCNT/Bi2SiO5 Nanocomposites // Phys. Scr. 2021. V. 96. № 12. № 125859. https://doi.org/10.1088/1402-4896/ac39ba
Haldar T., Kumar U., Yadav B.C., Ravi Kanth Kumar V.V. Hierarchical Flower-Like Bi2SiO5/MWCNT Nanocomposites for Highly Sensitive LPG Sensor at Room Temperature // J. Alloys Compd. 2021. V. 856. № 158157. https://doi.org/10.1016/j.jallcom.2020.158157
Sakamoto K., Hagiwara M., Taniguchi H., Fujihara S. Fabrication of Bismuth Silicate Bi2SiO5 Ceramics as a Potential High-Temperature Dielectric Material // J. Mater. Sci. 2021. V. 56. P. 8415–8426.
Haldar T., Kumar U., Yadav B.C., Ravi Kanth Kumar V.V. Effect of Direct–Current Biasing on the Adjustable Radio-Frequency Negative Permittivity Characteristics of Bi2SiO5/Multiwall Carbon Nanotube Metacomposites // Ceram. Int. 2021. V. 47. P. 1389–1398.
Chen D., Liang Y., Miao S., Bi J., Sun K. Nd3+-Doped Bi2SiO5 Nanospheres for Stable Ratiometric Optical Thermometry in the First Biological Window // J. Lumin. 2021. V. 234. № 117967. https://doi.org/10.1016/j.jlumin.2021.117967
Каргин Ю.Ф., Жереб В.П., Скориков В.М. Стабильное и метастабильное фазовые равновесия в системе Bi2O3–SiO2 // Журн. неорган. химии. 1991. Т. 36. № 10. С. 2611–2616.
Жереб В.П. Физико-химические исследования метастабильных равновесий в системах Bi2O3 – ЭO2, где Э – Si, Ge, Ti: Автореф. дис. … канд. хим. наук. М.: ИОНХ АН СССР, 1980. 22 с.
Бермешев Т.В., Жереб В.П., Тас-Оол Р.Н., Мазурова Е.В., Метелица С.И. Расслаивание в системе Bi2O3–SiO2. Влияние условий охлаждения расплава на фазовый состав и микроструктуру продуктов затвердевания // Изв. Академии наук. Сер. хим. 2021. Т. 70. № 8. С. 1462–1470.
Жереб В.П. Физико-химические исследования метастабильных равновесий в системах Bi2O3 – ЭO2, где Э – Si, Ge, Ti: Дис. … канд. хим. наук. М.: ИОНХ АН СССР, 1980.
Денисова Л.Т., Иртюго Л.А., Денисов В.М. Теплоемкость оксидов системы Bi2O3–SiO2 // Физика твердого тела. 2014. Т. 56. № 10. С. 2076–2078.
Golyshev V.D., Gonik M.A., Tsvetovsky V.B. Spectral Absorptivity and Thermal Conductivity of BGO and BSO Melts and Single Crystals // Int. J. Thermophys. 2008. V. 29. P. 1480–1490. https://doi.org/10.1007/s10765-008-0499-5
Зиновьев В.Е. Справочник теплофизические свойства металлов при высоких температурах. М.: Металлургия, 1989. С. 381.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


