Неорганические материалы, 2022, T. 58, № 11, стр. 1202-1207
Система KLa(SO4)2–SrSO4 при температуре выше 600°С
Н. Н. Бушуев 1, *, А. Н. Егорова 1, И. И. Плотко 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва,
Миусская пл., 9, Россия
* E-mail: nbushuev@muctr.ru
Поступила в редакцию 23.03.2022
После доработки 13.09.2022
Принята к публикации 13.09.2022
- EDN: AXTBZT
- DOI: 10.31857/S0002337X22100050
Аннотация
Методами рентгенофазового и термогравиметрического анализов исследована система KLa(SO4)2–SrSO4 при температуре выше 600°С. Установлено существование широкой области твердых растворов в интервале 0–70 мол. % KLa(SO4)2 на основе ромбической модификации β-SrSO4 (пр.гр. Pnma). Определены параметры элементарных ячеек твердых растворов. Объемы элементарных ячеек V в указанном концентрационном интервале закономерно увеличиваются от 307.67(6) до 313.54(21) Å3. Твердые растворы образуются в результате гетеровалентного замещения двух ионов стронция на ионы калия и лантана и распадаются выше температуры 950°С с выделением оксидов SO3, La2O3, сульфатов калия и стронция.
ВВЕДЕНИЕ
В работе [1] установлено существование полугидрата сульфата стронция SrSO4·0.5H2O, кристаллизующегося в гексагональной сингонии из водных растворов, с параметрами элементарной ячейки, близкими к параметрам известной гексагональной модификации полугидрата сульфата кальция CаSO4·0.5H2O. Отмечалась неустойчивость модификации SrSO4·0.5H2O, время существования которой не превышало 120 мин, затем происходила полная дегидратация с образованием ромбического безводного SrSO4.
В работе [2] отмечалось, что сульфат стронция может использоваться в качестве абсорбента редкоземельных элементов (РЗЭ) в водных растворах при участии калия в результате гетеровалентного замещения 2Sr2+ → K+ + La3+. В результате этого замещения гексагональная модификация SrSO4⋅0.5H2O приобретает высокую устойчивость и может существовать практически неограниченное время как в водной среде, так и на воздухе. В исследованной в работе [2] системе КLa(SO4)2⋅H2O–SrSO4⋅0.5H2O обнаружено существование широкой области твердых растворов на основе гексагональной модификации SrSO4⋅0.5H2O, термическая устойчивость которых ограничена 250°С.
В работе [3] система KLa(SO4)2⋅H2O–SrSO4⋅ ⋅0.5H2O исследована в температурном интервале 100–500°С. Показано, что в процессе нагревания твердых растворов на основе гексагональной модификации SrSO4⋅0.5H2O происходит разрушение их структуры с образованием соединений аналогичного состава, но содержащих 0.1 моль H2O. Соединение состава Sr0.5K0.25La0.25SO4·0.5H2O обезвоживается до состава Sr0.5K0.25La0.25SO4·0.1H2O с переходом гексагональной структуры SrSO4⋅0.5H2O в моноклинную SrSO4⋅0.1H2O. Определены параметры элементарных ячеек Sr0.5K0.25La0.25SO4·0.5H2O и Sr0.5K0.25La0.25SO4·0.1H2O. Область существования соединения Sr0.5K0.25La0.25SO4·0.1H2O ограничена узким температурным интервалом 250–350°С. Дальнейшее нагревание сопровождается значительной аморфизацией, постепенным обезвоживанием и полной потерей кристаллогидратной воды при температуре 500°С. Было установлено, что на фоне аморфной фазы при 500–550°С появляется кристаллическая структура хорошо известной безводной ромбической модификации β-SrSO4 (пр. гр. Pnma).
Структура ромбической модификации β-SrSO4 исследована и приведена в [4]. В работах [5–8] отмечена изоструктурность β-SrSO4 и сульфатов BaSO4, SnSO4 и PbSO4. В работе [9] исследована иерархическая структура синтезированного при комнатной температуре сульфата стронция, а эластичность его свойств изучена в работе [10] при повышенном давлении. Отмечено, что частичное гетеровалентное замещение двухзарядных ионов Sr2+ и ${\text{SO}}_{4}^{{2 + }}$ в структуре SrSO4 на трехзарядные ионы Sm3+ и ${\text{PO}}_{4}^{{3 - }}$ приводит к фотолюминесценции [11]. Характер включения РЗЭ в структуру SrSO4 представляет определенный научный интерес.
Целью настоящей работы является исследование системы KLa(SO4)2–SrSO4 при температуре 600–1200°С.
МЕТОДИКА И РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
Результаты [2, 3] позволили предположить, что после термической обработки образцов системы KLa(SO4)2⋅H2O–SrSO4⋅0.5H2O при температуре выше 600°С возможно отделение аморфной фазы KLa(SO4)2 от ромбической модификации β-SrSO4 в водных или слабокислых растворах вследствие большого различия их растворимости. C этой целью образцы твердого раствора состава (мол. %) 33.3КLa(SO4)2⋅H2O + 66.6SrSO4⋅0.5H2O, полученные по методике [2, 3], подвергли отжигу при температурах 300 и 600°С. После отжига образцы были тщательно перетерты и подвергнуты длительной отмывке в 50-кратном растворе дистиллированной воды. Оставшийся осадок был отфильтрован и исследован на рентгеновском спектрометре EDX-7000 (Shimadzu Scientific Instruments, Kyoto, Japan). Сохранение количественного элементного состава образцов до и после водной отмывки свидетельствует о достаточной устойчивости структуры как кристаллогидратных, так и безводных модификаций.
С целью исследования природы включения атомов K и La в структуру ромбической безводной модификации SrSO4 образцы системы KLa(SO4)2⋅H2O–SrSO4⋅0.5H2O были отожжены при температуре выше 550°С [2], а именно при 600–800°С с более длительной выдержкой в течение 100 ч.
Рентгенографический анализ выполнен с использованием камеры-монохроматора G-670 фирмы HUBER (${\text{Cu}}{{K}_{{{{\alpha }_{1}}}}}$-излучение, шаг измерения 2θ = = 0.005°) и программного комплекса WinXPOW (version 2.20 2006 г.) фирмы STOE. Погрешность в определении параметров элементарных ячеек не более 0.002 Å.
Камера-монохроматор G-670 осуществляет регистрацию дифракционных линий по методу Гинье на визуализирующую изогнутую пластину (Imaging Plate-Detector: Scintillation Counter) одновременно по всем направлениям 2θ от 10° до 90°. В качестве монохроматора в камере G-670 используется изогнутый германиевый монокристалл (Curved Germanium 111).
Термогравиметрический анализ проведен на синхронном термоанализаторе Netzsch STA 409 PC cо скоростью нагревания 5°С/мин до температуры 1300°С.
По результатам рентгенофазового анализа установлено, что все образцы системы KLa(SO4)2–SrSO4 в концентрационном интервале 0–70 мол. % KLa(SO4)2, отожженные при температуре 600°С, представляют собой однофазные твердые растворы на основе ромбического β-SrSО4. В концентрационной области 70–100 мол. % KLa(SO4)2 образцы, отожженные при 600°С, содержат две фазы: твердый раствор на основе β-SrSО4 и двойной сульфат KLa(SO4)2.
В табл. 1 приведены рентгенографические данные образца состава 33.3 мол. % KLa(SO4)2 + + 66.6 мол. % SrSО4, параметры элементарной ячейки составили: a = 8.4096 (16) Å, b = 5.3720 (12) Å, c = 6.8867(12) Å, V = 311.11 (13) Å3, пр. гр. Pnma. Надежность индицирования, в т. ч. первых 30 линий рентгенограммы, подтверждается критерием Смита–Снайдера F(30) = 47.6 при необходимом критерии F(30) > 15, среднее отклонение 2θэксп – 2θрасч составляет 0.021°.
Таблица 1.
Рентгенографические характеристики образца состава 33.3 мол. % KLa(SO4)2 + 66.6 мол. % SrSО4
| d, Å | 2θрасч | Δ(2θэксп – 2θрасч) | I, % | h k l |
|---|---|---|---|---|
| 4.236 | 20.962 | 0.0104 | 9.79 | 0 1 1 |
| 4.199 | 21.123 | 0.0366 | 3.55 | 2 0 0 |
| 3.784 | 23.506 | 0.0055 | 29.50 | 1 1 1 |
| 3.587 | 24.802 | 0.0166 | 1.18 | 2 0 1 |
| 3.443 | 25.864 | 0.0077 | 24.55 | 0 0 2 |
| 3.311 | 26.916 | 0.0071 | 82.63 | 2 1 0 |
| 3.186 | 27.990 | 0.0129 | 51.73 | 1 0 2 |
| 2.985 | 29.931 | –0.0004 | 100.00 | 2 1 1 |
| 2.741 | 32.660 | 0.0017 | 63.95 | 1 1 2 |
| 2.687 | 33.338 | –0.0025 | 49.28 | 0 2 0 |
| 2.597 | 34.535 | –0.0057 | 6.57 | 3 0 1 |
| 2.402 | 37.477 | –0.0457 | 4.40 | 1 2 1 |
| 2.388 | 37.674 | –0.0174 | 18.98 | 2 1 2 |
| 2.264 | 39.803 | –0.0049 | 17.17 | 2 2 0 |
| 2.215 | 40.728 | 0.0008 | 6.05 | 1 0 3 |
| 2.174 | 41.527 | –0.0048 | 10.28 | 3 0 2 |
| 2.151 | 41.995 | –0.0062 | 31.29 | 2 2 1 |
| 2.054 | 44.072 | –0.0086 | 54.03 | 1 2 2 |
| 2.048 | 44.219 | –0.0096 | 56.93 | 1 1 3 |
| 2.012 | 44.967 | 0.0656 | 85.96 | 4 0 1 |
| 1.9573 | 46.362 | 0.0087 | 19.33 | 4 1 0 |
| 1.8916 | 48.081 | –0.0007 | 1.34 | 2 2 2 |
| 1.8665 | 48.760 | 0.0104 | 7.02 | 3 2 1 |
| 1.7757 | 51.433 | 0.0023 | 26.21 | 3 0 3 |
| 1.7328 | 52.793 | 0.0143 | 4.11 | 0 3 1 |
| 1.7218 | 53.179 | –0.0064 | 4.33 | 0 0 4 |
| 1.7092 | 53.611 | –0.0197 | 1.10 | 1 2 3 |
| 1.6979 | 53.992 | –0.0140 | 3.40 | 1 3 1 |
| 1.6865 | 54.372 | 0.0023 | 18.56 | 1 0 4 |
| 1.6478 | 55.768 | –0.0091 | 9.34 | 2 3 0 |
| 1.6346 | 56.289 | –0.0382 | 2.79 | 5 0 1 |
| 1.6102 | 57.121 | 0.0586 | 23.46 | 2 2 3 |
| 1.6035 | 57.390 | 0.0522 | 15.07 | 5 1 0 |
| 1.5943 | 57.851 | –0.0471 | 2.37 | 2 0 4 |
| 1.5618 | 59.078 | 0.0436 | 16.35 | 5 1 1 |
| 1.5507 | 59.612 | –0.0217 | 1.39 | 4 0 3 |
| 1.5275 | 60.595 | –0.0077 | 2.60 | 2 1 4 |
| 1.5108 | 61.322 | 0.0049 | 1.24 | 5 0 2 |
| 1.4814 | 62.685 | –0.0024 | 22.16 | 3 2 3 |
| 1.4546 | 63.976 | –0.0038 | 7.32 | 5 1 2 |
| 1.4495 | 64.230 | –0.0061 | 4.35 | 0 2 4 |
| 1.4280 | 65.294 | 0.0160 | 10.13 | 1 2 4 |
| 1.4149 | 65.984 | 0.0064 | 2.48 | 3 1 4 |
В табл. 2 приведены параметры элементарных ячеек образцов системы KLa(SO4)2–SrSO4 различного состава. На рис. 1 приведены зависимости параметров и объема элементарных ячеек от состава образцов.
Таблица 2.
Параметры и объем элементарных ячеек твердых растворов системы KLa(SO4)2–SrSO4
| КLa(SO4)2, мол. % | a, Å | b, Å | c, Å | V, Å3 |
|---|---|---|---|---|
| 67 | 8.4271(25) | 5.3932(15) | 6.8987(19) | 313.54(21) |
| 54 | 8.4243(12) | 5.3788(9) | 6.8919(10) | 312.29(11) |
| 43 | 8.4210(12) | 5.3791(8) | 6.8914(9) | 312.16((10) |
| 33 | 8.4096(16) | 5.3720(12) | 6.8867(12) | 311.11(13) |
| 25 | 8.3974(10) | 5.3697(6) | 6.8839(8) | 310.41(8) |
| 18 | 8.3926(7) | 5.3647(4) | 6.8814(6) | 309.83(6) |
| 11 | 8.3810(8) | 5.3604(4) | 6.8773(6) | 308.97(6) |
| 5 | 8.3735(8) | 5.3570(4) | 6.8768(6) | 308.48(6) |
| 0 | 8.3637(8) | 5.3530(4) | 6.8721(6) | 307.67(6) |
Рис. 1.
Зависимости параметров и объема элементарных ячеек твердых растворов КLa(SO4)2–SrSO4 от состава.
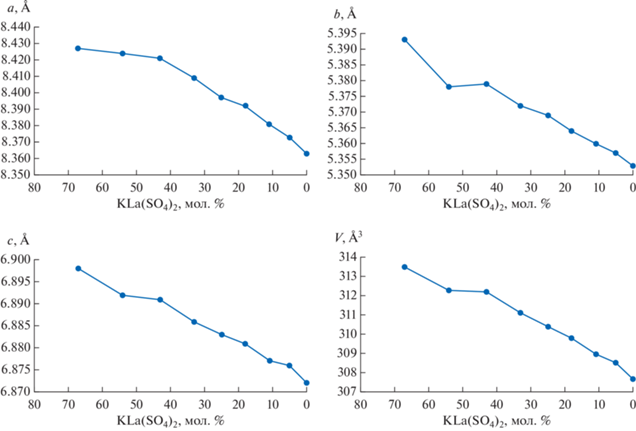
На рис. 1 прослеживается закономерный рост параметров и объема элементарных ячеек образцов с увеличением содержания иона K+ (имеющего больший размер (1.35 Å) по сравнению с ионом замещаемого Sr2+ (1.20 Å) [12]). Все образцы твердого раствора разлагаются при температуре 950–960°C, соответствующей разложению KLa(SO4)2, с выделением газообразного SO3 и образованием K5La(SO4)4 и La2O3.
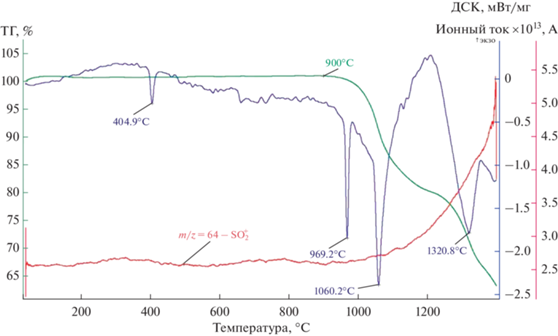
На рис. 2 приведены результаты термического анализа при нагревании двойного сульфата КLa(SO4)2. Эндотермический эффект при температуре 404°C соответствует либо возможному полиморфному превращению, либо потере остаточного количества кристаллогидратной воды структурой KLa(SO4)2⋅хH2O. Второй эндотермический эффект при температуре 950–960°С соответствует, как уже отмечалось, разложению KLa(SO4)2 и образованию K5La(SO4)4. Третий эндотермический эффект при температуре 1050–1060°С соответствует разложению K5La(SO4)4 с дальнейшим выделением оксидов SO3, La2O3 и сульфата К2SO4.
На кривых нагревания всех твердых растворов системы KLa(SO4)2–SrSO4 присутствуют три эндотермических эффекта. При температуре 950°С происходит разложение КLa(SO4)2. При температуре 1050°С наблюдается разложение K5La(SO4)4. При температуре 1230°С протекает полиморфное превращение ромбической модификации SrSO4 в высокотемпературную высокосимметричную гексагональную модификацию. Указанное полиморфное превращение инициирует разложение сульфата стронция, сопровождающееся дальнейшим выделением газообразного оксида серы.
На рис. 3 приведены результаты термического анализа образца состава 33.3 мол. % KLa(SO4)2 + + 66.6 мол. % SrSO4. Разложение твердого раствора начинается при температуре 950°С и сопровождается образованием K5La(SO4)4 по схеме
Рис. 3.
Результаты термического анализа твердого раствора состава 33.3 мол. % KLa(SO4)2 + 66.6 мол. % SrSO4.
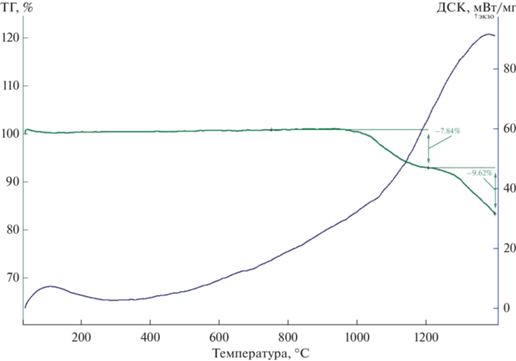
Отмеченная потеря массы 7.84% на кривой нагревания практически совпадает с расчетным количеством выделившегося оксида серы.
Исследуемая система KLa(SO4)2–SrSO4 может рассматриваться как бинарная только ниже 950°С (температуры разложения KLa(SO4)2). В указанной бинарной системе KLa(SO4)2–SrSO4 в отличие от ранее исследованной системы KLa(SO4)2–СаSO4 [13] существует широкая область твердых растворов. Отделение сульфатных соединений РЗЭ от сульфата стронция может быть реализовано не только в результате различия их растворимости, но и в результате гетерогенной конверсии растворимых сульфатных соединений РЗЭ в оксалаты с последующей их кристаллизацией из азотнокислых растворов [14–16].
ЗАКЛЮЧЕНИЕ
По итогам работы можно сделать вывод о высокой абсорбционной способности ромбической модификации β-SrSO4 (пр. гр. Pnma) к ионам La3+ в присутствии ионов калия вследствие гетеровалентного замещения по схеме 2Sr2+ → K+ + La3+. Десорбция РЗЭ из структуры сульфата стронция затруднена из-за образования твердых растворов замещения.
Извлечение РЗЭ из твердых растворов системы КLa(SO4)2–SrSO4 возможно только при температуре их разложения 950°С с последующим отделением хорошо растворимых сульфатов калия и лантана, а также частично образовавшейся высокодисперсной фазы La2O3 в слабокислых растворах.
Полученные результаты могут быть полезными при разработке процессов выделения соединений La с использованием ромбического β-SrSO4, имеющего меньшую растворимость по сравнению с сульфатом кальция.
Список литературы
Satoshi Takahashi, Masanobu Seki, Katsumi Setoyama. Formation of SrSO4·0.5H2O in an SrSO4–H2O System and Its Solid Solution in a CaSO4–SrSO4–H2O // Bull. Chem. Soc. Jpn. 1993. V. 66. P. 2219–2224. https://doi.org/10.1246/bcsj.66.2219
Бушуев Н.Н., Тюльбенджян Г.С., Великодный Ю.А., Егорова А.Н., Шаталова Т.Б. Исследование системы KLa(SO4)2·H2O–SrSO4·0.5H2O // Журн. неорган. химии. 2021. Т. 66. № 3. С. 382–388. https://doi.org/10.31857/S0044457X21030041
Бушуев Н.Н., Плотко И.И., Шаталова Т.Б. Исследование системы KLa(SO4)2⋅H2O–SrSO4⋅O.5H2O в температурном интервале 100–500°С // Хим. промышленность сегодня. 2021. № 3. С. 56–59.
Inorganic Structure Database Crystal – ICSD (date 85810 structure SrSO4).
Antao S.M. The Crystal Structure of Sulfate SnSO4 and Comparison with Isostructural SrSO4, PbSO4 and BaSO4 // Powder Diffraction. 2012. V. 27. № 3. P. 179–183. https://doi.org/10.1017/S0885715612000450
Antao S.M. The Structural Trends for Celestite (SrSO4), Anglesite (PbSO4) and Barite (BaSO4) Conformation of Expected Varuitions within the SO4 Groups // Am. Mineral. 2012. V. 97. № 4. P. 661–665. https://doi.org/10.2138/am.2012.3905
James R.W., Wood W.A. The Structures of Barytes, Celestine and Anglesite // Proc. R. Soc. London, A. 1925. V. 109. P. 598–620.
Miyke M., Minato J., Morikaw M., Hvai S. Crystal Structures and Sulpate Force Constants of Barite, Celestite and Anglesite // Am. Mineral. 1978. V. 63. № 5–6. P. 506–510.
Wen-Show Wang, Liang Zhen, Cheng-Yan Xu, Wen-Zhu Shao. Synthesis and Formation Process of SrSO4 Sisul-Like Hierarehical Structures at Room Temperature // CrystEngComm. 2011. V. 13. № 2. P. 620–625. https://doi.org/10.1039/C0CE00062K
Xuaqian Kuang, Jingui Xu, Doneyu Zhao, Dawei Fan, Xiaodony Li, Wenge Zhow, Hongsen Xie. The High-Pressure Elastic Properties of Celestine and the High-Pressure Behavier of Barit-Type Sulphates // High Temp.–High Pressures. 2017. V. 46. P. 481–495.
Jiayuc Sun., Buangchao San, Bing Xuc, Dianping Cui. Sinthesis and Formation Process of SrSO4: Sm3+-Phospers with Herarchical Structures and Its Electron Trapping Luminescence Properties // J. Alloys Compd. 2017. V. 574. № 10. P. 560–564.
Shannon R.D., Prewitt C.T. Effective Ionic Radii in Oxides and Fluorides // Acta Crystallogr., Sect. B. 1969. V. 25. P. 925–946. https://doi.org/10.1107/S0567740869003220
Бушуев Н.Н., Егорова А.Н., Тюльбенджян Г.С. Система KLa(SO4)2–CaSO4 // Неорган. материалы. 2021. Т. 57. № 2. С. 150–153. https://doi.org/10.1134/S0020168521020047
Бушуев Н.Н., Зинин Д.С. Особенности термического разложения оксалатов кальция и РЗЭ // Журн. неорган. химии. 2016. Т. 61. № 2. С. 173–179. https://doi.org/10.7868/S0044457X16020033
Бушуев Н.Н., Зинин Д.С. Гетерогенная конверсия сульфатного концентрата РЗЭ в оксалатную форму // Хим. промышленность сегодня. 2015. № 4. С. 6–15.
Зинин Д.С., Бушуев Н.Н. Раздельная кристаллизация оксалатов лантаноидов и кальция из азотнокислых растворов // Журн. неорган. химии. 2018. Т. 63. № 9. С. 1189–1194. https://doi.org/10.1134/S0044457X18090222
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы