Неорганические материалы, 2022, T. 58, № 11, стр. 1208-1218
Влияние термообработки расплава 6Bi2O3⋅SiO2 на фазовый состав и микроструктуру продуктов его кристаллизации
Т. В. Бермешев 1, *, В. П. Жереб 1, М. П. Бундин 1, А. С. Ясинский 1, 2, О. В. Юшкова 1, Д. С. Ворошилов 1, А. С. Самойло 1, Е. В. Мазурова 3, А. Н. Залога 1, О. В. Якивьюк 1, П. О. Юрьев 1
1 Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
2 IME, Institute for Process Metallurgy and Metal Recycling,
RWTH Aachen University
52056 Aachen, Intzestraße, 3, Germany
3 Институт химии и химической технологии СО Российской
академии наук
660036 Красноярск, Академгородок, 50, стр. 24, Россия
* E-mail: irbis_btv@mail.ru
Поступила в редакцию 23.03.2022
После доработки 05.08.2022
Принята к публикации 06.08.2022
- EDN: DBZAFV
- DOI: 10.31857/S0002337X22110021
Аннотация
Исследовано влияние режимов термической обработки (изотермической выдержки в температурной зоне С, температур начала охлаждения и скорости охлаждения) расплава, содержащего 85.7 мол. % Bi2O3 и 14.3 мол. % SiO2 (6 : 1) на фазовый состав и микроструктуру образующихся кристаллов. Определены условия кристаллизации метастабильного твердого раствора на основе δ-модификации Bi2O3 (δ*) при высоких скоростях охлаждения расплава. Показано, что при низких скоростях охлаждения расплава кристаллизуются δ* и твердый раствор на основе α-Bi2O3 с дальнейшим частичным или полным эвтектоидным распадом дендритных кристаллов δ*-фазы на смесь метастабильных фаз, содержащих также β*-Bi2O3 и η-Bi2SiO5. Повышение скорости охлаждения расплава ограничивает как образование вторичных фаз, так и эвтектоидный распад. Полученные результаты позволяют управлять процессами образования поликристаллических Bi12SiO20 и δ-Bi2O3 при кристаллизации расплава 6Bi2O3·SiO2.
ВВЕДЕНИЕ
В системе Bi2O3–SiO2 в области, богатой оксидом висмута, в состоянии стабильного равновесия образуется силикат висмута Bi12SiO20 с кристаллической структурой силленита, обладающий пьезоэлектрическими, фоторефрактивными, фотопроводящими, магнитооптическими и электрооптическими свойствами, что выдвинуло его в ряд наиболее перспективных материалов для создания устройств оптической обработки информации [1–3]. Bi12SiO20 является также перспективным материалом для создания пьезодатчиков, фильтров и линий задержки электромагнитных сигналов, электро- и магнитооптических измерителей напряженности полей, пространственно-временных модуляторов [4, 5], миниатюрных и пассивных микроволновых керамических компонентов с высокой производительностью для мобильных устройств [6], волоконно-оптических датчиков электрического тока [7], защитных систем электроники от космического излучения [8] и др.
В состоянии метастабильного равновесия в системе Bi2O3–SiO2 имеется широкая область твердых растворов (δ*) со структурой высокотемпературной δ-модификации Bi2O3, на основе которых получены уникальные суперионные проводники, фотокатализаторы, адсорбенты для нейтрализации изотопов радиоактивного йода [9] и удаления токсичных соединений селена из водных растворов [10].
Несмотря на возможности применения соединения Bi12SiO20 в поликристаллическом виде (например, при изготовлении керамики, фотокатализаторов и т.д.) до сих пор в большинстве случаев его применяют в виде монокристаллов. Однако возможность кристаллизации расплавов силиката висмута с образованием метастабильных фаз существенно ограничивает применение расплавных технологий для синтеза стабильного соединения с кристаллической структурой силленита для получения оптически совершенных монокристаллов [11]. Именно поэтому производителям монокристаллов удобнее использовать для выращивания уже готовый, заранее синтезированный, силикат висмута, который (в отличие от простой смеси исходных компонентов) не требуется перегревать, подвергая расплав риску перехода в метастабильное состояние [12, 13].
С другой стороны, получение метастабильной δ*-фазы с соотношением Bi2O3 : SiO2, равным 6 : 1, также осложняется возможностью частичного или полного перехода в стабильное состояние при охлаждении.
Большинство известных к настоящему времени способов синтеза как поликристаллического Bi12SiO20, так и δ-Bi2O3, которые могли бы быть использованы для получения исходной шихты для выращивания монокристаллов (химический [14, 15], гидротермальный [16, 17], твердофазный [18], механическое легирование [19], метод расплавленных солей [20], метод осаждения [21], сольвотермальный [22], пиролиз [23], распыление [24] и др.), несмотря на все свои достоинства, не могут конкурировать с расплавными технологиями. Однако, получение стабильных и метастабильных силикатов висмута из расплава ограничивается недостаточной изученностью взаимосвязи состояния расплава с характером фазообразования при его кристаллизации.
В работах [25, 26] показано, что на фазовой диаграмме стабильного равновесия системы Bi2O3–SiО2 в области жидкого состояния можно выделить три интервала температур, соответствующих трем зонам расплава – А, В и С (рис. 1 а), в которых состояние расплава отличается не только характером температурных зависимостей свойств, но и фазовым составом кристаллов, образующихся при кристаллизации медленно охлаждаемых (5–10°С/мин) расплавов от температур, относящихся к разным температурным зонам.
Рис. 1.
Границы температурных зон (1), построенные по результатам нагревания в области расплава на фазовой диаграмме стабильного равновесия (2) системы Bi2O3–SiO2 [25, 26] (а); фазовая диаграмма метастабильного равновесия системы Bi2O3–SiO2, построенная по результатам охлаждения расплава от температур, лежащих в зоне В [26, 27] (б).
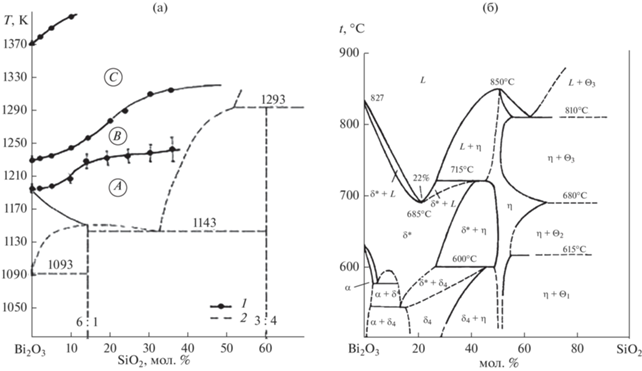
Метастабильные же равновесия могут характеризоваться несколькими фазовыми диаграммами разного вида. На рис. 1 б представлена диаграмма метастабильного равновесия системы Bi2O3–SiO2, построенная по результатам охлаждения расплава от температур зоны В.
Поэтому исследование взаимосвязи условий охлаждения расплава в системе Bi2O3–SiO2 с состоянием продуктов его кристаллизации представляет интерес для получения стабильных и метастабильных материалов на основе силикатов висмута.
Цель настоящей работы состояла в исследовании влияния режимов термообработки расплава (изотермической выдержки в температурной зоне С, температуры начала охлаждения и скорости охлаждения), содержащего 85.7 мол. % Bi2O3 и 14.3 мол. % SiО2, на фазовый состав, макро- и микроструктуру образующихся продуктов кристаллизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные образцы массой 10 г, полученные смешением в отношении 6 : 1 оксида висмута (III) в α-модификации квалификации “ос. ч.” и оксида кремния (IV) в аморфном состоянии квалификации “ч.д.а.”, помещали в платиновый тигель и нагревали в электрической печи сопротивления LMV 02/12 на воздухе до температуры, лежащей в зоне С, со скоростью ~20°С/мин, затем выдерживали в изотермических условиях 1 ч.
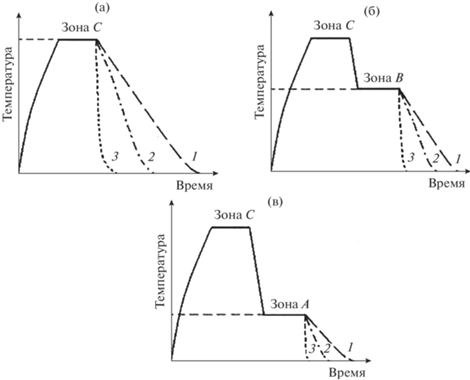
Режимы последующей термообработки расплава представлены на рис. 2 . В условиях, показанных на рис. 2 а, расплав охлаждали тремя различными способами: быстрое перемещение тигля с расплавом из печи и погружение тигля в воду без контакта воды с расплавом – закалка в воду; охлаждение извлеченного из печи тигля с расплавом на воздухе и медленное охлаждение с печью. Для других режимов, после изотермической (температура зоны С) выдержки, расплав охлаждали до более низкой температуры – зоны В и А, выдерживали определенное время, а затем также охлаждали тремя вышеописанными способами (рис. 2 б и 2в). Подобная термообработка расплава была использована в [28].
Рис. 2.
Схема режимов термообработки расплава при различных температурах начала охлаждения (tнач.охл), относящихся к различным температурным зонам (рис. 1 ): верхняя часть зоны С (а), зона В (б) и зона А (в): 1 – охлаждение с печью, 2 – охлаждение на воздухе, 3 – охлаждение тигля в воде (закалка в воду).
Макроструктуру поверхности образцов наблюдали с помощью стереоскопа Stemi 2000 (Carl Zeiss). Микроструктуру изучали с использованием оптического микроскопа Carl Zeiss Axio Observer A1m на микрошлифах, полученных после шлифовки, полировки и травления. Растровую электронную микроскопию (РЭМ) и локальный рентгеноспектральный анализ (ЛРСА) проводили на HITACHI TM-3000, рентгенофазовый анализ (РФА) порошка – на дифрактометре Shimadzu XRD 6000 (CuKα-излучение). Исследований по количественному содержанию платины в образцах не проводили.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Закалка в воду и охлаждение на воздухе. На рентгенограммах образцов, полученных закалкой тигля с расплавом в воду, обнаружено присутствие твердого раствора со структурой δ-Bi2O3 (рис. 3 а, табл. 1) без примеси других фаз, вид рентгенограмм не зависел от температуры начала охлаждения. В некоторых случаях (закалка в воду, зона В) на дифрактограмме наблюдаются искажения, характерные для δ*-фазы (Bi5.6Si0.5O9.4, номер карточки PDF 0-42-0182) (рис. 3 б).
Рис. 3.
Дифрактограмма образцов, полученных кристаллизацией расплавов, охлажденных от tнач.охл, относящихся к температурным зонам С и А при закалке тигля в воду и С, В, А при охлаждении на воздухе на примере образца, закаленного в воду из зоны С (а); сравнение дифрактограмм из зоны С (черный цвет) и зоны B (серый цвет) при закалке тигля в воду (пики настолько близки, что почти сливаются) (б).
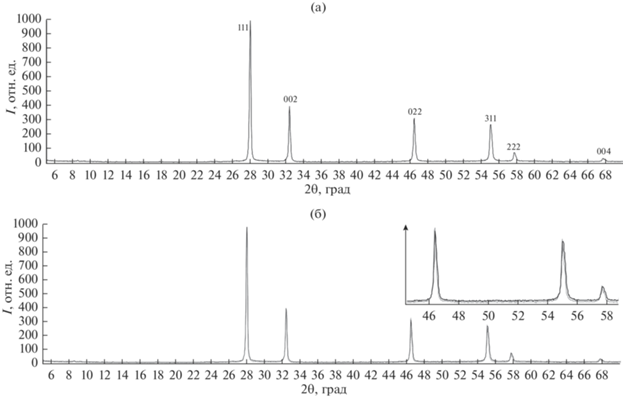
Таблица 1.
Условия термообработки расплава 85.7 мол. % Bi2O3 + 14.3 мол. % SiO2 и фазовый состав образующихся кристаллов
| Температура начала охлаждения, °С | Температурная зона | Режим охлаждения | Фазовый состав кристаллов |
|---|---|---|---|
| 1100 | С | Закалка в воду | δ-Bi2O3 |
| На воздухе | δ-Bi2O3 | ||
| С печью | α-Bi2O3, δ-Bi2O3, δ*-Bi2O3 (Bi5.6Si0.5O9.4), Bi2SiO5 (η) |
||
| 960 | В | Закалка в воду | δ*-Bi2O3 |
| На воздухе | δ-Bi2O3 | ||
| С печью | α-Bi2O3, β*-Bi2O3 (Bi54SiO83) |
||
| 910 | А | Закалка в воду | δ-Bi2O3 |
| На воздухе | δ-Bi2O3 | ||
| С печью | α-Bi2O3, β*-Bi2O3 (Bi54SiO83), Bi2SiO5 (η) |
||
| 1100 | С | Литье | Bi12SiO20 [34] |
Макроструктура образца, состоящего из δ*-фазы, полученного охлаждением с высокой скоростью при закалке тигля с расплавом в воду, грубая с ярко выраженным отличием периферийной и центральной частей. Образец у стенок тигля имеет более мелкую текстуру, при этом в нем хорошо заметны “концентрические кольца”, по-видимому, связанные с “усадкой” – изменением объема вещества при переходе из жидкого состояния в твердое, когда расплав, оттекая от стенок тигля и одновременно кристаллизуясь, образует волны. Образец в центральной части имеет более грубую текстуру, в которой наблюдаются обширные сферообразные области.
При понижении скорости охлаждения (охлаждение расплава на воздухе) макроструктура образцов имеет такой же вид, как и при закалке в воду. Зона “концентрических колец”, образующаяся при кристаллизации у стенок тигля, имеет небольшую ширину. Расплав, закристаллизовавшийся в центральной части тигля, состоит из крупных, хорошо различимых на общем фоне кристаллов.
Микроструктура образцов, закристаллизованных закалкой расплава в тигле в воду, имеет ярко выраженное дендритное строение (рис. 4). При этом размер дендритов, образовавшихся у стенок тигля (рис. 4а), значительно меньше, чем у дендритов центральной части (рис. 4б), что связано с их более высокой скоростью охлаждения. При этом и в центральных, и в периферийных участках материала области с мелкими дендритами соседствуют с областями с дендритами довольно крупных размеров. При уменьшении температуры начала охлаждения (зоны В и А), а следовательно, уменьшении градиентов температуры при кристаллизации, формируются более крупные дендриты.
Рис. 4.
Микроструктура образцов, полученных закалкой расплава в тигле в воду из зоны С: а – расплав, закристаллизовавшийся ближе к стенкам тигля, б – ближе к центру тигля.

Образцы, полученные охлаждением расплава на воздухе из зоны С (рис. 5), также имеют дендритное строение, при этом, как и в закаленных в воде образцах, наблюдается отличие размеров дендритов в периферийных (у стенок тигля) и центральных (ближе к центру тигля) областях. Дендриты на периферийных участках (рис. 5а) вытянуты в длину, в направлении теплоотвода. Дендриты же центральной части, наоборот, массивны и имеют правильную, хорошо развитую форму, с большой протяженностью осей второго порядка (рис. 5г).
Рис. 5.
Микроструктура образца, полученного охлаждением расплава на воздухе в тигле из зоны С: а – участок, закристаллизовавшийся ближе к стенкам тигля, б – переходная зона; в – граница переходной зоны, г – центральная часть тигля.

В этом образце также наблюдается и некоторая переходная зона (рис. 5б), состоящая из наиболее мелких дендритов и отделяющая периферийные участки от центральных, она может как отсутствовать полностью, так и занимать довольно значительные объемы. На рис. 5в показана граница между переходной зоной и центральной частью образца. При охлаждении расплава от температур зон В и А на воздухе наблюдается схожая микроструктура.
Наблюдение переходной области при небольшом увеличении на примере образца, охлажденного от температуры зоны А (рис. 6), обнаруживает существенное различие в размерах дендритов центральной и переходной областей. При кристаллизации дендриты, образовавшиеся из расплава первыми, во время роста практически не имели ограничений и могли расти до значительных размеров с образованием правильной формы. Оставшееся свободное пространство заполнялось другими дендритами – кристаллизующимися позже и уже значительно отличающимися по химическому составу от первичных кристаллов. Указанные факторы обуславливают в однофазном образце значительную концентрационную неоднородность.
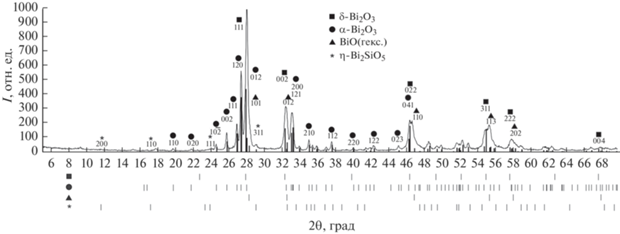
Охлаждение с печью. Нелинейное охлаждение расплава с печью из всех температурных зон (С, В и А) сопровождается большим фазовым разнообразием. В таких образцах обнаружено присутствие твердого раствора на основе α-Bi2O3 (согласно метастабильным диаграммам состояния), а также δ*-твердых растворов, β*-Bi2O3 и метастабильной фазы η-Bi2SiO5 (табл. 1). На рис. 7 представлена дифрактограмма образца, полученного охлаждением с печью из зоны С, демонстрирующая наибольшее фазовое разнообразие.
Рис. 7.
Дифрактограмма образца, полученного медленным охлаждением расплава с печью из температурной зоны С.
Макроструктура образцов, полученных охлаждением расплава с печью от температур, относящихся к разным температурным зонам, сформирована хорошо различимыми крупными кристаллами, имеющими дендритную форму. Все образцы имеют одинаковый желтоватый оттенок. В них полностью отсутствуют “концентрические кольца”, образующиеся в образцах, полученных при высоких скоростях охлаждения.
Микроструктура таких образцов имеет схожую с дендритной структуру и двухфазное строение. Сами дендриты очень неоднородны и образованы чередованием темных и светлых участков (рис. 8). Междендритное пространство содержит светлые однородные зерна, имеющие близкую к равноосной форму.
Рис. 8.
Микроструктура образцов, полученных охлаждением расплава с печью из температурных зон: С (а, г), В (б, д) и А (в, е).

Результаты РЭМ и ЛРСА показывают, что средняя концентрация кремния в дендритах меньше, чем в междендритном пространстве (рис. 9). Это различие невелико и на некоторых участках не превышает стандартного отклонения (табл. 2).
Рис. 9.
РЭМ-изображение образца, полученного при охлаждении расплава с печью от температуры зоны C (а); карты распределения Bi и Si (б).
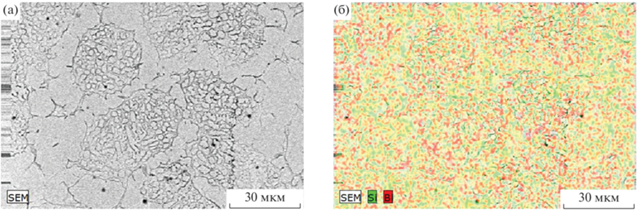
Таблица 2.
Химический состав дендритов (темные участки) и междендритного пространства (светлые участки) в образцах, охлажденных с печью от различных температур, по результатам РЭМ
| Элемент | Средняя концентрация элемента в образце, ат. % | |||||
|---|---|---|---|---|---|---|
| 1100°С | 960°С | 910°С | ||||
| дендриты | междендритное пространство | дендриты | междендритное пространство | дендриты | междендритное пространство | |
| Bi | 43.3 ± 1.2 | 43.1 ± 1.7 | 44.4 ± 1.6 | 43.7 ± 1.6 | 43.0 ± 1.5 | 41.9 ± 1.5 |
| Si | 3.2 ± 0.6 | 4.9 ± 1 | 4.2 ± 0.7 | 5.1 ± 0.5 | 3.9 ± 0.8 | 6.0 ± 1.7 |
| O | 53.6 ± 1.4 | 52.0 ± 1.0 | 51.4 ± 1.7 | 51.3 ± 1.7 | 53.1 ± 1.6 | 52.1 ± 2.3 |
Содержание висмута и кислорода как внутри самих структурных составляющих (дендриты и междендритное пространство), так и при сравнении структурных составляющих между собой мало изменяется.
Таким образом, при медленном охлаждении (с печью) из образовавшейся из расплава δ*-фазы сначала выделяется твердый раствор на основе α-Bi2O3 (светлые области междендритного пространства, рис. 8), а затем, когда температура опускается ниже линии эвтектоидного превращения (785°С, рис. 1 б), дендриты δ*-фазы претерпевают эвтектоидный распад, во время которого возможны различные варианты сложного метастабильного фазообразования (табл. 1). При ускоренном охлаждении (закалка тигля с расплавом в воду, охлаждение на воздухе), по-видимому, из-за диффузионных затруднений образования вторичных фаз и эвтектоидного распада не происходит и наблюдается только δ*-фаза.
Термическую обработку расплава следует рассматривать как основной фактор управления метастабильным фазообразованием при кристаллизации расплава, содержащего 85.7 мол. % Bi2O3 и 14.3 мол. % SiO2. Перегрев расплава до температур, значительно превышающих температуру стабильного ликвидуса (900°С), как было показано в [25, 26, 28], приводит к полимеризации [SiO4]-тетраэдров c образованием преимущественно Si2O7-димеров.
Сохранение подобной структуры ближнего порядка в расплаве при относительно низких скоростях его охлаждения затрудняет кристаллизацию стабильного стехиометрического соединения Bi12SiO20 и обеспечивает переохлаждение расплава на ~140–150°С, что в свою очередь сопровождается кристаллизацией метастабильных фаз в соответствии с правилом ступеней Оствальда.
Существенным фактором, способствующим метастабильному фазообразованию в системе Bi2O3–SiO2, является взаимодействие расплава с поверхностью платинового контейнера. В работе [29] показано, что определяющую роль в процессе взаимодействия Pt с оксидным висмутсодержащим расплавом играет окисление платины, которое может осуществляться как растворенным в расплаве кислородом, так и собственными кислородсодержащими ионами расплава. Изучение фазового состава пленок, образующихся на платине в процессе ее взаимодействия с расплавом, показало, что с увеличением температуры изменяется фазовый состав оксидной пленки на платине. При температуре выше 1200°С основную долю в пленке составляет PtO, что связано с термической нестабильностью высших оксидов платины. Кроме того, в составе такой пленки обнаружен продукт ее взаимодействия с расплавом – соединение Bi2PtO4. Это соединение изоструктурно Bi2CuO4 [30, 31] и содержит перовскитоподобные элементы структуры, способные обеспечить зарождение и стабилизацию фаз со структурой Ауривиллиуса. Таким образом, кристаллическая структура и состояние поверхности продуктов взаимодействия платинового контейнера и расплава могут существенно влиять на процесс зародышеобразования при кристаллизации переохлажденного метастабильного расплава, формируя “затравочные кристаллы” для метастабильной фазы. Такое влияние – очевидный аналог принципа ориентационно-размерного соответствия Данкова–Конобеевского для твердофазных превращений [32, 33].
В нашей предыдущей работе [28] для соотношения 1 : 1 в системе Bi2O3–SiO2 также было показано, что даже при высоких скоростях охлаждения (закалка в воду), когда весь расплав затвердевает с образованием стекла, в тех местах, где он контактировал с дном и стенками платинового тигля, все равно будет образовываться тончайший слой метастабильных поликристаллов.
Кристаллизация стабильной фазы Bi12SiO20 со структурой силленита, которая происходит при выливании расплава на платиновую пластину [34] и сопровождается большим экзотермическим эффектом, т.н. “самораскаливанием”, является следствием иной последовательности превращений. В этом случае высокая скорость охлаждения расплава и, следовательно, высокое переохлаждение не связаны с влиянием фактора ориентационно-размерного соответствия (выливание расплава происходит на чистую платиновую пластину), а массовое зародышеобразование даже в условиях большого переохлаждения сопровождается большим экзотермическим эффектом. В условиях низкой теплопроводности оксидных фаз это вызывает множество локальных перегревов в кристаллизующемся образце, температура которых превышает температуру распада метастабильных состояний, что приведет к их распаду и еще большему перегреву, т.к. процесс распада также будет сопровождаться экзотермическим эффектом. “Самораскаливание” образца вызывает лавинообразное повышение температуры, сопровождающееся переходом в стабильное состояние с формированием Bi12SiO20.
ЗАКЛЮЧЕНИЕ
Показано, что главными факторами в реализации метастабильного фазообразования в образце состава Bi2O3 : SiO2 = 85.7 : 14.3 (мол. %) являются термическая обработка расплава, обеспечивающая метастабильное равновесие (термодинамический фактор) и его взаимодействие с оксидами платины на стенках и дне тигля (кинетический фактор). Продукты взаимодействия расплава с оксидами платины являются “затравками” при кристаллизации метастабильных фаз из метастабильного расплава. Переохлаждению расплава и формированию его метастабильного состояния способствует изменение его структуры при полимеризации [Si${\text{O}}_{4}^{ - }$]-тетраэдров. Взаимодействие такого расплава с высокотемпературной фазой Bi2PtO4 может также способствовать кристаллизации δ(δ*)-Bi2O3.
Показано, что при охлаждении расплава с высокими скоростями (закалка в воду или охлаждение на воздухе) после термической обработки (изотермическая выдержка при температурах, относящихся к зоне С), образуется δ*-твердый раствор со структурой высокотемпературного δ-Bi2O3.
Установлено, что медленное охлаждение расплава с печью сопровождается образованием вторичной фазы α-Bi2O3 с дальнейшим частичным или полным эвтектоидным распадом дендритных кристаллов δ*-Bi2O3 на сложную смесь метастабильных фаз (возможно образование β*-Bi2O3, η-Bi2SiO5). Отсутствие фазы η-Bi2SiO5 в продуктах кристаллизации может говорить о том, что она будет образовываться в эвтектоиде. Ускоренное охлаждение расплава будет подавлять как образование вторичных фаз, так и эвтектоидный распад.
Список литературы
Vohl P., Nisenson P., Oliver D.S. Real-Time Incoherent-to-Coherent Optical Converter // IEEE Trans. Electron Devices. 1973. V. 20. № 11. P. 1032–1037. doi: 10.1109/T-ED.1973.17786
White J.O., Yariv A. Real-Time Image Processing Via Four-Wave Mixing in a Photorefractive Medium // Appl. Phys. Lett. 1980. V. 37. № 1. P. 5–7.
Burattini E., Capuccio G., Ferrari M.C., Grandolfo M., Vecchia P., Efendiev Sh.M. Medium Infrared Transmittance and Reflectance Spectra of Bi12GeO20, Bi12SiO20, and Bi12TiO20 Single Crystals // J. Opt. Soc. Am. B: Opt. Phys. 1988. V.5. № 3. P. 714–720. https://doi.org/10.1364/JOSAB.5.000714
Шлегель В.Н., Панцуркин Д.С. Выращивание кристаллов низкоградиентным методом Чохральского Bi12GeO20 и Bi12SiO20 // Кристаллография. 2011. Т. 56. № 2. С. 367–372.
Mori M., Yagai Y., Yatagai T., Watanabe M. Optical Learning Neural Network with a Pockels Readout Optical Modulator // Appl. Opt. 1998. V. 37. № 14. P. 2852–2857. https://doi.org/10.1364/AO.37.002852
Jeong B.-J., Joung M.-R., Kweon S.-H., Kim J.-S., Nahma S., Choi J.-W., Hwang S.-J. Microstructure and Microwave Dielectric Properties of Bi12SiO20 Ceramics // Mater. Res. Bull. 2012. № 47. P. 4510–4513.
Демин А.Н., Смыслов В.И., Клементьев А.Т. Метрологический анализ волоконно-оптических датчиков электрического тока на основе кристаллов с кубической симметрией Bi12SiO20 и Bi12GeO20 // Измерение. Мониторинг. Управление. Контроль. 2016. № 2 (16). С. 28–34.
Павленко А.В., Черкашина Н.И., Ястребинский Р.Н., Носков А.В. Расчет коэффициентов пропускания быстрых электронов при прохождении через полимерный полиимидный композиционный материал, наполненный силикатом висмута // ВАНТ. 2017. № 5 (111). С. 21–26.
Xiong Y., Dang B., Wang C., Wang H., Zhang S., Sun Q., Xu X. Cellulose Fibers Constructed Convenient Recyclable 3D Graphene-Formicary-like δ-Bi2O3 Aerogels for the Selective Capture of Iodide // ACS Appl. Mater. 2017. V. 9. № 24. P. 20554–20560. https://doi.org/10.1021/acsami.7b03516
Liu L., Chen N., Lei Y., Xue X., Li L., Wang J., Komarneni S., Zhu H., Yang D. Micro-Nanostructured δ-Bi2O3 with Surface Oxygen Vacancies as Superior Adsorbents for ${\text{SeO}}_{x}^{{2 - }}$ Ions // J. Hazard. Mater. 2018. V. 360. P. 279–287. https://doi.org/10.1016/j.jhazmat.2018.08.02510.1016/j.jhazmat.2018.08.025
Жереб В.П., Скорикови В.М. Влияние метастабильных фаз на совершенство монокристаллов стабильных соединений с оксидом висмута // Неорган. материалы. 2003. Т. 39. № 11. С. 1365–1372.
Новоселов И.И., Макаров И.В., Федотов В.А., Иванникова Н.В., Шубин Ю.В. Синтез оксидной висмут-германиевой шихты для выращивания монокристаллов Bi4Ge3O12 // Неорган. материалы. 2013. Т. 49. № 4. С. 429–433. https://doi.org/10.7868/S0002337X13030135
Панцуркин Д.С. Изучение закономерностей формообразования и качества кристаллов германатов и силикатов висмута, выращенных низкоградиентным методом Чохральского: Автореф. дис. ... канд. хим. наук. Новосибирск: Институт неорганической химии им. А.В. Николаева СО РАН, 2011.
Zhang H., Feng Y., Jia S., Jiang D., Zhan Q. Enhancing the Photocatalytic Performance of Bi12SiO20 by in situ Grown Bi2O2CO3 and Bi Through Two-Step Light Irradiation Method // Appl. Surf. Sci. 2020. № 520. 146355. doi.org/10.1016/j.apsusc.2020.146355
Zhang J., Han Q., Wang X., Zhu J., Duan G. Synthesis of δ-Bi2O3 Microflowers and Nanosheets Using CH3COO(BiO) Self-Sacrifice Precursor // Mater. Lett. 2016. № 162. P. 218–221. https://doi.org/10.1016/j.matlet.2015.10.024
Водянкин А.А., Ушаков И.П., Белик Ю.А., Водянкина О.В. Синтез и фотокаталитические свойства материалов на основе силикатов висмута // Кинетика и катализ. 2017. Т. 58. № 5. С. 606–613. https://doi.org/10.7868/S0453881117050264
Yin Y., Li F., Zhan Q., Jiang D., Chen R. Synthesis of δ-Bi2O3/Bi2MoO6 Composites with Enhanced Photocatalytic Activity by Hydrothermal Method // Mater. Res. Bull. 2018. V. 103. P. 47–54. https://doi.org/10.1016/j.materresbull.2018.03.021
Jeong B.-J., Joung M.-R., Kweon S.-H., Kim J.-S., Nahm S., Choi J.-W., Hwang S.-J. Microstructures and Microwave Dielectric Properties of Bi2O3-Deficient Bi12SiO20 Ceramics // J. Am. Ceram. Soc. 2013. V. 96. № 7. P. 2225–2229. https://doi.org/10.1111/jace.12323
Vasconcelos I.F., Pimenta M.A., Sombra A.S.B. Optical Properties of Bi12SiO20 (BSO) and Bi12TiO20 (BTO) Obtained by Mechanical Alloying // J. Mater. Sci. 2001. № 36. P. 587–592.
Lu J., Wang X., Jiang H. Synthesis of Pure Bi12SiO20 Powder by Molten Salt Method // Appl. Mech. Mater. 2012. V. 182–183. P. 52–56.
Xu J., Liu J. Facet-Selective Epitaxial Growth of δ‑Bi2O3 on ZnO Nanowires // Chem. Mater. 2016. № 28. P. 8141−8148. https://doi.org/10.1021/acs.chemmater.6b01739
Zhu S., Lu L., Zhao Z., Wang T., Liu X., Zhang H., Dong F., Zhang Y. Mesoporous Ni-Doped δ-Bi2O3 Microspheres for Enhanced Solar-Driven Photocatalysis: A Combined Experimental and Theoretical Tnvestigation // J. Phys. Chem. C. 2017. V. 121. № 17. P. 9394–9401. https://doi.org/10.1021/acs.jpcc.7b01608
Wang X., Jayathilake R., Taylor D.D., Rodriguez E.E., Zachariah M.R. Study of C/Doped δ-Bi2O3 Redox Reactions by In-Operando Synchrotron X-ray Diffraction: Bond Energy/Oxygen Vacancy and Reaction Kinetics Relationships // J. Phys. Chem. C. 2018. V. 122. № 16. P. 8796–8803. https://doi.org/10.1021/acs.jpcc.8b01402
Fan H.T., Pan S.S., Teng X.M., Ye C., Li G.H., Zhang L.D. δ-Bi2O3 Thin Films Prepared by Reactive Sputtering: Fabrication and Characterization // Thin Solid Films. 2006. № 513. P. 142–147. https://doi.org/10.1016/j.tsf.2006.01.074
Каргин Ю.Ф., Жереб В.П., Скориков В.М. Стабильное и метастабильное фазовые равновесия в системе Bi2O3–SiO2 // Журн. неорган. химии. 1991. Т. 36. № 10. С. 2611–2616.
Жереб В.П. Метастабильные состояния в оксидных висмутсодержащих системах. М.: МАКС Пресс, 2003. С. 162.
Жереб В.П. Физико-химические исследования метастабильных равновесий в системах Bi2O3–ЭO2, где Э–Si, Ge, Ti: Автореф. дис… канд. хим. наук. М.: ИОНХ АН СССР, 1980. 22 с.
Бермешев Т.В., Жереб В.П., Тас-Оол Р.Н., Мазурова Е.В., Метелица С.И. Расслаивание в системе Bi2O3—SiO2. Влияние условий охлаждения расплава на фазовый состав и микроструктуру продуктов затвердевания // Изв. Академии наук. Сер. хим. 2021. № 8. С. 1462–1470.
Воскресенская Е.Н. Взаимодействие платины с расплавленными висмутсодержащими оксидами: Автореф. дис. ... канд. хим. наук. М: ИОНХ АН СССР, 1983. 24 с.
Schwartz K.B., Prewitt C.T. Structural and Electronic Properties of Binary and Ternary Platinum Oxides // J. Phys. Chem. Solids. 1984. V. 45. № 1. P. 1–21.
Tsang C.-F., Meen J.K., Elthon D. Phase Equilibria of the Bismuth Oxide -CoPer Oxide System in Oxygen at 1 atm // J. Am. Ceram. Soc. 1994. V. 77. № 12. P. 3119–3124.
Данков П.Д. Механизм фазовых превращений с точки зрения принципа ориентационного и размерного соответствия // Изв. сектора физ.-хим. анализа АН СССР. 1943. Т. 16. № 1. С. 82–96.
Конобеевский С.Т. О природе связей в металлах // Докл. на совещании по теории металлических сплавов. М.: Изд-во МГУ, 1952. С. 4.
Bermeshev T.V., Zhereb V.P., Yasinskiy A.S., Mazurova E.V., Bundin M.P., Samoilo A.S., Bespalov V.M., Merdak N.V., Yushkova O.V., Yuryev P.O., Bezrukikh A.I. Casting Synthesis of Bi12SiO20 // Mendeleev Commun. 2021. V. 31. № 5. P. 721–722. https://doi.org/10.1016/j.mencom.2021.09.043
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы



