Неорганические материалы, 2022, T. 58, № 11, стр. 1219-1230
Фазовый комплекс и химическое взаимодействие в трехкомпонентной взаимной системе Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$
А. В. Харченко 1, Е. М. Егорова 1, И. К. Гаркушин 1, А. В. Бурчаков 1, *, В. М. Яковлев 2, В. А. Новиков 1
1 Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
2 Самарский государственный университет путей сообщения
443066 Самара, ул. Свободы, 2 В, Россия
* E-mail: turnik27@yandex.ru
Поступила в редакцию 15.04.2022
После доработки 05.09.2022
Принята к публикации 19.09.2022
- EDN: KVTMFO
- DOI: 10.31857/S0002337X22110082
Аннотация
В работе впервые теоретически и экспериментально изучен фазовый комплекс трехкомпонентной взаимной системы из бромидов и хроматов лития и рубидия. Проведено разбиение фазового комплекса на вторичные фазовые треугольники, получено линейное древо фаз, вершины каждого симплекса которого описывают кристаллизующиеся фазы. С помощью метода ионного баланса описаны химические превращения и спрогнозированы кристаллизующиеся фазы для смесей с заданным составом. На основе данных об элементах огранения построена компьютерная 3D-модель фазового комплекса, получены политермические и изотермические сечения, изотермы поверхности ликвидуса. Методами дифференциального термического анализа и рентгенофазового анализа подтверждена правильность разбиения на симплексы. Экспериментально изучены фазовые равновесия в системе, выявлены состав и температура плавления тройных нонвариантных точек. Состав тройной эвтектики Е3 245 рекомендован для использования в качестве расплавляемого электролита химического источника тока. Доказана адекватность моделирования фазовых равновесий с помощью 3D‑модели при сравнении экспериментальных данных с прогнозируемыми, полученными из модели.
ВВЕДЕНИЕ
Получение новых материалов (теплоаккумулирующих, электролитов для средне- и высокотемпературных источников тока) на основе солевых систем имеет в настоящее время важное значение [1–19]. Особый класс неорганических материалов представлен смесями на основе тройных взаимных систем, в которых, наряду с фазовыми превращениями, протекают реакции взаимного обмена (метатезиса). В зависимости от теплового эффекта реакции обмена они классифицируются на обратимо-взаимные (без резкого сдвига равновесия в сторону стабильной пары солей), необратимо-взаимные, сингулярные необратимо-взаимные (с резким сдвигом равновесия в сторону пары солей) [20].
В настоящей работе предложено описание химического взаимодействия в тройной взаимной системе из бромидов и хроматов лития и рубидия, выявлены низкоплавкие смеси, перспективные в качестве расплавляемых электролитов для химических источников тока.
Данные по индивидуальным веществам (температурам плавления, полиморфных переходов) приняты по [21, 22]. Все составы в тексте и на рисунках представлены в экв. %. Элементы огранения – двухкомпонентные системы. В системе LiBr–RbBr образуются эвтектика e2 287, tпл = 287°С, 59% LiBr и 41% RbBr; перитектика p1 300, tпл = 300°С, 54% LiBr и 46% RbBr; соединение иконгруэнтного плавления Dи 300, tпл = 300°С, 50% LiBr и 50% RbBr. В системе LiBr–Li2CrO4 образуется эвтектика e1 370, tпл = 370°С, 38% LiBr и 62% Li2CrO4. В системе RbBr–Rb2CrO4 образуются эвтектика e3 620, tпл = = 620°С, 63% RbBr и 37% Rb2CrO4 и переходная точка p2 730, 44% RbBr и 56% Rb2CrO4, характеризующая полиморфное превращение Rb2CrO4. В системе Li2CrO4–Rb2CrO4 образуется соединение конгруэнтного плавления Dк 610, tпл = 610°С, 50% Li2CrO4, 50% Rb2CrO4 и две эвтектики: e5 411, tпл = = 411°С, 79% Li2CrO4 и 21% Rb2CrO4, e4 602, tпл = = 602°С, 45% Li2CrO4 и 55% Rb2CrO4 [23–27].
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Первый этап предполагает разбиение системы Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$ на вторичные фазовые треугольники. Разбиение может быть проведено геометрическим и термодинамическим методами. Термодинамический вариант разбиения тройной взаимной системы включает расчет теплового эффекта и энергии Гиббса реакции обмена при стандартных условиях (конверсионный метод [20, 28]):
(1)
$\begin{gathered} {\text{R}}{{{\text{b}}}_{{\text{2}}}}{\text{Cr}}{{{\text{O}}}_{{4({\text{кр}},\alpha )}}} + 2{\text{LiB}}{{{\text{r}}}_{{\left( {{\text{кр}}} \right)}}} \rightleftarrows \\ \rightleftarrows \,\,{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{Cr}}{{{\text{O}}}_{{4({\text{кр}},\alpha )}}} + 2{\text{RbB}}{{{\text{r}}}_{{\left( {{\text{кр}}} \right)}}}, \\ {{\Delta }_{r}}H_{{298}}^{^\circ } = ~ - 68.292{\text{ кДж}}, \\ {{\Delta }_{r}}G_{{298}}^{^\circ } = ~ - 57.961{\text{ кДж}}{\text{.}} \\ \end{gathered} $Как показывает термодинамический расчет, наиболее вероятным вариантом разбиения является приведенный на рис. 1.
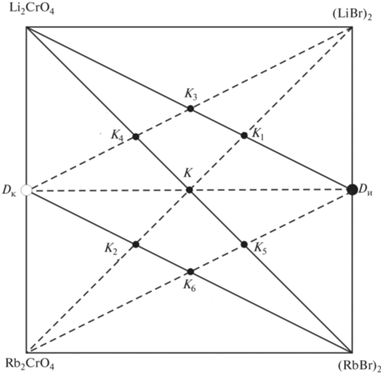
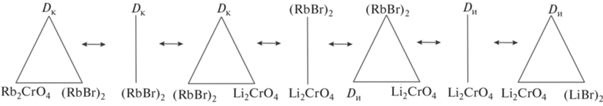
Кроме приведенной реакции обмена в точке полной конверсии K, рассмотрим реакции, протекающие в тройной взаимной системе для фигуративных точек составов, отвечающих пересечению стабильной диагонали Li2CrO4–(RbBr)2 и стабильных секущих Dк–(RbBr)2 и Dи– Li2CrO4 с нестабильными секущими Dк–(LiBr)2, (LiBr)2–Rb2CrO4, Dи–Rb2CrO4 (точки эквивалентности К1–К6). Для приведенного варианта разбиения построено древо фаз системы (рис. 2).
Древо фаз позволяет описать химическое взаимодействие для любых смесей (включая и составы смесей точек пересечения стабильных и нестабильных секущих К1–К6) методом ионного баланса и дает возможность определить симплекс, в который попадает состав после расплавления и кристаллизации. Рассмотрим различные варианты описания от трех до шести исходных солей в смесях.
Вариант 1. Исходная смесь содержит также три соли Rb2CrO4 + 3LiBr + 2LiRbBr2. Рассмотрим симплекс Li2CrO4–LiRbCrO4–(RbBr)2 и запишем уравнение в общем виде:
Определим коэффициенты a1, b1 и c1 из системы уравнений
Коэффициент b1 < 0, поэтому состав после расплавления и кристаллизации не принадлежит симплексу Li2CrO4–LiRbCrO4–(RbBr)2. Рассмотрим симплекс Li2CrO4–(RbBr)2–LiRbBr2.Уравнение в общем виде:
Так как все коэффициенты положительные, то исходная смесь после плавления и кристаллизации принадлежит стабильному треугольнику Li2CrO4–(RbBr)2–LiRbBr2.
Окончательное уравнение (брутто-реакция) имеет вид:
Брутто-реакцию можно представить в виде более простых:
Вариант 2. Возьмем три соли: 3RbBr + 2Li2CrO4 + + 4Rb2CrO4. Рассмотрим симплекс Dк–(RbBr)2–Rb2CrO4 и запишем в уравнении реакции правую часть с неопределенными коэффициентами a, b и c:
Определим коэффициенты a, b и c из системы линейных уравнений
Все коэффициенты в правой части уравнения положительные, поэтому уравнение в общем виде (брутто-реакцию) запишем как
Приведенную брутто-реакцию можно представить в виде более простых:
Аналогично можно рассматривать исходные смеси из 4–6 солей.
По данным элементов огранения, стабильной диагонали (LiBr)2–Rb2CrO4 и стабильной секущей Dк–(RbBr)2 (см. ниже) для изучаемой системы (рис. 3) построена трехмерная модель в программе КОМПАС 3D [31]. В плоскости Oxy модели лежит квадрат составов, по вертикальной оси аппликат откладывается температура в градусах Цельсия, рабочий диапазон температур 200–1000°С (рис. 4). Построение модели осуществляется по декартовым координатам, которые рассчитываются исходя из состава и температуры фигуративной точки. Вначале конструируется остов пространственной диаграммы, затем на боковых гранях фигуры модели строятся Т–х-диаграммы двойных ограняющих систем, далее наносятся нонвариантные точки внутри фигуры, строятся линии моновариантного фазового равновесия, поверхности дивариантного равновесия [31].
Рис. 3.
Проекция поверхности ликвидуса на квадрат составов трехкомпонентной взаимной системы Li+,Rb+||Br–, ${\text{CrO}}_{4}^{{2 - }}$.
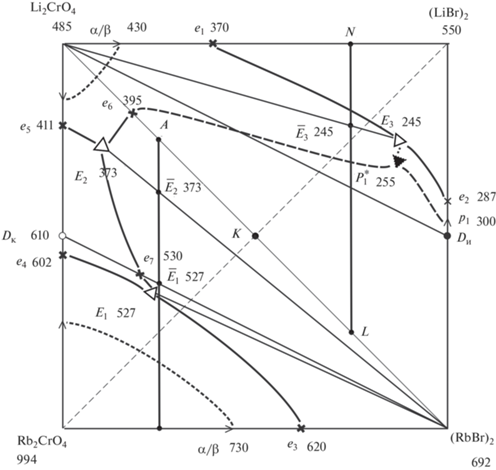
Рис. 4.
Изображение 3D-модели трехкомпонентной взаимной системы Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$ (диапазон температуры 200–1000°С).
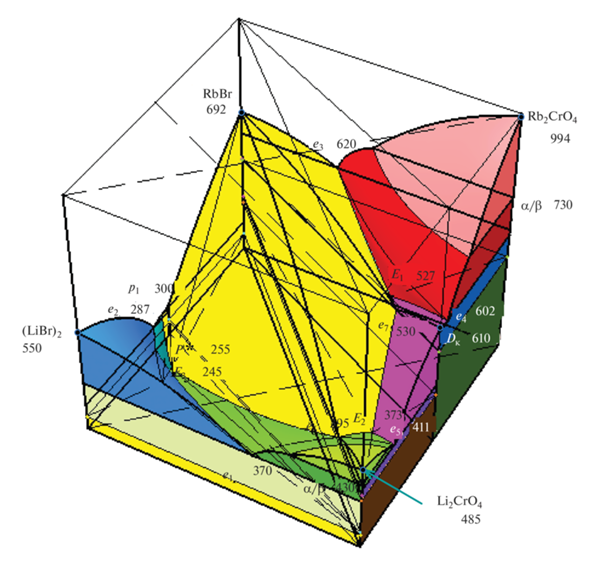
В модели не учитывались полиморфные превращения соединения LiRbCrO4, поскольку они практически не влияют на кривизну поверхности ликвидуса и их построение усложняет моделирование.
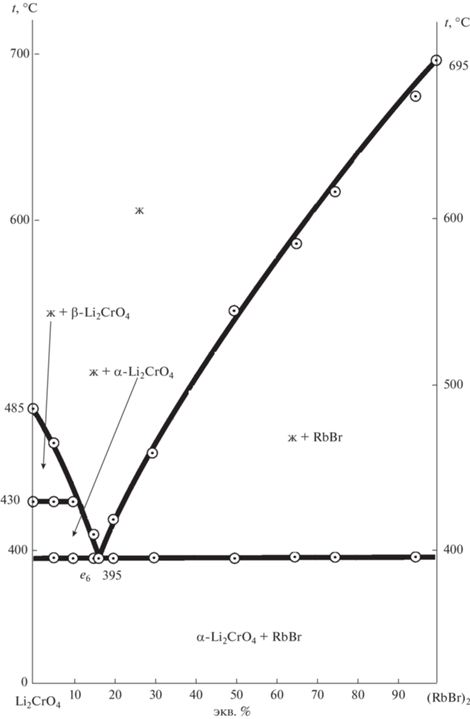
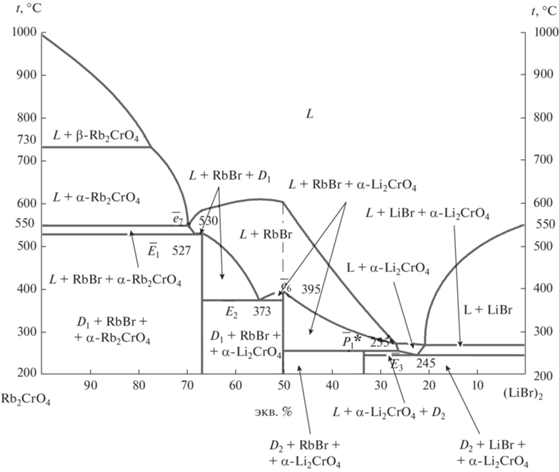
3D-модель фазового комплекса системы дает возможность прогнозировать политермические и изотермические сечения за счет пересечения вертикальной и горизонтальной плоскостью соответственно. На основе модели построена t–х-диаграмма политермического разреза нестабильной диагонали (LiBr)2–Rb2CrO4 (рис. 5). Разрез пересекает все четыре симплекса, каждый из которых характеризуется своим набором кристаллизующихся фаз, а также в разрезе фиксируются все нонвариантные равновесия в системе: нонвариантные эвтектические равновесия для стабильной диагонали (RbBr)2–Li2CrO4 (е6 395) и стабильной секущей (RbBr)2–Dк (е7 530); тройных эвтектик: Е3 245, Е2 373, Е1 527 и тройной перитектики Р1 255.
Рис. 5.
t–x-диаграмма политермического разреза нестабильной диагонали (LiBr)2–Rb2CrO4 трехкомпонентной взаимной системы Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$ (получена из модели).
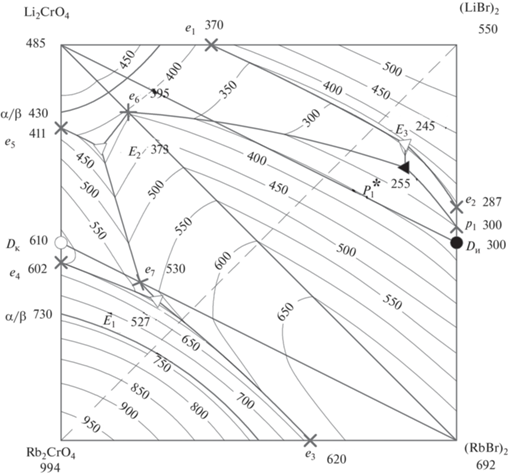
Из модели получены изотермы поверхности ликвидуса с шагом в 50°С, нанесенные на квадрат составов (рис. 6). Из рис. 6 видна крутизна поверхности ликвидуса.
Рис. 6.
Поверхность ликвидуса трехкомпонентной взаимной системы Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$ (получена из модели).
На рис. 7 приведены изотермические сечения при 600, 500, 400, 300°С, полученные из модели. С понижением температуры уменьшается область жидкости, увеличиваются, а затем уменьшаются двухфазные области сосуществования жидкости и твердой фазы, увеличиваются трехфазные области.
Рис. 7.
Изотермические сечения трехкомпонентной взаимной системы Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$ при 600, 500, 400 и 300°С, полученные из модели.
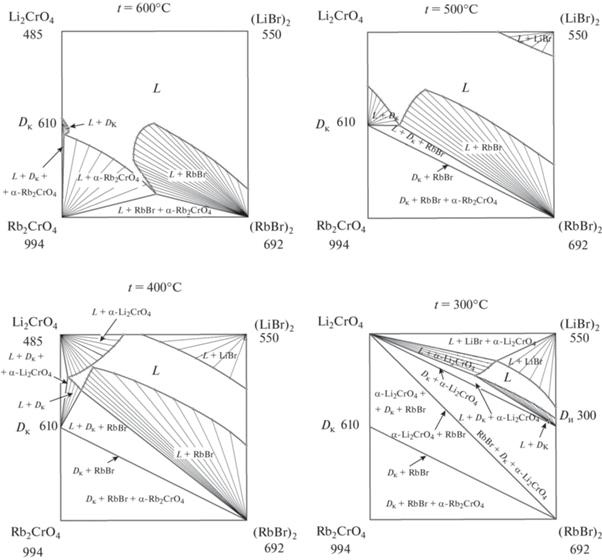
В солидусной области ниже эвтектической температуры для отрезков стабильной диагонали (RbBr)2–Li2CrO4 и стабильной секущей (RbBr)2–Dк фазовые равновесия описываются двумя фазами: RbBr + α-Li2CrO4 и RbBr + Dк соответственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все исходные вещества были предварительно обезвожены прокаливанием, гигроскопичные соли были переплавлены в печи, затем помещались в сухие бюксы и хранились в эксикаторах с осушителем. Квалификация исходных солей – “ч.”, содержание основного вещества не менее 99%. Экспериментальные исследования проводили методом дифференциального термического анализа (ДТА) [32–34], кристаллизующиеся фазы идентифицировали методом рентгенофазового анализа (РФА) [35, 36].
Исследование химического взаимодействия в гомогенизированной смеси эквивалентных количеств LiBr и Rb2CrO4 позволило подтвердить разбиение системы (рис. 3) на вторичные фазовые треугольники.
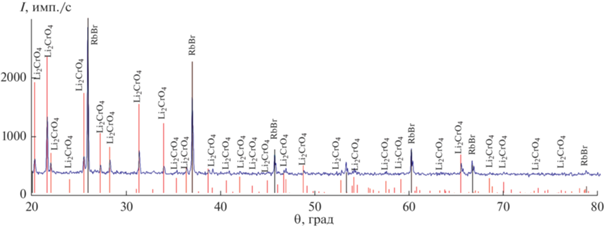
Также подтверждением разбиения являются данные ДТА квазибинарного сечения Li2CrO4–(RbBr)2 (рис. 8) [37] и РФА. Ликвидус на t–х-диаграмме представлен тремя кривыми кристаллизации: α- Li2CrO4, β-Li2CrO4 и RbBr. На рис. 9 представлена рентгенограмма порошка состава, отвечающего квазидвойной эвтектике e6 395, которая содержит 17% RbBr и 83% Li2CrO4.
Аналогично квазидвойной системе методом ДТА исследована стабильная секущая Dк–(RbBr)2, определена перевальная эвтектика.
Для выявления точек нонвариантных равновесий в фазовом треугольнике Li2CrO4–Rb2CrO4–RbBr исследован вначале политермический разрез А[25% RbBr + 75%Li2CrO4]–В[25% RbBr + 75% Rb2CrO4], из t–х-диаграммы которого (рис. 10) были выявлены температуры плавления тройных эвтектик и соотношения двух компонентов: хромата лития и соединения Dк для ${{\bar {Е}}_{2}}$ 373 и хромата рубидия и соединения Dк для ${{\bar {Е}}_{1}}$ 527.
Рис. 10.
Сравнение температур фазовых переходов на разрезе АВ трехкомпонентной взаимной системы Li+,Rb+||Br–, ${\text{CrO}}_{4}^{{2 - }}$, полученных экспериментальным путем (сплошные линии) и смоделированных (пунктирные линии).
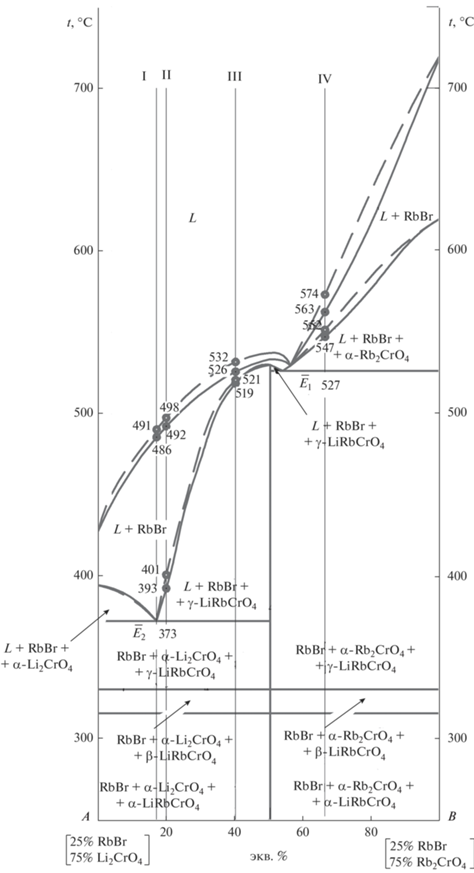
При исследовании разрезов, проходящих через проекции эвтектик и полюс кристаллизации – (RbBr)2, выявлены составы тройных эвтектик: 10% RbBr, 74% Li2CrO4, 16% Rb2CrO4 – E2 373 и 24.5% RbBr, 35.25% Li2CrO4, 40.25% Rb2CrO4 – E1 527. Фазовый состав тройной эвтектики Е2 373 подтвержден методом РФА. Аналогичным способом были выявлены координаты эвтектики Е3 245.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для проверки адекватности модели проведено сравнение экспериментально полученных температур фазовых переходов с прогнозируемыми при помощи модели. Для этого на политермическом разрезе АВ (рис. 3) выбраны составы I–IV (см. рис. 10 и табл. 1). Отклонения значений температур не превышают 11°С, в основном лежат в пределах 5–8°С, что свидетельствует о достаточно высокой точности моделирования.
Состав тройной эвтектики Е3 245 рекомендован для использования в качестве расплавляемого электролита химического источника тока.
Таблица 1.
Сравнение экспериментально полученных значений температур кристаллизации с прогнозируемыми при помощи 3D-модели для составов политермического разреза А–В системы Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$
| Образец | Состав | Температура, °С | Абсолютная ошибка, °С | Фазовая реакция | |
|---|---|---|---|---|---|
| эксперимент | моделирование | ||||
| I | RbBr – 25% Li2CrO4 – 62.25% Rb2CrO4 – 12.75% |
486 | 491 | 5 | L ⇄ RbBr |
| II | RbBr – 25% Li2CrO4 – 60% Rb2CrO4 – 15% |
492 | 498 | 6 | L ⇄ RbBr |
| 393 | 401 | 8 | L ⇄ RbBr + γ-LiRbCrO4 | ||
| III | RbBr – 25% Li2CrO4 – 45% Rb2CrO4 – 30% |
526 | 532 | 6 | L ⇄ RbBr |
| 519 | 521 | 2 | L ⇄ RbBr + γ-LiRbCrO4 | ||
| IV | RbBr – 25% Li2CrO4 – 49.5% Rb2CrO4 – 25.5% |
563 | 574 | 11 | L ⇄ RbBr |
| 547 | 552 | 5 | L ⇄ RbBr + α-Rb2CrO4 | ||
ЗАКЛЮЧЕНИЕ
В работе впервые исследованы фазовые равновесия в трехкомпонентной взаимной системе Li+,Rb+||Br–,${\text{CrO}}_{4}^{{2 - }}$. Методом ДТА и РФА доказана правильность разбиения фазового комплекса на вторичные фазовые треугольники. Древо фаз имеет линейное строение, кристаллизующимися фазами являются фазы постоянного состава, отвечающие компонентам и соединениям системы.
В системе реализуются эвтектические и перитектические равновесия, экспериментально выявлены координаты нонвариантных точек. Описаны химические превращения методом ионного баланса с прогнозом кристаллизующихся фаз.
Построена 3D-модель фазового комплекса, из которой получены политермические и изотермические сечения системы, изотермы поверхности ликвидуса. Доказана адекватность 3D-моделирования для прогноза фазовых превращений в системе.
Список литературы
Ushak S., Fernández A.G., Grageda M. Using Molten Salts and Other Liquid Sensible Storage Media in Thermal Energy Storage (TES) Systems // Advances in Thermal Energy Storage Systems: Methods and Applications. Woodhead Publishing Series in Energy, № 66. 2015. P. 49–63.
Dinker A., Agarwal M., Agarwal G.D. Heat Storage Materials, Geometry and Applications: A Review // J. Energy Inst. 2017. V. 90. № 1. P. 1–11. https://doi.org/10.1016/j.joei.2015.10.002
Onar O.C., Khaligh A. Energy Sources // Alternative Energy in Power Electronics. L.: Butterworths, 2015. P. 81–154.
Мозговой А.Г., Шпильрайн Э.Э., Дибиров М.А. Теплофизические свойства теплоаккумулирующих материалов // Кристаллогидраты: обзоры по теплофизическим свойствам веществ. М.: ТФЦ ИВТАН СССР. 1990. № 2 (82). С. 3.
Лидоренко Н.С., Мучник Г.В., Трушевский С.Н. Аккумулирование плавлением // Наука и жизнь. 1974. № 3. С. 19–21.
Харченко Н.В. Индивидуальные солнечные установки. М.: Энергоатомиздат, 1991. 254 с.
Ushak S., Vega M., Lovera-Copa J.A. Thermodynamic Modeling and Experimental Verification of New Eutectic Salt Mixtures as Thermal Energy Storage Materials // Sol. Energy Mater. Sol. Cells. 2020. V. 209. № 110475. https://doi.org/10.1016/j.solmat.2020.110475
Бараненко А.В., Кузнецов П.А., Захарова В.Ю., Цой А.П. Применение веществ с фазовыми переходами для аккумулирования тепловой энергии // Научно-технический вестник информационных технологий, механики и оптики. 2018. Т. 18. № 6. С. 990–1000. https://doi.org/10.17586/2226-1494-2018-18-6-990-1000
Сучков А.Б. Электролитическое рафинирование в расплавленных средах. М.: Металлургия, 1970. 256 с.
Васько А.Т., Ковач С.К. Электрохимия тугоплавких металлов. Киев: Техника, 1983. 160 с.
Великанов А.А. Электролиз сульфидных расплавов как метод переработки сырья в цветной металлургии. Электрохимия и расплавы. М.: Наука, 1974. С. 94–99.
Флюсы и шлаки // Материалы международного семинара (Никополь, 1974). Киев: Наук. думка, 1975. 74 с.
Beneš O., Konings R.J.M. Thermodynamic Properties and Phase Diagrams of Fluoride Salts for Nuclear Applications // J. Fluorine Chem. 2009. V. 130. № 1. P. 22–29. https://doi.org/10.1016/j.jfluchem.2008.07.014
Новиков В.М., Слесарев И.С., Алексеев П.Н. Ядерные реакторы повышенной безопасности. М.: Энергоатомиздат, 1993. 384 с.
Carlson F., Davidson J.H. Parametric Study of Thermodynamic and Cost Performance of Thermal Energy Storage Coupled with Nuclear Power // Energy Convers. Manage. 2021. V. 236. P. 114054. https://doi.org/10.1016/j.enconman.2021.114054
Дёмина М.А., Егорова Е.М., Гаркушин И.К., Бурчаков А.В., Игнатьева Е.О. Фазовые равновесия в трехкомпонентной системе NaCl–NaBr–Na2CrO4 // Журн. физ. химии. 2021. Т. 95. № 6. С. 955–957. https://doi.org/10.31857/S004445372106008X
Вердиев Н.Н., Гаркушин И.К., Вердиева З.Н., Бурчаков А.В., Кондратюк И.М., Егорова Е.М. Теплоаккумулирующая смесь из галогенидов и хроматов натрия // Теплофизика высоких температур. 2021. Т. 59. № 1. С. 82–85. https://doi.org/10.31857/S0040364421010166
Вердиев Н.Н., Гаркушин И.К., Бурчаков А.В., Вердиева З.Н., Алхасов А.Б., Мусаева П.А., Кондратюк И.М., Егорова Е.М. Фазовые равновесия в системе NaF–NaCl–NaBr–Na2CrO4 // Неорган. материалы. 2020. Т. 56. № 11. С. 1243–1251. https://doi.org/10.31857/S0002337X20110159
Харченко А.В., Гаркушин И.К., Егорова Е.М., Новиков В.А. Электролит для химического источника тока: Пат. RU 2 768 250. БИ. № 9.
Бергман А.Г., Бухалова Г.А. Термодинамические взаимоотношения в тройных взаимных системах с комплексообразованием // Изв. Сектора физ.-хим. анализа. 1952. Т. 21. С. 228–249.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. X. Ч. 1. 300 с.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. Х. Ч. 2. 300 с.
Бурчаков А.В., Дворянова Е.М. Анализ ряда двухкомпонентных систем Li2CrO4–M2CrO4 (M=Na, K, Rb, Cs) и экспериментальное исследование системы Li2CrO4–Rb2CrO4 // Тез. докл. XXXVII Самарск. обл. студ. науч. конф. Самара. 2011. С. 189.
Ильясов И.И., Авранов М.Д., Грудянов И.И. Ликвидус системы LiBr–RbBr // Журн. неорган. химии. 1975. Т. 20. № 1. С. 232–234.
Искандаров К.И., Литвинов Ю.Г., Ильясов И.И. Тройная система Li,Rb,Cs//Br // Журн. неорган. химии. 1976. Т. 21. № 7. С. 1990–1992.
Гаркушин И.К., Губанова Т.В., Петров А.С., Анипченко Б.В. Фазовые равновесия в системах с участием метаванадатов некоторых щелочных металлов. М.: Машиностроение-1, 2005. 118 с.
Топшиноева З.Н., Бухалова Г.А., Мирсоянова Н.Н. Двойная система RbBr–Rb2CrO4 // Журн. неорган. химии. 1976. Т. 21. № 1. С. 283.
Радищев В.П. Многокомпонентные системы: Деп. в ВИНИТИ АН СССР. 1963. № 1516-63. С. 502.
Терминология физико-химического анализа / Под ред. Кузнецова Н.Т. М.: ЛЕНАНД, 2017. 48 с.
Бурчаков А.В., Гаркушин И.К., Кондратюк И.М., Егорова Е.М., Милов С.Н. Моделирование фазового комплекса трехкомпонентной взаимной системы Na+,Sr2+||Cl–,${\text{WO}}_{4}^{{2 - }}$ // Журн. неорган. химии. 2021. Т. 66. № 7. С. 911–920. https://doi.org/10.31857/S0044457X2107004710.31857/S0044457X21070047
Бурчаков А.В., Гаркушин И.К., Милов С.Н., Калинина И.П. Модель фазового комплекса трехкомпонентной взаимной системы Na+,Sr2+||${\text{WO}}_{4}^{{2 - }}$,${\text{MoO}}_{4}^{{2 - }}$ // Бутлеровские сообщения. 2019. Т. 59. № 8. С. 103–115.
Уэндландт У. Термические методы анализа. М.: Мир, 1978. 528 с.
Егунов В.П., Гаркушин И.К., Фролов Е.И., Мощенский Ю.В. Термический анализ и калориметрия. Самара: Самар. гос. техн. ун-т, 2013. 457 с.
Wagner M. Thermal Analysis in Practice: Fundamental Aspects. East Brunswick: Hanser, 2018. P. 158–161.
Ковба Л.М. Рентгенография в неорганической химии. М.: Изд-во МГУ, 1991. 256 с.
Уманский Я.С., Скаков Ю.А. Кристаллография, рентгенография и электронная микроскопия. М.: Металлургия, 1982. 632 с.
Kharchenko A.V., Egorova E.M., Garkushin I.K. Study of Phase Equilibria in the Li2CrO4–RbBr Quasi-binary System // XVI Int. conf. on Thermal Analysis and Calorimetry in Russia RTAC-2020. M. 2020. P. 97.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы