Неорганические материалы, 2022, T. 58, № 11, стр. 1231-1236
Древо фаз, прогноз кристаллизующихся фаз и описание химического взаимодействия в системе MgO–SiO2–TiO2
И. К. Гаркушин 1, М. А. Сухаренко 1, *
1 Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: sukharenko_maria@mail.ru
Поступила в редакцию 01.04.2022
После доработки 21.06.2022
Принята к публикации 24.06.2022
- EDN: BRSVEL
- DOI: 10.31857/S0002337X22110045
Аннотация
На основании ранее изученной трехкомпонентной оксидной системы MgO–SiO2–TiO2 построено древо фаз, которое имеет линейное строение и включает пять стабильных треугольников, соединенных между собой четырьмя стабильными секущими. С использованием древа фаз проведен прогноз кристаллизующихся из расплава фаз с учетом элементов огранения, в которых образуются пять двойных соединений. Для пересечений стабильных и нестабильных секущих в точках, отвечающих эквивалентному соотношению веществ, описаны основные реакции химического взаимодействия и проведен термодинамический расчет их направления для стандартных условий. Также для произвольных сочетаний веществ от 3 до 8, входящих в систему, методом атомного баланса описано химическое взаимодействие, в результате которого выявлены симплексы, включающие смеси после расплавления и кристаллизации. Оценка взаимодействия проведена с помощью термодинамических расчетов.
ВВЕДЕНИЕ
Фазовые равновесия в различных солевых и оксидных системах изучены в работах [1–19]. Смеси на основе двойных и тройной системы имеют важное прикладное значение для моделирования и исследования технологических процессов получения периклазовых, магнезитовых, форстеритовых огнеупоров, форстеритовой и стеатитовой радиокерамики, электрокерамики. Кроме реакций образования двойных соединений и тройных смесей, в оксидных системах возможно протекание реакций обмена (метатезиса), если на смежных сторонах треугольника составов образуются двойные соединения, что аналогично взаимодействию во взаимных системах.
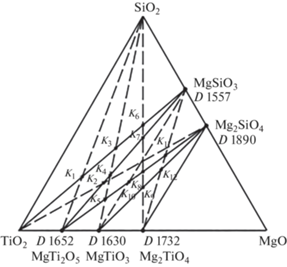
Система MgO–SiO2–TiO2 исследована в работе [20]. Однако проведено только разбиение на пять вторичных фазовых треугольников, не построено древо фаз и не осуществлен прогноз кристаллизующихся фаз. Тройные соединения в системе не образуются. Псевдобинарная эвтектика в сечении Mg2SiO4–Mg2TiO4 плавится при 1910°С. По мнению авторов [20], тройная эвтектика в фазовом треугольнике MgSiO3–TiO2–SiO2 плавится при температуре около 1650°С. Полностью поверхность ликвидуса не изучена.
В настоящей работе предположено построение древа фаз, которое позволяет не только осуществить прогноз кристаллизующихся фаз в стабильных треугольниках и секущих элементах тройной системы, но и описать химическое взаимодействие.
ДРЕВО ФАЗ И ПРОГНОЗ КРИСТАЛЛИЗУЮЩИХСЯ ФАЗ
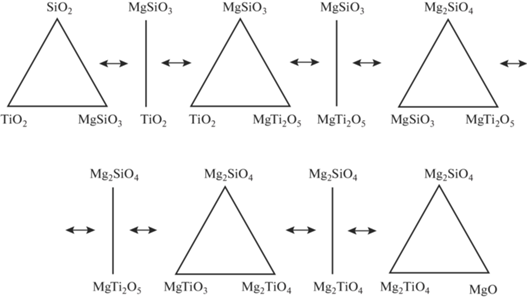
Данные по фазовым соотношениям в системе MgO–SiO2–TiO2 приведены в работе [20] (рис. 1). По полученным данным построено древо фаз, имеющее линейное строение (рис. 2), включающее пять стабильных треугольников: TiO2–SiO2–MgSiO3, TiO2–MgSiO3–MgTi2O5, MgSiO3–Mg2SiO4–MgTi2O5, MgTiO3–Mg2SiO4–Mg2TiO4, Mg2TiO4–Mg2SiO4–MgO, соединяющихся между собой четырьмя стабильными секущими TiO2–MgSiO3, MgSiO3–MgTi2O5, MgTiO3–Mg2SiO4, Mg2TiO4–Mg2SiO4.
Древо фаз позволяет провести прогноз кристаллизующихся фаз в стабильных и секущих элементах системы MgO–SiO2–TiO2 с учетом данных по ограняющим элементам и индивидуальным веществам (табл. 1–3) [20, 21]. Кристаллизующиеся фазы представлены в основном индивидуальными веществами, кроме Mg2TiO4, который образует со стороны MgO ограниченный твердый раствор (ОТР) (табл. 3). Также Mg2TiO4 образует в Mg2SiO4 ОТР до 4 мас. % Mg2TiO4 [20].
Таблица 1.
Данные по индивидуальным веществам тройной системы MgO–SiO2–TiO2
| Вещество | Температура плавления, °С | ${{\Delta }_{f}}H_{{298}}^{^\circ }$, кДж/моль | ${{\Delta }_{f}}G_{{298}}^{^\circ }$, кДж/моль |
|---|---|---|---|
| MgO | 2825 ± 25 | –601.491 ± 0.292 | –569.254 |
| TiO2 | 1870 ± 15 | –943.868 ± 0.962 | –888.610 |
| SiO2 | 1728 | –910.940 ± 1.422 | –856.669 |
| Mg2TiO4 (D1) | 1750 ± 15 | –2164.000 ± 1.631 | –2047.444 |
| MgTiO3 (D2) | 1660 ± 20 | –1571.928 ± 1.464 | –1483.587 |
| MgTi2O5 (D3) | 1650 ± 20 | –2507.889 ± 2.928 | –2367.470 ± 3.472 |
| MgSiO3 (D4) | 1560 ± 5 | –1548.946 | –1462.098 |
| Mg2SiO4 (D5) | 1887 ± 10 | –2171.914 ± 2.092 | –2052.929 |
Таблица 2.
Данные по двухкомпонентным системам тройной системы MgO–SiO2–TiO2 [20]
| Система | Данные по нонвариантным точкам | |
|---|---|---|
| координаты точек | фазовые равновесия | |
| TiO2–SiO2 | m 1780°С, 7 мас. % SiO2; n 81 мас. % SiO2 |
Жm ⇄ Жn + TiO2 |
| e 1550°C; 89.5 мас. % SiO2 | Ж ⇄ SiO2 + TiO2 | |
| MgO–SiO2 | D5 1890°С | Ж ⇄ Mg2SiO4 |
| p1 1557°C, 62 мас. % SiO2 | Ж + Mg2SiO4⇄ MgSiO3 | |
| p2 1543°C, 63.5 мас. % SiO2 | Ж + MgSiO3 ⇄ SiO2 | |
| m 1703°С | Жm ⇄ Жn + MgO | |
| MgO–TiO2 | D1 (~1490…1732°С) | Ж ⇄ Mg2TiO4 |
| D2 1630°С | Ж ⇄ MgTiO3 | |
| D3 1652°С | Ж ⇄ MgTi2O5 | |
| e1 1707°C, 34.5 мас. % TiO2 | Ж ⇄ MgO + Mg2TiO4 | |
| e2 1583°C, 61 мас. % TiO2 | Ж ⇄ Mg2TiO4 + MgTiO3 | |
| e3 1592°C, 72 мас. % TiO2 | Ж ⇄ MgTiO3 + MgTi2O5 | |
| e4 1606°C, 91 мас. % TiO2 | Ж ⇄ MgTi2O5 + TiO2 | |
Таблица 3.
Кристаллизующиеся фазы в стабильных и секущих элементах системы MgO–SiO2–TiO2
| Стабильная секущая | Фазы | Стабильный треугольник | Фазы |
|---|---|---|---|
| TiO2–MgSiO3 | TiO2, MgSiO3 | TiO2–SiO2–MgSiO3 | TiO2, SiO2, MgSiO3 |
| MgTi2O5–MgSiO3 | MgTi2O5, MgSiO3 | TiO2–MgSiO3–MgTi2O5 | TiO2, MgSiO3, MgTi2O5 |
| MgTi2O5–Mg2SiO4 | MgTi2O5, Mg2SiO4 | MgSiO3–MgTi2O5–Mg2SiO4 | MgSiO3, MgTi2O5, Mg2SiO4 |
| MgTiO3–Mg2SiO4 | MgTiO3, Mg2SiO4 | MgTi2O5–Mg2SiO4–MgTiO3 | MgTi2O5, Mg2SiO4, MgTiO3 |
| Mg2TiO4–Mg2SiO4 | Mg2TiO4, Mg2SiO4 | MgTiO3–Mg2SiO4–Mg2TiO4 | MgTiO3, Mg2SiO4, Mg2TiO4 |
| Mg2TiO4–Mg2SiO4–MgO | Mg2TiO4, Mg2SiO4 (ОТР), MgO (ОТР) |
ОПИСАНИЕ ХИМИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ
Основные реакции химического взаимодействия описываются в точках пересечения стабильных и нестабильных секущих аналогично описанию взаимодействия во взаимных системах [22–24]. Точки пересечения К являются диагоналями четырехугольников в тройных системах (табл. 4) [25, 26]. В табл. 5 приведены расчетные значения энтальпий и энергий Гиббса реакций обмена, протекающих в системе. Анализ табл. 5 показывает, что одной стабильной секущей может отвечать несколько нестабильных секущих (при различном соотношении нестабильных веществ). В табл. 6 стабильным секущим TiO2–MgSiO3, MgSiO3–MgTi2O5 и Mg2SiO4–MgTi2O5 отвечают по три нестабильных секущих, а стабильной секущей MgTiO3–Mg2SiO4 – две нестабильных секущих.
Таблица 4.
Элементы диаграммы, в которых протекают основные реакции
| Точка диаграммы | Секущие | Четырехугольники | |
|---|---|---|---|
| нестабильные | стабильные | ||
| К1 | MgTi2O5–SiO2 | TiO2–MgSiO3 | TiO2–SiO2–MgSiO3–MgTi2O5 |
| К2 | TiO2–Mg2SiO4 | MgTi2O5–MgSiO3 | TiO2–MgSiO3–Mg2SiO4–MgTi2O5 |
| К3 | MgTiO3–SiO2 | TiO2–MgSiO3 | MgTiO3–MgSiO3–SiO2–TiO2 |
| К4 | MgTiO3–SiO2 | MgTi2O5–MgSiO3 | MgTiO3–MgSiO3–SiO2–TiO2 |
| К5 | MgTiO3–SiO2 | MgTi2O5–Mg2SiO4 | MgTiO3–MgSiO3–SiO2–TiO2 |
| К6 | Mg2TiO4–SiO2 | TiO2–MgSiO3 | Mg2TiO4–Mg2SiO4–SiO2–TiO2 |
| К7 | Mg2TiO4–SiO2 | MgTi2O5–MgSiO3 | Mg2TiO4–Mg2SiO4–SiO2–TiO2 |
| К8 | Mg2TiO4–SiO2 | MgTi2O5–Mg2SiO4 | Mg2TiO4–Mg2SiO4–SiO2–TiO2 |
| К9 | Mg2TiO4–SiO2 | MgTiO3–Mg2SiO4 | Mg2TiO4–Mg2SiO4–MgSiO3–MgTiO3 |
| К10 | MgTiO3–MgSiO3 | MgTi2O5–Mg2SiO4 | MgTiO3–Mg2SiO4–MgSiO3–MgTi2O5 |
| К11 | Mg2TiO4–MgSiO3 | MgTi2O5–Mg2SiO4 | Mg2TiO4–Mg2SiO4–MgSiO3–MgTi2O5 |
| К12 | Mg2TiO4–MgSiO3 | MgTiO3–Mg2SiO4 | Mg2TiO4–Mg2SiO4–MgSiO3–MgTiO3 |
Таблица 5.
Тепловые эффекты и энергии Гиббса реакций для смесей, отвечающих точкам эквивалентности К
| Точка конверсии | ${{\Delta }_{r}}H_{{298}}^{^\circ }$, кДж | ${{\Delta }_{r}}G_{{298}}^{^\circ }$, кДж |
|---|---|---|
| К1 | +17.853 | +15.179 |
| К2 | +28.150 | +0.581 |
| К3 | –9.946 | –10.452 |
| К4 | –2.033 | –5.725 |
| К5 | +10.960 | +2.648 |
| К6 | –55.880 | –52.024 |
| К7 | –93.907 | –88.869 |
| К8 | –166.760 | –133.944 |
| К9 | –76.830 | –68.546 |
| К10 | +12.999 | +8.873 |
| К11 | –72.793 | –45.075 |
| К12 | –30.896 | –26.974 |
Таблица 6.
Стабильные и нестабильные секущие
| Стабильные секущие | Нестабильные секущие и соотношение веществ |
|---|---|
| TiO2–MgSiO3 (K1, K2, K3) | SiO2–MgTi2O5 |
| SiO2–MgTiO3 | |
| (2) SiO2–Mg2TiO4 | |
| MgSiO3–MgTi2O5 (K4, K5, K6) | (2) TiO2–Mg2SiO4 |
| (2) MgTiO3–SiO2 | |
| (2) Mg2TiO4–(3) SiO2 | |
| MgTi2O5–Mg2SiO4 (K7, K8, K9, K10) | (4) MgTiO3–SiO2 |
| (2) MgTiO3–MgSiO3 | |
| (2) Mg2TiO4–(3) SiO2 | |
| Mg2TiO4–MgSiO3 | |
| MgTiO3–MgSiO4 (K11, K12) | (2) Mg2TiO4–SiO2 |
| Mg2TiO4–MgSiO3 |
Кроме основных реакций в точках эквивалентности К, могут протекать реакции и фазовые превращения после расплавления и кристаллизации смесей из 3…8 соединений. Для их идентификации необходимо применить метод атомного баланса в левой и правой частях уравнений при переборе симплексов [20].
Возьмем исходную смесь оксидов в соотношении 2TiO2 + 3SiO2 + 4MgO и определим, в какой симплекс после расплавления и кристаллизации попадает смесь. Рассмотрим симплекс TiO2–SiO2–MgSiO3 и запишем правую часть уравнения с неизвестными коэффициентами при веществах:
Приравняем число атомов Ti, Si и Mg в левой и правой частях уравнения реакции и составим систему линейных уравнений для определения коэффициентов a, b и с:
Так как b = –1, то смесь после расплавления и кристаллизации не принадлежит фазовому треугольнику TiO2–SiO2–MgSiO3.
Рассмотрим симплекс TiO2–MgSiO3–MgTi2O5 и проведем аналогичное описание:
Отрицательных коэффициентов нет, поэтому уравнение в окончательном виде можно записать как
Проверяем правильность написания по числу атомов кислорода в левой и правой частях уравнения реакции: 14 = 14.
Таким образом, после расплавления и кристаллизации конечная смесь расположена на стабильной секущей MgSiO3–MgTi2O5.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Древо фаз системы позволило провести прогноз кристаллизующихся после расплавления и кристаллизации фаз. Стабильным секущим отвечает несколько нестабильных секущих (табл. 6).
Как видно из табл. 6, стабильной секущей MgTi2O5–Mg2SiO4 отвечают четыре нестабильных секущих. Двум стабильным секущим TiO2–MgSiO3 и MgSiO3–MgTi2O5 отвечают по три нестабильных секущих, а стабильной секущей MgTiO3–MgSiO4 соответствуют две нестабильные секущие.
Как видно из табл. 5 , реакции в смесях, соответствующих точкам эквивалентности K1, K2, K5, K10, практически невозможны, так как для стандартных значений энергии Гиббса ${{\Delta }_{r}}G_{{298}}^{^\circ }$ > 0.
Не все возможные пересечения стабильных и нестабильных секущих могут быть описаны реакциями химического взаимодействия.
Энергия Гиббса ${{\Delta }_{r}}G_{{298}}^{^\circ }$ смесей, отвечающих точкам эквивалетности K1 и K2, больше нуля. Однако, как отмечается в работе [20], секущая TiO2–MgSiO3 является настолько стабильной, что TiO2 и MgSiO3 не реагируют между собой и при давлении 1.5 ГПа. Поэтому при высоких температурах вполне осуществимы реакции для смесей, отвечающих точкам K1 и K2.
Используя метод атомного баланса, можно определять принадлежность сплавов из 3–8 исходных смесей после расплавления и кристаллизации к какому-либо стабильному симплексу системы. Таким образом, показана возможность синтеза стабильного сочетания фаз из исходных соединений.
ЗАКЛЮЧЕНИЕ
Построено фазовое древо системы MgO–SiO2–TiO2, имеющее линейное строение и включающее пять стабильных треугольников, соединяющихся между собой четырьмя стабильными секущими. На основании древа фаз проведен прогноз кристаллизующихся фаз и описаны основные реакции как для точек пересечения стабильных и нестабильных секущих, так и для различных сочетаний исходных веществ методом атомного баланса. Используя данный метод, можно проводить корректировку шихты из оксидов, двойных оксидов при определении смеси после расплавления и кристаллизации в соответствующем стабильном треугольнике.
Список литературы
Ilatovskaia M., Saenko I., Savinykh G. Experimental Study of Phase Equilibria in the Al2O3–MgO–TiO2 System and Thermodynamic Assessment of the Binary MgO–TiO2 system // J. Am. Ceram. Soc. 2018. V. 101. № 11. P. 5198–5218.
Guo C.H., Zhang Y.X. Multicomponent Diffusion in Silicate Melts: SiO2–TiO2–Al2O3–MgO–CaO–Na2O–K2O System // Geochim. Cosmochim. Acta. 2019. V. 259. P. 412–412.
Федоров П.П. Фазовые диаграммы систем дифторида свинца с трифторидами редкоземельных элементов // Журн. неорган. химии. 2021. Т. 66. № 2. С. 250–258. https://doi.org/10.31857/S0044457X21020070
Шестаков В.А., Косяков В.И. Особенности трансформации фазовой диаграммы трехкомпонентной системы со стехиометрическими соединениями при изменении параметров ее состояния // Журн. неорган. химии. 2021. Т. 66. № 3. С. 377–381. https://doi.org/10.31857/S0044457X21030168
Shi J.J., Chen M., Santoso I. 1250°C Liquidus for the CaO–MgO–SiO2–Al2O3–TiO2 System in Air // Ceram. Int. 2020. V. 46. № 2. P. 1545–1550.
Shi J.J., Chen M., Wan X.B. Phase Equilibrium Study of the CaO–SiO2–MgO–Al2O3–TiO2 System at 1300°C and 1400°C in Air // J. Mater. 2020. V. 72. № 9. P. 3204–3212.
Юрченко Д.А., Евстропьев С.К., Шашкин А.В. и др. Модифицирование MgO–Al2O3–TiO2–SiO2 стекла диффузией серебра для формирования люминесцентных молекулярных кластеров // Докл. Рос. акад. наук. Химия, науки о материалах. 2021. Т. 499. № 1. С. 40–44. https://doi.org/10.31857/S2686953521040099
Nurgali N., Sariev O., Mukhambetkaliyev A., Momenov B., Kuandykova A., Abdrashev R. Phase Composition Of Titanium-Containing Raw Materials Depending on its Titanium Oxide Content // Metalurgija (Zagreb, Croatia). 2021. V. 60. № 3–4. P. 374–376.
Алиев А.Р., Ахмедов И.Р., Какагасанов М.Г., Алиев З.А. Состояние кристаллической структуры Li2SO4, предшествующее фазовому переходу I рода // Неорган. материалы. 2020. Т. 56. № 3. С. 278–282. https://doi.org/10.31857/S0002337X20020025
Бушуев Н.Н., Егорова А.Н., Тюльбенджян Г.С. Система KLa(SO4)2–CaSO4 // Неорган. материалы. 2021. Т. 57. № 2. С. 150–153. https://doi.org/10.31857/S0002337X21020044
Гаматаева Е.Ю., Курбанова С.Н., Гасаналиев А.Н. и др. Фазовые равновесия в системе LiCl–LiVO3–V2O5 // Неорган. материалы. 2020. Т. 56. № 2. С. 145–150. https://doi.org/10.31857/S0002337X20020050
Нипан Г.Д., Корнилов Д.Ю. Фазовые равновесия в системе Li2O–Al2O3–Ni–CO–O // Неорган. материалы. 2020. Т. 56. № 8. С. 854–859. https://doi.org/10.31857/S0002337X20070118
Базарова Ж.Г., Логвинова А.В., Базаров Б.Г. Фазообразование в системах Rb2MoO4–R2(MoO4)3–ZR(MoO4)2 (R – Al, Fe, Cr, Y) // Неорган. материалы. 2020. Т. 56. № 12. С. 1350–1355. https://doi.org/10.31857/S0002337X20120040
Вердиев Н.Н., Гаркушин И.К., Бурчаков А.В. Фазовые равновесия в системе NaF–NaCl–NaBr–Na2CrO4 // Неорган. материалы. 2020. Т. 56. № 11. С. 1243–1251. https://doi.org/10.31857/S0002337X20110159
Асадов М.М., Ахмедова Н.А., Мамедова С.Р. и др. Фазовые равновесия и электрические свойства образцов Li2O–B2O3–YB2O3 // Журн. неорган. химии. 2020. Т. 65. № 7. С. 974–981. https://doi.org/10.31857/S0044457X20070016
Огарков А.И., Восков А.Л., Ковалев И.А. и др. Термодинамическое моделирование фазовых равновесий в системе U–Zr–N // Неорган. материалы. 2021. Т. 57. № 8. С. 829–837. https://doi.org/10.31857/S0002337X21080236
Данилушкина Е.Г., Гаркушин И.К., Тарасова Н.С. Исследование фазовых равновесий в трехкомпонентной взаимной системе K+, Ba2+||Br–, ${\text{MoO}}_{4}^{{2 - }}$ // Неорган. материалы. 2021. Т. 57. № 12. С. 1337–1343. https://doi.org/10.31857/S0002337X2112004610.31857/S0002337X21120046
Сухаренко М.А., Гаркушин И.К., Зубкова А.В. Фазовые равновесия в трехкомпонентной взаимной системе Na+, Ba2+||Br–,${\text{SO}}_{4}^{{2 - }}$ // Неорган. материалы. 2021. Т. 57. № 8. С. 852–860. https://doi.org/10.31857/S0002337X2108030310.31857/S0002337X21080303
Нипан Г.Д. Фазовые равновесия в системе Cd–Ga–As–Te // Неорган. материалы. 2021. Т. 57. № 12. С. 1281–1285. https://doi.org/10.31857/S0002337X21120125
Бережной А.С. Многокомпонентные системы окислов. Киев: Наук. думка, 1970. 544 с.
Термические константы веществ. База данных / Институт теплофизики экстремальных состояний Объединенного института высоких температур РАН, Химический факультет МГУ им. М.В. Ломоносова. http://www.chem.msu.su/cgi-bin/tkv.pl?show=welcom.html (дата обращения: 06.06.2022).
Радищев В.П. Многокомпонентные системы / Под ред. Перельман Ф.М. М.: ИОНХ АН СССР, 1964. 502 с.
Сечной А.И., Гаркушин И.К. Фазовый комплекс многокомпонентных систем и химическое взаимодействие. Самара: СамГТУ, 1999. 116 с.
Сечной А.И. Моделирование равновесного состояния смесей фаз многокомпонентных физико-химических систем: автореф. дис. ... докт. хим. наук. Новосибирск. 2003. 39 с.
Афиногенов Ю.П., Гончаров Е.Г., Семенова Г.В., Зломанов В.П. Физико-химический анализ многокомпонентных систем. М.: МФТИ, 2006. 332 с.
Garkushin I.K., Lavrenteva O.V., Shterenberga A.M. Forecast of Crystallizing Phases and Description of the Chemical Interaction in the Al2O3–TiO2–MgO System // Glass Phys. Chem. 2021. V. 47. № 6. P. 622–629.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы