Неорганические материалы, 2022, T. 58, № 12, стр. 1396-1403
Получение порошка гидроксиапатита повышенной текучести
И. А. Бородулина 1, *, Н. В. Булина 1, С. В. Макарова 1
1 Институт химии твердого тела и механохимии СО Российской академии наук
630090 Новосибирск, ул. Кутателадзе, 18, Россия
* E-mail: borodulina@solid.nsc.ru
Поступила в редакцию 04.05.2022
После доработки 14.09.2022
Принята к публикации 19.09.2022
- EDN: BUCEAD
- DOI: 10.31857/S0002337X22120041
Аннотация
Статья посвящена разработке простого способа получения порошка кристаллического гидроксиапатита кальция с повышенной текучестью, пригодного для плазменного напыления, а также для 3D-печати керамических биорезорбируемых имплантатов. Показано, что частицы размером менее 15 мкм оказывают влияние на текучесть порошка гидроксиапатита. Обнаружено, что, используя методику, включающую процедуры измельчения, обжига и отсева мелкой фракции мокро-сухим способом, можно получить порошок с текучестью 57.1 с/50 г размерного диапазона 40–90 мкм.
ВВЕДЕНИЕ
Гидроксиапатит (ГАП), имеющий химическую формулу Ca10(PO4)6(OH)2, является структурным аналогом минеральной составляющей костного вещества, имеет сходные физические и механические свойства, обладает уникальной биологической совместимостью и способностью активно стимулировать размножение клеток соединительной ткани и новообразование костной ткани, что указывает на большие потенциальные возможности применения ГАП в медицине. На сегодняшний день ГАП используется для изготовления биосовместимой керамики и биопокрытий инертных металлических имплантатов, в качестве лекарственных, косметических и стоматологических средств [1–6].
К сожалению, установленные протезы и зубные имплантаты приходится периодически заменять, как правило, по причине недостаточного формирования кости вокруг имплантата, особенно у пациентов с остеопорозом или инфекцией [7–11].
Синтетические материалы для костных имплантатов должны обладать определенными поверхностными и объемными характеристиками, чтобы соответствовать требованиям биосовместимости и механических свойств для данного применения. Костные и зубные имплантаты для несущих нагрузок обычно изготавливаются из металлов или сплавов (титан, сплавы Ti-6Al-4V, нержавеющая сталь) [12]. Поверхностная модификация металлических имплантатов является эффективной стратегией ускорения заживления кости в ранние периоды имплантации. Разработаны различные типы покрытий для повышения биосовместимости и остеокондуктивности металлических имплантатов. Покрытие слоем ГАП является одним из жизнеспособных решений благодаря превосходной биосовместимости, биоактивности и остеокондуктивным свойствам [13].
Среди большого разнообразия методов получения ГАП-покрытий [13] наибольшее распространение имеют технологии плазменного напыления [14] в связи с высокой доступностью данного оборудования в промышленности [13]. Химический и фазовый составы покрытия, получаемого при плазменном напылении порошка ГАП, зависят от параметров напыления, термической стабильности и фракционного состава напыляемого материала.
Авторы [15] путем проведения анализа структуры порошков ГАП различного фракционного состава после нахождения в плазменной струе установили, что частицы диаметром менее 30 мкм расплавляются полностью и имеют аморфную структуру, а частицы диаметром 55 мкм и более имеют наряду с расплавом кристаллическое ядро, соответствующее структуре ГАП. Известно, что аморфные фосфаты кальция имеют более высокую скорость растворения [16], что приводит к быстрой деградации полученного биопокрытия. Следовательно, при получении биопокрытий на основе ГАП методом плазменного напыления необходимо использовать частицы размером более 50 мкм, позволяющие сохранять исходную кристаллическую структуру вещества. Авторы [17] исследовали микроструктуру покрытий, полученных плазменным напылением порошков ГАП с различным распределением частиц по размерам (от 1 до 180 мкм) на титановые подложки, и установили, что, несмотря на высокую кристалличность покрытий, образованных из крупных частиц ГАП размером более 125 мкм, происходит их быстрая деградация при погружении в деионизированную воду, обуславливающая высокую пористость.
В последнее десятилетие активно развивается направление 3D-печати керамических имплантатов, позволяющее создавать изделия сложной формы [18], в т.ч. из порошкового материала [19, 20]. В работе [21] сообщается, что для 3D-печати керамических изделий путем лазерной обработки порошкового слоя рекомендуется использовать частицы размером более 20 мкм. Верхняя граница размера определяется толщиной создаваемого при печати слоя. Необходимость удаления высокодисперсных и мелких фракций применительно к технологии 3D-печати объясняется тем, что их присутствие в массе порошка из-за наличия адгезии приводит к агломерации частиц, что существенно ухудшает технологический процесс создания изделия. Кроме того, для данного способа печати важным параметром является текучесть порошка [19]. Чем выше текучесть, тем ровнее насыпной слой, подготавливаемый для лазерной обработки.
Текучесть порошков – комплексная реологическая характеристика, которая зависит от плотности, гранулометрического состава, формы частиц, а также состояния их поверхности. Определяющими являются силы трения и сцепления частиц между собой (адгезии), затрудняющие течение порошков [22]. Для частиц порошка размером более 15–20 мкм силы адгезии малы в сравнении с гравитационными силами, которые отделяют частицы друг от друга. У высокодисперсных и мелких фракций порошков силы адгезии начинают превалировать, поэтому данные фракции обладают низкой текучестью [23, 24]. Присутствующие в массе порошка мелкие частицы из-за высокой удельной поверхности способствуют увеличению контакта между ними и внутреннего трения, образованию более рыхлой структуры, в результате чего снижается насыпная плотность порошка, ухудшается его текучесть.
Из приведенных данных следует, что и для изготовления ГАП-покрытий плазменным напылением, и для печати 3D-изделий из порошка ГАП важным фактором является фракционный состав исходного порошка.
Традиционно ГАП получают химическим осаждением из растворов прекурсоров, содержащих фосфат-ионы и ионы кальция, при постоянном контроле рН. При данном способе синтеза формируются наноразмерные частицы с низкой степенью кристалличности [25]. Дальнейшее применение такого нанопорошка, склонного к агломерации и комкованию, затруднительно. Для предотвращения агрегации частиц ГАП, полученных осаждением, можно модифицировать поверхность, например, посредством катионного ПАВ [26]. Однако данная методика не всегда приемлема, т.к. в этом случае появляется необходимость удаления ПАВ в процессе изготовления изделия из ГАП, поэтому, как правило, проводятся простые процедуры дополнительной термообработки для укрупнения частиц синтезированного материала. Например, в работе [27] порошок ГАП, осажденный при контролируемом значении рН, после отмывки от маточного раствора сушат, затем обжигают при температуре 600°С и получают частицы ГАП размером 20–60 мкм. В работе [28] для получения частиц ГАП, обладающих текучестью, после процедур синтеза (старение, промывание, сушка до влагосодержания 1–2 мас. %) проводят дополнительное измельчение, обкатку и обжиг. Именно проведение обкатки порошка на сите, как утверждают авторы [28], позволяет получить порошок ГАП с размером частиц 63–80 мкм и текучестью 74–78 с/50 г.
Для получения частиц порошка с высокой текучестью используют также процедуру распылительной сушки с последующей термообработкой [29, 30]. В результате получается достаточно широкое распределение по размерам частиц, что приводит к необходимости рассева с целью получения узкой размерной фракции.
Целью данной работы была разработка простого способа получения порошка ГАП с узким распределением частиц по размерам, пригодного для дальнейшего применения в изготовлении покрытий и трехмерных изделий методами, использующими в качестве исходного сырья текучие порошки определенного размерного диапазона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сырья использовали ГАП, синтезированный механохимическим способом [31, способ 5]. Данный способ включает в себя обработку смеси гидроортофосфата кальция и отожженного оксида кальция в стехиометрии ГАП в планетарной шаровой мельнице АГО-3 при вращении барабанов со скоростью 1200 об./мин. Время обработки составляет 20 мин. В результате синтеза получается однофазный продукт в мелкодисперсном состоянии.
Синтезированный ГАП измельчался в механической ступке до получения порошка с преимущественным размером частиц не более 90 мкм, затем обжигался в высокотемпературной печи ПВК-1,6-5 при 1200°С в атмосфере воздуха в течение 1 ч для повышения плотности частиц. После естественного остывания продукта в печи проводился отсев мелкой фракции на сите с размером ячеек 40 мкм тремя способами: сухим, мокрым и комбинированным мокро-сухим. Фракционирование порошка проводили по ГОСТ 18318-94 для сухого способа и до чистых промывных вод для мокрого способа.
Рентгенограммы полученных образцов регистрировали на дифрактометре Bruker D8 Advance с использованием CuKα-излучения, диапазон съемки 2θ = 10°–70° с шагом 0.02° и временем накопления 35 с.
Морфологию частиц исследовали с помощью растрового электронного микроскопа (РЭМ) Hitachi TM-1000.
Гранулометрический состав определяли с помощью метода лазерного светорассеяния при использовании прибора “Микросайзер 201А”.
Удельную поверхность (Sуд) измеряли на приборе “Сорбтометр-М” с использованием многоточечного метода БЭТ и азота в качестве газа-адсорбата.
Текучесть определяли по ISO 4490:2018(E) посредством калиброванной воронки Холла. Анализировался порошок массой 50.000 ± 0.001 г, время истечения порошка измерялось секундомером с точностью ±0.1 с. Для измерений использовалась стальная воронка с диаметром выходного отверстия 2.5 мм. За результат принималось среднее арифметическое из пяти измерений.
Насыпную плотность определяли по ГОСТ 19440-94. Использовалась стальная воронка, зафиксированная на высоте отверстия 25 мм от верхнего края цилиндрической емкости вместимостью 25 ± 0.05 см3 и внутренним диаметром 30 ± 1 мм. Насыпную плотность вычисляли по формуле ρнас = m/V, где m – масса испытуемого порошка в емкости, V – объем емкости. За результат принималось среднее арифметическое из пяти определений.
Для определения пикнометрической плотности использовался гелиевый пикнометр Ultrapyc 1200e. Измерения проводились при температуре 20.2°С с использованием газообразного гелия с объемной долей не менее 99.99%.
Микротвердость по Виккерсу измеряли с помощью прибора DuraScan-50 при нагрузке 0.02 Н и времени выдержки 10 с. Для образца делали 50 отпечатков.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно данным рентгенофазового анализа, синтезированный продукт представляет собой ГАП, рентгенограмма которого идентична приведенной в базе данных PDF-2 за номером 72-1243, без примеси исходных компонентов и других фаз (рис. 1). Продукт обладает удельной поверхностью 53 м2/г и насыпной плотностью 0.54 г/см3.
Рис. 1.
Рентгенограммы механохимически синтезированного ГАП до (2) и после обжига при температуре 1200°С (3) в сравнении с рентгенограммой ГАП, приведенной в базе данных порошковых рентгенограмм PDF-2 № 72-1243 (1).

Выбор температуры обжига порошка определялся исходя из следующих положений. Более высокая температура обжига нецелесообразна, т.к. она способствует накоплению микродеформаций в структуре ГАП и появлению продуктов разложения [32]. Уменьшение температуры обжига приведет к формированию менее плотных частиц, т.к. максимальная усадка материала наблюдается при 1200°С [33]. Использование частиц с низкой плотностью в дальнейших технологических процессах приводит к низкой эффективности массопереноса вещества (уменьшается плотность потока массы вещества). Снижение температуры обжига влечет за собой также увеличение содержания мелкой фракции в массе порошка, что усложняет процесс отсева. К примеру, в массе порошка ГАП, обожженного при 1000°С, содержание фракции до 15 мкм составляет 40% против 30% в случае обжига при 1200°С.
Используемый в работе ГАП после измельчения и обжига при 1200°С представляет собой агломераты частиц с достаточно широким распределением по размерам (рис. 2). Присутствуют частицы от 1 до 130 мкм (рис. 3). Высокотемпературный обжиг порошка ГАП приводит к снижению удельной поверхности материала с 53 до 3.1 м2/г за счет снижения пористости частиц и к росту насыпной плотности с 0.54 до 0.80 г/см3, однако данный порошок обладает нулевой текучестью.
Рис. 3.
Весовое содержание и массовая доля частиц исходного порошка ГАП в зависимости от их размера.
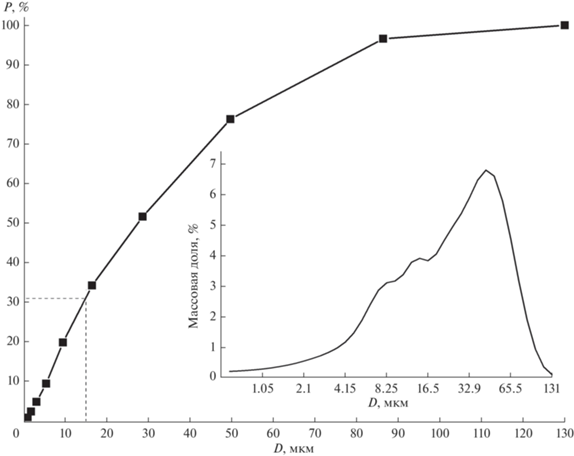
В наших исследованиях особое внимание уделялось тому, чтобы в целях получения порошка ГАП, обладающего текучестью, найти продуктивный способ освобождения порошка от фракции менее 15 мкм, т.к. содержание этой фракции в массе порошка во многом определяет его реологические характеристики и состав получаемого изделия, о чем сообщалось выше. Из рис. 3 видно, что частиц с размером менее 15 мкм в порошке присутствует около 30%.
Освобождение порошка ГАП от мелкой фракции проводилось с использованием сита с размером ячейки 40 мкм тремя способами: сухим, мокрым и комбинированным мокро-сухим. Исследования гранулометрического состава порошков, полученных тремя способами фракционирования, показали, что содержание в них частиц менее 15 мкм уменьшается при переходе от сухого способа к комбинированному мокро-сухому от 14 до 3.5% (рис. 4, табл. 1). Эти данные подтверждаются также результатами РЭМ-исследований порошков, полученных тремя способами отсева мелкой фракции. На рис. 5 видно, что при сухом методе присутствует еще довольно много мелких частиц (рис. 5а), которые могут негативно влиять на текучесть порошка. При мокром способе отдельно лежащие мелкие частицы не наблюдаются, однако они присутствуют на поверхности других частиц (рис. 5б). После комбинированного способа частицы микронного размера практически отсутствуют даже на поверхности более крупных частиц (рис. 5в, 5г). Микрофотографии образцов ГАП, полученных разными способами удаления мелкой фракции, свидетельствуют о том, что во всех случаях частицы имеют преимущественно осколочную форму, совпадающую с формой исходных частиц, которые не обладают текучестью.
Рис. 4.
Весовое содержание частиц порошка ГАП в зависимости от их размера после процедуры отсева: 1 – сухой, 2 – мокрый, 3 – мокро-сухой.
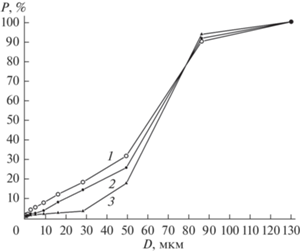
Таблица 1.
Характеристики порошка ГАП до и после отсева мелкой фракции
| Способ отсева | Без отсева (исходный) | Сухой | Мокрый | Мокро-сухой |
|---|---|---|---|---|
| Содержание фракции до 15 мкм, мас. % | 32 ± 2 | 14 ± 2 | 8 ± 1 | 3.5 ± 0.5 |
| Текучесть, с/50 г | Не течет | 71.9 ± 0.3 | 60.6 ± 0.1 | 57.1 ± 0.1 |
| Sуд, м2/г | 3.1 ± 0.2 | 0.28 ± 0.02 | 0.24 ± 0.01 | 0.21 ± 0.01 |
| ρнас, г/см3 | 0.799 ± 0.008 | 1.31 ± 0.01 | 1.35 ± 0.01 | 1.38 ± 0.01 |
| Время рассева 50 г, ч | – | 1 | 0.3 | 0.5 |
Рис. 5.
РЭМ-изображения частиц образцов ГАП при разных способах отсева мелкой фракции: сухой (а), мокрый (б) и мокро-сухой (в, г).

Из табл. 1 видно, что с уменьшением количества фракции менее 15 мкм увеличиваются текучесть порошка и насыпная плотность, снижается удельная поверхность. Наилучшие параметры наблюдаются для комбинированного способа рассева: текучесть – 57.1 с/50 г, удельная поверхность – 0.21 м2/г, насыпная плотность – 1.38 г/см3. Однако с точки зрения длительности процесса наиболее быстрым способом является процедура мокрого рассева.
Проведенные испытания текучести порошков ГАП, полученных разными способами фракционирования, показали, что показатель текучести порошка находится в прямой зависимости от содержания частиц с размером менее 15 мкм. С уменьшением содержания таких частиц в массе порошка возрастает его подвижность, улучшается текучесть.
Применение мокрого способа отсева мелкой фракции из массы порошка ГАП позволяет существенно сократить время фракционирования и более качественно удалить мелкую фракцию, а следовательно, улучшить текучесть и увеличить насыпную плотность порошка. Стадия последующего сухого отсева за небольшое дополнительное время дает возможность улучшить показатели текучести.
Для образца с наибольшей текучестью (мокро-сухой способ) были измерены пикнометрическая плотность и микротвердость. Значение пикнометрической плотности составило 3.1223 ± 0.0005 г/см3, что близко к теоретической плотности ГАП – 3.15 г/см3 [34]. Микротвердость частиц составила 5.10 ± 0.16 ГПа, что также близко к значению, полученному для спрессованного образца – 6 ГПа [35]. Использование образцов со столь высокими характеристиками позволит осуществлять эффективный массоперенос вещества в процедурах напыления и делает частицы более стойкими к истиранию и внешнему воздействию. Высокая пикнометрическая плотность порошка, обладающего повышенной текучестью, позволяет создать более плотный слой спекаемого/сплавляемого материала при печати 3D-изделий.
Изменение размера ячейки используемых сит влияет на фракционный состав получаемого порошка. Варьируя наборами сит при первичном и вторичном рассевах, взяв за основу предлагаемую методику, можно получать различные фракции порошков с размером частиц в диапазоне 15–500 мкм.
ЗАКЛЮЧЕНИЕ
С целью получения порошка ГАП с повышенной текучестью и узким распределением частиц по размерам были исследованы три образца, полученных разными способами удаления частиц размером менее 15 мкм путем отсева. В результате проведенных исследований показано, что показатель текучести порошков напрямую зависит от содержания в них фракции частиц менее 15 мкм. Наиболее эффективным способом удаления мелкой фракции является мокро-сухой рассев.
Разработана методика получения порошка ГАП с фракцией 40–90 мкм с высоким показателем текучести. Методика включает в себя процедуры измельчения, обжига и отсева мелкой фракции. Наилучший показатель текучести достигнут при применении мокро-сухого способа отсева – 57.1 с/50 г. Данная методика приготовления является наиболее быстрой из рассматриваемых и может применяться для получения различных фракций текучих частиц апатита в диапазоне 15–500 мкм.
Список литературы
Pokhrel S. Hydroxyapatite: Preparation, Properties and Its Biomedical Applications // Adv. Chem. Eng. Sci. 2018. V. 8. № 4. P. 225–240. https://doi.org/10.4236/aces.2018.84016
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. 2-е изд. М.: Наука, 2014. 201 с.
Mucalo M.R. Hydroxyapatite (HAp) for Biomedical Applications. Cambridge: Woodhead, 2015. 404 p.
Папынов Е.К., Шичалин О.О., Буравлев И.Ю., Портнягин А.С., Белов А.А., Майоров В.Ю., Скурихина Ю.Е., Меркулов Е.Б., Главинская В.О., Номеровский А.Д., Голуб А.В., Шапкин Н.П. Реакционный искровой плазменный синтез пористого биокерамического волластонита // Журн. неорган. химии. 2020. Т. 65. № 2. С. 261–270. https://doi.org/10.31857/S0044457X20020130
Крохичева П.А., Гольдберг М.А., Хайрутдинова Д.Р., Антонова О.С., Ахмедова С.А., Кирсанова В.А., Свиридова И.К., Сергеева Н.С., Леонов А.В., Баикин А.С., Смирнов И.В., Баринов С.М., Комлев В.С. Костные цементы на основе струвита: влияние введения ванкомицина, оценка биосовместимости и остеокондуктивных потенций in vivo // Журн. неорган. химии. 2021. Т. 66. № 8. С. 964–976. https://doi.org/10.31857/S0044457X21080110
Трубицын М.А., Хунг Хоанг Вьет, Фурда Л.В., Тхам Хонг Нгуен Тхи. Исследование влияния мольных отношений в кристаллохимической структуре биомиметического наноструктурного гидроксиапатита на характеристики синтезированного продукта // Журн. неорган. химии. 2021. Т. 66. № 5. С. 601–609. https://doi.org/10.31857/S0044457X21050214
Tomsia A.P., Launey M.E., Lee J. S., Mankani M.H., Wegst U.G.K., Saiz E. Nanotechnology Approaches for Better Dental Implants // Int. J. Oral Maxillofac. Implants. 2011. V. 26. Suppl. P. 25–49.
Christenson E.M., Anseth K.S., van der Beucken J.J.J.P., Chan C.K., Ercan B., Jansen J.A., Laurenin C.T., Li W.J., Murugan R., Nair L.S., Ramakrishna S., Tuan R.S., Webster T.J., Mikos A.G. Nanobiomaterial Applications in Orthopedics // J. Orthop. Res. 2007. V. 25. № 1. P. 11–22. https://doi.org/10.1002/jor.20305
Fini M., Giavaresi G., Torricelli P., Borsari V., Giardino R., Nicolini A., Carpi A. Osteoporosis and Biomaterial Osteointegration // Biomed. Pharmacother. 2004. V. 58. № 9. P. 487–493. https://doi.org/10.1016/j.biopha.2004.08.016
Franchi M., Fini M., Martini D., Orsini E., Leonardi L., Ruggeri A., Giavaresi G., Ottani V. Biological Fixation of Endosseous Implants // Micron. 2005. V. 36. № 7–8. P. 665–671. https://doi.org/10.1016/j.micron.2005.05.010
Campoccia D., Montanaro L., Arciola C.R. The Significance of Infection Related to Orthopedic Devices and Issues of Antibiotic Resistance // Biomaterials. 2006. V. 27. № 11. P. 2331–2339. https://doi.org/10.1016/j.biomaterials.2005.11.044
Navarro M., Michiardi A., Castano O., Planell J.A. Biomaterials in Orthopaedics // J. R. Soc. Interface. 2008. V. 5. № 27. P. 1137–1158. https://doi.org/10.1098/rsif.2008.0151
Dorozhkin S.V. Calcium Orthophosphate Deposits: Preparation, Properties and Biomedical Applications // Mater. Sci. Eng., C. 2015. V. 55. P. 272–326. https://doi.org/10.1016/j.msec.2015.05.033
Булина Н.В., Титков А.И., Исаев Д.Д., Макарова С.В., Баев С.Г., Воробьев А.М., Бессмельцев В.П., Ляхов Н.З. Селективное лазерное плавление Zn–Si-замещeнного гидроксиапатита // Изв. АН. Сер. хим. 2021. № 9. С. 1682–1689.
Cheang P., Khor K.A. Thermal Spraying of Hydroxyapatite (HA) Coatings: Effects of Powder Feedstock // J. Mater. Process. Technol. 1995. V. 48. № 1–4. P. 429–436. https://doi.org/10.1016/0924-0136(94)01679-U
Dorozhkin S.V. Bioceramics of Calcium Orthophosphates // Biomaterials. 2010. V. 31. № 7. P. 1465–1485. https://doi.org/10.1016/j.biomaterials.2009.11.050
Tong W., Chen J., Li X., Cao Y., Yang Z., Feng J., Zhang X. Effect of Particle Size on Molten States of Starting Powder and Degradation of the Relevant Plasma-Sprayed Hydroxyapatite Coatings // Biomaterials. 1996. V. 17. № 15. P. 1507–1513. https://doi.org/10.1016/0142-9612(96)89775-4
Chen Z., Sun X., Shang Y., Xiong K., Xu Z., Guo R., Cai S., Zheng C. Dense Ceramics with Complex Shape Fabricated by 3D Printing: A Review // J. Adv. Ceram. 2021. V. 10. № 2. P. 195–218. https://doi.org/10.1007/s40145-020-0444z
Grossin D., Montόn A., Navarrete-Segado P., Özmen E., Urruth G., Maury F., Maury D., Frances C., Tourbin M., Lenormand P., Bertrand G. A Review of Additive Manufacturing of Ceramics by Powder Bed Selective Laser Processing (Sintering/Melting): Calcium Phosphate, Silicon Carbide, Zirconia, Alumina, and Their Composites // Open Ceram. 2021. V. 5. P. 100073. https://doi.org/10.1016/j.oceram.2021.100073
Kamboj N., Ressler A., Hussainova I. Bioactive Ceramic Scaffolds for Bone Tissue Engineering by Powder Bed Selective Laser Processing: A Review // Materials. 2021. V. 14. № 18. P. 5338. https://doi.org/10.3390/ma14185338
Navarrete-Segado P., Frances C., Grossin D., Tourbin M. Tailoring Hydroxyapatite Microspheres by Spray-Drying for Powder Bed Fusion Feedstock // Powder Technol. 2022. V. 398. P. 117116. https://doi.org/10.1016/j.powtec.2022.117116
Урьев Н.Б. Высококонцентрированные дисперсные системы. М.: Химия, 1980. 320 с.
Князев А.Е., Востриков А.В. Рассев порошков в аддитивном и гранульном производствах (обзор) // Тр. ВИАМ. 2020. № 11 (93). С. 11–20.
Борисов Ю.С., Борисова А.Л., Туник А.Ю., Карпец М.В., Бобрик В.Г., Войнарович С.Г., Кузьмич-Янчук Е.К. Структура и свойства порошков для получения биокерамических покрытий способом плазменного напыления // Автоматическая сварка. 2007. № 4. С. 12–16.
Sadat-Shojai M., Khorasani M.T., Dinpanah-Khoshdargi E., Jamshidi A. Synthesis Methods for Nanosized Hydroxyapatite with Diverse Structures // Acta Biomater. 2013. V. 9. № 8. P. 7591–7621. https://doi.org/10.1016/j.actbio.2013.04.012
Каракатенко Е.Ю., Хайруллин А.И., Иванов П.И., Королева М.Ю. Получение наноструктур гидроксиапатита, обладающих высокой удельной поверхностью // Успехи в химии и химической технологии. 2017. Т. 31. № 13. С. 34–36.
Рычков В.Н., Машковцев М.А., Алешин Д.К. и др. Способ получения гранулированных частиц гидроксиапатита: Патент РФ № 2717275 С2. опубл. 19.03.20.
Дубок В.А., Ульянчич Н.В., Крючков Ю.Н. Способ получения порошка гидроксиапатита для плазменного напыления: Патент UA 19491A. опубл. 25.12.1997.
Kweh S.W.K., Khor K.A., Cheang P. The Production and Characterization of Hydroxyapatite (HA) Powders // J. Mater. Process. Technol. 1999. V. 89–90. P. 373–377. https://doi.org/10.1016/S0924-0136(99)00061-8
Bastan F.E., Rehman M.A.U., Ustel F. Thermo-Physical Insights into a Series of Strontium Substituted Hydroxyapatite // Mater. Chem. Phys. 2021. V. 258. P. 123910. https://doi.org/10.1016/j.matchemphys.2020.123910
Chaikina M.V., Bulina N.V., Vinokurova O.V., Prosanov I.Yu. Dudina D.V. Interaction of Calcium Phosphates with Calcium Oxide or Calcium Hydroxide during the “Soft” Mecha-Nochemical Synthesis of Hydroxyapatite // Ceram. Int. 2019. V. 45. № 14. P. 16927–16933. https://doi.org/10.1016/j.ceramint.2019.05.239
Bulina N., Makarova S., Baev S., Matvienko A., Gerasimov K., Logutenko O., Bystrov V. A Study of Thermal Stability of Hydroxyapatite // Minerals. 2021. V. 11. № 12. P. 1310. https://doi.org/10.3390/min11121310
Champion E. Sintering of Calcium Phosphate Bioceramics // Acta Biomater. 2013. V. 9. № 4. P. 5855–5875. https://doi.org/10.1016/j.actbio.2012.11.029
ГОСТ Р ИСО 13175-3-2015. Имплантаты для хирургии. Фосфаты кальция. Ч. 3. Костные заменители на основе гидроксиапатита и бета-трикальций фосфата.
Muralithran G., Ramesh S. The Effects of Sintering Temperature on the Properties of Hydroxyapatite // Ceram. Int. 2000. V. 26. № 2. P. 221–230. https://doi.org/10.1016/S0272-8842(99)00046-2
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы



