Неорганические материалы, 2022, T. 58, № 2, стр. 168-172
Титанат лития-кобальта со структурой шпинели как анодный материал для литий-ионных аккумуляторов
И. В. Мацукевич 1, *, А. И. Кулак 1, **, В. И. Попков 2, В. И. Романовский 1, М. Г. Файед 3, 4, С. Г. Мохаммед 3
1 Институт общей и неорганической химии Национальной академии наук Беларуси
220072 Минск, ул. Сурганова, 9/1, Беларусь
2 Физико-технический институт им. А.Ф. Иоффе Российской академии наук
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
3 Таббинский институт металлургических исследований
11421 Каир, Таббин, 109, Египет
4 Менуфийский университет
11722 Шебин Эль Ком, Египет
* E-mail: irinavas.k1975@gmail.com
** E-mail: kulak@igic.bas-net.by
Поступила в редакцию 22.07.2021
После доработки 23.09.2021
Принята к публикации 27.09.2021
- EDN: KWNXHI
- DOI: 10.31857/S0002337X22010080
Аннотация
Методом самораспространяющегося высокотемпературного синтеза из глицин-цитрат-нитратных смесей получен мезопористый порошок титаната лития-кобальта шпинельной структуры, перспективный в качестве анодного материала для литий-ионных батарей. Изучены кристаллическая структура, фазовый состав, микроструктура и дисперсность титаната лития-кобальта. Результаты исследования электрохимических свойств титаната лития-кобальта показали, что приготовленный электрод на его основе имеет высокую зарядную емкость (более 250 мА ч/г при плотности тока 100 мА/г) – и высокую циклическую стабильность.
ВВЕДЕНИЕ
Титанаты со шпинельной структурой Li2MTi3O8 (M – Со, Сu, Zn и др.) привлекают внимание как анодные материалы для литий-ионных аккумуляторов ввиду их высокой устойчивости к многократным циклам зарядки/разрядки [1–3]. Кристаллическая структура шпинели Li2MTi3O8 кубической сингонии с общей формулой АВ2О4 описывается формулой (Li0.5М0.5)tet[Li0.5Ti1.5]octO4 [4]. Часть ионов лития и ионы металла занимают тетраэдрическое положение, а оставшиеся ионы лития и ионы титана – октаэдрическое. За счет этого формируются “тоннели”, в которые ионы лития интеркалируют при минимальных деформационных изменениях, обуславливая повышенную устойчивость по отношению к процессу образования литиевых дендритов [5]. Особенностью титаната лития-кобальта Li2CoTi3O8 является то, что ионы кобальта в его структуре могут иметь различную степень окисления: 2+, 3+ и 4+, предпочтительно занимая тетраэдрические положения, однако могут занимать и октаэдрические позиции. Такое разупорядочение приводит к увеличению концентрации дефектов, что в свою очередь способствует увеличению проводимости за счет увеличения подвижности носителей заряда.
Для получения титанатов лития в ряде работ используется метод высокотемпературного твердофазного синтеза, обеспечивающий формирование плотной керамики спеканием стехиометрической смеси порошков диоксида титана, карбоната лития с оксидом либо ацетатом цинка (синтез Li2ZnTi3O8 [3, 5–8]), с оксидом либо ацетатом кобальта (синтез Li2CoTi3O8 [9, 10]), с оксидами меди и цинка (синтез Li2CuxZn1– xTi3O8 [11]). Наряду с этим методом для получения титанатов лития с повышенной пористостью и электрохимической активностью для использования в качестве анодного материала литий-ионных источников тока применялся золь–гель-метод [1, 4, 12, 13]. Источником титана в этом методе служили алкоксиды титана – тетрабутоксититан (ТBТ) либо тетра-i-пропоксититан (TТIP), другие металлы вводились в виде ацетатов, причем золь–гель-процесс осуществлялся при минимальном количестве воды [4, 13] либо в этаноле [1, 12]. В неводной среде осуществлялся синтез Li2ZnTi3O8 путем трансформации TTIP в цитратную форму с последующим введением карбоната лития и ацетата цинка и термообработкой при 100°С в этиленгликоле, приводящей к образованию полимерного прекурсора, который затем разлагался при 500–1000°С [14, 15]. Подобный прием трансформации ТBТ в цитратную форму с введением в реакционную смесь нитратов кобальта и лития, а также лимонной кислоты (хелатирующий агент) с последующими упариванием и зажиганием смеси, нагретой до 250°С, был применен для синтеза Li2CoTi3O8 [2].
Использование процессов горения в синтезе сложнооксидных соединений, таких как титанаты лития, открывает дополнительные возможности в обеспечении пористой структуры электродных материалов, снижении продолжительности их синтеза, минимизации использования органических растворителей.
Цель данной работы состояла в получении наноструктурированного порошка титаната лития-кобальта методом самораспространяющегося высокотемпературного синтеза (СВС) из глицин-цитрат-нитратных смесей без предварительного растворения исходных компонентов и исследовании его электрохимических свойств как активного компонента анодного материала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. В качестве исходных материалов были использованы тетрабутоксититан Ti(C4H9O)4, нитраты металлов LiNO3·6H2O (“ч. д. а.”), Со(NO3)2·6H2O (“ч. д. а.”), лимонная кислота C6H8O7 (“х. ч.”), глицин NH2CH2COOH (“ч. д. а.”). Для получения титаната лития-кобальта Li2CoTi3O8 СВС-методом из механических смесей в ступке смешивали предварительно измельченные исходные нитраты, лимонную кислоту и глицин (n(C6H8O7)/ n(NH2CH2COOH) ≈ 1/1). Далее к этой смеси добавляли ТBТ, взятый в стехиометрическом соотношении, и растиранием доводили до однородной массы, которую термообрабатывали на электроплитке при температуре около 200°C. Смесь превращалась в гель, который в какой-то момент начинал гореть, после чего образовывался ксерогель. Температура СВС росла вплоть до 800°С. Финишную термообработку ксерогеля проводили при температуре 1100°С в течение 3 ч.
Характеристика порошка титаната лития-кобальта. Рентгенофазовый анализ (РФА) порошков проводили на дифрактометре Bruker D8 XRD Advance (CuKα-излучение). Теоретическую (рентгеновскую) плотность ρr образцов рассчитывали по формуле ρr = Мz/(VNA), где М – масса формульной единицы вещества, z – число формульных единиц, приходящихся на элементарную ячейку, V – объем элементарной ячейки, NA – число Авогадро.
Микроструктуру порошков исследовали при помощи сканирующего электронного микроскопа Mira Tescan (Чехия) при ускоряющем напряжении 20 кВ. Гранулометрический состав порошков определяли лазерным анализатором размера частиц Analysette 22 compact (Fritsch, Германия). Насыпную плотность измеряли в соответствии с ГОСТ 19440-94.
Адсорбционные свойства образцов оценивали объемным методом на анализаторе площади поверхности и пористости ASAP 2020 МР (Micromeritics, США) из изотерм низкотемпературной (–196°C) физической адсорбции–десорбции азота. Удельную поверхность определяли многоточечным методом Брунауэра–Эммета–Теллера (АБЭТ, м2/г). Удельный объем пор (Vsp des, см3/г), средний диаметр пор (Dsp des, нм) и распределение пор по размерам в линейной форме определяли методом Барретта–Джойнер–Халенды, используя десорбционную ветвь изотермы и модель цилиндрических пор. Перед анализом образцы вакуумировали в течение 1 ч при температуре 200°С и остаточном давлении 133.3 × 10–3 Па.
Исследования электрохимических свойств. Для изготовления катода Li2СоTi3O8, синтезированный CВС-методом из глицин-цитрат-нитратных смесей, смешивали с проводящим материалом Super-P (угольный порошок) и поливинилиденфторидом, растворенным в N-метилл-2-пирролидоне, в массовом соотношении 7 : 2 : 1 до образования гомогенной смеси, которую равномерно наносили на медную фольгу и сушили в течение 12 ч при температуре 80°С. Далее из фольги с нанесенным материалом был изготовлен электрод диаметром 16 мм.
Для измерения электрохимических характеристик в качестве катода были использованы монетные ячейки R2032 с металлическим литием, в качестве электролита использовали 1 М растворы LiPF6 в этиленкарбонате и диметилкарбонате, взятые в объемном соотношении 1 : 1. Электрохимическая ячейка была собрана в перчаточном боксе в атмосфере аргона и выдержана сутки при комнатной температуре. Циклические вольтамперограммы были получены при постоянной скорости развертки потенциала 5 мВ/с в диапазоне потенциалов от 0.01 до 3.0 В. Гальваностатические зарядно-разрядные характеристики исследовались на установке для тестирования химических источников тока NEWARE BTS-4000 при разной плотности тока (100, 200, 500, 1000 мА/г).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После завершающей стадии синтеза при температуре 1100°С титанат лития-кобальта, по результатам РФА (рис. 1), идентифицирован как однофазный сложный оксид со структурой Li2СоTi3O8 [16] с кристаллической решеткой типа шпинели (пр. гр. Р4332). Параметр элементарной ячейки сложного оксида составил 0.8365 нм (табл. 1), что хорошо согласуется с результатами ряда работ [4, 11, 12, 17–20].
Рис. 1.
Рентгеновская дифрактограмма Li2СоTi3O8, полученного СВС-методом из глицин-цитрат-нитратных смесей.
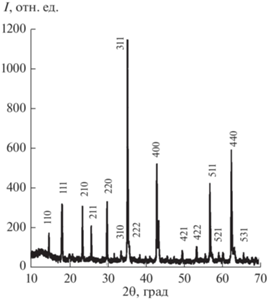
Таблица 1.
Параметры кристаллической решетки (а, V), размеры преобладающей фракции частиц (tpr), удельная поверхность (AБЭТ), общий объeм пор (Vsp des), средний диаметр пор (Dsp des), рентгеновская плотность (ρr, г/см3) и насыпная плотность (ρb, г/см3) Li2СоTi3O8
| a, нм | 0.8365(1) |
| V, нм3 | 0.5852(1) |
| tpr, мкм | 8 |
| AБЭТ, м2/г | 12 |
| Vsp des, см3/г | 0.011 |
| Dsp des, нм | 3.8 |
| ρr, г/см3 | 3.9092 |
| ρb, г/см3 | 0.83 |
Рисунок 2 демонстрирует однородную микроструктуру титаната лития-кобальта с преимущественно равноосными частицами с размерами порядка нескольких микрометров, при этом размеры агломератов (преобладающей фракции частиц) составили около 8 мкм (табл. 1).
Для порошка титаната лития-кобальта, полученного СВС-методом из глицин-цитрат-нитратных смесей, после отжига при 1100°С величина удельной поверхности составила 12 м2/г. Такое значение удельной поверхности в два раза выше, чем полученное в работе [14], авторы которой установили, что после термообработки прекурсоров при 500–600°С и при дальнейшем увеличении температуры отжига значения удельной поверхности практически не изменялись и составляли около 6 м2/г.
Следует отметить, что в результате ранее проведенного сравнительного анализа методов получения титанатов лития со структурой шпинели [21] установлено, что более технологичным методом получения шпинелей Li2СоTi3O8 является СВС-метод из глицин-цитрат-нитратных смесей по сравнению с золь–гель-методом, так как он характеризуется явным преимуществом – отсутствием растворителя – а также позволяет получить более активные порошки с большей удельной поверхностью и меньшей степенью агрегации частиц. Для порошков, полученных золь–гель-методом, спеченные агломераты сложных оксидов значительно превышали размеры зерен порошков Li2СоTi3O8, полученных СВС-методом из глицин-цитрат-нитратных смесей, при этом значения удельной поверхности Li2СоTi3O8, полученного СВС, были в два раза больше, чем для порошка, полученного золь–гель-методом [21].
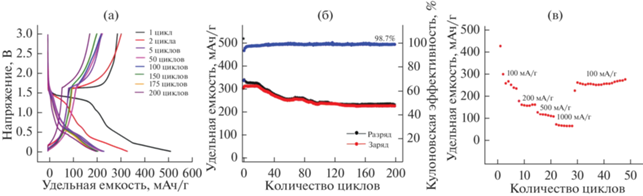
На рис. 3а показаны кривые разряда–заряда электрода, полученного на основе Li2CoTi3O8, при этом его поведение при первом разряде значительно отличается от поведения в последующих циклах и показывает емкость, превышающую 500 мА ч/г, а после многократного циклирования удельная емкость составляет около 200 мА ч/г, что связано с процессами формирования твердоэлектролитной пленки на границе электрод–электролит и восстановлением электролита на первом цикле. Электрод, изготовленный на основе Li2CoTi3O8, показал хорошую стабильность: кулоновская эффективность сохраняет высокое значение (на уровне 98.7%), при этом зарядная и разрядная емкости были примерно одинаковыми – около 250 мА ч/г (рис. 3б). При различных плотностях тока стабильность удельной емкости электрода сохраняется (рис. 3в).
ЗАКЛЮЧЕНИЕ
Разработана методика, позволяющая СВС-методом получить из горючих глицин-цитрат-нитратных смесей стехиометрический однофазный сложный оксид Li2СоTi3O8 со структурой шпинели с развитой микроструктурой и удельной поверхностью 12 м2/г.
Результаты исследований электрохимических свойств титаната лития-кобальта, полученного СВС-методом из глицин-цитрат-нитратных смесей, показали, что приготовленный электрод на основе кобальтсодержащего титаната лития имеет высокую зарядную емкость – более 250 мА ч/г при плотности тока 100 мА/г – и высокую циклическую стабильность.
Список литературы
Wang L., Wua L., Li Z., Lei G., Xiao Q., Zhang P. Synthesis and Electrochemical Properties of Li2ZnTi3O8 Fibers as an Anode Material for Lithium-Ion Batteries // Electrochim. Acta. 2011. V. 56. P. 5343–5346. https://doi.org/10.1016/j.electacta.2011.03.122
Wang J., Zhao H., Shen Y., Du Zh., Chen X., Xia Q. Structure, Stoichiometry, and Electrochemical Performance of Li2CoTi3O8 as an Anode Material for Lithium-Ion Batteries // ChemPlusChem. 2013. V. 78. № 12. P. 1530–1535. https://doi.org/10.1002/cplu.201300235
Tang H., Tang Z. Effect of Different Carbon Sources on Electrochemical Properties of Li2ZnTi3O8/C Anode Material in Lithium-Ion Batteries // J. Alloys Compd. 2014. V. 613. P. 267–274. https://doi.org/10.1016/j.jallcom.2014.06.050
Nikiforova P.A., Stenina I.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. Effect of Particle Size on the Conductive and Electrochemical Properties of Li2ZnTi3O8 // Inorg. Mater. 2016. V. 52. № 11. P. 1137–1142. https://doi.org/10.1134/S002016851611011X
Inamdara A.I., Ahmeda A.T.A., Chavana H.S., Joa Y., Choa S., Kima J., Pawara S.M., Houb B., Chab S.N., Kima H., Ima H. Influence of Operating Temperature on Li2ZnTi3O8 Anode Performance and High-Rate Charging Activity of Li-Ion Battery // Ceram. Int. 2018. V. 44. № 15. P. 18625–18632. https://doi.org/10.1016/j.ceramint.2018.07.087
Sumesh G., Mailadil T.S. Microware Dielectric Properties of Novel Temperature Stable High Q Li2Mg1 –xZnxTi3O8 and Li2A1 – xCaxTi3O8 (A = Mg, Zn) Ceramics // J. Eur. Ceram. Soc. 2010. V. 30. P. 2585–2592. https://doi.org/10.1016/j.jeurceramsoc.2010.05.010
Lu X., Zheng Y., Huang Q., Dong Z. Structural Dependence of Microwave Dielectric Properties of Spinel-Structured Li2ZnTi3O8 Ceramic: Crystal Structure Refinement and Raman Spectroscopy Study // J. Electron. Mater. 2016. V. 45. № 2. P. 940–946. https://doi.org/10.1007/s11664-015-4232-4
Bari M., Taheri-Nassaj E., Taghipour-Armaki H. Phase Evolution, Microstructure, and Microwave Dielectric Properties of Reaction-Sintered Li2ZnTi3O8 Ceramic Obtained Using Nanosized TiO2 Reagent // J. Electron. Mater. 2015. V. 44. № 10. P. 3670–3676. https://doi.org/10.1007/s11664-015-3885-3
Fang L., Chu D., Zhou H., Chen X., Yang Z. Microwave Dielectric Properties and Low-Temperature Sintering Behavior of Li2CoTi3O8 Ceramic // J. Alloys Compd. 2011. V. 509. № 5. P. 18840–18843. https://doi.org/10.1016/j.jallcom.2010.10.078
Reeves N., Pasero D., West A.R. Order–Disorder Transition in the Complex Lithium Spinel Li2CoTi3O8 // J. Solid State Chem. 2007. V. 180. № 6. P. 1894–1901. https://doi.org/10.1016/j.jssc.2007.04.015
Fang L., Liu Q., Tang Y., Zhang H. Adjustable Dielectric Properties of Li2CuxZn1 –xTi3O8 (x = 0 to1) Ceramics with Low Sintering Temperature // Ceram. Int. 2012. V. 38. P. 6431–6434. https://doi.org/10.1016/j.ceramint.2012.05.018
Xu Y., Hong Zh., Xia L., Yang J., Wei M. One Step Sol-Gel Synthesis of Li2ZnTi3O8/C Nanocomposite with Enhanced Lithium-Ion Storage Properties // Electrochim. Acta. 2013. V. 88. P. 74–78. https://doi.org/10.1016/j.electacta.2012.10.044
Стенина А.И., Никифорова А.П., Кулова Л.Т., Скун-дин М.А., Ярославцев Б.А. Электрохимические свойства наноматериалов Li2ZnTi3O8/C // Российские нанотехнологии. 2017. Т. 12. № 2. С. 30–37.
Camara M.S.C., Lisboa-Filho P.N., Cabrelon M.D., Gama L., Ortiz W.A., Paiva-Santos C.O., Leite E.R., Longo E. Synthesis and Characterization of Li2ZnTi3O8 Spinel Using the Modified Polymeric Precursor Method // Mater. Chem. Phys. 2003. V. 82. P. 68–72. https://doi.org/10.1016/S0254-0584(03)00144-5
Camara M.S.C., Gurgel M.F.C., Lazaro S.R., Boschi T.M., Pizani P.S., Leite E.R., Beltran A., Longo E. Room Temperature Photoluminescence of the Li2ZnTi3O8 Spinel: Experimental and Theoretical // Int. J. Quantum Chem. 2005. V. 103. P. 580–587. https://doi.org/10.1002/qua.20549
Powder Diffraction File. Swarthmore: Joint Committee on Powder Diffraction Standard: Card № 00-049-0449.
Wang L., Meng Zh., Wang H., Li X., Zang G. Effects of TiO2 Starting Materials on the Synthesis of Li2ZnTi3O8 for Lithium-Ion Battery Anode // Ceram. Int. 2016. V. 42. P. 16872–16881. https://doi.org/10.1016/j.ceramint.2016.07.184
Li Y., Du Ch., Liu J., Zhang F., Xu Q., Qu D., Zhang X., Tang Zh. Synthesis and Characterization of Li2Zn0.6Cu0.4Ti3O8 Anode Material via a Sol-Gel Method // Electrochim. Acta. 2015. V. 167. P. 201–206. https://doi.org/10.1016/j.electacta.2015.03.138
Liu T., Tang H., Zan L., Tang Zh. Comparative Study of Li2ZnTi3O8 Anode Material with Good High Rate Capacities Prepared by Solid State, Molten Salt and Sol-Gel Methods // J. Electroanal. Chem. 2016. V. 771. P. 10–16. https://doi.org/10.1016/j.jelechem.2016.03.036
Chen W., Du R., Ren W., Liang H., Xu B., Shu J., Wang Zh. Solid-State Synthesis of Li2Co0.5Cu0.5Ti3O8 and Li2CoTi3O8 and Their Comparative Lithium Storage Properties // Ceram. Int. 2014. V. 40. № 8. Part B. P. 13757–13761. https://doi.org/10.1016/j.ceramint.2014.05.083
Мацукевич И.В., Кулак А.И., Полховская О.В., Кулёмин Д.А. Сравнительный анализ получения титанатов лития // Докл. НАН Беларуси. 2020. Т. 64. № 1. С. 42–49. https://doi.org/10.29235/1561-8323-2019-63-6-42-49
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы