Неорганические материалы, 2022, T. 58, № 2, стр. 186-191
Получение дихлорида олова высокой чистоты
М. В. Мастрюков 1, М. Н. Бреховских 1, *, Л. И. Демина 2, Л. В. Моисеева 1, 3, В. А. Федоров 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119991 Москва, Ленинский пр., 31, корп. 4, Россия
3 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: mbrekh@igic.ras.ru
Поступила в редакцию 07.10.2021
После доработки 16.11.2021
Принята к публикации 17.11.2021
- EDN: WLRBVB
- DOI: 10.31857/S0002337X22020105
Аннотация
Получен особо чистый SnCl2 квалификации 99.9985 мас. % из технического металлического олова и газообразного хлороводорода. После очистки синтезированного дихлорида олова на ректификационной колонне при нормальных условиях получены образцы SnCl2 особой чистоты с содержанием примесей менее 10–4 мас. %. Полученные образцы охарактеризованы методами масс-спектрометрии с индуктивно-связанной плазмой, ИК- и КР-спектроскопии, а также РФА.
ВВЕДЕНИЕ
Высокочистый хлорид олова SnCl2 играет важную роль во многих областях науки и техники, в том числе в ядерной медицине [1] и катализе в органической химии [2]. Высокочистый SnCl2 также нашел применение в производстве газовых датчиков в качестве прекурсора при химическом осаждении из паровой фазы полупроводниковых слоев [3]. По технологии, описанной в [3], при испарении хлорида олова SnCl2 происходит его окисление в газовой фазе и осаждение на подложке в виде пленок SnO2. В ядерной медицине SnCl2 используется в качестве восстановителя для маркировки радиофармацевтических препаратов, содержащих 99mTc [4]. Хлорид олова применяется в качестве эффективного катализатора при восстановлении по Стивену, где нитрил восстанавливается до альдимин-станнихлорида, который легко гидролизуется до альдегида [5]. Наиболее перспективной областью применения SnCl2 является солнечная энергетика. Органо-неорганические перовскитные солнечные ячейки на основе свинца состава CH3NH3PbX3 (X = Br, I) и различных его модификаций показывают достаточно высокую эффективность по сравнению с кремниевыми солнечными ячейками [6–9].
Наряду с этим, использование свинцовых ячеек в промышленных масштабах может привести к загрязнению окружающей среды соединениями свинца. Одним из решений данной проблемы является разработка бессвинцовых перовскитов, при этом доступными и безопасными агентами для их получения оказываются галогениды олова особой чистоты [10]. В связи с этим возрастает спрос на галогениды олова высокого качества, в том числе и SnCl2, в рамках не только лабораторного исследования, но и промышленного производства в перспективе. Показано, что эффективность солнечного элемента снижается на 2% с увеличением содержания металлических примесей на 0.7 ppm [11]. Наиболее нежелательными примесями оказываются Ti, Cu, Pb и Fe, наличие которых в SnCl2 одновременно уменьшает ток короткого замыкания (Jsc), напряжение разомкнутой цепи (Voc) и коэффициент заполнения (FF) [11–13].
Существует несколько методов синтеза хлоридов металлов: синтез с использованием хлорирующих агентов [14], синтез из водных растворов солей [15] и синтез путем взаимодействия газообразного хлороводорода с металлами [16].
Цель настоящей работы – получение дихлорида олова и его глубокая очистка методом ректификации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе хлорид олова получен путем взаимодействия газообразного хлороводорода с металлическим оловом [16]:
(1)
${\text{S}}{{{\text{n}}}_{{{\text{мет}}}}} + 2{\text{HCl}} = {\text{SnC}}{{{\text{l}}}_{2}} + {{{\text{H}}}_{2}}.$В качестве исходных компонентов использовали гранулы металлического олова Sn (“ч.”, Lanhit.ltd) и сжиженный хлороводород HCl (марки “О” ТУ 2114-016-56856807-2002). Для синтеза сконструирована установка из кварца “ос. ч.”. Газообразный хлороводород подается через кварцевую трубку в куб, содержащий гранулы металлического олова, который выдерживается при 250°С в течение 4 ч. Так как энтальпия реакции (1) $\Delta Н_{{298}}^{^\circ }$ = –331.01 кДж/моль [17] отрицательна, реакция носит экзотермический характер и протекает с выделением большого количества тепла, во время синтеза необходимо устанавливать дефлегматор, в котором конденсируется образующийся SnCl2. Пары дихлорида олова (tкип = 623°С) конденсируются в дефлегматоре и остаются в замкнутой системе.
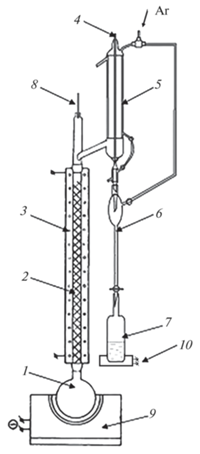
Анализ имеющихся в литературе данных свидетельствует об эффективной очистке летучих галогенидов на колоннах тарельчатого типа [18]. Полученные образцы хлорида олова после синтеза подвергались глубокой очистке на ректификационной установке из кварца “ос. ч.” при н.у. на ситчатой колонне эффективностью 18 теоретических тарелок (рассчитанный диаметр колонны 35 мм, высота 2000 мм) (рис. 1) [19, 20]. При этом к кубу с синтезированным хлоридом олова присоединяли ректификационную цельнопаяную колонну, исключая контакт с атмосферой воздуха путем подачи в систему аргона “ос. ч.”, что позволяет проводить отбор очищенного хлорида олова и запаивать приемник без доступа кислорода и влаги. Температура в кубовой части составляла tкуб = 653°С, температура в колонне контролировалась термометром и не превышала tкол = 624°С. Скорость отбора vотб = 1 мл/мин.
Рис. 1.
Схема установки глубокой очистки хлорида олова: 1 – куб, 2 – ситчатая колонна, 3, 9, 10 – печь сопротивления, 4 – игольчатый вентиль, 5 – холодильник, 6 – кварцевая воронка, 7 – приемник, 8 – термометр.
Примесный состав определяли атомно-эмиссионным методом на спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo (Thermo).
Для определения кислородсодержащих примесей использовали методы ИК- и КР-спектроскопии. Спектры КР регистрировали на спектрометре inViaRenishaw. Возбуждение производили лазерным излучением с длиной волны λ = 33 нм, мощностью <1 мВт с разрешением 2 см–1.
ИК-спектры регистрировали в интервале 4000–400 см–1 на ИК-Фурье-спектрометре NEXUS фирмы Nicolet (однолучевой, сканирующий, светоделитель – CsI, детектор – TGS-CsI, фотометрическая точность 0.1%, разрешение 2 см–1). Образцы готовили в виде суспензии в вазелиновом масле. Измерения проводили при стандартных условиях.
Рентгенограммы образцов были получены при комнатной температуре с использованием дифрактометра BrukerD8 Advance (CuKα-излучение, Ni-фильтр и детектор LYNXEYE) в диапазоне 2θ от 5° до 60° с шагом 0.01°, время накопления 0.3 с/шаг. Для идентификации синтезированного соединения использовали пакет программ DIFFRAC.EVA (Bruker) и Fullprof Suite и базу кристаллографических данных JCPDS.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Можно ожидать, что при воздействии хлористого водорода на металлическое олово примеси металлов, находящиеся в нем, попадут в синтезируемый SnCl2 в виде хлоридов, при этом селективность в процессе хлорирования примесей маловероятна. Результаты по содержанию примесей металлов в SnCl2 после синтеза и после ректификационной очистки представлены в табл. 1. Ректификационная очистка SnCl2 позволяет удалить значительное количество примесей. Труднолетучие примеси элементов концентрируются в кубовом остатке.
Таблица 1.
Результаты определения примесного состава образцов SnCl2
| Примесь | С × 104, мас. % | |||
|---|---|---|---|---|
| после синтеза | основная фракция | головная фракция | кубовый остаток | |
| Al | 12.1 | 1.5 | 8.4 | 2.2 |
| B | 3 | 1 | 1.4 | 1.7 |
| Ba | 2.5 | 0.4 | 0.9 | 1 |
| Ca | 5 | 1.1 | 1.5 | 2.5 |
| Cd | 2.5 | 0.4 | 0.6 | 1.5 |
| Co | 4.5 | 0.4 | 1.6 | 2.5 |
| Cr | 2.1 | 0.1 | 0.4 | 1.5 |
| Cu | 6.4 | 1.3 | 2.6 | 3.4 |
| Fe | 3.4 | 0.7 | 1.3 | 1.4 |
| K | 0.8 | 0.1 | 0.3 | 0.4 |
| Li | 0.7 | 0.1 | 0.2 | 0.5 |
| Mg | 0.6 | 0.2 | 0.2 | 0.2 |
| Mn | 0.3 | 0.1 | 0.1 | 0.1 |
| Na | 1.2 | 0.1 | 0.3 | 0.8 |
| Ni | 2.5 | 0.9 | 0.7 | 0.9 |
| Pb | 11.3 | 0.2 | 1.7 | 9.4 |
| Si | 1.3 | 1.3 | 1.3 | 1.3 |
| Sr | 0.3 | 0.1 | 0.1 | 0.2 |
| Ti | 1.2 | 0.1 | 0.4 | 0.7 |
| V | 1.5 | 0.4 | 0.4 | 0.7 |
| Zn | 0.6 | 0.1 | 0.2 | 0.3 |
Показано, что в результате ректификационной очистки содержание щелочных металлов в образце SnCl2 уменьшилось в ~8 раз, Al – в 8 раз, Cu – в 3.7 раз, а Fe – в 5 раз и Pb – в 56 раз. Содержание остальных металлических примесей находится ниже пределов обнаружения (<0.1 ppm). Таким образом, образцы после ректификационной очистки отвечают квалификации 99.9985%.
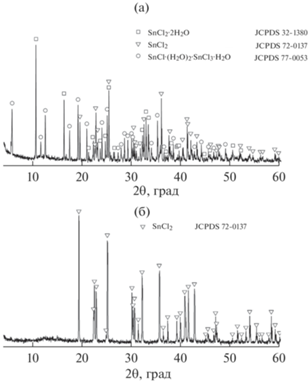
Хлориды олова склонны к гидролизу и образованию кристаллогидратов, поэтому в исходном синтезированном хлориде олова, по данным РФА (рис. 2а), наряду с SnCl2 присутствуют дигидрат SnCl2·2H2O и полуторагидрат SnCl2·1.5H2O, который в [21–23] обозначен как фаза SnCl·(H2O)2· ·SnCl3·H2O. На рис. 2б приведена дифрактограмма образца высокочистого хлорида олова после ректификационной очистки, на которой фазы кристаллогидратов не наблюдаются. Рассчитанные параметры орторомбической ячейки Pmmm равны: a = 9.2063(62) Å, b = 7.7925(23) Å, c = = 4.4277(74) Å и α = β = γ = 90°.
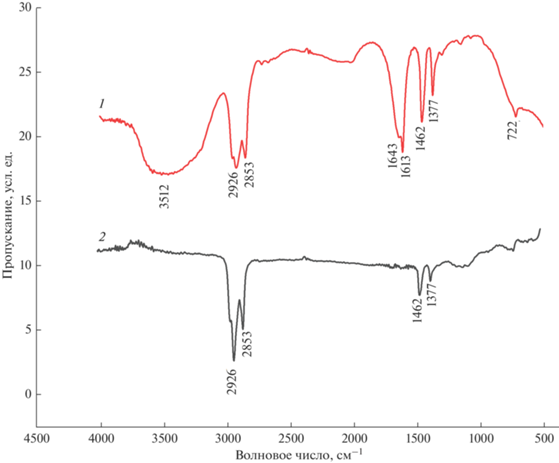
Интересный вывод можно сделать о поведении молекул воды в дихлориде олова из анализа ИК-спектров образцов до (1) и после очистки (2) (рис. 3). В спектре исходного образца (1) регистрируется широкая полоса с частотой 3512 см–1, описывающая валентные колебания ν(OH) молекул воды. Расщепление полосы деформационного колебания δ(HOH) на 1643 и 1613 см–1 свидетельствует о неэквивалентности молекул H2O в составе соединения. Известно, что элементарная ячейка SnCl2·2H2O содержит четыре молекулы пирамидальных комплексов SnCl2(H2O) и координированная молекула воды на вершине каждой пирамиды образует двумерную сеть водородных связей с другой сольватной (некоординированной) молекулой воды [24]. В ИК-спектре очищенного образца (2) полосы, характеризующие колебания молекул воды, как координированных, так и сольватных, связанных водородными связями, отсутствуют. Фиксируются только полосы вазелинового масла: ν(CH2), ν(CH3) 3000–2800 см–1, δ(CH2) 1420, 1380 см–1.
Рис. 3.
ИК-спектры образцов SnCl2 (суспензия в вазелиновом масле) до (1), после очистки ректификационным методом (2).
О дегидратации образца свидетельствует сравнительный анализ спектров КР очищенного дихлорида олова (2) и SnCl2·2H2O (спектр взят из базы данных CAS) (1), представленных на рис. 4. В спектре 1 широкая полоса валентных колебаний ν(OH) молекул воды расположена в диапазоне 3000–3400 см–1, уширенная полоса деформационного колебания δ(HOH) фиксируется при 1670 см–1. Полосы νas(Cl–Sn–Cl), νs(Cl–Sn–Cl) и δ(Cl–Sn–Cl) проявляются на фоне широкой интенсивной полосы в интервале 300–100 см–1. Эта широкая полоса относится к либрационным колебаниям координированных и сольватных молекул воды, образующих водородные связи O–H⋯O в кристаллической решетке SnCl2·2H2O.
Рис. 4.
КР-спектры SnCl2·2H2O из базы данных CAS (1), SnCl2 после очистки на ректификационной колонне (2).
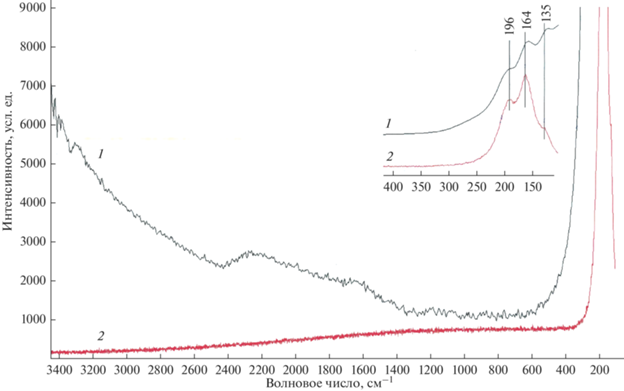
В спектре 2 очищенного образца SnCl2 отсутствуют полосы валентных и деформационных колебаний молекул Н2О и не наблюдается связанного с наличием воды поднятия общего фона спектра в диапазоне 300–100 см–1. Это позволяет более четко зафиксировать (см. вставку к рис. 4) интенсивные полосы 196, 164, 135 см–1, характеризующие колебания νas(Cl–Sn–Cl), νs(Cl–Sn–Cl) и δ(Cl–Sn–Cl) соответственно [24].
ЗАКЛЮЧЕНИЕ
Синтезирован дихлорид олова из элементов в сконструированной установке, исключающей взаимодействие с атмосферой воздуха, с последующей ректификационной очисткой, в результате которой содержание нежелательных металлических примесей снижается в десятки раз. Однофазность синтезированного и очищенного ректификацией образца хлорида олова установлена методом РФА. Обнаружено, что после синтеза SnCl2 образуются примесные кристаллогидраты SnCl2·2H2O и SnCl·(H2O)2·SnCl3·H2O, которые исчезают в процессе ректификационной очистки. Отсутствие гидратов хлорида олова подтверждается ИК- и КР-спектрами очищенного образца. Показано, что с помощью ректификационной очистки зможно получить SnCl2 особой чистоты с содержанием примесей менее 10–4 мас. %.
Список литературы
Cabral R.E., Leitao A.C., Lage C., Caldeira-de-Araujo A., Bernardo-Filho M., Dantas F.J., Cabral-Neto J.B. Mutational Potentiality of Stannous Chloride: an Important Reducing Agent in the Tc-99m-radiopharmaceuticals // Mutat. Res., DNA Repair. 1998. V. 408. №. 2. P. 129–135. https://doi.org/10.1016/S0921-8777(98)00026-3
Mukherjee Singh O., Ronibala Devi L. Stannous Chloride as a Versatile Catalyst in Organic Synthesis // Mini-Rev. Organ. Chem. 2013. V. 10. № 1. P. 84–96. https://doi.org/10.2174/1570193X11310010007
Yadav J.B., Patil R.B., Puri R.K., Puri V. Studies on Undoped SnO2 Thin Film Deposited by Chemical Reactive Evaporation Method // Mater. Sci. Eng.: B. 2007. V. 139. № 1. P. 69–73. https://doi.org/10.1016/j.mseb.2007.01.032
Widyasari E.M., Simarmata M.Y.A., Marzuki M., Sriyani M.E., Sugiharti R.J., Nuraeni W. Preparation of 99m Tc-quercetin as Cancer Radiotracer in Drug Discovery // Rasayan J. Chem. 2019. V. 12. № 1. P. 278–283. https://doi.org/10.31788/RJC.2019.1215052
Wang Hg. Comprehensive Organic Name Reactions. N.Y.: Wiley, 2010. https://doi.org/10.1002/9780470638859
Chen Z. et al. Single-Crystal MAPbI3 Perovskite Solar Cells Exceeding 21% Power Conversion Efficiency // ACS Energy Lett. 2019. V. 4. № 6. P. 1258–1259. https://doi.org/10.1021/acsenergylett.9b00847
Kojima A., Teshima K., Shirai Y., Miyasaka T. Organometal Halide Perovskites as Visible-Light Sensitizers for Photovoltaic Cells // J. Am. Chem. Soc. 2009. V. 131. № 17. P. 6050–6051. https://doi.org/10.1021/ja809598r
Etgar L., Gao P., Xue Z., Peng Q., Chandiran A.K., Liu B., Grätzel M. Mesoscopic CH3NH3PbI3/TiO2 Heterojunction Solar Cells // J. Am. Chem. Soc. 2012. V. 134. P. 17396–17399. https://doi.org/10.1021/ja307789s
Kim H.S., Lee C.R., Im J.H., Lee K.B., Moehl T. Lead Iodide Perovskite Sensitized All-Solid-State Submicron Thin Film Mesoscopic Solar Cell with Efficiency Exceeding 9% // Sci. Rep. 2012. V. 2. № 1. P. 1–7. https://doi.org/10.1038/srep00591
Babayigit A., Ethirajan A., Muller M., Conings B. Toxicity of Organometal Halide Perovskite Solar Cells // Nature Mater. 2016. V. 15. № 3. P. 247–251. https://doi.org/10.1038/nmat4572
Coletti G. Sensitivity of State-of-the-Art and High Efficiency Crystalline Silicon Solar Cells to Metal Impurities // Prog. Photovoltaics. 2013. V. 21. № 5. P. 1163–1170. https://doi.org/10.1002/pip.2195
Hofstetter J., Lelièvre J.F., Del Cañizo C., Luque A.D. Acceptable Contamination Levels in Solar Grade Silicon: From Feedstock to Solar Cell // Mater. Sci. Eng.: B. 2009. V. 159. P. 299–304. https://doi.org/10.1016/j.mseb.2008.05.021
Coletti G., Bronsveld P.C., Hahn G., Warta W., Macdonald D., Ceccaroli B., Wambach K., Quang N.L., Fernandez J.M. Impact of Metal Contamination in Silicon Solar Cells // Adv. Funct. Mater. 2011. V. 21. № 5. P. 879–890. https://doi.org/10.1002/adfm.201000849
Брауэр Г. (ред.). Руководство по неорганическому синтезу / Под ред. Брауэра Г.; пер. с нем. Т. 3. М.: Мир, 1985.
Джолли У. Синтезы неорганических соединений. М.: Мир, 1966. 278 с.
Карякин Ю.В., Ангелов И.И. Чистые химические вещества. М.: Химия, 1974. Т. 408. С. 299.
Lide D.R. CRC Handbook of Chemistry and Physics, 72 ed. Boca Raton: CRC Press, 1992.
Девятых Г.Г., Еллиев Ю.Е. Введение в теорию глубокой очистки веществ. М.: Наука, 1981. 320 с.
Brekhovskikh M.N., Mastryukov M.V., Kornev P.V., Gasanov A.A., Kovalenko A.E., Fedorov V.A. Synthesis and Ultrapurification of Tin Diiodide // Inorg. Mater. 2019. V. 55. № 9. P. 974–978. https://doi.org/10.1134/S0020168519090012
Мастрюков М.В., Демина Л.И., Моисеева Л.В., Солдаткина А.Д., Бреховских М.Н. Синтез и глубокая очистка тетрахлорида олова // Журн. неорган. химии. 2021. Т. 66. № 7. С. 857–862. https://doi.org/10.31857/S0044457X21070072
Pirnat J., Trontelj Z. Two-Dimensional Protonic Conductor SnCl2·1.5H2O–Comparison with SnCl2·2H2O // Solid State Ionics. 1999. V. 125. № 1–4. P. 135–140. https://doi.org/10.1016/S0167-2738(99)00167-8
Pirnat J., Lužnik J., Jagličić Z., Trontelj Z. Dehydration of Solid SnCl2 (OH2)·H2O to SnCl2 // Z. Naturforsch. A. 1994. V. 49. № 1–2. P. 367–372. https://doi.org/10.1515/zna-1994-1-254
Pirnat J., Lužnik J., Trontelj Z., Kaučič V. Chlorine NQR of Single Crystals SnCl2⋅xH2O (x = 1.5, 2): The Evidence for the Existence of Hydrate with x = 1.5 // J. Chem. Phys. 1982. V. 76. № 5. P. 2585–2590. https://doi.org/10.1063/1.443236
Trujillo S.A., Peña-Solórzano D., Bejarano O.R., Ochoa-Puentes C. Tin (II) Chloride Dihydrate/Choline Chloride Deep Eutectic Solvent: Redox Properties in the Fast Synthesis of N-arylacetamides and Indolo (pyrrolo)[1, 2-a] quinoxalines // RSC Adv. 2020. V. 10. № 66. P. 40552–40561. https://doi.org/10.1039/D0RA06871C
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы