Неорганические материалы, 2022, T. 58, № 2, стр. 181-185
Теплоемкость и термическое расширение гафната празеодима
А. В. Гуськов 1, *, П. Г. Гагарин 1, В. Н. Гуськов 1, А. В. Хорошилов 1, К. С. Гавричев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
* E-mail: a.gus@igic.ras.ru
Поступила в редакцию 17.08.2021
После доработки 21.09.2021
Принята к публикации 22.09.2021
- EDN: MMZNPE
- DOI: 10.31857/S0002337X22010055
Аннотация
Синтезирован порошкообразный гафнат празеодима Pr2Hf2O7 со структурой пирохлора. С помощью РФА, СЭМ и химического анализа определены его молярная теплоемкость в интервале температур 315–1345 K и температурная зависимость параметра кристаллической решетки в области 298–1273 K.
ВВЕДЕНИЕ
Соединения Ln2Hf2O7 со структурой типа пирохлора (Fd3m) образуются при взаимодействии оксидов легких лантаноидов (Ln = La, Pr, Nd, Sm, Eu, Gd и Tb) и диоксида гафния. Существование этих соединений в ряду гафнатов лантаноидов ограничено соотношением ионных радиусов ${{{{r}_{{{\text{L}}{{{\text{n}}}^{{{\text{3 + }}}}}}}}} \mathord{\left/ {\vphantom {{{{r}_{{{\text{L}}{{{\text{n}}}^{{{\text{3 + }}}}}}}}} {{{r}_{{{\text{H}}{{{\text{f}}}^{{{\text{4 + }}}}}}}}}}} \right. \kern-0em} {{{r}_{{{\text{H}}{{{\text{f}}}^{{{\text{4 + }}}}}}}}}}$ > 1.46, характерным для образования соединений со структурой пирохлора [1, 2]. Соединения имеют высокие температуры плавления или превращения в твердый раствор со структурой дефектного флюорита Ln2O3 · 2HfO2 (Fm3m) (2800–3050 K) и характеризуются отсутствием структурных превращений во всей области существования [3, 4], что подтверждает возможность их использования в качестве высокотемпературных материалов, например термобарьерных покрытий [5]. Однако для практического применения в дополнение к этим свойствам необходима информация о коррозионной стойкости по отношению к окружающей среде и контактирующим веществам, а также параметрах термического расширения. Что касается химической инертности веществ, то задача может быть решена, по крайней мере в первом приближении, термодинамическим моделированием [6]. Энтальпии образования большинства гафнатов Ln2Hf2O7 приведены в работе [7], а термодинамические функции и термическое расширение – в работах [8–15]. Вместе с тем, высокотемпературный Pr2Hf2O7 с этих позиций не изучен (известна только энтальпия образования ‒4148.9 Дж/моль [7]). Гафнат празеодима является единственным соединением в системе Pr2O3–HfO2 [3, 4]. Pr2Hf2O7 кристаллизуется в структуре пирохлора и сохраняет эту структуру во всей температурной области существования. Авторы [16, 17] считают, что гафнат празеодима конгруэнтно плавится при температуре 2613 ± 30 K, тогда как в [4] полагают, что Pr2Hf2O7 при температурах выше 2473 K претерпевает разупорядочение и превращение в твердый раствор дефектного флюорита (Fm3m). Физические свойства гафната празеодима при температурах 0.35–25 K изучены с точки зрения возможности образования квантовой системы спинового льда [18–21]. В работах [20, 21] выращены образцы монокристаллического Pr2Hf2O7 с параметрами кубической решетки 10.68411(2) и 10.6727(1) Å соответственно.
Целью настоящей работы является измерение молярной теплоемкости и термического расширения гафната празеодима со структурой пирохлора в областях температур 315–1345 и 298–1273 K соответственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порошок гафната празеодима получали методом обратного осаждения. Исходными веществами являлись оксид празеодима Pr6O11 (99.99 мас. %), диоксид гафния (99.99 мас. %) производства ООО “Ланхит”, соляная кислота (35–38 мас. %, ОСЧ 20-4) и раствор аммиака (25–28 мас. % “ос. ч.”) производства ООО “Химмед”. Синтез, методы измерения термического расширения и теплоемкости подробно описаны в работах [12, 22]. Полученный в результате окончательного прокаливания при 1550 K (4 ч) образец, по данным химического анализа, имел состав Pr1.94Hf2O6.97 (величина индекса при кислороде рассчитана исходя из соотношения оксидов металлов). Такое отклонение от стехиометрии, по нашим оценкам, не может внести существенной погрешности в величину теплоемкости [23]. Молярную массу рассчитывали из атомных масс [24], она составила М = = 750.79112 г/моль.
Измерения молярной теплоемкости методом дифференциальной сканирующей калориметрии (ДСК) проводили в интервале 315–1345 K на приборе STA 449 F1 Jupiter (Netzsch). Методики измерений и сглаживания экспериментальных данных по температурной зависимости теплоемкости описаны в [25].
Термическое расширение изучали с помощью расчета параметра кубической решетки из дифрактограмм порошков, полученных при 298–1273 K с шагом 100 K на воздухе с помощью 2θ–θ-рентгеновского дифрактометра SHIMADZU XRD-600 с приставкой НА-1001 на фильтрованном CuKα-излучении [26].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
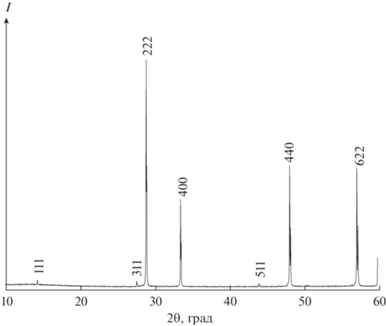
Дифракционные исследования (рис. 1) показали, что синтезированный однофазный образец Pr2Hf2O7 имеет кубическую структуру типа пирохлора с параметром решетки a = 10.671(9) Å, который удовлетворительно соответствует данным [21]. Оценка размера областей когерентного рассеяния пo Дебаю–Шереру и результаты растровой электронной микроскопии (рис. 2) показали, что образец хорошо закристаллизован и не является наноразмерным, следовательно, вводить поправки на размерный фактор к полученным термодинамическим величинам не нужно.
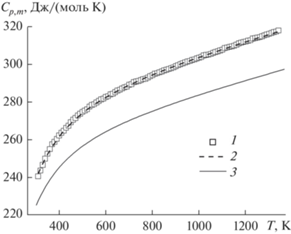
Температурную зависимость молярной теплоемкости гафната празеодима измеряли методом ДСК в интервале температур 315–1345 K. Температурная зависимость теплоемкости представляет собой гладкую кривую, что свидетельствует об отсутствии структурных превращений в изученном интервале температур (рис. 3). Сглаживание экспериментальных данных проводили с помощью уравнения Майера–Келли [27], которое для Pr2Hf2O7 имеет следующий вид:
(1)
$\begin{gathered} {{C}_{{p,m}}}\,\,({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{(моль}}\,\,{\text{K)}}}}} \right. \kern-0em} {{\text{(моль}}\,\,{\text{K)}}}}) = \\ = \,\,272.8 + 0.0347198T--4129441.4{{T}^{--}}^{2}, \\ {{R}^{2}} = {\text{ }}0.9996. \\ \end{gathered} $На рис. 3 для сравнения с полученными данными приведен расчет молярной теплоемкости по правилу Неймана–Коппа из теплоемкостей простых оксидов: Pr2O3 (P3m1) [28] и HfO2 (моноклинная структура) [29]. Как видно, несмотря на структурные различия исходных оксидов (гексагональная и моноклинная) и гафната празеодима (кубическая), модельная (кривая 2) и экспериментальная (кривая 1) теплоемкости совпадают во всем температурном интервале. На рис. 3 приведена температурная зависимость теплоемкости гафната лантана [8] (кривая 3). Видно, что теплоемкости Pr2Hf2O7 и La2Hf2O7 значительно отличаются. Это трудно объяснить только различием молярных масс гафнатов лантана и празеодима, которое составляет ~0.3%, и уменьшением параметра кристаллической решетки Pr2Hf2O7 (a = 10.671(9) Å) по сравнению с La2Hf2O7 (a = 10.772(1) Å), что должно привести к понижению теплоемкости гафната празеодима. Следует полагать, что увеличение теплоемкости гафната празеодима возникает за счет вклада аномалии Шоттки (CSch), которую можно рассчитать из спектроскопических данных либо оценить по разности теплоемкостей гафнатов празеодима и лантана [30]:
(2)
${{C}_{{Sch}}} \approx \Delta {{C}_{{p,m}}} = {{C}_{{p,m}}}({\text{P}}{{{\text{r}}}_{{\text{2}}}}{\text{H}}{{{\text{f}}}_{{\text{2}}}}{{{\text{O}}}_{7}})--{{C}_{{p,m}}}({\text{L}}{{{\text{a}}}_{{\text{2}}}}{\text{H}}{{{\text{f}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}),$(3)
$\begin{gathered} \Delta {{C}_{{p,m}}}\,\,\,({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{(моль}}\,\,{\text{K}})}}} \right. \kern-0em} {{\text{(моль}}\,\,{\text{K}})}}) = \\ = \,\,23.9 + 0.00158694Т--309005.1{{Т}^{{--2}}}, \\ \end{gathered} $что составляет от ~21 (315 K) до ~26 (1345 K) Дж/(моль K).
Температурную зависимость термического расширения гафната празеодима изучали методом высокотемпературной рентгеновской дифрактометрии [15, 27]. Результаты расчетов параметра кубичеcкой ячейки пирохлора Pr2Hf2O7 приведены в табл. 1. Температурная зависимость параметра решетки может быть описана уравнением
(4)
$\begin{gathered} a\left( {\AA} \right) = 10.6576 + \\ + \,\,6.3725{\text{ }} \times {{10}^{{--5}}}T + 2.5080 \times {{10}^{{--8}}}{{T}^{2}}. \\ \end{gathered} $Таблица 1.
Температурные зависимости параметра кристаллической решетки гафната празеодима (пирохлор), текущего (αT) и относительного (α298) коэффициентов линейного термического расширения и относительного линейного расширения (ТЕ)
| T, K | a, Å | αT × 10–6, K–1 | α298 × 10–6, K–1 | TE, % |
|---|---|---|---|---|
| 298 | 10.680 | 7.36 | 7.36 | 0 |
| 473 | 10.692 | 8.17 | 8.18 | 0.11 |
| 573 | 10.703 | 8.64 | 8.65 | 0.22 |
| 672 | 10.710 | 9.10 | 9.12 | 0.28 |
| 773 | 10.721 | 9.56 | 9.60 | 0.38 |
| 873 | 10.733 | 10.02 | 10.07 | 0.50 |
| 973 | 10.745 | 10.48 | 10.54 | 0.61 |
| 1073 | 10.756 | 10.94 | 11.01 | 0.71 |
| 1173 | 10.767 | 11.39 | 11.48 | 0.81 |
| 1273 | 10.778 | 11.85 | 11.96 | 0.92 |
Линейные коэффициенты термического расширения вычисляли с помощью следующих соотношений:
текущий αT = (daT/dT)/aT,
относительный α298 = (daT/dT)/a298,
линейное термическое расширение ТЕ(%) = = 100(aT – a298)/a298.
Рассчитанные параметры термического расширения приведены в табл. 1. По данным дилатометрии, линейный относительный коэффициент термического расширения равен 9.13 × 10–6 K–1 [4], что сравнимо с полученным значением 9.6 × × 10–6 K–1 при средней температуре 773 K.
Температурная зависимость параметра кристаллической решетки гафната празеодима приведена на рис. 4 в сравнении с данными для гафнатов лантана, неодима, самария, европия, гадолиния и тербия (структура пирохлора) [8–13]. Температурные зависимости практически параллельны и близки к линейным, т.е. коэффициенты термического расширения всех представленных гафнатов приблизительно одинаковы и слабо зависят от температуры.
ЗАКЛЮЧЕНИЕ
Синтезированный обратным осаждением гафнат празеодима со структурой пирохлора охарактеризован методами рентгенофазового и химического анализа и электронной микроскопии.
Проведено измерение молярной теплоемкости методом ДСК в области температур 315–1345 K и показано, что теплоемкость содержит вклад аномалии Шоттки.
Зависимость параметра кристаллической решетки от температуры изучена методом высокотемпературной рентгеновской дифракции в интервале 298–1273 K, проведена оценка коэффициентов линейного термического расширения гафната празеодима.
Список литературы
Subramanian M.A., Aravamudan G., Subba Rao G.V. Oxide Pyrochlores – a Review // Prog. Solid State Chem. 1983. V. 15. P. 55–143. https://doi.org/10.1016/0079-6786(83)90001-8
Fuentes A.F., Montemayor S.M., Maczka M., Lang M., Ewing R.C., Amador U. A Critical Review of Existing Criteria for the Prediction of Pyrochlore Formation and Stability // Inorg. Chem. 2018. https://doi.org/10.1021/acs.inorgchem.8b01665
Andrievskaya E.R. Phase Equilibria in the Refractory Oxide Systems of Zirconia, Hafnia and Yttria with Rare-Earth Oxides // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363–2388. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Arseniev P.A., Glushkova V.B., Evdokimov A.A. et al. Compounds of Rare-Earth Elements. Zirconates, Hafnates, Niobates, Tantalates, Antimonates. M.: Nauka, 1985. 261 p.
Pan W., Phillpot S.R., Wan C., Chernatynskiy A., Qu Z. Low Thermal Conductivity Oxides // MRS Bull. 2012. V. 37. P. 917–922. https://doi.org/10.1557/mrs.2012.234
Summers W.D., Poerschke D.L., Begley M.R., Levi C.G., Zok F.W. A Computational Modeling Framework for Reaction and Failure of Environmental Barrier Coatings under Silicate Deposits // J. Am. Ceram. Soc. 2020. https://doi.org/10.1111/jace.17187
Paputsky Y.N., Krjijanovskaya V.A., Glushkova V.B. Enthalpies of Formation of Hafnates and Zirconates RE (on Russian) // Izv. AN SSSR. Neorgan. Mater. 1974. V. 10. P. 1551–1552.
Guskov A.V., Gagarin P.G., Guskov V.N., Khoroshilov A.V., Gavrichev K.S. Heat Capacity and Thermal Expansion of Lanthanium Hafnate // Russ. J. Inorg. Chem. 2021. V. 66. P. 1017–1020. https://doi.org/10.1134/S0036023621070056
Guskov V.N., Gagarin P.G., Guskov A.V., Tyurin A.V., Khoroshilov A.V., Gavrichev K.S. Heat Capacity and Thermal Expansion of Neodimium Hafnate Ceramics // Ceram. Int. 2019. V. 43. P. 20733–20737. https://doi.org/10.1016/j.ceramint.2019.07.057
Guskov A.V., Gagarin P.G., Guskov V.N., Khoroshilov A.V., Gavrichev K.S. Heat Capacity and Thermal Expansion of Samarium Hafnate // Inorg. Mater. 2021. V. 57. P. 1015–1019. https://doi.org/10.1134/S0020168521100046
Guskov A.V., Gagarin P.G., Guskov V.N., Khoroshilov A.V., Gavrichev K.S. Thermal Expansion and Thermodynamic Function of Europian Hafnate at 298–1300 K // Russ. J. Inorg. Chem. 2021. V. 66. P. 1710–1713. https://doi.org/1034/S0036023621110085
Guskov V.N., Tyurin A.V., Guskov A.V., Gagarin P.G., Khoroshilov A.V., Gavrichev K.S. Thermal Expansion and Thermodynamic Properties of Gadolinium Hafnate Ceramics // Ceram. Int. 2020. V. 46. P. 12822–12827. https://doi.org/10.1016/j.ceramint.2020.02.052
Guskov A.V., Gagarin P.G., Guskov V.N., Khoroshilov A.V., Gavrichev K.S. Heat Capacity and Thermal Expansion of Tebium Hafnate // Inorg. Mater. 2021. V. 57. P. 710–713. https://doi.org/10.1134/S0020168521070074
Kutty K.V.G., Rajagopalan S., Mathews C.K. et al. Thermal Expansion Behaviour of Some Oxide Pyrochlores // Mater. Res. Bull. 1994. V. 29. P. 759–766. https://doi.org/10.1016/0025-5408(94)90201-1
Kutty K.V.G., Rajagolapan S., Asuvathraman R. Thermal Expansion Studies on Some Rare-Earth Pyrohafnates by High Temperature X-Ray Powder Diffractometry // Thermochim. Acta. 1990. V. 168. P. 205–209. https://doi.org/10.1016/0040-6031(90)80639-G
Shevchenko A.V., Lopato L.M., Zaitseva Z.A. Interaction of HfO2 with Lanthana, Praseodimia and Neodimia at High Temperatures // Izv. AN SSSR. Neorg. Mater. 1984. V. 20. P. 1530.
Portnoi K.I., Timofeeva N.I., Salibelov S.E., Romanovich I.V. Synthesis and Study of Properties of Complex Oxygen-Containing Compounds of REE and Hafnium // Izv. AN SSSR. Neorg. Mater. 1970. V. 6. P. 91.
Anand V.K., Opherden L., Xu J. et al. Physical Properties of the Candidate Qyantum Spin-Ace System Pr2Hf2O7 // Phys. Rev. B. 2016. V. 94. 144415. https://doi.org/10.1103/PhysRevB.94.144415
Sibile R., Lhotel E., Hatnean M.C. et al. Candidate Quantum Spin Ice in the Pyrochlore Pr2Hf2O7 // Phys. Rev. B. 2016. V. 94. 024436. https://doi.org/10.1103/PhysRevB.94.024436
Hatnean M.C., Sibile R., Lees M.R. et al. Single Crystal Growth, Structure and Magnetic Properties of Pr2Hf2O7 Pyrochlore // J. Phys.: Condens. Matter. 2017. V. 29. 075902 (9 P.). https://doi.org/10.1088/1361-648X/29/7/075902
Anand V.K., Islam A.T.M.N., Samartzis A. et al. Optimization of Single Crystal Growth of Candidate Quantum Spin-Ace Pr2Hf2O7 by Optical Floating-Zone Method // J. Cryst. Growth. 2018. V. 498. P. 124. https://doi.org/10.1016/J.jcrysgro.2018.06.011
Gagarin P.G., Tyurin A.V., Guskov V.N., Nikiforova G.E., Gavrichev K.S., Shlyakhtina A.V. Thermodynamic Properties of Dy2O3·2ZrO2 and Ho2O3·2ZrO2 in the Range 10–340 K // Inorg. Mater. 2017. V. 53. P. 86–92. https://doi.org/10.1134/S002016851701006X
Gagarin P.G., Guskov A.V., Guskov V.N. et al. Dysprosium Orthotantalate Ceramics: Thermal Expansion and Heat Capacity // Ceram. Int. 2021. V. 47. P. 2892–2896. https://doi.org/10.1016/j.ceramint.2020.09072
Wieser M.E. Atomic Weights of the Elements 2005 (IUPAC Technical Report) // Pure Appl. Chem. 2006. V. 78. P. 2051–2066. https://doi.org/10.1351/pac200678112051
Ryumin M.A., Nikiforova G.E., Tyurin A.V. et al. Heat Capacity and Thermodynamic Functions of La2Sn2O7 // Inorg. Mater. 2020. V. 56. P. 102–109. https://doi.org/10.1134/S00201685200101148
Kolomiets T.Yu., Tel’nova G.B., Ashmarin A.A., Chelpanov V.I., Solntsev K.A. Synthesis and Sintering of Submicron Nd:YAG Particles Preparated from Carbonate Precursor // Inorg. Mater. 2017. V. 53. P. 874–882. https://doi.org/10.1134/S0020168517080076
Maier C.G., Kelley K.K. An Equation for Representation of High Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. P. 3243–3246. https://doi.org/10.1021/ja01347a029
Konings R.J.M., Beneš O., Kovács O.A., Manara D., Sedmidubský D., Gorokhov L.N., Iorish V.S., Yungman V., Shenyavskaya E., Osina E. The Thermodynamic Properties of the f-Elements and Their Compounds. Part 2. The Lanthanide and Actinide Oxides // J. Phys. Chem. Ref. Data. 2014. V. 43. № 1. P. 013101. https://doi.org/10.1063/1.4825256
Pankratz L.B. Thermodynamic Properties of Elements and Oxides // U.S. Bur. Mines Bull. 1982. V. 672. P. 188.
Westrum E.F. Lattice and Schottky Contributions to the Morphology of Lanthanide Heat Capacities // J. Chem. Thermodyn. 1983. V. 15. P. 305. https://doi.org/10.1016/0021-9614(83)90060-5
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы