Неорганические материалы, 2022, T. 58, № 3, стр. 317-326
Золь–гель-синтез порошков Ca3(PO4)2 и Ca3 – xNa2x(PO4)2 для формирования биокерамики методом 3D-печати
Д. С. Ларионов 1, 2, В. А. Битанова 1, П. В. Евдокимов 1, 2, 3, А. В. Гаршев 1, 2, В. И. Путляев 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, с. 3, Россия
2 Московский государственный университет им. М.В. Ломоносова, Факультет наук о материалах
119991 Москва, Ленинские горы, 1, с. 73, Россия
3 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
* E-mail: valery.putlayev@gmail.com
Поступила в редакцию 17.11.2021
После доработки 27.12.2021
Принята к публикации 29.12.2021
- EDN: NJEZKQ
- DOI: 10.31857/S0002337X22030095
Аннотация
Разработаны методики синтеза микрокристаллических порошков трикальцийфосфата (ТКФ) β-Ca3(PO4)2 и фазы А (Ca2.5Na(PO4)2 – упорядоченного твердого раствора на основе α-ренанита Ca3 –хNa2х(PO4)2) при помощи золь–гель-метода Печини. В качестве фосфорсодержащих реагентов использованы триэтилфосфат (ТЭФ) PO(OC2H5)3 и этилендиаминтетраметиленфосфоновая (ЭДТМФ) кислота (H2O3PCH2)2N(CH2)2N(CH2PO3H2)2. Проанализированы фазовый состав, микроморфология полученных порошков и их активность в процессе спекания. Использование ТЭФ в качестве фосфорсодержащего реагента приводит к нарушению стехиометрии Ca/P в конечном продукте за счет испарения ТЭФ при поликонденсации геля с образованием смеси гидроксиапатита Ca10(OH)2(PO4)6 и оксида кальция. В случае использования ЭДТМФ за счет хелатирования Са2+ комплексоном стехиометрия сохраняется: при синтезе ТКФ после термолиза гелей при температурах 750–1000°С кристаллизуется β-ТКФ (средний размер частиц 1 мкм), при синтезе фазы А после термолиза гелей при температурах 500–800°С образуется смесь β-ТКФ, β-CaNaPO4 и фазы А (средний размер частиц при 500–700°С – 250 нм). По данным дилатометрии, синтезированные порошки уплотняются быстрее по сравнению с порошками с керамической предысторией. Полученные результаты дают основание рекомендовать золь–гель-методику с использованием ЭДТМФ для синтеза порошков резорбируемых фосфатов – ТКФ и Ca3 –хNa2х(PO4)2, приемлемых для стереолитографического формирования из них остеокондуктивной биокерамики.
ВВЕДЕНИЕ
Современный подход к разработке биоматериалов для замещения костной ткани основан на использовании резорбируемых и остеокондуктивных имплантатов, временно заполняющих пространство дефекта и создающих условия для стимуляции естественных процессов регенерации кости [1–3]. Подходящей основой для создания таких материалов являются фосфаты кальция: трикальцийфосфат (ТКФ) Ca3(PO4)2 и смешанные натриевые фосфаты Ca3 –xNa2x(PO4)2 (т. н. натриевые ренаниты) за счет их биосовместимости и значительной резорбируемости [4].
Важным требованием, которое предъявляется к структуре имплантата, является наличие в ней системы пор диаметром не менее 200 мкм [2] для прорастания костной ткани, кровеносных сосудов и повышения остеокондуктивных свойств материала. Спроектированную систему пор и сложную архитектуру материала можно воспроизвести при помощи метода стереолитографической 3D-печати, обладающего высоким пространственным разрешением [5, 6]. Для применения данного метода, а также обеспечения лучшей резорбируемости имплантата необходимо использовать порошки с малым размером частиц (100–500 нм) [7].
Традиционно для синтеза ТКФ и ренанитов применяют твердофазный метод [8], поскольку указанные фосфаты нельзя получить осаждением из водного раствора вследствие гидролиза и осаждения более устойчивых при данных условиях синтеза фосфатов, например, гидроксиапатита (ГАП) Са10(РО4)6(ОН)2. Высокие температуры обжига – неотъемлемая черта твердофазного метода синтеза – приводят к интенсивному спеканию и образованию крупных агломератов частиц с широким распределением по размерам. В этой связи необходим поиск альтернативного подхода к синтезу таких порошков.
В литературе с различной степенью доскональности освещаются методики синтеза некоторых фосфатов кальция осаждением из неводных (метанольных, этиленгликолевых) растворов [7, 9], описано применение гидротермального метода [10–12], разработаны методики золь–гель-синтеза ГАП [13–16], однако мало сведений о таких синтезах для ТКФ [17], отсутствуют данные в отношении ренанитов. Значительные перспективы для получения мелкодисперсных порошков фосфатов имеет цитратный вариант золь–гель-процесса, т. н. метод Печини. Он основан на протекании реакции поликонденсации между цитратными комплексами металлов и этиленгликолем (ЭГ) с образованием в растворе полиэфирных цепей [18, 19]. Ранее нами были предложены методики синтеза ТКФ и натрийзамещенных ренанитов осаждением и золь–гель-методом в среде ЭГ, однако результаты потребовали доработки методик из-за нарушения соотношения Ca/Na в ходе синтеза ренанитов осаждением в ЭГ и систематического присутствия примеси оксида кальция при использовании метода Печини [20], о чем сообщалось и в ранних работах по золь–гель-синтезу фосфатов, например в [13].
Основная трудность, возникающая при применении золь–гель-подхода к синтезу ТКФ и ренанитов, заключается в правильном подборе фосфорсодержащего реагента. Последний не должен взаимодействовать с солями кальция на начальных этапах синтеза с образованием и осаждением малорастворимых фосфатов [21]. Данному требованию удовлетворяют органические эфиры фосфорной кислоты – алкилфосфаты PO(RO)3– n(OH)n (n = = 0, 1, 2), не взаимодействующие с солями кальция при нормальных условиях ввиду малой скорости гидролиза [22]. Другим подходящим реагентом являются фосфонатные комплексоны, в частности, использованная в настоящей работе этилендиаминтетраметилфосфоновая (ЭДТМФ) кислота (H2O3PCH2)2N(CH2)2N(CH2PO3H2)2, способная выступать не только источником фосфора, но и хелатирующим агентом вместе с традиционно применяемой в методе Печини лимонной кислотой.
Целью данной работы стала разработка и апробация достаточно универсальной методики золь–гель-синтеза дисперсных, активных к спеканию порошков ТКФ и смешанных натрийсодержащих фосфатов (ренанитов) для их дальнейшего использования в качестве исходного материала для изготовления макропористых керамических и композитных имплантатов методом стереолитографической 3D-печати.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез ТКФ с использованием триэтилфосфата (ТЭФ). В качестве фосфорсодержащего реагента использовался ТЭФ (Sigma-Aldrich № 216003-500G, d = 1.068–1.069 г/мл), в качестве источника кальция – предварительно дегидратированный при 250°C нитрат кальция (РусХим, “ч. д. а.”). В ЭГ (Sigma-Aldrich № 293237-1L, d = 1.11 г/мл) растворяли нитрат кальция, избыток лимонной кислоты (Sigma-Aldrich 27487-250G-F) и приливали рассчитанный объем ТЭФ. Полученный после перемешивания раствор нагревали в течение 2 ч до 70°C и упаривали в течение нескольких часов при данной температуре до значительного уменьшения в объеме с образованием геля (прозрачной, очень вязкой смолы). При слишком быстром нагревании раствор мутнел.
Полученный гель высушивали при 130°C и подвергали термической обработке при температуре 1000°C:
(1)
${\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{7}} \leftrightarrow {\text{Ca}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{{{\text{O}}}_{7}}} \right) + 2{\text{HN}}{{{\text{O}}}_{3}},$(2)
$\begin{gathered} 3{\text{Ca}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{{{\text{O}}}_{{\text{7}}}}} \right) + 2{\text{PO}}{{\left( {{\text{O}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}} \right)}_{3}} + {{65} \mathord{\left/ {\vphantom {{65} 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} = t \\ = \,\,{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} + 30{\text{C}}{{{\text{O}}}_{2}} + 24{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Синтез ТКФ с использованием ЭДТМФ. В качестве фосфорсодержащего реагента использовалась кислота ЭДТМФ (Реахим № 1088-70, “ч.”), предварительно перекристаллизованная приготовлением насыщенного при 60°C раствора, фильтрованием на бумажном фильтре, упариванием и фильтрованием при пониженном давлении. В качестве источника кальция – дегидратированный нитрат кальция. В воде при перемешивании на магнитной мешалке растворяли рассчитанное количество ЭДТМФ и нитрата кальция, избыток лимонной кислоты и ЭГ. Полученный раствор нагревали в течение 2 ч до 80°C и медленно упаривали в течение 2–3 ч до образования геля:
(3)
$\begin{gathered} 6{\text{Ca}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{{{\text{O}}}_{{\text{7}}}}} \right) + {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{20}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{12}}} + 39{{{\text{O}}}_{2}} = t \\ = \,\,{\text{ }}2{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} + 42{\text{C}}{{{\text{O}}}_{2}} + 28{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{N}}{{{\text{O}}}_{2}} \\ \end{gathered} $Полученный гель высушивали при 130°C и подвергали термической обработке при 750 и 1000°C.
Синтез Ca2.5Na(PO4)2 (фазы А). В воде при перемешивании на магнитной мешалке растворяли ЭДТМФ и гидроксид натрия (Лабтех № 4328-77, “ч. д. а.”) в качестве источника натрия (происходило быстрое растворение кислоты за счет образования хорошо растворимой натриевой соли), добавляли к раствору нитрат кальция, а также избыток лимонной кислоты и ЭГ. Полученный раствор нагревали в течение 2 ч до 70°C и медленно упаривали в течение 3 ч до образования геля:
(4)
$\begin{gathered} {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{20}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{12}}} + 2{\text{NaOH}} = \\ = \,\,{\text{N}}{{{\text{a}}}_{{\text{2}}}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{18}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{{\text{12}}}}}} \right) + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(5)
$\begin{gathered} {\text{N}}{{{\text{a}}}_{{\text{2}}}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{18}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{{\text{12}}}}}} \right) + 5{\text{Ca}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{{{\text{O}}}_{{\text{7}}}}} \right) + \\ + \,\,{{69} \mathord{\left/ {\vphantom {{69} {2{{{\text{O}}}_{2}}}}} \right. \kern-0em} {2{{{\text{O}}}_{2}}}} = t{\text{ }}2{\text{C}}{{{\text{a}}}_{{{\text{2}}{\text{.5}}}}}{\text{Na}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} + \\ + \,\,36{\text{C}}{{{\text{O}}}_{2}} + 24{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{N}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Полученный гель высушивали при 130°C и подвергали термической обработке при 510, 610, 680 и 800°C.
Рентгенофазовый анализ (РФА) проводили на дифрактометре Rigaku D/Max-2500 с вращающимся анодом (Япония). Съемку осуществляли в режиме на отражение (геометрия Брегга–Брентано) в кварцевых кюветах с использованием CuKα-излучения (λср = 1.54183 Å). Качественный анализ полученных рентгенограмм проводили с помощью программы WinXPOW и базы данных PCPDF ICDD PDF-2.
Массовую долю компонента в количественном РФА оценивали по методу Чанга [23] по следующей формуле:
(6)
$\omega (A) = \frac{{{{{{I}_{i}}(A)} \mathord{\left/ {\vphantom {{{{I}_{i}}(A)} {({I \mathord{\left/ {\vphantom {I {{{I}_{{cor}}}(A)I_{i}^{{rel}}(A)}}} \right. \kern-0em} {{{I}_{{cor}}}(A)I_{i}^{{rel}}(A)}}}}} \right. \kern-0em} {({I \mathord{\left/ {\vphantom {I {{{I}_{{cor}}}(A)I_{i}^{{rel}}(A)}}} \right. \kern-0em} {{{I}_{{cor}}}(A)I_{i}^{{rel}}(A)}}}}}}{{\Sigma (N){{{{I}_{j}}(N)} \mathord{\left/ {\vphantom {{{{I}_{j}}(N)} {({I \mathord{\left/ {\vphantom {I {{{I}_{{cor}}}(N)I_{j}^{{rel}}(N))}}} \right. \kern-0em} {{{I}_{{cor}}}(N)I_{j}^{{rel}}(N))}}}}} \right. \kern-0em} {({I \mathord{\left/ {\vphantom {I {{{I}_{{cor}}}(N)I_{j}^{{rel}}(N))}}} \right. \kern-0em} {{{I}_{{cor}}}(N)I_{j}^{{rel}}(N))}}}}}},$Термогравиметрический (ТГ) и дифференциальный термический (ДТА) анализ образцов проводили на синхронном термоанализаторе с вертикальной загрузкой образцов STA 409 PC Luxx (Netzsch, Германия). Измерения проводили на воздухе в интервале температур от 40 до 1000°С со скоростью нагрева 10°С/мин.
Распределение частиц по размерам определяли методом динамического рассеяния света на приборе Zetasizer Nano ZS в диапазоне 0.2–100 мкм.
Растровая электронная микроскопия (РЭМ) проводилась на растровом электронном микроскопе с автоэмиссионным источником LEO SUPRA 50VP (Carl Zeiss, Германия). Образцы наклеивали на медную подложку при помощи проводящего углеродного скотча без дополнительного напыления. Ускоряющее напряжение электронной пушки составляло 1–21 кВ. Изображения получали во вторичных электронах при увеличениях до 10 000/25 000× при использовании детектора SE2 и InLens.
Дилатометрический анализ проводили в горизонтальном дилатометре DIL 402 C (Netzsch, Германия). Образцы нагревали со скоростью 52°C/мин до температур 1000–1200°C с последующей выдержкой в течение 6 ч.
Геометрическую плотность спеченных при 800–1000°C (2 ч) керамических таблеток рассчитывали, измеряя массу образцов (с точностью до 10–4 г) и линейные размеры (с точностью до 10 мкм, микрометр).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для синтеза ТКФ и Ca2.5Na(PO4)2 (фаза А) была выбрана методика золь–гель-синтеза по методу Печини в этиленгликолевых и смешанных водно-этиленгликолевых растворах с использованием в качестве гелеобразователя (и хелатирующего агента) лимонной кислоты. Было проведено несколько опытов с различными фосфорсодержащими реагентами: ТЭФ и ЭДТМФ, взятых для достижения соотношения Ca/P = 1.5 в конечном продукте. Выбор источников фосфора был обусловлен необходимостью предотвратить их преждевременное взаимодействие с солями кальция с образованием малорастворимых фосфатов. Описанные в литературе золь–гель-методики с использованием гидрофосфатов аммония [17] были апробированы нами, но не привели к успеху из-за образования осадка еще до начала протекания процессов гелеобразования при нагревании раствора. По-видимому, комплексообразующего действия лимонной кислоты недостаточно для предотвращения взаимодействия ионов кальция с фосфат-анионами. В качестве кальцийсодержащего реагента использовался хорошо растворимый в воде и умеренно в ЭГ нитрат кальция, за счет которого в системе появляется азотная кислота, выступающая в качестве дополнительного окислителя на последующих этапах синтеза и ускоряющая процессы термолиза. В случаях использования водно-этиленгликолевых смесей молярное соотношение лимонной кислоты и ЭГ, равное 1 : 1, было выбрано как достаточное для протекания процесса гелеобразования [16].
Синтез ТКФ с использованием ТЭФ. В ЭГ растворяли нитрат кальция, лимонную кислоту и ТЭФ исходя из концентраций 0.5, 1 и 0.33 М соответственно. Растворение и упаривание полученного раствора занимает длительное время (3–4 ч), в соответствии с реакцией (1) образуются цитратные комплексы кальция, взаимодействующие с молекулами ЭГ по реакции поликонденсации с образованием сложноэфирных связей. Высушенный гель подвергали термической обработке при 1000°C, в ходе которой происходило разрушение органической матрицы и взаимодействие компонентов с образованием фосфатов по реакции (2).
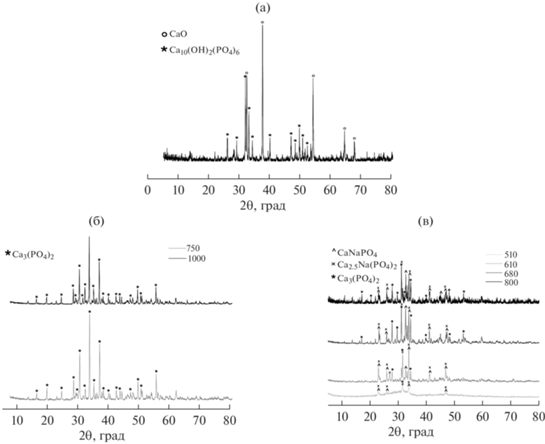
По данным РФА (рис. 1а), после термолиза геля образуется смесь ГАП и оксида кальция, что свидетельствует о нарушении соотношения Ca/P в ходе синтеза: оно превышает 1.67, т.е. наблюдается недостаток фосфора по отношению к исходно заложенному составу ТКФ. В связи с этим был сделан вывод, что температура кипения ТЭФ (289°С) ниже, чем температура начала его взаимодействия с кальцийсодержащим реагентом. В альтернативной методике ТЭФ добавляли после образования и остывания геля. Попытка зафиксировать реагент в полимерной сетке, препятствуя его преждевременному испарению, не привела к желаемому результату.
Рис. 1.
Рентгенограммы образцов, полученных при синтезе ТКФ с использованием ТЭФ после обжига геля при 1000°C (а); с использованием ЭДТМФ после обжига гелей при 750, 1000°C (б); при синтезе фазы А после обжига гелей при 510–800°C (в).
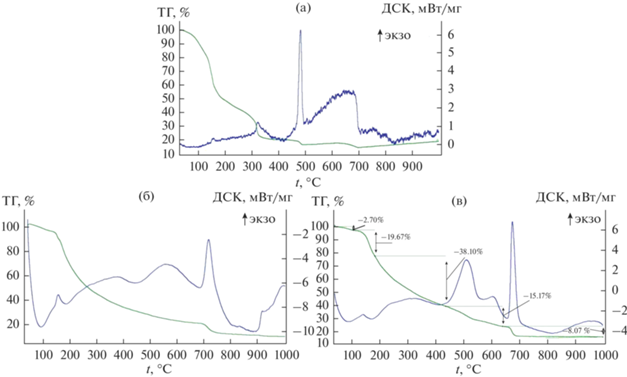
По данным термического анализа (рис. 2а), экзоэффекты начинают проявляться при 320°C (предположительно, на данном этапе происходит испарение фосфорсодержащего реагента). Наиболее интенсивное выделение тепла наблюдается при температуре около 500°C. Можно предположить, что в этих условиях происходят окислительный пиролиз органической матрицы и кристаллизация фосфатов.
Рис. 2.
Данные ТГ и ДТА, соответствующие синтезам ТКФ с использованием ТЭФ (а), ТКФ с использованием ЭДТМФ (б), фазы А (в).
Синтез ТКФ с использованием ЭДТМФ. В воде растворяли ЭДТМФ (процесс занимает длительное время, но ускоряется при нагревании) с образованием 0.03 М раствора, добавляли нитрат кальция, лимонную кислоту, исходя из концентраций 0.18 и 0.3 М соответственно, и ЭГ в молярном соотношении с лимонной кислотой 1 : 1. В ходе длительного упаривания происходило гелеобразование, полученный гель подвергали обжигу (реакция (3)).
Для выбора подходящих режимов термической обработки геля был проведен термический анализ (рис. 2б), по данным которого наиболее интенсивный экзоэффект и скачок в уменьшении массы с выделением углекислого газа и оксида азота(II) соответствуют температуре 720°C, т.е. на данном этапе происходят разложение органических компонентов и кристаллизация продуктов синтеза. Менее интенсивный экзоэффект наблюдается при температуре 1000°C.
С использованием справочных и литературных данных [24, 25] о константах устойчивости комплексов кальция с лимонной кислотой и ЭДТМФ были проанализированы ионные равновесия в растворах при различных концентрациях компонентов (рис. 3). Был сделан вывод о том, что в кислой среде лимонная кислота является более сильным комплексообразователем, чем ЭДТМФ, поэтому на начальных этапах синтеза именно она связывает катионы кальция. Однако следует заметить, что при pH > 4 ЭДТМФ также существует в растворе в виде тех или иных комплексов с ионами кальция (например, СаН3ЭДТМФ3–), т.е. фосфатный компонент уже содержит прочную связь Са–(О–Р–). По-видимому, это предотвращает пирогидролиз фосфатного компонента при последующем обжиге и нарушение стехиометрии в конечном продукте. Данные подтверждаются экспериментально: согласно РФА (рис. 1б; табл. 1), продукты термолиза гелей при 750 и 1000°C представляют собой однофазный β-ТКФ.
Рис. 3.
Зависимости долей преимущественных форм в растворе от pH для систем Ca2+–ЭДТМФ(EDTMP)–цитратный анион (cit3–) (а), Ca2+–${\text{PO}}_{4}^{{3 - }}$–cit3– (б).
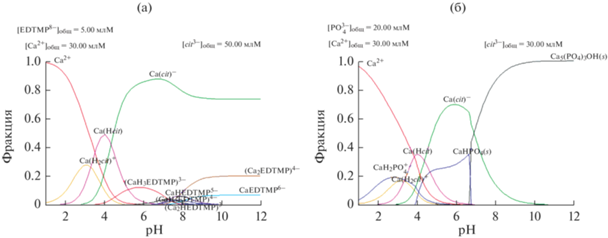
Таблица 1.
Результаты количественного РФА продуктов синтезов
| Синтез | C, мас. доля | ||||
|---|---|---|---|---|---|
| Ca3(PO4)2 | Ca10(PO4)6(OH)2 | CaNaPO4 | CaO | Ca2.5Na (PO4)2 | |
| ТКФ из ТЭФ | Отсутствует | 0.71 | Отсутствует | 0.29 | Отсутствует |
| ТКФ из ЭДТМФ | 1 | Отсутствует | – | Отсутствует | – |
| Фазы А | 0.43 | Отсутствует | 0.40 | Отсутствует | 0.17 |
Синтез Ca2.5Na(PO4)2 (фазы А). В воде растворяли ЭДТМФ и гидроксид натрия (за счет образования растворимой соли по реакции (4) время растворения кислоты значительно сократилось) до концентраций 0.1 и 0.2 М. К раствору добавляли нитрат кальция и лимонную кислоту до концентраций 0.5 и 1 М и приливали ЭГ до концентрации 1 М. Гель, образовавшийся после упаривания раствора, подвергли обжигу.
Температуры термической обработки были выбраны на основе данных термического анализа (рис. 2в) в соответствии с наиболее интенсивными экзоэффектами. Максимальная интенсивность тепловыделения и резкая потеря массы наблюдаются при температуре 680°C, сравнимый по интенсивности экзоэффект наблюдается при температуре 550°C.
Согласно данным РФА (рис. 1в), в результате термической обработки при 800°C была получена смесь, содержащая β-ТКФ, β-CaNaPO4 и фазу А (реакция (5)). Так как фаза А является упорядоченным высокотемпературным твердым раствором, в соответствии с фазовой диаграммой системы Ca3(PO4)2–CaNaPO4 при охлаждении ниже 980°С она эвтектоидно разлагается с образованием ТКФ и ренанита в массовом соотношении 1 : 1 [26]. Следует отметить, что в исследованных в работе золь–гель-порошках, отожженных при температурах ниже эвтектоидной, образуется метастабильная фаза А (образование метастабильных фаз довольно типично для золь–гель-синтеза). По данным количественного РФА, в ходе синтеза было получено массовое соотношение фаз Ca3(PO4)2 : CaNaPO4 : Ca2.5Na(PO4)2, равное 2.42 : 2.26 : 1 (табл. 1). В результате обжигов при других температурах в диапазоне 550–800°C образовались продукты аналогичного фазового состава.
Анализ микроморфологии полученных порошков ТКФ и фазы А на основе данных РЭМ (рис. 4, 5) показал, что при высоких температурах термолиза (более 700°C) образуются крупные частицы диаметром более 1 мкм. Активная рекристаллизация образца, заметная по укрупнению и срастанию первичных частиц, свидетельствует о том, что полученные порошки проявляют активность в процессах спекания, что потенциально позволяет получать из них плотную и, следовательно, прочную биокерамику. Это особенно важно при изготовлении макропористых образцов методами 3D-печати, где за счет высокой пористости (более 80%) происходит потеря прочности. При более низких температурах обжига (500–700°C) полученные частицы имеют характерную для золь–гель-синтеза округлую форму и значительно меньший диаметр 200–500 нм, приемлемый для целей синтеза.
Рис. 4.
Микроморфология порошков, полученных при синтезе фазы А термолизом гелей при 610 (а, б), 680 (в), 800°C (г).

Рис. 5.
Микроморфология порошков, полученных при синтезе ТКФ термолизом гелей при 750 (а), 1000°C (б).

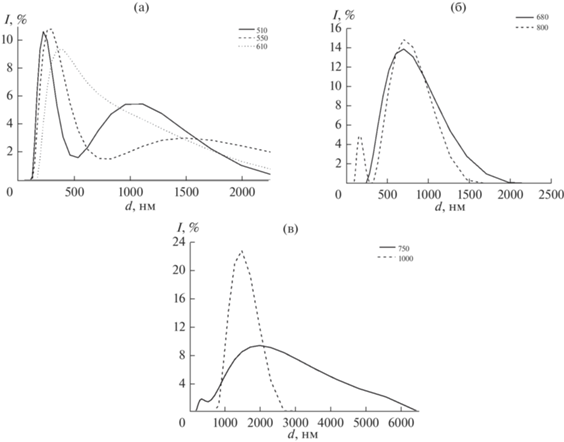
Данные динамического светорассеяния (рис. 6) подтверждают выводы о размерах частиц, сделанные на основе микрофотографий порошков: для крупнокристаллических образцов, полученных при высоких температурах, результаты отражают наличие частиц диаметром 2 и более мкм; для порошков, полученных при температурах 500–680°C, средний размер частиц составляет 250 нм. Наличие мод в распределениях, соответствующих диаметрам 1 и 5 мкм, можно объяснить образованием агломератов.
Рис. 6.
Данные динамического светорассеяния: сравнение размеров частиц порошков фазы А после обжигов при 510, 550, 610°C (а), при 680 и 800°C (б); сравнение размеров частиц порошков ТКФ после обжигов при 750 и 1000°C (в).
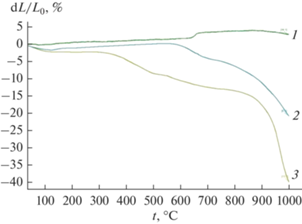
По данным дилатометрии (рис. 7), усадка спрессованных золь–гель-порошков начинается значительно раньше, чем у механической смеси β-ТКФ и β-CaNaPO4, и характеризуется большими значениями. При температурах выше 1000°С наблюдаются явления, отвечающие вторичной рекристаллизации: рост линейного размера образцов и увеличение размеров некоторых зерен выше 50 мкм. Это заставляет не поднимать температуру спекания выше 1000°С в противовес порошкам с керамической предысторией, где температуру одностадийного изотермического спекания образцов, например системы CaNaPO4–CaKPO4, устанавливают в диапазоне 1200–1300°С [27].
ЗАКЛЮЧЕНИЕ
Предложены методики синтеза порошков ТКФ и смешанного фосфата кальция-натрия, основанные на цитратном методе Печини с использованием кислоты ЭДТМФ в качестве источника фосфора.
Лимонная кислота и ЭДТМФ способны выступать хелатирующими агентами и предотвращать выпадение в осадок кристаллических фосфатов кальция из раствора, что делает их подходящими реагентами для применения в золь–гель-синтезе ТКФ и смешанных фосфатов натрия-кальция (ренанитов). Малая растворимость ЭДТМФ осложняет ее использование в водных и водно-этиленгликолевых средах, но при синтезе соединений ренанитного состава (в частности, Са2.5Na(PO4)2 – фазы А) данная проблема исчезает в связи с образованием хорошо растворимой натриевой соли.
Использование алкилфосфатов в золь–гель-синтезе ТКФ влечет за собой нарушение соотношения Ca/P, следовательно, и стехиометрии продукта на стадии термической обработки геля из-за удаления фосфорсодержащего реагента из зоны реакции. В случае использования ЭДТМФ потери фосфора удается избежать, по-видимому, вследствие частичного связывания ЭДТМФ катионами кальция.
В результате термической обработки гелей при 1000°C образуются крупные частицы диаметром в несколько микрометров, что свидетельствует об активности полученных порошков в процессах спекания. При обработке в диапазоне температур 500–700°C образуются частицы оптимального размера – 200–500 нм, удовлетворяющие требованиям стереолитографической 3D-печати. Заметное уплотнение таких порошков начинается при температурах на 300°C меньше по сравнению с порошками с керамической предысторией.
Полученные данные дают основания использовать золь–гель-методику с ЭДТМФ в качестве источника фосфора для синтеза резорбируемых фосфатных материалов, таких как ТКФ и ренаниты, а также считать ее перспективной для дальнейшего исследования, модификации и применения при изготовлении биокерамики и наполнении композитов.
Список литературы
Mironov V., Visconti R.P., Kasyanov V., Forgacs G., Drake C.J., Markwald R.R. Organ Printing: Tissue Spheroids as Building Blocks // Biomaterials. 2009. № 30. P. 2164–2174.
Zocca A., Colombo P., Gomes C.M., Gunsher J. Additive Manufacturing of Ceramics: Issues, Potentialities, and Opportunities // J. Am. Ceram. Soc. 2015. V. 98. № 7. P. 1984–2001.
Uchida A., Nade S.M.L., McCartney E., Ching W. The Use of Ceramics for Bone Replacement // J. Bone Joint Surg., B. 1984. V. 66. № 2. P. 269–275.
Dorozhkin S.V. Calcium Orthophosphates // Biomatter. 2011. V. 1. № 2. P. 121–164.
Vorndran E., Moseke C., Gbureck U. 3D Printing of Ceramic Implants // Mater. Res. Soc. 2015. V. 40. P. 127–136.
Ievlev V.M., Putlyaev V.I., Safronova T.V., Evdokimov P.V. Additive Technologies for Making Highly Permeable Inorganic Materials with Tailored Morphological Architectonics for Medicine // Inorg. Mater. 2015. V. 51. № 13. P. 1297–1315.
Larionov D.S., Kuzina M.A., Evdokimov P.V., Garshev A.V., Orlov N.K., Putlyaev V.I. Synthesis of Calcium Phosphate Powders in Nonaqueous Media for Stereolithography 3D Printing // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 312–322.
Yang X., Wang Z. Synthesis of Biphasic Ceramics of Hydroxyapatite and β-Tricalcium Phosphate with Controlled Phase Content and Porosity // J. Mater. Chem. 1998. V. 8. № 10. P. 2233–2237.
Bow J.-S., Liou S.-C., Chen S.-Y. Structural Characterization of Room-Temperature Synthesized Nano-Sized β-Tricalcium Phosphate // Biomaterials. 2004. № 25. P. 3155–3161.
Toyama T., Nakashima K., Yasue T. Hydrothermal Synthesis of β-Tricalcium Phosphate from Amorphous Calcium Phosphate // J. Ceram. Soc. Jpn. 2002. № 110. P. 716–721
Vani R., Girija E.K., Elayaraja K., Parthiban S.P., Kesavamoorthy R., Kalkura S.N. Hydrothermal Synthesis Of Porous Triphasic Hydroxyapatite/(α and β) Tricalcium Phosphate // J. Mater. Sci.: Mater. Med. 2009. № 20. P. 43–48.
Takeo H., Yasuhiko I. Hydrothermal Preparation of HAp Powders // J. Am. Ceram. Soc. 1990. V. 73. № 6. P. 1803–1805.
Jillavenkatesa A., Condrate R.A. Sol–Gel Processing of Hydroxyapatite // J. Mater. Sci. 1998. № 33. P. 4111–4119.
Beganskienė A., Dudko O., Sirutkaitis R., Giraitis R. Water Based Sol-Gel Synthesis of Hydroxyapatite // Mater. Sci. 2003. V. 9. № 4. P. 383–386.
Ben-Nissan B., Green D.D., Kannangara G.S.K., Chai C.S., Milev A. P NMR Studies of Diethyl Phosphite Derived Nanocrystalline Hydroxyapatite // J. Sol-Gel Sci. Technol. 2001. № 21. P. 27–37.
Omori Y., Okada M., Takeda S., Matsumoto N. Fabrication of Dispersible Calcium Phosphate Nanocrystals via a Modified Pechini Method under Non-stoichiometric Conditions // Mater. Sci. Eng. C. 2014. № 42. P. 562–568.
Ghosh R., Sarkar R. Synthesis and Characterization of Sintered Beta-Tricalcium Phosphate: a Comparative Study on the Effect of Preparation Route // Mater. Sci. Eng. C. 2016. № 67. P. 345–352.
Pechini M.P. Method of Preparing Lead and Alkaline Earth Titanates and Niobates and Coating Method Using the Same to Form a Capacitor: US Patent. 1967. 3330697A.
Danks A.E., Hall S.R., Schnepp Z. The Evolution of ‘Sol-Gel’ Chemistry as a Technique for Materials Synthesis // Mater. Horiz. 2016. V. 3. P. 91–112.
Ларионов Д.С., Евдокимов П.В., Гаршев А.В., Козлов Д.А., Путляев В.И. Синтез субмикронных порошков замещенных фосфатов кальция Са3 –хNa2х(PO4)2 в неводной среде для стереолитографического формирования биокерамики // Неорган. материалы. 2021. Т. 57. № 9. С. 1008–1017.
Livage J., Barboux P., Vanderborre M.T., Schmutz C., Taulelle F. Sol-Gel Synthesis of Phosphates // J. Non-Cryst. Solids. 1992. № 147&148. P. 18–23.
Svara J., Weferling N., Hofmann T. Phosphorus Compounds, Organic. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH., 2012. 49 p.
Davis B.L. “Standardless” X-ray Diffraction Quantitative Analysis // Atmos. Environ. 1967. V. 14. № 2. P. 217–220.
Kalman F.K., Kiraly R., Brucher E. Stability Constants and Dissociation Rates of the EDTMP Complexes of Samarium(III) and Yttrium(III) // Eur. J. Inorg. Chem. 2008. № 30. P. 4719–4727.
https://www.kth.se/che/medusa/
Ando J. Phase Diagrams of Ca3(PO4)2–Mg3(PO4)2 and Ca3(PO4)2–CaNaPO4 // Bull. Chem. Soc. Jpn. 1958. V. 31. P. 201–205.
Orlov N., Milkin P., Evdokimov P., Garshev A., Putlayev V., Grebenev V., Günster J. Phase Equilibria in the System CaNaPO4–CaKPO4 and Their Influence on the Formation of Bioceramics Based on Mixed Calcium Potassium-Sodium Phosphates // J. Eur. Ceram. Soc. 2019. V. 39. № 16. P. 5410–5422.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы