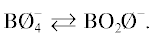Неорганические материалы, 2022, T. 58, № 5, стр. 562-568
Исследование зависимостей вязкости и энергии активации вязкого течения литиевоборатных расплавов от содержания оксида лития
А. А. Хохряков 1, С. Ю. Мельчаков 1, М. А. Самойлова 1, *, В. В. Рябов 1
1 Институт металлургии УрО Российской академии наук
620016 Екатеринбург, ул. Амундсена, 101, Россия
* E-mail: mari.makarenko.1993@mail.ru
Поступила в редакцию 25.11.2021
После доработки 03.02.2022
Принята к публикации 10.02.2022
- EDN: DSNMLJ
- DOI: 10.31857/S0002337X22050050
Аннотация
Вязкость бинарных расплавов xLi2O–(100 – x)B2O3, в которых концентрация оксида лития менялась от 4.5 до 55.7 мол. %, была измерена от 1003 до 1630 К методом вибрационной вискозиметрии. С повышением температуры вязкость снижается. Температурная зависимость вязкости может быть разбита на низкотемпературную (1000–1300 К) и высокотемпературную (1300–1620 К) части. При постоянной температуре вязкость литиевоборатных расплавов в зависимости от состава меняется в пределах от 0.1 до 12.3 Па с, тогда как энергии активации вязкого течения меняются от 31.7 до 103.8 кДж/моль. Из конфигурационно-активационной модели вязкого течения рассчитаны конфигурационная энергия активации εh, которая изменялась от 12 до 25.4 кДж/моль, и активационная энергия переключения мостиковых кислородных связей U∞ – от 11.5 до 78.4 кДж/моль. Неаддитивное отклонение вязкости при последовательном увеличении содержания оксида лития в бинарном расплаве связано с изменением характера химической связи, формируемой разными отношениями базовых единиц BØ3, BØ4, BØ2O– в цепочечных и кольцевых группировках борокислородной сетки расплава.
ВВЕДЕНИЕ
Литиевоборатные расплавы составляют основу многих электролитов, флюсов и шлаков, использующихся в технологии получения металлов, сплавов, кристаллов и стекол. Разработка новых технологий с участием боратных расплавов требует знаний их физико-химических свойств.
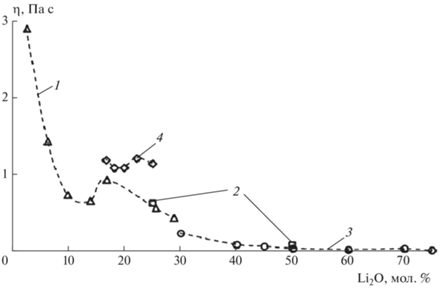
Одним из структурно-чувствительных свойств расплавов является вязкость. Вязкость определяет скорость диффузии в расплавах, влияет на кинетику химических реакций и физико-химические процессы, протекающие при кристаллизации и стекловании расплавов. Исследованию вязкости расплавов Li2O–B2O3 посвящено ограниченное количество научных статей. Шартсис с сотрудниками [1] исследовали вязкость литиевоборатных расплавов в интервале 773–1273 K для составов 2.5–28.8 мол. % Li2O. Мусихин и Кудряшов изучали вязкость расплавов, содержащих 25 и 50 мол. % оксида лития, в интервале температур 1053–1536 K [2]. Они обнаружили отклонение от линейной зависимости на графике логарифма вязкости от обратной температуры для состава 25Li2O–75B2O3. Причины нелинейности авторы не обсуждали. Ота и Сога [3] исследовали вязкость в интервале 959–1333 K для расплавов, содержащих 30–75 мол. % Li2O. Лиу с соавторами исследовали вязкость шести составов стекол в интервале 16.7–28.6 мол. % Li2O в температурном диапазоне 1093–1193 K [4]. Они показали, что у стекол, содержащих 22.2 мол. % Li2O, наибольшая вязкость по сравнению с другими исследованными составами. Авторы объяснили это явление образованием большего отношения ${\text{BO}}_{4}^{ - }$/BO3. В работах [5, 6] приводятся данные по температурам стеклования и физическим свойствам стекол Li2O–B2O3.
По данным [1–4] в табл. 1 собраны сведения о вязкости литиевоборатных расплавов, а на рис. 1 приводится зависимость вязкости расплава от содержания оксида лития при 1173 K. Как видно из рис. 1, вязкость расплавов отличается у разных авторов, что, вероятно, связано с ограничениями и погрешностями методов ее определения.
Таблица 1.
Обзор литературных данных по вязкости расплавов xLi2O–(100 – x)B2O3
| Li2O, мол. % | A | B | ΔT, K | Источник |
|---|---|---|---|---|
| lg η = A + B/T (Па с) | ||||
| 2.5 | –4.884 | 6271 | 776–1280 | [1] |
| 6.3 | –5.856 | 7057 | 873–1263 | [1] |
| 9.9 | –8.974 | 10372 | 767–1271 | [1] |
| 13.9 | –9.651 | 11107 | 878–1170 | [1] |
| 16.7 | –8.072 | 9496 | 1093–1193 | [4] |
| 16.8 | –8.814 | 10308 | 972–1273 | [1] |
| 18.2 | –8.807 | 10385 | 1093–1193 | [4] |
| 20.0 | –10.114 | 11923 | 1093–1193 | [4] |
| 21.6 | –12.290 | 14017 | 967–1073 | [1] |
| 22.2 | –9.375 | 11136 | 1153–1193 | [4] |
| 25.0 | –6.005 | 6818 | 1099–1250 | [2] |
| –4.040 | 4362 | 1250–1536 | ||
| –15.944 | 18773 | 1173–1193 | [4] | |
| 25.6 | –8.459 | 9632 | 1074–1174 | [1] |
| 28.6 | –0.561* | 1193 | [4] | |
| 28.8 | –10.062 | 11379 | 1071–1170 | [1] |
| 30.0 | –7.130 | 7642 | 1178–1298 | [3] |
| 40.0 | –3.931 | 3421 | 1163–1276 | [3] |
| 45.0 | –3.953 | 3295 | 1123–1281 | [3] |
| 50.0 | –5.015 | 4700 | 1053–1333 | [2] |
| –3.897 | 3018 | 1122–1333 | [3] | |
| 60.0 | –5.016 | 4137 | 1041–1225 | [3] |
| 70.0 | –1.527 | 166 | 959–1142 | [3] |
| 75.0 | –2.801 | 1255 | 1069–1228 | [3] |
Цель настоящей работы заключается в определении вязкости расплавов xLi2O–(100 – x) B2O3 в интервалах концентраций 0 ≤ x ≤ 56 мол. % Li2O и температур 960—1650 K в связи с отсутствием систематических данных в справочной литературе по этой проблеме.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хорошо известно, что границы измерения вязкости зависят от применяемого метода измерения [7, 8]. Вязкость бинарных расплавов Li2O–B2O3 измеряли на вискозиметре [9], работающем в режиме вынужденных колебаний. Конструкция вискозиметра, построенного в Институте металлургии УрО РАН, детально описана в работе [9]. Вискозиметр калибровали по эталонным жидкостям, использовали растворы глюкозы в тяжелой жидкости М-45 (ТУГХ № 150-59), применяемой для выделения мономинеральных фракций. Расчет относительной погрешности измерений был также выполнен в работе [9].
Боратные смеси готовили из предварительно переплавленного оксида бора и карбоната лития (“х. ч.”). Смесь нагревали до 1600 К и выдерживали в течение 1 ч, затем расплав выливали на стальную плиту. Полученную стекловидную массу использовали для измерений вязкости.
Зависимость вязкости от температуры и состава расплава приведена на рис. 2, коэффициенты зависимости lg η = f(1/Т) – в табл. 2.
Рис. 2.
Зависимости вязкости от состава расплава xLi2O–(100 – x)B2O3 при 1173 (1), 1273 (2), 1373 K (3).
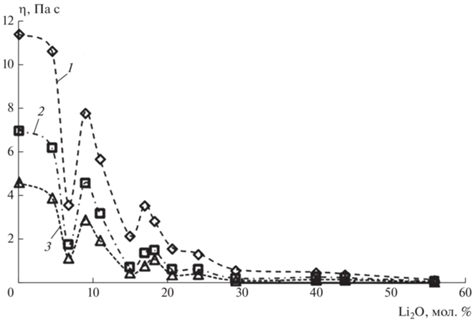
Таблица 2.
Вязкость расплавов xLi2O–(100 – x)B2O3
| Li2O, мол. % | A | B | ±∆A | ±∆B | ±lg η | ∆Т, K |
|---|---|---|---|---|---|---|
| lg η = A + B/T | ||||||
| 0 | –1.657 | 3182 | 0.027 | 39 | 0.012 | 1173–1613 |
| 4.5 | –1.975 | 3520 | 0.031 | 43 | 0.017 | 1148–1622 |
| 6.7 | –3.36 | 4592 | 0.08 | 88 | 0.024 | 1035–1307 |
| –1.73 | 2459 | 0.09 | 128 | 0.022 | 1307–1605 | |
| 8.9 | –2.08 | 3485 | 0.11 | 133 | 0.028 | 1111–1373 |
| –1.34 | 2460 | 0.06 | 82 | 0.010 | 1373–1597 | |
| 10.9 | –2.45 | 3758 | 0.05 | 62 | 0.018 | 1062–1381 |
| –1.53 | 2489 | 0.05 | 76 | 0.009 | 1381–1622 | |
| 14.9 | –5.63 | 6998 | 0.31 | 356 | 0.09 | 1025–1288 |
| –2.44 | 2894 | 0.17 | 243 | 0.046 | 1288–1630 | |
| 16.9 | –4.80 | 6277 | 0.16 | 188 | 0.041 | 1070–1294 |
| –2.61 | 3439 | 0.14 | 206 | 0.036 | 1294–1597 | |
| 18.2 | –3.70 | 4873 | 0.18 | 205 | 0.044 | 1008–1245 |
| –1.80 | 2516 | 0.11 | 150 | 0.033 | 1245–1597 | |
| 20.6 | –7.26 | 8755 | 0.22 | 241 | 0.042 | 1051–1220 |
| –3.18 | 3779 | 0.20 | 286 | 0.08 | 1220–1605 | |
| 24.1 | –6.56 | 7843 | 0.32 | 348 | 0.07 | 1032–1208 |
| –2.88 | 3395 | 0.17 | 229 | 0.042 | 1208–1506 | |
| 29.1 | –6.00 | 6777 | 0.17 | 206 | 0.038 | 1114–1319 |
| –2.66 | 2354 | 0.13 | 194 | 0.031 | 1319–1597 | |
| 39.8 | –9.5 | 10 684 | 0.8 | 836 | 0.14 | 1021–1153 |
| –3.81 | 4098 | 0.24 | 318 | 0.08 | 1153–1491 | |
| 43.7 | –8.73 | 9782 | 0.27 | 284 | 0.06 | 1003–1174 |
| –3.42 | 3545 | 0.22 | 284 | 0.07 | 1174–1482 | |
| 55.7 | –3.76 | 3373 | 0.09 | 108 | 0.05 | 1017–1430 |
| –1.82 | 599 | 0.16 | 243 | 0.014 | 1430–1572 | |
Из рис. 2 видно, что при увеличении содержания оксида лития в расплаве значения вязкости отклоняются от правила аддитивности. Наблюдаемая зависимость отражает изменение межчастичных взаимодействий вследствие образования кольцевых и цепочечных группировок, формирующих мостиковые и немостиковые кислородные связи, соотношение между которыми зависит от состава расплава.
Вводимый в расплавленный B2O3 оксид лития взаимодействует в первую очередь с более рыхлой частью сетки расплава, в которой ион лития занимает наибольшее количество вакансий. В результате в диапазоне 0–9 мол. % Li2O в расплавах формируется “субмикронеоднородная” структура, вытянутая в одном направлении, в окрестностях которой концентрируются ионы лития [10]. Эта “субмикронеоднородная” структура представляет собой цепочки из полиэдров ${\text{B\O }}_{4}^{ - }$, в которых связи BIV–O–BIV слабее по сравнению со связями BIII–O–BIII (IV – к. ч. атомов бора, Ø – мостиковый кислород). Это значительно облегчает сдвиги мостиковых атомов кислорода во фрагментах BIV–O–BIV, что является причиной снижения вязкости. Следует отметить, что образование таких цепочек не нарушает в целом слоистого строения бинарной системы Li2O–B2O3.
В интервале 9–11 мол. % Li2O при контакте цепочек из полиэдров BØ4 с бороксольными кольцами начинают образовываться триборатные группировки (B3O3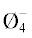 ). Последние формируют трехмерные фрагменты сетки расплава. Это увеличивает вязкость
бинарного боратного расплава. Поскольку межчастичное взаимодействие между оставшимися
бороксольными кольцами достаточно сильное, вводимый оксид лития при x > 11 мол. % переводит цепочки, собранные из полиэдров ${\text{B\O }}_{4}^{ - }$, в метаборатные группировки BØ2O–. Ион лития становится мостиковым ионом между метаборатными единицами расплава, его
к. ч. увеличивается. Трансформация цепочечных группировок заканчивается при содержании
Li2O ~ 15 мол. %. Дальнейшее увеличение содержания оксида лития в расплаве приводит к
образованию кольцевых три-, пента- и ди-триборатных групп (B3O3
). Последние формируют трехмерные фрагменты сетки расплава. Это увеличивает вязкость
бинарного боратного расплава. Поскольку межчастичное взаимодействие между оставшимися
бороксольными кольцами достаточно сильное, вводимый оксид лития при x > 11 мол. % переводит цепочки, собранные из полиэдров ${\text{B\O }}_{4}^{ - }$, в метаборатные группировки BØ2O–. Ион лития становится мостиковым ионом между метаборатными единицами расплава, его
к. ч. увеличивается. Трансформация цепочечных группировок заканчивается при содержании
Li2O ~ 15 мол. %. Дальнейшее увеличение содержания оксида лития в расплаве приводит к
образованию кольцевых три-, пента- и ди-триборатных групп (B3O3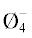 , B5O6Ø4, B5O6
, B5O6Ø4, B5O6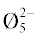 ), изображение этих структур приведено в [11]. Известно, что в щелочноборатных расплавах в области 15–30 мол. % оксида щелочного
металла происходит реакция диспропорционирования
), изображение этих структур приведено в [11]. Известно, что в щелочноборатных расплавах в области 15–30 мол. % оксида щелочного
металла происходит реакция диспропорционирования
При повышенных температурах динамическое равновесие реакции (1) смещается вправо.
В области 30 мол. % Li2O происходит заметное снижение вязкости расплава (рис. 2). В области 30–45 мол. % Li2O формируются диборатные группы (B4O5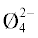 ). Взаимодействие ионов лития с диборатными единицами приводит к практически постоянному
значению вязкости.
). Взаимодействие ионов лития с диборатными единицами приводит к практически постоянному
значению вязкости.
По данным табл. 2, в области температур 1200–1300 K для составов с x > 6 мол. % Li2O наблюдается излом, который разделяет зависимость lg η = = f(1/T) на низко- и высокотемпературный интервалы и связан с распадом кольцевых групп при повышении температуры [11]. Для расплавов, содержащих менее 6 мол. % Li2O, температура излома (Тизл) не зафиксирована. Это означает, что она, вероятно, находится в более высокотемпературной области, недоступной для используемого метода измерений.
Необходимо отметить, что в отличие от работы [1] (рис. 1, табл. 1) на зависимости вязкости от состава (рис. 2, табл. 2) выделяется дополнительный минимум при х = 6.7 мол. % Li2O. Этот минимум отделяет область образования цепочечных единиц из полиэдров B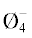 от области образования кольцевых полярных группировок. Наблюдаемое отличие, возможно,
связано с тем, что используемый в работе [1] метод измерения вязкости дает более усредненные величины вследствие более низкой
чувствительности к химическим связям бинарного расплава.
от области образования кольцевых полярных группировок. Наблюдаемое отличие, возможно,
связано с тем, что используемый в работе [1] метод измерения вязкости дает более усредненные величины вследствие более низкой
чувствительности к химическим связям бинарного расплава.
Для расчетов энергетических параметров литиевоборатных расплавов была использована конфигурационно-активационная модель вязкого течения Д.С. Сандитова [12], согласно которой вязкость описывается уравнением Эйринга
В уравнении (2) температурная зависимость свободной энергии активации вязкого течения имеет вид
(3)
${{F}_{\eta }} = {{U}_{\infty }} + \gamma \frac{{{{v}_{0}}}}{{{{v}_{h}}}}RT{\kern 1pt} \left[ {\exp \left( {\frac{{{{\varepsilon }_{h}}}}{{RT}}} \right) - 1} \right].$Здесь N – число кинетических единиц расплава, h – постоянная Планка, Vη – активационный объем вязкого течения, U∞ – энергия переключения мостиковых связей в сетке расплава, εh – конфигурационная энергия активации борокислородной сетки расплава (или энергия образования микродырки), γ – коэффициент перекрывания микропустот (0.5 ≤ γ ≤ 1), ${{v}_{0}}$ – минимальный объем микродырки, в который может перескочить частица, ${{v}_{h}}$ – изменение объема аморфной среды, вызванное образованием дырки.
В статье [12] было показано, что множитель $\gamma \frac{{{{v}_{0}}}}{{{{v}_{h}}}}$ существенно не влияет на вычисляемые значения Fη и варьируется в интервале 0.5 ≤ γ ≤ 1, поэтому для упрощения расчетов его значение было принято равным единице.
Энергию активации вязкого течения литиевоборатных расплавов для высокотемпературного (Ea(L)) и низкотемпературного (Ea(H)) интервалов рассчитывали по формуле:
(4)
${{E}_{a}} = ~R\frac{{\ln {\kern 1pt} {{\eta }_{1}} - \ln {\kern 1pt} {{\eta }_{2}}}}{{1{\text{/}}{{T}_{1}} - 1{\text{/}}{{T}_{2}}}},\,\,\,\,{{T}_{1}} > {{T}_{2}}.$В работе [12] показано, что начиная с некоторой температуры смещение кинетических единиц оксидного расплава осуществляется только переключением мостиковых кислородных связей (Fη = const). Тогда энергия активации вязкого течения расплава Ea соответствует энергии переключения мостиковых связей U∞ и для высокотемпературного интервала будет справедливо тождество
На зависимости lg η = f(1/T) в области низких температур свободная энергии активации вычисляется по уравнению (3). В данном случае использовать значение Ea(H) для расчета Fη по уравнению (5) уже нельзя, т.к. Ea(H) включает в себя и энергию переключения мостиковых кислородных связей, и энергию образования “микродырок”. Поэтому при расчетах необходимо учитывать приращение свободной энергии вязкого течения ΔFη = Eа(H) – Eа(L) для интервала ΔT = Tизл – 0. В качестве температурной “привязки” был выбран абсолютный нуль шкалы Кельвина. Тогда уравнение (3) для расчета свободной энергии активации в низкотемпературном интервале можно представить в виде
(6)
${{F}_{\eta }} = {{E}_{{a\left( L \right)}}} + RT{\text{exp}}\left( {\frac{{{{\varepsilon }_{h}}}}{{RT}}} \right) - RT,$а приращение функции ΔFη в низкотемпературном интервале
(7)
$\Delta {{F}_{\eta }} + R\Delta T = ~R\Delta T~{\text{exp}}\left( {\frac{{{{\varepsilon }_{h}}}}{{R{{\Delta }}T}}} \right).$Параметр εh может быть вычислен по формуле
(8)
$\begin{gathered} {{\varepsilon }_{h}} = R{{\Delta }}T{\text{ln}}\left( {\frac{{{{\Delta }}{{F}_{\eta }}}}{{R{{\Delta }}T}} + 1} \right) = \\ = \,\,R{{T}_{{{\text{изл}}}}}\ln \left( {\frac{{{{E}_{{a\left( H \right)}}} - {{E}_{{a\left( L \right)}}}}}{{R{{T}_{{{\text{изл}}}}}}} + 1} \right). \\ \end{gathered} $Из уравнений (5) и (8) следует важный вывод, что параметры εh и U∞ не являются функциями температуры, а определяются только составом и физико-химическими параметрами расплава, которые в свою очередь зависят от его структуры. Значения параметров εh и U∞ для исследованных литиевоборатных расплавов приведены в табл. 3.
Таблица 3.
Параметры конфигурационно-активационной модели для расплавов хLi2O–(100 – x)B2O3
| Li2O, мол. % | U∞, кДж/моль | εh, кДж/моль | Fη = U∞+ εh, кДж/моль | Структурная единица [11] |
|---|---|---|---|---|
| 4.5 | Ea = 67.4* | 67.4 | Цепочки ${\text{В\O }}_{4}^{ - }$ | |
| 6.7 | 47.1 | 17.0 | 64.1 | |
| 8.9 | 47.6 | 12.0 | 59.2 | B3O3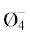 |
| 10.9 | 47.7 | 13.0 | 60.7 | Цепочки 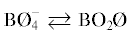 |
| 14.9 | 55.4 | 22.7 | 78.1 | |
| 16.9 | 65.9 | 19.4 | 85.3 | В3О3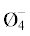 B5O6 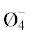 B5O6 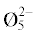 B4O5 B4O5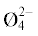 |
| 18.2 | 48.2 | 17.4 | 65.6 | |
| 20.6 | 72.3 | 23.7 | 96.0 | |
| 24.1 | 65.0 | 22.6 | 87.6 | |
| 29.1 | 45.1 | 23.7 | 78.0 | |
| 39.8 | 78.4 | 25.4 | 103.8 | |
| 43.7 | 67.9 | 25.2 | 93.1 | |
| 55.7 | 11.5 | 20.2 | 31.7 | |
Из табл. 3 следует, что зависимость энергии активации вязкого течения литиевоборатных расплавов
εh, U∞, Fη от состава достаточно сложная и определяется несколькими факторами. При х < 6.7 мол. % она зависит от количества мостиковых атомов кислорода BIV–O–BIV , входящих в состав цепочек из полиэдров B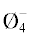 . При концентрациях оксида лития больше 6.7 мол. % величины активационных энергий
обусловлены соотношением кинетических единиц B
. При концентрациях оксида лития больше 6.7 мол. % величины активационных энергий
обусловлены соотношением кинетических единиц B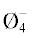 /BØ2O–, а также типом кольцевых группировок, формирующих мостиковые связи BIV–O–BIV. Необходимо отметить, что минимумы энергии активации вязкого течения в расплавах
Fη приходятся на составы 8.9, 18.2 и 29.1 мол. % Li2O, в которых отношение концентраций B
/BØ2O–, а также типом кольцевых группировок, формирующих мостиковые связи BIV–O–BIV. Необходимо отметить, что минимумы энергии активации вязкого течения в расплавах
Fη приходятся на составы 8.9, 18.2 и 29.1 мол. % Li2O, в которых отношение концентраций B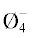 /BØ2O– является максимальным.
/BØ2O– является максимальным.
ЗАКЛЮЧЕНИЕ
Методом вибрационной вискозиметрии измерена вязкость литиевоборатных расплавов в температурном 1003—1630 К и концентрационном 0 ≤ х ≤ 56 мол. % Li2O интервалах.
В области малых концентраций 0 ≤ х ≤ 9 мол. % Li2O снижение вязкости вызвано образованием цепочек из полиэдров ${\text{BO}}_{4}^{ - }$, а увеличение вязкости при 9 ≤ х ≤ 11 мол. % Li2O – образованием кольцевых триборатных групп.
В целом нелинейное изменение вязкости с увеличением концентрации оксида лития связано с конверсией ${\text{BO}}_{4}^{ - }$ в группы BØ2O–, входящих в другие типы кольцевых полиборатных цепочек.
С использованием конфигурационной теории вязкого течения вычислены конфигурационная энергия активации εh и энергия переключения мостиковых связей U∞ для исследованных составов расплава.
В области температур 1200—1300 К наблюдается излом, который разделяет зависимость lg η = f(1/T) на низко- и высокотемпературный интервалы и связан с распадом кольцевых боратных группировок при увеличении температуры.
Список литературы
Shartsis L., Capps W., Spinner S. Viscosity and Electrical Resistivity of Molten Alkali Borates // J. Am. Ceram. Soc. 1953. V. 36. № 10. P. 319–326.
Мусихин В.И., Кудряшов В.Н. Строение и свойства металлургических расплавов Свердловск: Ин-т металлургии УНЦ АН СССР, 1974. Т. 28. С. 91–96.
Ota R., Soga N., Yogyo-Kyokai-Shi // J. Ceram. Soc. Jpn. 1983. V. 91. № 6. P. 265–271.
Liu H., Shen G., Wang X., Wei J.D. Viscosity and Ir Investigations in the Li2O-B2O3 System // Prog. Cryst. Growth Character. Mater. 2000. V. 40. P. 235–241.
Chryssikos G.D., Duffy J.A., Hutchinson J.M., Ingram M.D., Kamitsos E.I., Pappin A.J. Lithium Borate Glasses: a Quantitative Study of Strength and Fragility // J. Non-Cryst. Solids. 1994. V. 172–174. Part 1. P. 378–383.
Kojima S., Novikov V.N., Kodama M. Fast Relaxation, Boson Peak, and Anharmonicity in Li2O–B2O3 Glasses // J. Chem. Phys. 2000. V. 113. № 15. P. 6344–6350.
Соловьев А.Н., Каплун А.Б. Вибрационный метод измерения вязкости жидкостей. Новосибирск: Наука, 1970. 140 с.
Viswanath D.S., Ghosh. T.K., Prasad D.H.L., Dutt N.V.K., Rani K.Y. Viscosity of liquids. Theory, Estimation, and Data. Dordrecht: Springer, 2007.
Штенгельмейер С.В., Прусов В.А., Бочегов В.А. Усовершенствование методики измерения вязкости вибрационным вискозиметром // Завод. лаб. 1985. Т. 51. № 9. С. 56–57.
Голубков В.В. Структура B2O3 и щелочных боратов в стеклообразном и расплавленном состоянии // Физика и химия стекла. 1992. Т. 18. № 2. С. 14–33.
Осипов А.А., Осипова Л.М., Быков В.Н. Структура щелочноборатных стекол и расплавов. Миасс. 2009. С. 417.
Сандитов Д.С. Вязкость стеклообразующих расплавов в области перехода “жидкость-стекло” // ЖЭТФ. 2010. Т. 137. № 4. С. 767–782.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы