Неорганические материалы, 2022, T. 58, № 5, стр. 530-537
Термодинамическое моделирование фазовых равновесий в системе Nb–Zr–N
А. Л. Восков 1, И. А. Ковалев 2, *, Г. П. Кочанов 2, А. В. Шокодько 2, А. И. Огарков 2, С. С. Стрельникова 2, А. С. Чернявский 2, К. А. Солнцев 1, 2
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
* E-mail: vankovalskij@mail.ru
Поступила в редакцию 19.11.2021
После доработки 11.02.2022
Принята к публикации 12.02.2022
- EDN: OXUCVQ
- DOI: 10.31857/S0002337X22050116
Аннотация
Предложена термодинамическая модель конденсированных фаз в тройной системе Nb–Zr–N при 298–3000 K, основанная как на имеющихся экспериментальных данных, так и на существующих моделях бинарных подсистем Nb–Zr, Nb–N и Zr–N. Полученная модель согласуется с имеющейся субсолидусной фазовой диаграммой системы Nb–Zr–N, а также позволяет оценивать фазовые равновесия с участием жидкой фазы.
ВВЕДЕНИЕ
Сплавы на основе ниобия имеют практическое значение из-за своей тугоплавкости, жаропрочности, сверхпроводящих свойств. Тройная система ниобий–цирконий–азот представляет интерес для синтеза твердой и стойкой к окислению керамики, защитных нитридных покрытий, упрочнения сплавов ниобия введением в них нитридов и т. п. [1]. Для тройной системы Nb–Zr–N получена субсолидусная фазовая диаграмма [2, 3], а также измерены температура и состав эвтектики в квазибинарной подсистеме Nb–ZrN [4]. В литературе не описана термодинамическая модель тройной системы Nb–Zr–N.
Для тройной системы Nb–Zr–N имеются фазовые диаграммы всех ее двойных подсистем – Nb–Zr, Nb–N и Zr–N, рассчитанные на основе термодинамических моделей присутствующих в ней фаз в них, т. е. полученные с помощью подхода CALPHAD (CALculation of PHAse Diagrams) [5]. Во всех этих моделях использовались термодинамические свойства полиморфных модификаций простых веществ из SGTE Unary Database 5.0 [6]. Согласно этой базе данных, у циркония имеются две полиморфные модификации: α-Zr и β-Zr с кристаллическими решетками ГПУ (hcp) и ОЦК (bcc) соответственно. Температура перехода α-Zr–β-Zr – 1139.45 K, температура плавления β‑Zr – 2127.85 K. У ниобия – одна полиморфная модификация с ОЦК-решеткой и Tпл = 2750 K.
Литературные данные по термодинамическим свойствам фаз в тройной системе Nb–Zr–N весьма неполны. Так, в работе [2] получили субсолидусную фазовую диаграмму системы Nb–Zr–N, которая приведена в обзорных работах [1, 3]. На ней присутствуют равновесия Nb–Nb2N–β-Zr, Nb–Nb2N–(Nb,Zr)N и Nb–ZrN, а тройные соединения отсутствуют. Все фазы системы Nb–Zr–N приведены в табл. 1.
Таблица 1.
Фазы, кристаллические решетки и термодинамические модели подрешеток в системе Nb–Zr–N
| Фаза | Кристаллическая решетка | Модель подрешеток |
|---|---|---|
| liq (расплав) | – | (Nb,Zr,N) |
| Α-Zr | hcp (ГПУ) | (Nb,Zr)1(N,V)0.5 |
| Nb2N | hcp (ГПУ) | (Nb,Zr)1(N,V)0.5 |
| (Nb, β-Zr) | bcc (ОЦК) | (Nb,Zr)1(N,V)3 |
| (Nb, Zr)Nx | fcc (ГЦК) | (Nb,Zr)1(N,V)1 |
| N2 (газ) | – | – |
Также изучены квазибинарные подсистемы NbN–ZrN и Nb–ZrN. Согласно данным [7, 8], мононитриды ниобия NbN и циркония ZrN с ГЦК-решеткой неограниченно растворяются друг в друге, хотя в [3] на основе параметров ячеек твердых растворов предсказывается появление расслаивания при T < 775 K. Квазибинарная система Nb–ZrN изучалась в работе [4], в ней была найдена эвтектика с x(ZrN) = 10.1–10.6 мол. % и Tпл = 2703 K (2430°C).
Термодинамическая модель системы Nb–Zr и ее расчетная фазовая диаграмма предложены в работе [9]. В ней есть три фазы: расплав, твердые растворы с ОЦК- и ГПУ-решетками. В ОЦК-растворе появляется расслаивание при T < 1259 K. Температура появления жидкой фазы в этой двойной системе – 2041 K, xZr = 0.81. В ГПУ-растворе имеется ограниченная взаимная растворимость Nb в Zr и Zr в Nb. В жидкости расслаивания не наблюдается.
Термодинамическая модель системы Nb–N и ее расчетная фазовая диаграмма предложены в работе [10]. В ней есть четыре фазы: расплав, твердый раствор азота в ниобии, а также соединения Nb2N и NbN с областями нестехиометрии. При p(N2) = 1 бар нитрид Nb2N с ГПУ-решеткой инконгруэнтно плавится при 2858 K с выделением N2, а нитрид NbN с ГЦК-решеткой разлагается при 2343 K на азот и NbN.
Термодинамическая модель системы Zr–N и ее расчетная фазовая диаграмма предложены в работе [11]. Она основана на модели, полученной ранее [12]. В этой бинарной подсистеме имеется только одно соединение – нитрид циркония ZrN с ГЦК-решеткой и областью нестехиометрии. При p(N2) = 1 бар и T = 3299 K это соединение имеет состав xZr = 0.48 и инконгруэнтно плавится.
Целью настоящей работы является расчет и построение термодинамической модели тройной системы Nb–Zr–N на основе имеющихся моделей ее бинарных подсистем Nb–Zr, Nb–N, Zr–N.
РАСЧЕТНАЯ ЧАСТЬ
При экстраполяции термодинамических моделей фаз в двойных подсистемах считалось, что нитриды ниобия и циркония NbN и ZrN с кристаллической решеткой ГЦК (fcc) неограниченно растворимы друг в друге во всем интервале температур. Также учитывалось, что температура эвтектического плавления в системе Nb–ZrN составляет 2703 K.
Мольная энергия Гиббса жидкой фазы описывалась полиномами Редлиха–Кистера следующим образом:
Все твердые растворы в тройной системе Nb–Zr–N описывались с помощью модели подрешеток (Nb,Zr)1(N,V)a, энергия Гиббса для которой выглядит следующим образом:
Выражение для ${{G}^{\phi }}\left( {y,T,a} \right)$ приведено на моль составляющих (в т. ч. вакансий), а не на моль компонентов, переход к энергии Гиббса на моль компонентов требует пересчета. Мольные доли составляющих в подрешетках легко выразить через мольные доли компонентов xNb, xZr и xN. Для этого сначала найдем количества компонентов в растворе (Nb,Zr)1(N,V)a с известным составом:
Суммарное число компонентов с учетом того, что ${{y}_{{{\text{Nb}}}}} + {{y}_{{{\text{Zr}}}}} = 1,$
Теперь запишем систему уравнений, связывающую x и y, и решим ее
Полученные соотношения дают возможность перейти от энергии Гиббса на моль составляющих подрешеток ${{G}^{\phi }}(y,T,a)$ к энергии Гиббса на моль компонентов $G_{m}^{\phi }(x,T,a){\kern 1pt} :$
Для воспроизведения фазовых диаграмм бинарных подсистем использовался алгоритм на основе метода выпуклых оболочек, описанный в [14], реализованный на языках программирования Си и MATLAB. Изобарно-изотермические сечения тройной системы Nb–Zr–N рассчитывались в программе TernAPI, также основанной на методе выпуклых оболочек [15].
Параметры тройного взаимодействия ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}}$ и ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}~}}^{{liq}}$ оптимизировались следующим образом:
1. Параметр ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}}$ выбирался для предотвращения расслаивания твердого раствора (Nb,Zr)Nx при T = 1500–3000 K.
2. Параметр тройного взаимодействия для жидкой фазы ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}~}}^{{liq}}$ оптимизировался таким образом, чтобы при 2700 K на квазибинарном сечении Nb–ZrN не образовывалось жидкой фазы. Значение ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}}$ при этом не менялось.
Все использованные или полученные в данной работе параметры термодинамических моделей, за исключением параметров стабильностей элементов из [6], приведены в табл. 2 и 3.
Таблица 2.
Параметры модели подрешеток для трехкомпонентных растворов в системе Nb–Zr–N
| Фаза | Параметры модели, Дж/моль | Источник |
|---|---|---|
| liq | ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}}}}^{{liq}} = 13\,192;$${}_{{}}^{1}L_{{{\text{Nb}},{\text{Zr}}}}^{{liq}} = 10{\kern 1pt} 055$ | [9] |
| ${}_{{}}^{0}L_{{{\text{Nb}},{\text{N}}}}^{{liq}} = - 292\,101;$${}_{{}}^{1}L_{{{\text{Nb}},{\text{N}}}}^{{liq}} = 105\,406$ | [10] | |
| ${}_{{}}^{0}L_{{{\text{Zr}},{\text{N}}}}^{{liq}} = - 427\,557;$${}_{{}}^{1}L_{{{\text{Zr}},{\text{N}}}}^{{liq}} = 153\,838$ | [11] | |
| ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{liq}} = 480\,000$ | Настоящая работа | |
| α-Zr и Nb2N | ${}_{{}}^{0}G_{{{\text{Nb}}:{\text{N}}}}^{{hcp}} = {}_{{}}^{0}G_{{{\text{Nb}}}}^{{bcc}} + 0.25{}_{{}}^{0}G_{{{{{\text{N}}}_{2}}}}^{{gas}} - 135\,568 + 59.295T - 2T\ln T$ | [10] |
| ${}_{{}}^{0}L_{{{\text{Zr}}:{\text{N}},V}}^{{hcp}} = - 139\,011 + 45.439T;$${}_{{}}^{0}L_{{{\text{Zr}}:{\text{N}},V}}^{{hcp}} = - 41\,938$ | [11] | |
| ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}}}}^{{hcp}} = 24\,411$ | [9] | |
| (β-Zr, Nb) | ${}_{{}}^{0}L_{{{\text{Nb}}:{\text{N}},V}}^{{bcc}} = - 357\,277 + 129.474T;$${}_{{}}^{0}G_{{{\text{Nb}}:{\text{N}}}}^{{bcc}} = {}_{{}}^{0}G_{{{\text{Nb}}}}^{{bcc}} + 1.5{}_{{}}^{0}G_{{{{{\text{N}}}_{2}}}}^{{gas}} - 207\,283 + 110.085T$ | [10] |
| ${}_{{}}^{0}L_{{{\text{Zr}}:{\text{N}},V}}^{{bcc}} = - 1\,508\,137;$${}_{{}}^{0}G_{{{\text{Zr}}:{\text{N}}}}^{{bcc}} = {}_{{}}^{0}G_{{{\text{Zr}}:{\text{N}}}}^{{fcc}} + {}_{{}}^{0}G_{{{{{\text{N}}}_{2}}}}^{{gas}} + 632\,009 + 321.432T$ | [11] | |
| ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}}}}^{{bcc}} = 14\,390 + 4.26T;$${}_{{}}^{1}L_{{{\text{Nb}},{\text{Zr}}}}^{{bcc}} = 3417$ | [9] | |
| (Zr, Nb)Nx | ${}_{{}}^{0}L_{{{\text{Nb}}:{\text{N}},V}}^{{fcc}} = - 65\,218;$${}_{{}}^{0}G_{{{\text{Nb}}:{\text{N}}}}^{{fcc}} = {}_{{}}^{0}G_{{{\text{Nb}}}}^{{bcc}} + 0.5{}_{{}}^{0}G_{{{{{\text{N}}}_{2}}}}^{{gas}} - 227\,779 + 120.567T - 4T\ln T$ | [10] |
| ${}_{{}}^{0}L_{{{\text{Zr}}:{\text{N}},V}}^{{fcc}} = 19\,575;$${}_{{}}^{0}G_{{{\text{Zr}}:{\text{N}}}}^{{fcc}} = FT$ | [11] | |
| ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}} = - 55\,000$ | Настоящая работа |
Таблица 3.
| Уравнение (в Дж/моль) | Температурный интервал, K |
|---|---|
| −367080.182 + 278.330233T − 46.4312194TlnT − 3.52792791 × 10–3T 2 + 1.33236681 × 10–9T 3 + + 358416.094/T | 298.15–2000 |
| −309671.768 − 11.4672139T − 9.01132806T lnT – 1.42983599 × 10–2T 2 + 5.79050986 × 10–7T 3 – ‒ 16048445/T | 2000–2600 |
| −357218.131 + 237.61238T − 41.3250297T lnT − 4.69480362 × 10–3T 2 + 5.0809381 × 10–8T3 – ‒ 3201806/T | 2000–3225 |
| −302090.81 + 345.052575T − 58.5870002T lnT | 3225–5000 |
Из них лишь ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}}$ и ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}~}}^{{liq}}$ получены в данной работе. Если какой-то из параметров избыточной энергии Гиббса, ${}_{{}}^{0}L$ или ${}_{{}}^{1}L,$ не указан в этих таблицах, то он равен 0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Перед расчетом фазовой диаграммы тройной системы нами были успешно воспроизведены расчетные фазовые диаграммы бинарных подсистем Nb–Zr, Nb–N и Zr–N. Затем были оптимизированы значения параметров ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}}$ и ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}~}}^{{liq}}.$ Рассчитанные в программе TernAPI изобарно-изотермические сечения тройной системы Nb–Zr–N для T = 298.15, 1500, 2000, 2700 и 3000 K и p(N2) = 1 бар представлены на рис. 1, 2, 3, 4 и 5 соответственно.
Рис. 1.
Расчетное изобарно-изотермическое сечение тройной системы Nb–Zr–N при T = 298.15 K и p(N2) = 1 бар.
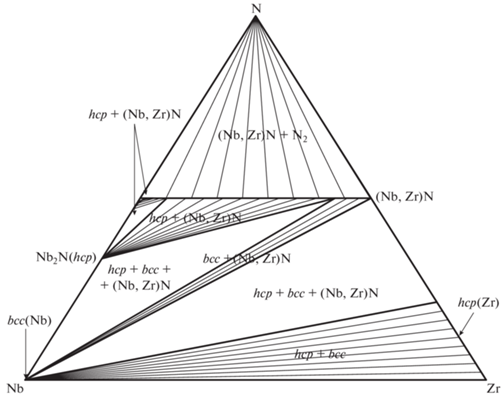
Рис. 2.
Расчетное изобарно-изотермическое сечение тройной системы Nb–Zr–N при T = 1500 K и p(N2) = 1 бар.
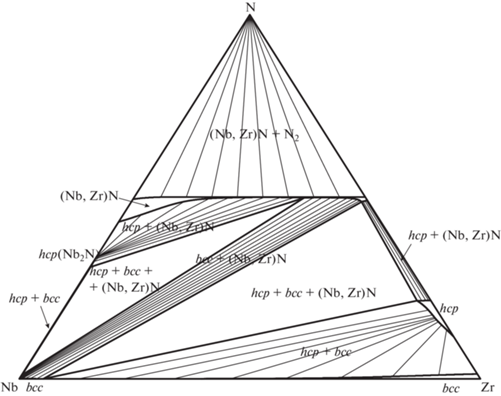
Рис. 3.
Расчетное изобарно-изотермическое сечение тройной системы Nb–Zr–N при T = 2000 K и p(N2) = 1 бар.
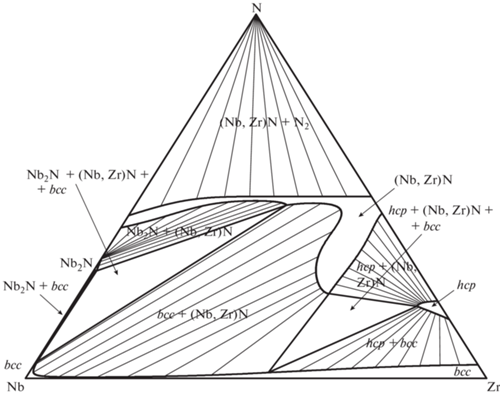
Рис. 4.
Расчетное изобарно-изотермическое сечение тройной системы Nb–Zr–N при T = 2700 K и p(N2) = 1 бар.
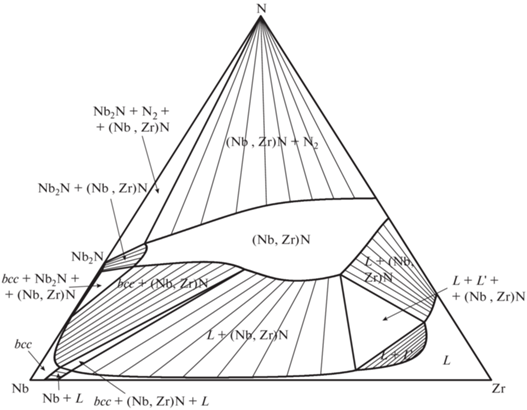
Рис. 5.
Расчетное изобарно-изотермическое сечение тройной системы Nb–Zr–N при T = 3000 K и p(N2) = 1 бар.
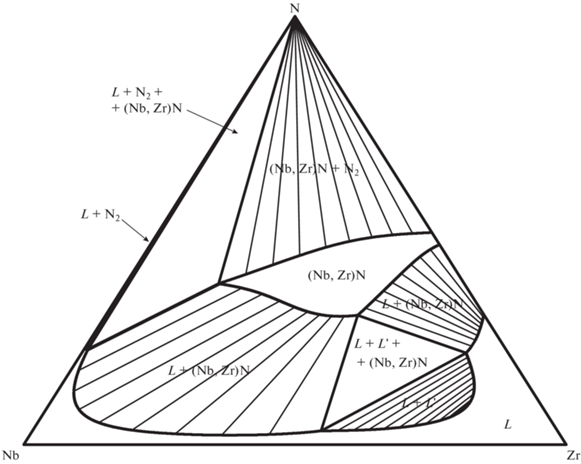
Изобарно-изотермические сечения для T = = 298.15 и 1500 K согласуются с приведенными в обзорах [1, 3]. При T = 298.15 K на диаграмме наблюдается артефакт, не описанный в литературе, – расслаивание раствора (Nb,Zr)Nx вблизи состава NbN с сохранением гомогенности на квазибинарном сечении NbN–ZrN (см. рис. 1). Попытки избавиться от него изменением значения ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}}}^{{fcc}}$ или введением в модель твердого fcc-раствора полиномов высших порядков к успеху не привели. Также с ростом температуры (но только до появления жидкой фазы) растет ширина области нестехиометрии твердого раствора (Nb,Zr)Nx, что связано с аналогичными изменениями для чистого ZrN1 – x [11].
На сечениях для T = 2700 и 3000 K (см. рис. 4 и 5) наблюдается жидкая фаза, расслаивающаяся в области составов, богатой цирконием. Эта область расслаивания не вводилась целенаправленно на основе экспериментальных данных, а получилась за счет большого положительного значения параметра ${}_{{}}^{0}L_{{{\text{Nb}},{\text{Zr}},{\text{N}}~}}^{{liq}},$ необходимого для предотвращения появления жидкой фазы на квазибинарном сечении Nb–ZrN при T < 2703 K.
ЗАКЛЮЧЕНИЕ
Полученная термодинамическая модель тройной системы Nb–Zr–N согласуется с имеющимися в литературе субсолидусными изобарно-изотермическими сечениями, а также температурой эвтектики в квазибинарной подсистеме Nb–ZrN. Но следует с осторожностью относиться к предсказываемым этой моделью ликвидусам, а также областям нестехиометрии твердого раствора (Nb, Zr)Nx, т. к. соответствующие параметры тройного взаимодействия получены на основе весьма скудного набора экспериментальных данных. Для дальнейшего уточнения модели нужны новые данные по фазовым равновесиям с участием жидкой фазы, а также по областям нестехиометрии тройных твердых растворов.
Список литературы
Sheftel E.N., Bannykh O.A. Niobium-Base Alloys // Int. J. Refract. Met. Hard Mater. 1993–1994. V. 12. № 5. P. 303–314. https://doi.org/10.1016/0263-4368(93)90038-H
Баньковский О.И., Моисеев В.Ф., Печковский Э.П., Трефилов В.И. Фазовый состав литых сплавов Nb–Zr–N при температурах солидуса // Металлофизика. 1974. № 53. С. 103–109.
Holleck H. Binary and Ternary Carbides and Nitrides of. the Transition Metals and Their Phase Relations. Karlsruhe: Kernforschungszentrum, 1981. 340 p.
Барабаш О.М., Козырский Г.Я., Шульженко В.К., Шурин А.К. Структура и прочность сплавов Nb–ZrN // Изв. АН СССР. Металлы. 1976. № 3. С. 220–225.
Saunders N., Miodownik A.P. CALPHAD (Calculation of Phase Diagrams): A Comprehensive Guide. Elsevier, 1998. 478 p.
Dinsdale A.T. SGTE Data for Pure Elements // CALPHAD. 1991. V. 15. № 4. P. 317–425. https://doi.org/10.1016/0364-5916(91)90030-N
Duwez P., Odell F. Phase Relationships in the Binary Systems of Nitrides and Carbides of Zr, Nb, Nb and V // J. Electrochem. Soc. 1950. V. 97. № 10. P. 299–304.
Toth L.E., Yen C.M., Rosner L.G., Anderson D.E. Superconducting Critical Fields, Currents and Temperatures in the Nb–Zr–N Ternary System // J. Phys. Chem. Solids. 1966. V. 27. № 11–12. P. 1815–1819. https://doi.org/10.1016/0022-3697(66)90112-0
Lafaye P., Toffolon-Masclet C., Crivello J.-C., Joubert J.-M. Experimental Investigations and Thermodynamic Modelling of the Cr–Nb–Sn–Zr System // CALPHAD. 2019. V. 64. P. 43–54. https://doi.org/10.1016/j.calphad.2018.11.002
Huang W. Thermodynamic Assessment of the Nb–N System // Metall. Mater. Trans. A. 1996. V. 27. № 11. P. 3591–3600. https://doi.org/10.1007/BF02595450
Sridar S., Kumar R., Hari Kumar K.C. Thermodynamic Modelling of Ti–Zr–N System // CALPHAD. 2017. V. 56. P. 102–107. https://doi.org/10.1016/j.calphad.2016.12.003
Xiaoyan Ma, Changrong Li, Kewu Bai, Ping Wu, Weijing Zhang Thermodynamic Assessment of the Zr–N System // J. Alloys Compd. 2004. V. 373. № 1–2. P. 194–201. https://doi.org/10.1016/j.jallcom.2003.10.051
Hillert M. The Compound Energy Formalism // J. Alloys Compd. 2001. V. 320. № 2. P. 161–176. https://doi.org/10.1016/S0925-8388(00)01481-X
Chen S.L., Zhang J.Y., Lu X.G. et al. Application of Graham Scan Algorithm in Binary Phase Diagram Calculation // J. Phase Equilib. Diffus. 2006. V. 27. № 2. P. 121–125. https://doi.org/10.1007/s11669-006-0034-y
Voskov A.L., Dzuban A.V., Maksimov A.I. TernAPI Program for the Calculation of Ternary Phase Diagrams with Isolated Miscibility Gaps by the Convex Hull Method // Fluid Phase Equilib. 2015. V. 388. P. 50–58. https://doi.org/10.1016/j.fluid.2014.12.028
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


