Неорганические материалы, 2022, T. 58, № 7, стр. 742-749
Адсорбционные и фотокаталитические свойства диоксида титана, модифицированного молибденом
М. Л. Беликов 1, *, С. А. Сафарян 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Мурманская обл, Апатиты, Академгородок, 26а, Россия
* E-mail: masim-bek@mail.ru
Поступила в редакцию 24.02.2022
После доработки 23.03.2022
Принята к публикации 24.03.2022
- EDN: MXLSEJ
- DOI: 10.31857/S0002337X2207003X
Аннотация
Синтезированы фотокаталитически активные материалы на основе диоксида титана, модифицированного молибденом. Изучены особенности формирования полученных материалов, их физико-химические, адсорбционные и фотокаталитические свойства. Синтезированные композиты обладают высокой адсорбционной способностью и фотокаталитической активностью (ФКА), значительно превышающей ФКА немодифицированного TiO2 схожего генезиса и промышленного диоксида титана Р25 фирмы Degussa. Образцы, содержащие анатаз с молибденом, внедренным в его кристаллическую решетку, демонстрируют максимальную ФКА.
ВВЕДЕНИЕ
О фотокаталитических свойствах диоксида титана сообщалось еще в 20-е годы двадцатого века [1, 2], однако особое внимание на диоксид титана как фотокатализатор (ФК) обратили после публикации Fujishima и Honda [3] в 1972 г., в которой была показана возможность фотокаталитического расщепления воды в присутствии TiO2. Диоксид титана, обладая высокой фотокаталистической активностью (ФКА), оказался высокоэффективным при деградации многих органических загрязнителей [4–7], в том числе различной микробиоты [8–10].
Кроме диоксида титана, в качестве ФК применяются различные полупроводниковые материалы: ZnO [11], WO3 [12, 13], Fe2O3 [14], CdSe [15], SrTiO3 [16] и др.
Однако из множества материалов, изученных для фотокатализа, лишь диоксид титана обладает рядом необходимых свойств: высокая ФКА, физическая, химическая и биологическая устойчивость, доступность, нетоксичность [4, 17].
Несмотря на преимущества, чистый диоксид титана, вследствие значительной энергии запрещенной зоны (Eg = 3.2 эВ для анатаза и 3.0 эВ для рутила), фотокаталитически активен лишь при облучении ультрафиолетовым (УФ) светом, что приводит к очень низкой эффективности использования солнечного света. Доля УФ-света составляет всего около 3–7% солнечного спектра, доля же видимого света – ~45% [18–21]. Этот факт существенно ограничивает применение TiO2 как ФК при облучении светом с длиной волны λ > 400 нм. Расширение спектрального диапазона фотовосприимчивости TiO2 в видимую и ближнюю ИК-области может быть достигнуто введением различных модифицирующих добавок. Результатом модифицирования диоксида титана является смещение края его фотокаталитической восприимчивости в более длинноволновую область спектра и, как следствие, уменьшение Eg [22].
Ранее авторами [23–25] было показано, что модифицирование диоксида титана различными катионами приводит к существенному улучшению его фотокаталитических свойств.
Перспективным модификатором диоксида титана является молибден. Молибден является переходным металлом, и модифицирование TiO2 им может смещать край спектрального поглощения в видимую область и, как следствие, усиливать ФКА TiO2 [26–29].
Так, в работе [30] сообщается об увеличении фотокаталитической эффективности Мо-модифицированного диоксида титана при очистке фармацевтических сточных вод в сравнении с немодифицированным TiO2. Модифицирование диоксида титана молибденом улучшает эффективность разложения метиленового синего [31]; при этом сообщается, что оптимальная температура прокалки образца составляла 550°C, а оптимальное количество Mo в диоксиде титана составляло 2 мас. %. В работах [32, 33] продемонстрировано, что тонкие пленки диоксида титана, модифицированного молибденом, проявляют повышенные фотокаталитические свойства.
В данной работе предпринята попытка поиска оптимальных составов ФК и условий их термообработки при использовании простого метода синтеза.
Цель работы – синтез материалов на основе Mо-модифицированного диоксида титана, фотокаталитически активных при облучении видимым светом, а также исследование их физико-химических, адсорбционных и фотокаталитических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фотокаталитические материалы синтезировали в процессе совместного щелочного гидролиза TiCl4 (99.9%, Соликамский магниевый завод, Россия) и водорастворимой соли молибдена (NH4)6[Mo7O24]·4H2O (99%, Нева-Реактив, Россия) в гидроксиде аммония (25%, Нева-Реактив, Россия) по методике, приведенной в работах [23, 25, 34]. Термообработку проводили в температурном диапазоне 300–800°С при скорости нагрева/охлаждения 15°С/мин и выдержке при заданной температуре в течение 60 мин. При варьировании содержания модифицирующего металла в пределах 0.1–3.1 мас. % и термообработке на воздухе получали ФКА-материалы, охарактеризованные методами химического анализа, рентгенофлуоресцентного анализа, рентгенофазового анализа (РФА, ДРОН-3, излучение CuKα), низкотемпературной адсорбции азота (БЭТ, FlowSorb II 2300, TriStar 3020 V1. 03).
Адсорбционную способность и ФКА полученных материалов оценивали фотоколориметрически (спектрофотометр СФ-56) по степени обесцвечивания растворов, содержащих по 50–100 мг/л красителей: ферроина (C12H8N2)3⋅FeSO4 (“ч. д. а.”, Нева-Реактив, Россия), метиленового синего (МС) C16H18N3SCl⋅H2O (“ч. д. а.”, Реахим, Россия) или анилинового (анилин) C27H34N2O4S (“х. ч.”, Реахим, Россия), в полной темноте или при облучении суспензий видимым светом (λ > 400 нм).
Для изучения ФКА и адсорбции навеску ФК массой 0.1 г помещали в стеклянную колбу емкостью 250 мл с 50 мл раствора красителя. Суспензию, находящуюся на свету (искусственное освещение, лампа накаливания, 100 Вт, степень освещенности 4300 лк (контролировалась с помощью люксометра ТКА-ПКМ(06), Россия)) или в изоляции от освещения, выдерживали 2 ч при встряхивании колбы с частотой 200 мин–1 на перемешивающем устройстве ЛАБ-ПУ-01.
После разделения суспензии центрифугированием определяли остаточную концентрацию красителя в полученном растворе. Применение фильтрации для отделения раствора оказалось невозможным из-за значительных потерь красителя на фильтровальной бумаге [35].
О величине адсорбции судили по количеству сорбированного ФК красителя, отнесенному к единице массы порошка:
где А – адсорбция (мг/г), С0 – исходная концентрация красителя в растворе (мг/л), Ск – конечная концентрация красителя в растворе (мг/л), V – объем раствора (л), m – масса навески исследуемого порошка (г). Степень ФКА (%) рассчитывали по формулеОбразцами сравнения служили: TiO2 аналогичного с модифицированным молибденом TiO2 генезиса и промышленный TiO2 фирмы Degussa – P-25 (Degussa AG, Франкфурт, Германия), предложенный ранее в качестве стандарта сравнения [36]. Маркировка образцов модифицированного TiO2, например, 600-Мо-3.1 содержит данные о температуре термообработки – 600°С, модифицирующем металле – Мо и его содержании в композите – 3.1 мас. %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
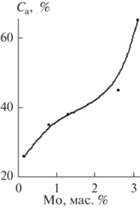
Фазообразование. РФА показывает, что в процессе гидролиза во всех случаях формируется осадок, сохраняющий свою рентгеноаморфность до 300°С. Увеличение содержания в диоксиде титана молибдена в диапазоне 0.15–3.1 мас. % не приводит к увеличению температуры начала кристаллизации анатаза. Фазовый переход анатаз–рутил протекает во всех случаях при температуре 800°С (рис. 1, табл. 1). Однако процентное содержание анатаза с увеличением степени модифицирования молибденом при прокаливании (800°С) растет (рис. 2). Переход анатаз–рутил смещается в более высокотемпературную область, поэтому при увеличении степени модифицирования до 3.1 мас. % анатаза, не перешедшего в рутил, при 800°С в 2.5 больше, чем при содержании 0.15 мас. % Мо, что может указывать и на сохранение высокой ФКА прокаленных при 800°С продуктов. Это имеет значение при высокотемпературной регенерации фотокаталитических материалов “выжиганием” на их поверхности органических продуктов распада красителей.
Рис. 1.
Дифрактограммы Mо-модифицированного диоксида титана в системе Ti–O–Mо в зависимости от температуры обработки (цифры у кривых, °С) и содержания Mо 0.15 (а), 3.1 мас. % (б).
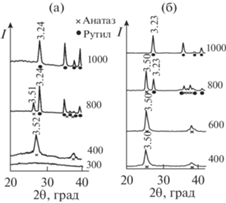
Таблица 1.
Физико-химические свойства TiO2 и его Mо-модифицированных образцов
| Образец | t, °C | С, мас. % | РФА | S, м2/г | d, нм | |||
|---|---|---|---|---|---|---|---|---|
| TiO2 | Cl– | N${\text{H}}_{4}^{ + }$ | Mo6+ | БЭТ | ||||
| 80-Мо-0 | 80 | 79.8 | 1.06 | 2.84 | 0 | ам | 270.0 | 8.54 |
| 300-Мо-0 | 300 | – | – | – | 0 | ам | 258.8 | 8.9 |
| 400-Мо-0 | 400 | 98.5 | 0.06 | 0.42 | 0 | а | 155.4 | 9.90 |
| 600-Мо-0 | 600 | 99.8 | 0 | 0.02 | 0 | а | 34.2 | 45.0 |
| 800-Мо-0 | 800 | – | – | – | 0 | а, р | 2.95 | 484.3 |
| P-25 | – | – | 0 | 0 | 0 | а, р | 48.4 | 29.5 |
| 80-Mо-0.15 | 80 | – | <0.001 | 3.84 | – | ам | 394 | 5.9 |
| 300-Mо-0.15 | 300 | – | – | – | – | ам | 302 | 7.6 |
| 400-Mо-0.15 | 400 | – | – | – | – | а | 159 | 14.5 |
| 600-Mо-0.15 | 600 | 99.8 | <0.001 | 0.072 | 0.15 | – | 29 | 53 |
| 800-Mо-0.15 | 800 | – | – | – | – | а, р | 6.3 | 227 |
| 80-Mо-0.3 | 80 | – | <0.001 | 3.31 | – | ам | 326 | 7.1 |
| 300-Mо-0.3 | 300 | – | – | – | – | ам | – | – |
| 400-Mо-0.3 | 400 | – | – | – | – | а | 211 | 7.3 |
| 600-Mо-0.3 | 600 | 99.6 | <0.001 | 0.078 | 0.3 | а, р | 15 | 103 |
| 800-Mо-0.3 | 800 | – | – | – | – | а, р | 8 | 179 |
| 80-Mо-0.8 | 80 | – | <0.001 | 4.12 | – | ам | 285 | 8.1 |
| 300-Mо-0.8 | 300 | – | – | – | – | ам | 226 | 10.2 |
| 400-Mо-0.8 | 400 | – | – | – | – | а | 61 | 25 |
| 600-Mо-0.8 | 600 | 98.77 | <0.001 | 0.064 | 0.8 | а | 17 | 90 |
| 800-Mо-0.8 | 800 | – | – | – | – | а, р | 5.7 | 257 |
| 80-Mо-1.3 | 80 | – | <0.001 | 3.91 | – | ам | 132 | 17.5 |
| 300-Mо-1.3 | 300 | – | – | – | – | ам | 225 | 10.3 |
| 400-Mо-1.3 | 400 | – | – | – | – | а | 142 | 10.8 |
| 600-Mо-1.3 | 600 | 98.1 | <0.001 | 0.05 | 1.3 | а | 15.7 | 91 |
| 800-Mо-1.3 | 800 | – | – | – | – | а, р | 7.7 | 186 |
| 80-Mо-2.6 | 80 | – | – | – | – | ам | – | – |
| 300-Mо-2.6 | 300 | – | – | – | – | ам | – | – |
| 400-Mо-2.6 | 400 | – | – | – | – | а | – | – |
| 600-Mо-2.6 | 600 | 96.1 | – | – | 2.6 | а | – | – |
| 800-Mо-2.6 | 800 | – | – | – | а, р | – | – | |
| 80-Mo-3.1 | 80 | – | – | – | – | ам | – | – |
| 300-Mо-3.1 | 300 | – | – | – | – | ам | 190 | 12.1 |
| 400-Mо-3.1 | 400 | – | – | – | – | а | 148 | 10.4 |
| 600-Mо-3.1 | 600 | 95.4 | – | – | 3.1 | а | 35 | 55 |
| 800-Mо-3.1 | 800 | – | – | – | – | а, р | 8.3 | 238 |
Рис. 2.
Зависимость содержания анатаза в образцах диоксида титана, прокаленных при 800°С, от содержания молибдена.
Отдельных фаз, образованных молибденом (МоО3 и/или МоО2), с помощью РФА не обнаружено, что связано с точностью метода (≥5 мас. %). Также авторы полагают на примере W-модифицированного диоксида титана [37], что Мо в виде иона Мо6+ внедряется в структуру TiO2. Ионный радиус Мо6+ составляет 0.062 нм, а Ti4+ – 0.068 нм [38]. Оттенки серого цвета прокаленных при 500–800°С порошков указывают на наличие в диоксиде титана примеси молибдена, что подтверждается химическим анализом.
Повышение температуры термообработки продуктов гидролиза ведет к сокращению удельной поверхности порошков (табл. 1, рис. 3), связанному с трансформацией рентгеноаморфного продукта в анатаз и рутил. Значения удельной поверхности всех модифицированных образцов остаются довольно высокими во всем диапазоне температур термообработки, что благоприятно сказывается на их адсорбционной способности и ФКА.
Рис. 3.
Зависимости удельной поверхности TiO2 и Мо-модифицированных порошков TiO2 от температуры термообработки и содержания Мо: 1 – 0, 2 – 0.15, 3 – 0.3, 4 – 0.8, 5 – 1.3, 6 – 3.1 мас. %.
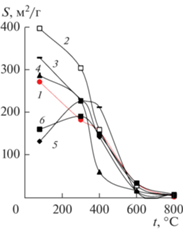
Следует заметить, что более развитой поверхностью по сравнению с чистым TiO2 подобного генезиса обладают менее модифицированные (0.15, 0.3 мас. % Мо) образцы. С повышением содержания Mо от 0.8 до 1.3 мас. % удельная поверхность рентгеноаморфных образцов заметно снижается (рис. 3). С началом фазообразования при температурах выше 400°С эта разница значительно сокращается.
Таким образом, особенностью продуктов синтеза в системе Ti–O–Mо является формирование нескольких полифазных зон в зависимости от модифицирования и температуры термообработки с возможными фазовыми переходами: рентгеноаморфная масса → анатаз → рутил, зависящими от содержания Мо.
Адсорбция и ФКА. Экспериментальные данные по адсорбции (А) и ФКА (Е) различных красителей представлены в табл. 2 и на рис. 4, 5.
Таблица 2.
Зависимость адсорбции (А) и ФКА (Е) образцов TiO2 от степени модифицирования Мо, температуры термообработки, удельной поверхности и фазового состава
| Образец | t, °С | РФА | S, м2/г | А, мг/г | Е, % | А, мг/г | Е, % | А, мг/г | Е, % |
|---|---|---|---|---|---|---|---|---|---|
| ферроин (С = 100 мг/л) | МС (С = 50 мг/л) | анилин (С = 100 мг/л) | |||||||
| Р-25 | – | а, р | 48 | 0 | 0 | 0 | 1.2 | 0 | 1.2 |
| 500-Мо-0 | 500 | а | 52.4 | 3.11 | 3.8 | 0.00 | 0 | 36.30 | 34.7 |
| 600-Мо-0 | 600 | а | 34.2 | 20.20 | 3.4 | 18.20 | 0 | 28.26 | 41.1 |
| 800-Мо-0 | 800 | а, р | 2.95 | 1.05 | 1.7 | 0.23 | 0 | 7.68 | 4 |
| 500-Mо-0.15 | 500 | а | 113 | 0.91 | 0 | 0.00 | 0.66 | 8.99 | 17.6 |
| 600-Mо-0.15 | 600 | – | 29 | 0.40 | 2.41 | 0.00 | 0.04 | 21.43 | 8.4 |
| 800-Mо-0.15 | 800 | а, р | 6.3 | 4.11 | 2.54 | 3.70 | 18.32 | – | 10.7 |
| 500-Mо-0.3 | 500 | а | 113 | 2.34 | 2.5 | 0.61 | 13.4 | 37.53 | 34 |
| 600-Mо-0.3 | 600 | а, р | 15 | 2.20 | 7.2 | 3.13 | 10.7 | 30.71 | 24.6 |
| 800-Mо-0.3 | 800 | а, р | 8 | 8.00 | 10.8 | 6.58 | 34.0 | – | 9.3 |
| 500-Mо-0.8 | 500 | а | 39 | 2.12 | 2.1 | 0.70 | 6.6 | 43.55 | 44.2 |
| 600-Mо-0.8 | 600 | а | 17 | 2.17 | 6.5 | 3.60 | 11.5 | 29.54 | 24.0 |
| 800-Mо-0.8 | 800 | а, р | 5.7 | 7.54 | 14.2 | 7.61 | 33.3 | – | 11.0 |
| 500-Mо-1.3 | 500 | а | 79 | 2.97 | 5.3 | 4.25 | 28.4 | 28.63 | 19.4 |
| 600-Mо-1.3 | 600 | а | 15.7 | 6.68 | 10.9 | 9.56 | 27.5 | 9.87 | 9.7 |
| 800-Mо-1.3 | 800 | а, р | 7.7 | 15.19 | 28.6 | 12.72 | 52.5 | – | 1.1 |
| 500-Mо-2.6 | 500 | а | – | 9.04 | 23.3 | 10.33 | 54.5 | – | 47.8 |
| 600-Mо-2.6 | 600 | а | – | 20.70 | 37.8 | 19.35 | 65.5 | – | 0 |
| 800-Mо-2.6 | 800 | а, р | – | 14.75 | 29.9 | 9.87 | 40.2 | – | 0 |
| 500-Mо-3.1 | 500 | а | 91 | 7.34 | 16.6 | 12.53 | 51.9 | – | 22.2 |
| 600-Mо-3.1 | 600 | а | 35 | 16.23 | 30.1 | 17.03 | 64.7 | – | 14.5 |
| 800-Mо-3.1 | 800 | а, р | 8.3 | 11.69 | 21.4 | 7.14 | 43.9 | – | 0 |
Рис. 4.
Зависимости адсорбции красителя от температуры термообработки при содержании Мо в диоксиде титана: 1 – 0.15, 2 – 0.3, 3 – 0.8, 4 – 1.3, 5 – 3.1, 6 – 0 мас. % для ферроина (а), МС (б), анилина (в).
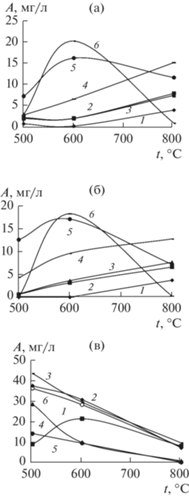
Рис. 5.
Зависимости ФКА TiO2 от температуры термообработки при содержании Мо: 1 – 0.15, 2 – 0.3, 3 – 0.8, 4 – 1.3, 5 – 3.1, 6 – 0 мас. % для ферроина (а), МС (б), анилина (в).
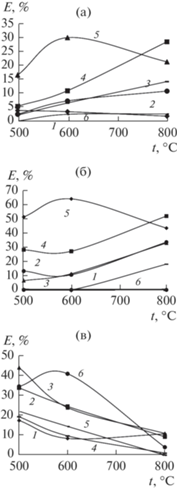
Симбатная зависимость между величинами А и Е, наблюдаемая на рис. 4 и 5, совпадает с результатами [39–41].
Данные по адсорбции и ФКА отражают совокупное влияние содержания модификатора, сочетания структурных компонентов и текстуры порошков, нелинейно зависящих от условий термообработки и объекта деградации. Например, не всегда высокие значения адсорбции и ФКА определяются более развитой поверхностью образцов, прокаленных при температуре 500°С, по сравнению с 600 и даже 800°С (рис. 4, 5).
Мо-модифицированные образцы проявляют более высокую ФКА относительно коммерческого фотокатализатора Р-25 фирмы Degussa (табл. 2, рис. 3, 4) и немодифицированного TiO2 идентичного генезиса. Наилучшие значения адсорбции и ФКА по отношению к ферроину и МС наблюдаются для образцов TiO2, модифицированного 1.3 и 3.1 мас. % Мо, а по отношению к анилину – для образцов TiO2, содержащих 0.3 и 0.8 мас. % Мо. При этом максимальными значениями ФКА по отношению к анилину обладают порошки, прокаленные при температурах 500–600°С, а по отношению к ферроину и МС – при 800°С, что показывает избирательный характер проявления ФКА изучаемых образцов, зависящей от природы красителя и образованных фаз.
Избирательный характер ФКА исследованных материалов по отношению к различным органическим соединениям открывает возможность их применения при организации фотокаталитической очистки воды от органических примесей по схеме: конкретный ФК–конкретный загрязнитель.
Одним из лучших показателей ФКА обладает образец 600-Мо-3.1, на нем провели опыты по циклированию. После каждого цикла ФК отделяли фильтрованием, после чего в одном эксперименте его сушили при температуре 80°С, а в другом – регенерировали прокаливанием при 600°С.
Результаты по циклированию приведены на рис. 6.
Рис. 6.
Зависимости ФКА образца 600-Мо-3.1 от количества циклов на примере ферроина: 1 – порошок после каждого цикла сушили при температуре 80°С, 2 – порошок после каждого цикла регенерировали прокаливанием при температуре 600°С.

Снижение ФКА от цикла к циклу связано с отравлением активных центров ФК продуктами разложения органических веществ, которые могут полностью разложиться за большее время или при термообработке порошка при температуре не менее 400°С. Поэтому высушенный при 80°С порошок постепенно теряет свою способность к фотокаталитической деструкции красителя и к 4-му циклу его ФКА составляет менее 2%, в отличие от образца, регенерированного при температуре 600°С в течение 30 мин. Увеличение времени термообработки до 60 мин приводит к более полной регенерации ФК.
Таким образом, фотокаталитические материалы на основе диоксида титана, модифицированного молибденом, эффективно работают в цикле, однако после каждого цикла требуется регенерация при температуре не менее 400°С в течение 30–60 мин.
ЗАКЛЮЧЕНИЕ
Синтезированы фотокаталитически активные материалы на основе TiO2, модифицированного молибденом в интервале 0.15–3.1 мас. % и прокаленные при температурах 500–800°С.
Изучены физико-химические характеристики полученных материалов, их адсорбционные и фотокаталитические свойства. Подтверждено существование симбатной зависимости между массой адсорбированного из водного раствора органического вещества, отнесенной к единице массы ФК, и его ФКА.
Установлены корреляции между физико-химическими, адсорбционными и фотокаталитическими свойствами полученных материалов.
Показано, что максимальную ФКА по отношению к ферроину и МС проявляют образцы, модифицированные 1.3–3.1 мас. % Мо, прокаленные при 600°С. По отношению к анилину максимальной ФКА обладают образцы, содержащие 0.3 и 0.8 мас. % Мо. Наблюдаемые различия значений ФКА по отношению к разным красителям, по-видимому, связаны с их отличными редокс-потенциалами. Тем не менее наиболее универсальным ФК является образец 600-Мо-3.1.
На примере образца 600-Мо-3.1 показано, что его ФКА в цикле в случае регенерации после каждого цикла стабильна и держится на высоком уровне. Напротив, у нерегенерируемого образца ФКА падает от цикла к циклу. Это связано с отравлением активных центров ФК продуктами разложения органических веществ, которые могут разложиться за большее время или при термообработке порошка при температуре не менее 400°С.
Список литературы
Renz C. Lichtreaktionen der Oxyde des Titans, Cers und der Erdsäuren // Helv. Chim. Acta. 1921. V. 4. P. 961–968. https://doi.org/10.1002/hlca.192100401101
Keidel E. The Fading of Aniline Dyes in the Presence of Titanium White // Farben-Ztg. 1929. V. 34. P. 1242–1243.
Fujishima A., Honda K. Electrochemical Photolysis of Water at a Semiconductor Electrode // Nature. 1972. V. 238. № 5358. P. 37–38. https://doi.org/10.1038/238037a0
Dong H., Zeng G., Tang L., Fan C., Zhang C., He X. An Overview on Limitations of TiO2-Based Particles for Photocatalytic Degradation of Organic Pollutants and the Corresponding Countermeasures // Water. Res. 2015. V. 79. P. 128–146. https://doi.org/10.1016/j.watres.2015.04.038
Jiang L., Wang Y., Feng C. Application of Photocatalytic Technology in Environmental Safety // Procedia Eng. 2012. V. 45. P. 993–997. https://doi.org/10.1016/j.proeng.2012.08.271
Tasbihi M., Călin I., Šuligoj A., Fanetti M., Lavrenčič Štangar U. Photocatalytic Degradation of Gaseous Toluene by Using TiO2 Nanoparticles Immobilized on Fiberglass Cloth // J. Photochem. Photobiol., A. 2017. V. 336. P. 89–97. https://doi.org/10.1016/j.jphotochem.2016.12.025
Bhattacharyya A., Kawi S., Ray M.B. Photocatalytic Degradation of Orange II by TiO2 Catalysts Supported on Adsorbents // Catal. Today. 2004. V. 98. № 3. P. 431–439. https://doi.org/10.1016/j.cattod.2004.08.010
Jacoby W.A., Maness P.C., Wolfrum E.J., Blake D.M., Fennell J.A. Mineralization of Bacterial Cell Mass on a Photocatalytic Surface in Air // Environ. Sci. Technol. 1998. V. 32. № 17. P. 2650–2653. https://doi.org/10.1021/es980036f
Caballero L., Whitehead K.A., Allen N.S., Verran J. Inactivation of Escherichia Coli on Immobilized TiO2 Using Fluorescent Light // J. Photochem. Photobiol. A. 2009. V. 202. № 2. P. 92–98. https://doi.org/10.1016/j.jphotochem.2008.11.005
Hsuan-Liang Liu, Thomas C.-K. Yang. Photocatalytic Inactivation of Escherichia Coli and Lactobacillus Helveticus by ZnO and TiO2 Activated with Ultraviolet Light // Process Biochem. 2003. V. 39. № 4. P. 475–481. https://doi.org/10.1016/S0032-9592(03)00084-0
Burton P., Peterson E., Boyle T. et al. Synthesis of High Surface Area ZnO(0001) Plates as Novel Oxide Supports for Heterogeneous Catalysts // Catal. Lett. 2010. V. 139. № 1. P. 26–32. https://doi.org/10.1007/s10562-010-0405-1
Bignozzi C.A., Caramori S., Cristino V. et al. Nanostructured Photoelectrodes Based on WO3: Applications to Photooxidation of Aqueous Electrolytes // Chem. Soc. Rev. 2013. V. 42. № 6. P. 2228–2246. https://doi.org/10.1039/c2cs35373c
Tian L., Ye L., Liu J. et al. Solvothermal Synthesis of CNTs–WO3 Hybrid Nanostructures with High Photocatalytic Activity under Visible Light // Catal. Commun. 2012. V. 17. P. 99–103. https://doi.org/10.1016/j.catcom.2011.10.023
Franking R., Li L., Lukowski M.A. et al. Facile Post-Growth Doping of Nanostructured Hematite Photoanodes for Enhanced Photoelectrochemical Water Oxidation // Energy Environ Sci. 2013. V. 6. № 2. P. 500–512. https://doi.org/10.1039/C2EE23837C
Bang J.U., Lee S.J., Jang J.S. et al. Geometric Effect of Single or Double Metal-Tipped CdSe Nanorods on Photocatalytic H2 Generation // J. Phys. Chem. Lett. 2012. V. 3. № 24. P. 3781–3785. https://doi.org/10.1021/jz301732n
Wang J., Yin S., Zhang Q. et al. Mechanochemical Synthesis of Fluorine-Doped SrTiO3 and Its Photo-oxidation Properties // Chem. Lett. 2003. V. 32. № 6. P. 540–541. https://doi.org/10.1246/cl.2003.540
Bhatkhande D.S., Pangarkar V.G., Beenackers A.A.C.M. Photocatalytic Degradation for Environmental Applications – a Review // J. Chem. Technol. Biotechnol. 2002. V. 77. № 1. P. 102–116. https://doi.org/10.1002/jctb.532
Jimmy C.Y.U., Wingkei H.O., Jiaguo Y.U., Hoyin Y.I.P., Po Keung Wong, Jincai Zhao. Efficient Visible-Light-Induced Photocatalytic Disinfection on Sulfur-Doped Nanocrystalline Titania // Environ. Sci. Technol. 2005. V. 39. № 4. P. 1175–1179. https://doi.org/10.1021/es035374h
Wanjun Wang, Guocheng Huang, Jimmy C.Yu., Po Keung Wong. Advances in Photocatalytic Disinfection of Bacteria: Development of Photocatalysts and Mechanisms // J. Environ. Sci. 2015. V. 34. P. 232–247. https://doi.org/10.1016/j.jes.2015.05.003
Karvinen S.M. The Effects of Trace Element Doping on the Optical Properties and Photocatalytic Activity of Nanostructured Titanium Dioxide // Ind. Eng. Chem. Res. 2003. V. 42. № 5. P. 1035–1043. https://doi.org/10.1021/ie020358z
Szczepanik B. Photocatalytic Degradation of Organic Contaminants over Clay-TiO2 Nanocomposites: A Review // Appl. Clay Sci. 2017. V. 141. P. 227–239. https://doi.org/10.1016/j.clay.2017.02.029
Hayat Khan, Dimitrios Berk. Synthesis, Physicochemical Properties and Visible Light Photocatalytic Studies of Molybdenum, Iron and Vanadium Doped Titanium Dioxide // React. Kinet., Mech. Catal. 2014. V. 111. № 1. P. 393–414. https://doi.org/10.1007/s11144-013-0637-3
Sedneva T.A., Lokshin E.P., Kalinnikov V.T., Belikov M.L. Photocatalytic Activity of Tungsten-Modified Titanium Dioxide // Dokl. Phys. Chem. 2012. V. 443. Part 1. P. 57–59. https://doi.org/10.1134/S0012501612030037
Sedneva T.A., Lokshin E.P., Belikov M.L., Beljaevskij A.T. Structure and Morphology of Iron-Modified Titania Powders // Inorg. Mater. 2011. V. 47. № 11. P. 1205–1213. https://doi.org/10.1134/S0020168511100177
Седнева Т.А., Локшин Э.П., Беликов М.Л., Беляевский А.Т. Синтез и исследование фотокаталитических оксидных нанокомпозитов титана(IV) и кобальта(II) // Хим. технология. 2015. Т. 16. № 7. С. 398–407.
Devi L.G., Murthy B.N. Characterization of Mo Doped TiO2 and Its Enhanced Photo Catalytic Activity under Visible Light // Catal. Lett. 2008. V. 125. № 3. P. 320–330. https://doi.org/10.1007/s10562-008-9568-4
Li C.X., Zhang D., Jiang Z.H., Yao Z.P., Jia F.Z. Mo-Doped Titania Films: Preparation, Characterization and Application for Splitting Water // New J. Chem. 2011. V. 35. № 2. P. 423–429. https://doi.org/10.1039/C0NJ00409J
Li M., Zhang J., Zhang Y. Electronic Structure and Photocatalytic Activity of N/Mo Doped Anatase TiO2 // Catal. Commun. 2012. V. 29. P. 175–179. https://doi.org/10.1016/j.catcom.2012.10.014
Devi L.G., Murthy B.N., Kumar S.G. Photocatalytic Activity of V5+, Mo6+ and Th4+ Doped Polycrystalline TiO2 for the Degradation of Chlorpyrifos under UV/Solar Light // J. Mol. Catal., A. 2009. V. 308. № 1–2. P. 174–181. https://doi.org/10.1016/j.molcata.2009.04.007
Shahmoradi B., Ibrahim I.A., Sakamoto N., Ananda S., Guru Row T.N., Soga Kohei, Byrappa K., Parsons S., Shimizu Yoshihisa. In situ Surface Modification of Molybdenum-Doped Organic–Inorganic Hybrid TiO2 Nanoparticles under Hydrothermal Conditions and Treatment of Pharmaceutical Effluent // Environ. Technol. 2010. V. 31. № 11. P. 1213–1220. https://doi.org/10.1080/09593331003592261
Huang J., Guo X., Wang B., Li L., Zhao M., Dong L., Liu X., Huang Y. Synthesis and Photocatalytic Activity of Mo-Doped TiO2 Nanoparticles // J. Spectrosc. 2015. V. 2015. P. 1–8. https://doi.org/10.1155/2015/681850
Wang Z.C., Hu X.F., Helmersson U.P. Peroxo Sol–Gel Preparation: Photochromic/Electrochromic Properties of Mo–Ti Oxide Gels and Thin Films // J. Mater. Chem. 2000. V. 10. № 10. P. 2396–2400. https://doi.org/10.1039/b004933f
Miyauchi M., Nakajima A., Watanabe T., Hashimoto K. Photocatalysis and Photoinduced Hydrophilicity of Various Metal Oxide Thin Films // Chem. Mater. 2002. V. 14. № 6. P. 2812–2816. https://doi.org/10.1021/cm020076p
Седнева Т.А., Локшин Э.П., Беликов М.Л., Калинников В.Т. Способ получения фотокаталитического нанокомпозита, содержащего диоксид титана: Пат. № 2435733. РФ. Ин.-т химии и технологии редких элементов и минер. сырья КНЦ РАН. Бюл. № 34.
Sedneva T.A., Lokshin E.P., Belikov M.L. Ferroin Adsorption on TiO2-Based Photocatalytic Materials // Inorg. Mater. 2012. V. 48. № 5. P. 480–487. https://doi.org/10.1134/S0020168512050160
Matthews R.W., McEvoy S.R. Destruction of Phenol in Water with Sun, Sand, and Photocatalysis // Sol. Energy. 1992. V. 49. № 6. P. 507–513. https://doi.org/10.1016/0038-092X(92)90159-8
Belikov M.L., Sedneva T.A., Lokshin E.P. Adsorptive and Photocatalytic Properties of Tungsten-Modified Titanium Dioxide // Inorg. Mater. 2021. V. 57. № 2. P. 146–153. https://doi.org/10.1134/S0020168521020023
Khan M., Xu J., Chen N., Cao W. First Principle Calculations of the Electronic and Optical Properties of Pure and (Mo, N) co-Doped Anatase TiO2 // J. Alloys Comp. 2012. V. 513. P. 539–545. https://doi.org/10.1016/j.jallcom.2011.11.002
Ichimura Sh., Ebisu H., Nonami T., Kato K. Photocatalytic Activity of Titanium Dioxide Coated with Apatite // Jpn. J. Appl. Phys. Pt. 1. 2005. V. 44. № 7. P. 5164–5170. https://doi.org/10.1143/JJAP.44.5164
Yang Shi-ying, Chen You-yuan, Zheng Jian-guo, Cui Ying-jie. Enhanced Photocatalytic Activity of TiO2 by Surface Fluorination in Degradation of Organic Cationic Compound // J. Environ. Sci. 2007. V. 19. № 1. P. 86–89. https://doi.org/10.1016/S1001-0742(07)60014-X
Khalyavka T.A., Kapinus E.I., Viktorova T.I., Tsyba N.N. Adsorption and Photocatalytic Properties of Nanodimensional Titanium–Zinc Oxide Composites // Theor. Exp. Chem. 2009. V. 45. № 4. P. 234–238. https://doi.org/10.1007/s11237-009-9087-4
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


