Неорганические материалы, 2022, T. 58, № 8, стр. 875-883
Исследование продуктов реакции TaCl5 с ацетиленом в бензоле – катализатора циклотримеризации алкинов
Е. Г. Ильин 1, *, А. С. Паршаков 1, А. Ю. Тетерин 2, К. И. Маслаков 3, В. Г. Яржемский 1, Ю. А. Тетерин 2, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 НИЦ “Курчатовский институт”
123182 Москва, пл. Академика Курчатова, 1, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: eg_ilin@mail.ru
Поступила в редакцию 26.01.2022
После доработки 30.03.2022
Принята к публикации 04.04.2022
- EDN: TJCIPI
- DOI: 10.31857/S0002337X22070090
Аннотация
Методами сканирующей электронной микроскопии, ИК- и рентгеновской фотоэлектронной спектроскопии (РФЭС) изучены продукты реакции TaCl5 c C2H2 в бензоле состава TaCl3.7C15H22 – гетерогенные катализаторы циклотримеризации алкинов. Катализатор представляет собой сферические наночастицы среднего диаметра 70 нм. По данным РФЭС, элементный состав поверхности – TaCl1.80C28O3. Величины энергий связи (Eb) 4f7/2- и 5p3/2-электронов тантала, равные 26.3 и 37.2 эВ, указывают на степень окисления тантала 5+ на поверхности образца. После травления ионами Ar+ наряду с Та5+ наблюдались линии электронов Ta 4f7/2 и 5p3/2 с Eb = 23.8 и 34.6 эВ соответственно, что свидетельствует о степени окисления тантала в активном катализаторе 3+. Линия Cl 2p электронов состоит из двух перекрывающихся дублетов c энергиями 198.7 и 200.1 эВ, что обусловлено наличием мостиковых и концевых ионов хлора в каталитически активном комплексе. Энергия связи Eb(C1s) = 284.2 эВ соответствует циклическим ненасыщенным углеводородам с сопряженными связями в углеводородной матрице. Катализатор устойчив при высоком вакууме и не заряжается под пучком рентгеновского излучения, что характеризует его слабые диэлектрические свойства.
ВВЕДЕНИЕ
Моно- и биядерные комплексы ниобия(III) и тантала(III) – [MX3(L3)] и [M2X6(L3)] (Х = Cl, Br, I; L = OC4H8, SO4H8 и M2S) – гомогенные катализаторы циклотримеризации алкинов [1–4]. Гетерогенными катализаторами стереоселективной циклотримеризации ацетилена и замещенных алкинов HC≡CR (R, R' = H, R) являются нестехиометрические продукты реакции NbCl5 и TaCl5 с ацетиленом [5, 6]. Это мелкодисперсные вещества темно-синего цвета, практически не растворимые в органических растворителях и разлагающиеся при нагревании, сведения о них ограничены изучением состава [6]. Методом рентгеновской фотоэлектронной спектроскопии (РФЭС) изучены элементный и ионный составы поверхности катализатора NbCl2 ± 0.1(CnHn) (n = 10–12) [7]. На основании величин энергий связи электронов ниобия Eb(Nb 3d5/2) = 203.8 и 204.2 эВ образцов после травления поверхности катионами аргона сделано заключение, что степень окисления ниобия в катализаторе 2+ или 3+. Относительно узкая линия в спектре C 1s-электронов свидетельствует об эквивалентности атомов углерода в органической части катализатора, а величина Eb(C 1s) = = 284.0 эВ близка к энергии связи в циклических ненасыщенных углеводородах с сопряженными двойными связями. Линии Cl представляли собой два перекрывающихся дублета с энергиями связи Cl 2p3/2-электронов, равными 198.7 и 200.1 эВ, что свидетельствовало о наличии концевых и мостиковых атомов хлора в каталитически-активном комплексе. На основании полученных данных был сделан вывод, что катализатор представляет собой композит, содержащий металлорганические кластеры низших хлоридов ниобия в органической матрице, представляющей собой циклические ненасыщенные углеводороды с сопряженными двойными связями [7].
Метод MALDI-TOF масс-спектрометрии оказался эффективным при изучении катализатора линейной олигомеризации ацетилена – продуктов реакции MoCl5 с С2Н2 в бензоле состава, близкого MoCl2(C30H30). Было показано, что каталитически активными центрами являются наноразмерные 13-атомные металлорганические кластеры низших хлоридов молибдена [8]. При изучении катализатора NbCl2 ± 0.1(CnHn) (n = 10–12) методом MALDI TOF масс-спектрометрии в режиме регистрации отрицательных ионов были идентифицированы неизвестные ранее кластеры оксохлоридов ниобия, образующиеся вследствие активного взаимодействия мелкодисперсного катализатора с кислородом и влагой воздуха в процессе пробоподготовки [9].
Несмотря на то что соединения тантала гораздо менее склонны к процессам гидролиза, применение этого метода при изучении TaCl3.7C15H22 – нестехиометрических продуктов реакции TaCl5 c C2H2 в бензоле, также не позволило установить состав металлорганического каталитически активного комплекса тантала, были идентифицированы семейства и ряды неизвестных ранее кластеров оксохлоридных анион-радикалов [${\text{Ta}}_{n}^{{}}$OxCly]– (n = 1–10) [10].
Цель настоящей работы – комплексное исследование танталового катализатора состава TaCl3.7C15H22, продукта реакции TaCl5 с ацетиленом в бензоле, методами сканирующей электронной микроскопии (СЭМ), ИК-спектроскопии и РФЭС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы исследования. В качестве исходного использовали TaCl5 особой степени чистоты (LANXIT) и высокочистый ацетилен. Бензол предварительно осушали перегонкой над металлическим натрием. Ацетилен очищали от органических примесей и влаги пропусканием через олеум и склянку Тищенко с P2O5.
Состав продуктов реакции изучали с использованием СЭМ (Carl Zeiss), оснащенного приставкой для энергодисперсионного анализа EDX Oxford Instruments (ЦКП ИОНХ РАН).
РФЭС образца TaCl3.7C15H22 были получены на спектрометре Kratos Axis Ultra DLD (Center for Collective Use of the Moscow State University) с использованием монохроматического AlKα-излучения (hν = 1486.6 эВ) при 150 Вт рентгеновской пушки при давлении 1.3 × 10–7 Па и комнатной температуре. Измельченный порошок шпателем наносили на поверхность двухстороннего проводящего скотча и придавливали. После этого излишек порошка стряхивали. В результате образовывался плотный, относительно толстый слой, что исключало появление линий материала подложки в спектре изучаемого образца. Площадь поперечного сечения пучка была 300 × 700 мкм2. Калибровка спектрометра проведена относительно положения пиков Au 4f7/2 (83.96 эВ) и Cu 2p3/2 (932.62 эВ) для чистых золота и меди. Спектры получены в энергетическом постоянном окне с использованием энергии прохождения 20 эВ, шаг 0.05 эВ. Разрешение спектрометра, измеряемое как полная ширина на полувысоте (FWHM Г, эВ) максимума линии Au 4f7/2-электронов была меньше 0.65 эВ. Энергии связи были измерены относительно Eb C 1s-электронов насыщенных углеводородов, адсорбированных на поверхности образца. В этой шкале энергия связи C 1s-электронов равна 285.0 эВ. Ошибка в определении энергии связи электронов и ширины линий не превышала ±0.1 эВ, а погрешности в определении относительной интенсивности линии ±10%. Фон, связанный с вторично рассеянными электронами, вычитался по методу Ширли [11]. Спектры были получены как для исходного образца, так и для образца после травления его поверхности ионами аргона. Травление поверхности образца проведено катионами Ar+ при напряжении U = 2 кВ и токе I = 50 мкА в течение 45 с. Скорость травления по глубине для SiO2 равна 7–10 нм/мин. Были получены обзорные спектры в диапазоне энергий связи от 0 до 1250 эВ, спектры валентной зоны от 0 до 50 эВ и спектры Ta 4d, 4s-, Cl 2p-, O 1s- и C 1s-электронов. Образец под действием рентгеновского излучения практически не заряжался (до 0.2 эВ), что позволяет считать его слабым диэлектриком.
Был проведен элементный количественный анализ поверхности (глубина ~5 нм [12]), основанный на том, что интенсивность линии спектра пропорциональна количеству атомов в исследуемом образце. Использовано следующее соотношение: ni/nj = (Si/Sj)(kj/ki), где ni/nj – относительная концентрация исследуемых атомов, Si/Sj – относительная интенсивность линий спектра, kj/ki – относительный экспериментальный коэффициент чувствительности. Использованы следующие коэффициенты чувствительности по отношению к электронам углерода С 1s: 1.00 (C 1s), 2.81 (O 1s), 0.12 (O 2s), 3.21 (Cl 2p), 11.09 (Ta 4f), 18.55 (Ta 4d), 0.88 (Ta 4s).
Синтез танталового катализатора. Для синтеза исходных продуктов через насыщенный раствор TaCl5 в бензоле (0.0174 моль/л) пропускали ацетилен со скоростью ~3 л/ч до прекращения выделения HCl. Через несколько минут после начала пропускания ацетилена первоначально желтый раствор зеленел, что свидетельствовало о снижении степени окисления тантала до 4+, и одновременно наблюдалось выделение HCl. Затем начинали появляться тонкодисперсные темно-синие частицы – комплексы тантала 3+ в зеленом растворе. При дальнейшем пропускании ацетилена их содержание возрастало, раствор начинал разогреваться и превращался в гель. Температура раствора не снижалась, пока пропускание ацетилена продолжалось, т.е. темно-синее вещество являлось активным катализатором экзотермической реакции циклотримеризации ацетилена. Осадок темно-синего цвета отделяли, промывали растворителем и высушивали под вакуумом до постоянного веса. По данным химического анализа, состав полученных продуктов отвечал формуле TaCl3.7C15H22.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение катализатора методами СЭМ и ИК-спектроскопии. На рис. 1 представлена морфология поверхности композита, изученная методом СЭМ. Композит представляет собой однородное вещество темно-синего цвета с частицами сферической формы со средним диаметром 70 нм.
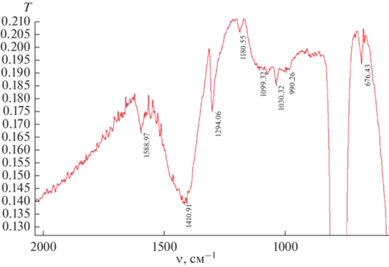
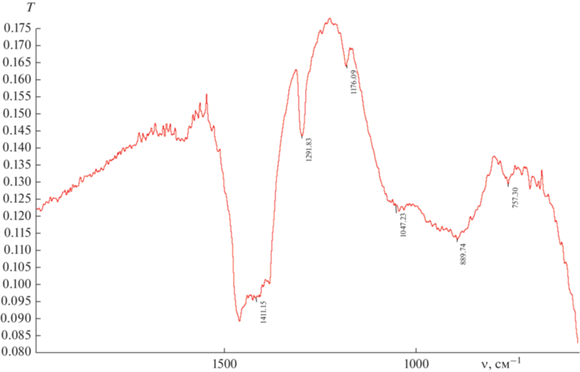
ИК-спектры катализатора приведены на рис. 2 и 3. В спектре, снятом в суспензии CCl4 (рис. 2), отчетливо видны интенсивные полосы поглощения деформационных колебаний C–H-связей (при 1410, 1294 см–1). Линия при 1588 см–1 соответствует колебанию двойных углеродных связей С=С.
Полосы поглощения в области 1030 см–1 могут быть связаны с присутствием фрагментов Ta=O, возникающих вследствие частичного окисления образцов во время пробоподготовки. В ИК-спектрах, снятых в вазелиновом масле (рис. 3), проявляются линии связей C–Cl (757 см–1), что может быть обусловлено с внедрением ацетилена по связи металл–хлор в ходе реакции TaCl5 с C2H2.
Полосы поглощения при 1598 см–1 отражают наличие двойных связей С=С, а линия при 472 см–1 относится к связям Ta–C [13].
Изучение катализатора методом РФЭС. При использовании метода РФЭС информация о свойствах вещества может быть получена на основании структуры спектров остовных электронов [14], электронов внешних (от 0 до ~13 эВ, ВМО) и внутренних (от ~13 до ~50 эВ, ВВМО) молекулярных орбиталей [15, 16]. При этом рассматриваются не только химические сдвиги и интенсивности линий электронов, но и характеристики сложной структуры спектров.
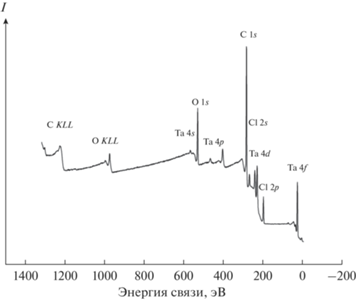
В обзорном РФЭС поверхности композита TaCl3.7C15H22 наблюдаемые линии соответствуют элементам композита и кислороду, присутствующему на поверхности образца в результате контакта с кислородом и влагой воздуха (рис. 4). Других элементов в заметных количествах (до 0.5 ат. %) в образце не обнаружено (табл. 1). Для сравнения в табл. 1 приведены некоторые данные РФЭС оксидов и других соединений тантала.
Таблица 1.
Энергии связи электронов Eb и ширины линий Г элементов поверхности образца катализатора и (для сравнения) некоторых ранее изученных соединений тантала
| Образец | Eb*, эВ (Γ, эВ) | |||||
|---|---|---|---|---|---|---|
| MO | Ta 4f7/2 | Ta 5p3/2 | Cl 2p3/2 | O 1s | C 1s | |
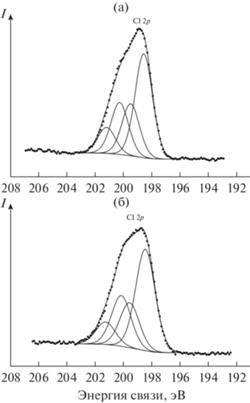
| Исходная поверхность катализатора | 4.8 (2.2) 6.5 (2.2) 8.0 (2.5) 15.6 (2.4) 22.0 (2.5) |
26.3 (1.3) | 37.2 (2.5) | 198.6 (1.6) 200.3 (1.6) |
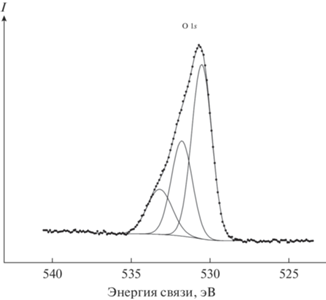
530.5 (1.5) 531.8 (1.5) 533.2 (1.9) |
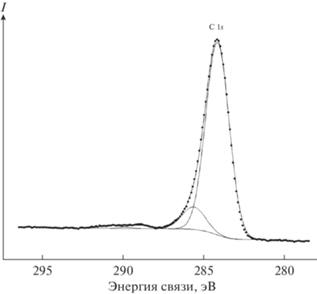
284.2 (1.7) 285.7 (1.7) 289.0 (1.8) 290.7 (1.8) |
| После обработки ионами Ar+ | 1.1 (2.5) 5.3 (2.5) 8.0 (2.5) 16.0 (2.5) |
23.8 (2.4) 26.3 (1.9) |
34.6 (2.5) 37.1 (2.5) |
198.5 (1.6) 200.2 (1.6) |
530.7 (1.5) 531.8 (1.5) 533.2 (1.7) |
284.2 (1.8) 285.7 (1.8) 288.9 (1.9) 290.6 (1.9) |
| Ta** | 21.6 | 32.7 | ||||
| TaC | 23.6 (0.9) | 34.7 | 284.3 (1.0) | |||
| TaC0.95** | 23.5 | 34.6 | ||||
| Ta2O5** | 26.5 | 37.3 | ||||
| TaCl5** | 27.3 | 38.4 | ||||
* Энергии связи приведены в шкале, для которой Eb(C 1s) = 285.0 эВ (насыщенные углеводороды). ** База данных РФЭС [17].
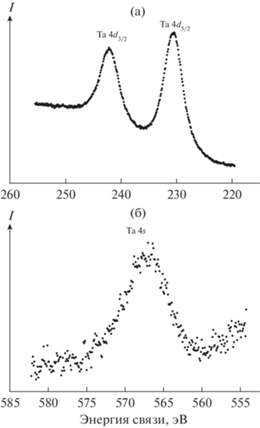
Линии электронов ВМО и ВВМО расположены в области энергий от 0 до ~50 эВ. Для образца TaCl3.7C15H22 такие спектры до и после травления ионами Ar+ представлены на рис. 5.
Рис. 5.
РФЭС валентных электронов катализатора TaCl3.7C15H22: а – исходный образец, б – после травления поверхности Ar+.
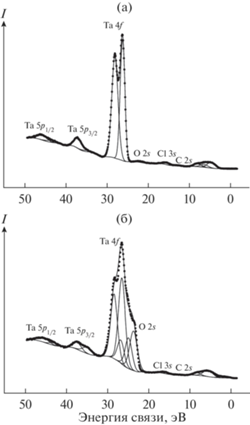
В низкоэнергетической области при 4.8, 6.5 и 8.0 эВ наблюдаются максимумы линий электронов ВМО, образованных в основном внешними валентными Ta 5d-, Cl 3p-, С 2р- и O 2p-электронами (табл. 1). Линии в области ~13–~50 эВ отражают структуру электронов ВВМО, в основном обусловленных Cl 3s-, O 2s-, C 2s-, Ta 5p- и 4f- атомными орбиталями (АО). Линия С 2s-электронов имеет малую интенсивность и наблюдается справа от линии Cl 3s-электронов (рис. 5а). Следует отметить, что величины сечений фотоэффекта O 2s- и особенно Cl 3s-электронов значительно превосходят соответствующую величину для С 2s-электронов [17]. Максимумы этих линий наблюдаются при 15.6 эВ для Cl 3s- и при 22.0 эВ для O 2s-электронов (рис. 5).
Спектры Ta 4f- и Ta 5p-электронов композита TaCl3.7C15H22 могут быть использованы для оценки степени окисления тантала, если предположить, что эти электроны слабо участвуют в образовании химической связи. Наблюдаемые величины энергий связи электронов тантала (Eb(Ta 4f7/2) = 26.3 эВ и Eb(Ta 5p3/2) = 37.2 эВ) и Ta2O5 (табл. 1) практически совпадают, поэтому можно заключить, что на поверхности образца до травления катионами аргона тaнтал находится в степени окисления 5+. Это совпадает с результатами масс-спектрометрии [10], показавшими образование оксохлоридов тантала(V), и объясняется активным взаимодействием пористых наноразмерных частиц образца с кислородом и влагой воздуха в процессе пробоподготовки.
После травления поверхности образца катионами аргона (рис. 5б) в области спектров ВВМО Ta 4f- и Ta 5p-электронов, наряду с ранее наблюдаемыми, появляются линии в области несколько меньших энергий, сдвинутые на ΔEb = ~2.5 эВ: Eb(Ta 4f7/2) = 23.8 эВ и Eb(Ta 5p3/2) = 34.6 эВ (табл. 1), отнесенные нами к ионам тантала в степени окисления 3+, продуктов реакции TaCl5 c C2H2 – каталитически активных комплексов. Отметим, что менее интенсивный максимум Та 5р-электронов тантала(III) наблюдался и в спектре образца до травления (рис. 5а).
Спектры РФЭС остовных электронов (от ~50 до 1250 эВ). Остовным электронам в спектрах отвечает область энергий от ~50 до 1250 эВ. На рис. 6 представлены РФЭС Ta 4d- и Ta 4s-электронов композита. Спектр Та 4d-электронов представляет собой характерный дублет широких линий с величиной спин-орбитального расщепления ΔEsl = 11.7 эВ и энергией Ta 4d5/2-электронов, равной 230.3(4.0) эВ (рис. 6а), что несколько выше значения 229.6 эВ для Ta2O5 [17].
Величина энергии связи Ta 4s-электронов равна 567.7(6.5) эВ, что также больше значения 566.6 эВ [18] для Ta2O5. Увеличение энергий Та 4d- и Ta 4s- электронов, по нашему мнению, можно объяснить образованием на поверхности оксохлоридов тантала. Следует отметить, что относительно большие величины ширин линий для Та 4d- и Ta 4s-электронов затрудняют корректное определение различных ионов и энергий связи их электронов.
Можно предположить, что в спектрах Ta 4s- и Ta 5s-электронов в наиболее простой форме может проявляться мультиплетное расщепление, если присутствуют неспаренные Ta 5d n-электроны. Это должно приводить к расщеплению линий на две компоненты, как это наблюдается в спектрах соединений 3d-металлов [19].
Мультиплетное расщепление ΔEms(Ta 4s или Та 5s) для атома Ta 5d36s2 пропорционально обменному интегралу G l(n1s,ns) (<4s5d|U|5d4s> = 0.41 эВ или <5s5d|U|5d5s> = 4.51 эВ) и числу неспаренных электронов N:
Например, для иона Ta2+(5d3) ΔEms(Ta 5s) = = 3.61 эВ и I1 : I2= 1.67; ΔEms(Ta 4s) = 0.33 эВ и I1 : I2= 1.67, а для иона Та5+(5d0) мультиплетное расщепление должно отсутствовать.
Поскольку значение обменного интеграла <4s5d|U|5d4s> = 0.41 эВ на порядок меньше величины <5s5d|U|5d5s> = 4.51 эВ, это может привести к незначительному расщеплению (0.33 эВ) линии Та 4s-электронов.
Расщепление линии Та 5s-электронов может быть значительным. Однако в спектре этих электронов может проявляться динамический эффект из-за возникновения дополнительного двухдырочного (Та 5s25p45dn+1) конечного состояния, которое будет взаимодействовать с основным однодырочным конечным состоянием (Та 5s15p65dn), что приведет к усложнению общей структуры спектра [20]. К сожалению, небольшая величина сечения фотоэффекта для Ta 5s-электронов ограничивает возможности получения спектра с удовлетворительной статистикой при энергии возбуждения рентгеновского излучения AlKα (1486.6 эВ). Однако с увеличением интенсивности энергии возбуждения такой спектр может быть получен с удовлетворительной статистикой.
Несмотря на то что сечение фотоэффекта Ta 4s-электронов значительно больше соответствующей величины для Ta 5s-электронов, из-за малой величины расщепления (0.33 эВ) и относительно большой полуширины линии Г(Ta 4s) = = 6.5 эВ нельзя корректно измерить величину такого расщепления. Отметим, что в отличие от 3d- электронов 5d-электроны более делокализованы и спин-орбитальное взаимодействие между ними сильнее, чем между 3d-электронами, что должно приводить к размытию структуры расщепления. Поэтому параметры мультиплетного расщепления Ta 4d- и Тa 4s-электронов трудно использовать для определения степени окисления 5d-переходных металлов, кроме случая иона Та5+(5d0), когда должна наблюдаться одиночная линия.
Известно, что травление поверхности ионами Ar+ разрушает химические связи соединений на поверхности образца и приводит к удалению поверхностного слоя [5]. В настоящей работе поверхность образца была обработана ионами Ar+. В результате снятия поверхностного слоя относительная концентрация продуктов гидролиза – оксохлоридов тантала(V) уменьшалась и проявлялись линии тантала каталитически-активного комплекса в степенях окисления 2+ или 3+. Последнее является более вероятным, поскольку известные моно- и биядерные каталитически-активные комплексы ниобия и тантала имеют степень окисления 3+ [1–4]. Относительная концентрация углерода, кислорода и хлора по отношению к танталу после снятия поверхностного слоя уменьшается [1, 2].
В спектре Cl 2p-электронов катализатора до травления (рис. 7а) наблюдаются два дублета с величиной спин-орбитального расщепления ΔEsl= = 1.7 эВ и энергией связи Eb(Cl 2p3/2) = 198.6(1.6) и 200.3(1.6) эВ (табл. 1). Это связано с двумя химическими состояниями ионов хлора, например мостиковыми и концевыми в каталитически-активном комплексе Та.
После травления образца Ar+ концентрация ионов хлора по отношению к танталу уменьшается от 1.80 до 1.08 (составы поверхности I и II – см. ниже), но структура спектра мало изменяется (табл. 1, рис 7б).
Спектр O 1s-электронов исходного образца катализатора (рис. 8) представляет собой асимметричную линию, что свидетельствует о присутствии ионов кислорода в различных химических состояниях, отнесенных нами к Та=О (530.5 эВ), Та–О—Та, Та–ОН (531.8 эВ) и Н2О (533.2 эВ) (табл. 1).
После травления Ar+ концентация ионов кислорода уменьшается по отношению к танталу (составы поверхности I и II – см. ниже), но структура спектра мало изменяется.
В спектре C 1s-электронов (рис. 9, табл. 1) основной является относительно узкая интенсивная симметричная линия при 284.2(1.7) эВ, которую мы отнесли к электронам сопряженных связей –СН=СН–СН=СН– полиароматической углеводородной органической матрицы.
Линия при 285.7(1.7) эВ отнесена к электронам атомов углерода концевых групп С=О и –СН3 (насыщенных углеводородов). Слабые линии при 289.0 (1.8) и 290.7(1.8) эВ мы отнесли к электронам атомов углерода, связанных с атомами кислорода –С=О. В результате травления образца ионами Ar+ наблюдается уменьшение интенсивности линий C 1s-электронов (см. ниже составы поверхности I и II).
Количественный элементный и ионный анализ. На основании интенсивностей компонентов линий отдельных элементов, с учетом относительных коэффициентов чувствительности, был проведен элементный и ионный анализ поверхностей (I) и (II) и суммарных концентраций каждого элемента относительно тантала (Ta 4d5/2):
На основании полученных данных можно заключить, что поверхностный состав исходного композита, в допущении состава углеводородной матрицы CnHn, отвечает формуле Та(V)Cl1.8C27.58H27.58O2.08. Углеводородная полиацетиленовая матрица представляет собой структуры с сопряженными связями –СН=СН–СН=СН–.
После травления катионами аргона на поверхности образца уменьшается содержание хлора и углерода и состав отвечает формуле Ta(III)0.45Ta(V)0.55Cl1.08C17.68H17.68O2.08. Уменьшение содержания углерода может быть следствием испарения углеводородов, а уменьшение содержания хлора – диспропорционирования оксохлоридов тантала на Ta2O5 и TaCl5 с испарением последнего под действием потока катионов Ar+. Интересно отметить, что установленный при изучении этого продукта методом LDI масс-спектрометрии [9], состав кластерных анион-радикалов тантала в рядах TanOxCly (n = 2–10) отличается на группу TaO2Cl.
Изученное вещество устойчиво в высоком вакууме и слабо (до 0.2 эВ) заряжается под пучком рентгеновского излучения, что характеризует его как слабый диэлектрик.
ЗАКЛЮЧЕНИЕ
На основании полученных данных можно заключить, что катализатор тримеризации ацетилена – продукт реакции ТаCl5 с С2Н2 – представляет собой сферический нанокомпозит среднего диаметра 70 нм, содержащий металлорганические кластеры низших хлоридов тантала в углеводородной матрице – высокомолекулярные циклические углеводороды с сопряженными связями. Степень окисления тантала в каталитически активном комплексе катализатора 3+.
Список литературы
Hartung J.B., Jr., Pederson S.F. Synthesis and Characterization of Trihaloniobium Alkyne Complexes // Organometallics. 1990. V. 9. № 5. P. 1414–1417. https://doi.org/10.1021/om00119a010
Oshiki T., Takai K. Jpn. Kokai Tokkyo Koh. 2002. Art. 2002–60354.
Cotton F.A., Hall W.T. Reactions of Niobium(III) and Tantalum(III) Compounds with Acetylenes. 4. Polymerization of Internal Acetylenes // Macromolecules. 1981. V. 14. № 2. P. 233–236. https://doi.org/10.1021/ma50003a001
Kakeya M., Fujihara T., Kasaya T., Nagasawa A. Dinuclear Niobium(III) Complexes [{NbCl2(L)}2(μ-Cl)2(μ-L)] (L = Tetrahydrothiophene, Dimethyl Sulfide): Preparation, Molecular Structures, and the Catalytic Activity for the Regioselective Cyclotrimerization of Alkynes // Organometallics. 2006. V. 25. P. 4134–4136. https://doi.org/10.1021/om0601100
Lachmann G., Plessis J.A.K., Toit C.J. The Role of Niobium(V) Chloride in the Catalytic Cyclotrimerization of Phenylacetylene // J. Mol. Catal. 1987. V. 42. P. 151–159. https://doi.org/10.1016/0304-5102(87)85021-6
Dandliker G. Katalytische Cyclisierung von Acetylen und substituiertem Acetylen zu aromatischen Kohlenwasserstoffen // Helv. Chim. Acta. 1969. V. 52. № 6. P. 1482–1487. https://doi.org/10.1002/hlca.19690520608
Ильин Е.Г., Паршаков А.С., Тетерин А.Ю., Маслаков К.И., Тетерин Ю.А. Исследование катализатора циклотримеризации ацетилена NbCl2(CnHn) (n = 10–12) методом рентгеновской фотоэлектронной спектроскопии // Журн. неорган. химии. 2011. Т. 56. № 11. С. 1871–1876.
Ильин Е.Г., Паршаков А.С., Буряк А.К., Кочубей Д.И., Дробот Д.В., Нефёдов В.И. Наноразмерные кластеры хлоридов молибдена – активные центры в каталитических процессах олигомеризации ацетилена // Докл. РАН. 2009. Т. 427. № 5. С. 641–645.
Ильин Е.Г., Яржемский В.Г., Паршаков А.С., Буряк А.К. Оксохлориды ниобия в газовой фазе. Квантово-химические расчёты структурных параметров и относительной устойчивости изомеров // Журн. неорган. химии. 2013. Т. 58. № 1. С. 41–48. https://doi.org/10.7868/S0044457X1301008X
Il’in E.G., Parshakov A.S., Buryak A.K. Laser Desorption-Ionization Mass Spectrometry of Tantalumoxochloride Anion Clusters // Int. Mass Spectrom. 2020. V. 458. P. 116448. https://doi.org/10.1016/j.ijms.2020.116448
Shirley D.A. High-Resolution X-Ray Photoemission Spectrum of the Valence Bands of Gold // Phys. Rev. B. 1972. V. 5. № 12. P. 4709–4714. https://doi.org/10.1103/PhysRevB.5.4709
Немошкаленко В.В., Алешин. А.Г. Электронная спектроскопия кристаллов. Киев: Наук. думка, 1976. 335 с.
Ferrari A.C. Raman Spectroscopy of Graphene and Graphite: Disorder, Electron–Phonon Coupling, Doping and Nonadiabatic Effects // Solid State Commun. 2007. V. 143. P. 47–57. https://doi.org/10.1016/j.ssc.2007.03.052
Нефедов В.И. Рентгеноэлектронная спектроскопия химических соединений. М.: Химия, 1984. 256 с.
Тетерин Ю.А., Гагарин С.Г. Внутренние валентные молекулярные орбитали соединений и структура рентгеноэлектронных спектров // Успехи химии. 1996. Т. 65. № 10. С. 895–912.
Тетерин Ю.А., Баев А.С. Рентгеновская фотоэлектронная спектроскопия соединений лантаноидов. М.: ЦНИИатоминформ, 1987. 128 с.
NIST X-ray Photoelectron Spectroscopy Database, NIST Standard Reference Database Number 20. Gaithersburg National Institute of Standards and Technology: 2000 MD.20899. https://doi.org/10.18434/T4T88K
Scofield J.H. Hartree-Slater Subshell Photoionization Cross-Sections at 1254 and 1487 eV // J. Electron Spectr. Relat. Phenom. 1976. V. 8. № 2. P. 129–137. https://doi.org/10.1016/0368-2048(76)80015-1
Yarzhemsky V.G., Teterin Y.A., Presnyakov I.A., Maslakov K.I., Teterin A.Y., Ivanov K.E. Many-Electron Effects in Co 3sX-Ray Photoelectron Spectra of Diamagnetic ScCoO3 and Paramagnetic BiCoO3 Cobaltites // JETP Lett. 2020. V. 111. № 8. P. 422–427. https://doi.org/10.1134/S0021364020080135
Яржемский В.Г., Тетерин Ю.А., Маслаков К.И., Тетерин А.Ю., Иванов К.Е. Влияние многоэлектронных эффектов на структуру рентгеновских фотоэлектронных спектров Th 5p- и 5s-электронов ThO2 // Письма в ЖЭТФ. 2021. Т. 114. № 10. С. 661–668. https://doi.org/10.31857/S1234567821220079
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы