Неорганические материалы, 2022, T. 58, № 8, стр. 868-874
Взаимодействие пентахлорида ниобия с борогидридом натрия в ионных расплавах
А. А. Винокуров 1, Д. Ю. Ковалев 2, Г. Р. Нигматуллина 2, Н. Н. Дремова 1, С. П. Шилкин 1, *
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. Академика Семенова, 1, Россия
2 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова
Российской академии наук
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 8, Россия
* E-mail: ssp@icp.ac.ru
Поступила в редакцию 08.02.2022
После доработки 16.05.2022
Принята к публикации 18.05.2022
- EDN: QERGMX
- DOI: 10.31857/S0002337X22080140
Аннотация
Исследовано взаимодействие предварительно активированных механохимическим способом порошков NbCl5 и NaBH4, взятых в мольном соотношении 1 : 2.4, в ионных расплавах Na2B4O7, КСl, KBr, а также в эвтектических смесях мол. %: 50NaCl + 50KCl или 58LiCl + 42KCl – в течение 8–15 ч при температурах 873–1073 K под давлением аргона 4 МПа. Показано, что применение ионных расплавов позволяет получать близкие к сферическим наночастицы диборида ниобия со средним размером в зависимости от температуры ~12–17 нм, кристаллизующиеся в гексагональной сингонии, пр. гр. P6/mmm, с периодами элементарной ячейки NbB2a = 0.3105–0.3125 нм, c = 0.3269–0.3294 нм.
ВВЕДЕНИЕ
В силу высоких температур плавления, твердости, прочности, модуля упругости, износоустойчивости, широкого спектра электрических свойств, низкой скорости испарения, химической и коррозионной инертности бориды металлов IV–VI групп находят применение в различных областях промышленности [1–4]. Типичным представителем боридов V группы является диборид ниобия NbB2.
Создание тугоплавких материалов в наноструктурном состоянии с физико-химическими, механическими и другими свойствами, превосходящими таковые для микрокристаллических аналогов, обещает значительное расширение сферы их применения и стимулирует работы, направленные на разработку новых методик синтеза наноразмерных тугоплавких соединений [5]. В этой связи актуальными становятся исследования по изучению взаимодействия различных солей ниобия с борсодержащими реагентами с целью разработки новых эффективных методик получения наночастиц диборида ниобия.
Для синтеза наночастиц NbB2 обычно используют методики, разработанные для получения диборидов переходных металлов IV, VI групп, которые условно можно свести к нескольким основным типам: высокотемпературный твердофазный синтез из элементов; “бестоковый” метод синтеза при взаимодействии бора и ниобия в ионных расплавах; боротермическое или карботермическое восстановление различных оксидов и солей металлов бором (аморфным или кристаллическим), углеродом в той или иной форме (сажа, нановолокна, графит); восстановление оксидов металлов и бора магнием, натрием или оловом; механохимический синтез из элементов; химическое осаждение из паровой фазы (CVD); термолиз соответствующих борогидридов металлов или их комплексных производных; взаимодействие хлоридов переходных металлов с борогидридами щелочных металлов без стадии выделения борогидридных производных переходных металлов при повышенных температурах и давлениях; синтез в плазме [6–23].
В [6] отмечено, что при высокотемпературном твердофазном взаимодействии порошкообразных ниобия и аморфного бора NbB2 образуется с высокой скоростью, но в оригинальной работе отсутствуют данные о чистоте и размере частиц (кристаллитов) полученного диборида ниобия. В [7, 8] синтезированы близкие к сферическим наноразмерные частицы диборида ниобия со средним диаметром 65 нм при взаимодействии аморфного бора с порошком ниобия в аргоне при температуре 1073 K в ионных расплавах буры или галогенидов щелочных металлов. В [9, 10] установлено, что при взаимодействии NbO2 с бором при 1573 K в аргоне образуются агломерированные наностержни NbB2 диаметром 40 и длиной до 800 нм. При 1923 K карботермическим восстановлением смеси аморфного бора и оксидов ниобия углеродом могут быть получены наночастицы NbB2 (~50 нм) [11]. В [12] получены наностержни NbB2 диаметром 50–60 и длиной до 600 нм при взаимодействии NbCl5 с NaBH4 в аргоне при температурах 823–1173 K.
Наноразмерный диборид ниобия с размером частиц ~30 нм может быть получен при 1173 K взаимодействием Mg, Nb2O5 и H3BO3 в расплавах смесей NaCl + MgCl2 или LiCl + KCl [13, 14]. Наночастицы диборида ниобия образуются при взаимодействии NbCl5 с порошками бора и олова при температуре 923 K в атмосфере азота [15]. Порошкообразный NbB2 с размером частиц ~100 нм получали при 1073 K взаимодействием предварительно активированной механохимическим способом смеси порошков магния и ниобия с оксидом бора [16]. Для выделения из реакционной смеси диборида ниобия полученный спек последовательно обрабатывали соляной кислотой, водой и этиловым спиртом. Достаточно крупнозернистые частицы NbB2 (~200 нм) могут быть получены магнийтермическим восстановлением смеси оксидов ниобия и бора [17]. Наноразмерный диборид ниобия получали также осаждением из газовой фазы, содержащей NbCl5, BCl3 и H2, на кварцевую подложку в виде гомогенной пленки при 1223–1323 K и в виде кристаллической фазы при 1323–1473 K [18]. Наноразмерный NbB2 с размером частиц ~38 нм получен при взаимодействии Nb2O5 c порошком Mg и Na2B4O7⋅10H2O в автоклаве при 1073 K [19]. По методикам, разработанным для синтеза наночастиц диборида циркония разложением соответствующих борогидридных производных, можно также получать и наночастицы NbB2 [20, 21]. В [22] показана принципиальная возможность получения наночастиц боридов ниобия в RF-термической плазме. Наночастицы NbB2 образуются также при взаимодействии NbO2 с бором в присутствии серы и металлического натрия [23].
В настоящей работе рассматривается методика синтеза наночастиц NbB2, основанная на взаимодействии активированных в высокоэнергетической планетарной шаровой мельнице пентахлорида ниобия и борогидрида натрия в ионных расплавах (L) различного состава и химической природы (L = Na2B4O7, КСl, KBr, эвтектические смеси (мол. %): 50NaCl + 50KCl или 58LiCl + 42KCl)
(1)
$\begin{gathered} {\text{NbC}}{{{\text{l}}}_{{\text{5}}}}{\text{ + 2NaB}}{{{\text{H}}}_{{\text{4}}}}\xrightarrow[L]{t}{\text{Nb}}{{{\text{B}}}_{{\text{2}}}}{\text{ + }} \\ {\text{ + }}\,\,{\text{2NaCl + 3HCl + 2}}{\text{.5}}{{{\text{H}}}_{2}}. \\ \end{gathered} $Эта работа является непосредственным продолжением работы [24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные реагенты. Борогидрид натрия с чистотой >99.5% получали перекристаллизацией технического препарата из 1N раствора NaOH и сушили в вакууме 0.13 Па при 373 K, в работе использовали NbCl5 квалификации “х. ч.”, аргон высокой чистоты – 99.998% (ТУ 2114–005–0024760–99). Источником водорода с чистотой не менее 99.999% служил автономный лабораторный генератор, содержащий в качестве рабочего материала гидридные фазы на основе LaNi5 и TiFe, принцип действия которого подробно описан в [25]. Хлориды и бромиды лития, калия, натрия квалификации “х. ч.” или их смеси непосредственно перед синтезом вакуумировали до остаточного давления 0.13 Па при температуре 573 K. Безводный Na2B4O7 получали вакуумированием товарного Na2B4O7⋅5H2O квалификации “х. ч.”, в вакууме 0.13 Па при температуре 623 K.
Методы анализа. Рентгенофазовый анализ (РФА) полученных наночастиц NbB2 проводили на дифрактометре ДРОН-3 с монохроматором на вторичном пучке. Регистрацию дифрактограмм вели в режиме пошагового сканирования на излучении CuKα в интервале углов 2θ 20°–90° с шагом съемки 0.02° и экспозицией 4 с в точке. Профильный анализ дифрактограмм осуществляли в программном пакете “Буревестник”. Расчет метрики ячейки и параметров тонкой структуры проводили по 8 рефлексам. Инструментальное уширение учитывали по уширению линий эталона LaB6 (SRM 660b). Для расчета областей когерентного рассеяния (ОКР) использовали метод вторых моментов.
Термические исследования выполняли методом синхронного термического анализа с масс-спектрометрическим анализом газовой фазы на термоанализаторе Netzch STA 409 PC Luxx и масс-спектрометре QVS 403 C Aeolos при линейном нагреве навески образца со скоростью 10°C/мин в потоке аргона высокой чистоты.
Электронно-микроскопические исследования и энергодисперсионный анализ (ЭДА) осуществляли на комплексе приборов, состоящем из автоэмиссионного сканирующего электронного микроскопа (СЭМ) Zeiss Supra 25 и рентгеноспектральной приставки INCA Х-sight. Микрофотографии получали при низких ускоряющих напряжениях электронного пучка (~4 кВ). При таких ускоряющих напряжениях вклад в регистрируемый сигнал от подложки минимален либо отсутствует вовсе. ЭДА осуществляли при ускоряющем напряжении ~8 кВ.
Удельную поверхность образцов находили при температуре жидкого азота с использованием анализатора Quadrasorb SI. Из данных измерений удельной поверхности (Sуд) проводили оценку диаметра частиц NbB2 в предположении их сферической формы по известной формуле: dx = 6/(γSуд), где dx – размер частиц, γ – рентгеновская плотность NbB2, равная 6.93 г/см3.
Содержание бора, ниобия, хлорид- и бромид-ионов определяли по стандартным аналитическим методикам, а также методом ЭДА. Содержание водорода и кислорода определяли на CHNS/O-элементном анализаторе Vario EL cube Elementar.
Методика эксперимента. Смесь NbCl5 + NaBH4 в мольном соотношении 1 : 2.4 активировали в шаровой планетарной мельнице Pulverisette 6 (шары из ZrO2 диаметром 10 мм, шаровая загрузка 1 : 10, скорость вращения 400 об./мин, время обработки 2 мин) в атмосфере аргона при комнатной температуре. Активированную смесь порошков 3.25 г NbCl5 (0.012 моля) и 1.10 г NaBH4 (0.029 моля) вместе с навесками (по 15.0 г) KCl, KBr, Na2B4O7 или эвтектической смеси (мол. %): 50NaCl + 50KCl, 58LiCl + 42КCl засыпали в кварцевую ампулу, а затем помещали в реактор-автоклав из нержавеющей стали в атмосфере аргона высокой чистоты.
Температуры синтеза выбирали выше температур плавления используемых ионных расплавов. Давление аргона в реакторе над расплавом реагентов (4 МПа) гарантировало в экстренных ситуациях отсутствие возможного контакта расплава со следами кислорода и азота воздуха.
Реакционную смесь вакуумировали до остаточного вакуума 0.13 Па, заполняли аргоном под давлением 4 МПа и нагревали в течение 8–15 ч в интервале температур 873–1073 K. В ходе синтеза давление в реакторе повышалось до ~10 МПа за счет выделения газообразных продуктов реакции (1). Затем температуру в реакторе доводили до комнатной и понижали давление до атмосферного. После вскрытия реактора полученную реакционную массу последовательно обрабатывали охлажденной до 277 K дистиллированной водой, ацетоном, этиловым спиртом и вакуумировали при 313 К до остаточного вакуума 0.13 Па. Затем полученный порошок снова помещали в реактор, вакуумировали и обрабатывали H2 из водородного аккумулятора в проточном режиме под давлением H2 5 МПа при 373 К по методике [26]. После обработки водородом реактор вновь вакуумировали при комнатной температуре до остаточного вакуума 0.13 Па, заполняли аргоном до атмосферного давления и выгружали из реактора полученное вещество.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 приведены результаты расчета термодинамических параметров реакции (1). Как следует из этих данных, в рассматриваемом интервале температур взаимодействие характеризуется высокой термодинамической вероятностью образования диборида ниобия. Реакция является экзотермической. Расчеты изменения энергии Гиббса указывают на то, что реакция в данном температурном интервале энергетически выгодна, а повышение температуры способствует ее протеканию. Термодинамические данные для NbB2 взяты из работы [27], для остальных веществ – из справочника NIST Chemistry Webbook [28].
Таблица 1.
Результаты расчета термодинамических параметров реакции (1) в температурном интервале 673–1173 K
| Т, К | ΔН, кДж/моль | ΔS, Дж/(моль К) | ΔG, кДж/моль |
|---|---|---|---|
| 673 | –119.8 | 547.7 | –488.4 |
| 723 | –123.4 | 542.4 | –515.6 |
| 773 | –126.8 | 538.0 | –542.6 |
| 823 | –185.7 | 465.5 | –568.9 |
| 873 | –186.4 | 465.0 | –592.3 |
| 923 | –187.0 | 464.4 | –615.7 |
| 973 | –187.7 | 463.9 | –639.1 |
| 1023 | –188.2 | 463.5 | –662.4 |
| 1073 | –188.7 | 463.2 | –685.7 |
| 1123 | –189.0 | 463.0 | –708.9 |
| 1173 | –189.2 | 462.8 | –732.1 |
На рис. 1 и в табл. 2 представлены результаты и условия взаимодействия NbCl5 с NaBH4 по реакции (1) при различных температурах и времени взаимодействия в соответствующих ионных расплавах. Как видно из этих данных, образование наночастиц диборида ниобия наблюдается при температурах, превышающих температуру интенсивного разложения борогидрида натрия, которая равна 868 K [29]. Выделенный из реакционной смеси наноразмерный NbB2, по результатам химического анализа и ЭДА, независимо от используемого ионного расплава имеет валовый химический состав NbB1.99–2.02O0.01–0.02. Следов галогенид-ионов и водорода в нем не обнаружено.
Рис. 1.
Дифрактограммы наночастиц NbB2, полученных при 1073 K в ионном расплаве KBr (a), при 1023 K в ионном расплаве (мол. %) 50NaCl – 50KCl (б), при 873 K в ионном расплаве 58LiCl – 42KCl (в) и подвергнутых термообработке в политермическом режиме в аргоне до 1273 K (г).
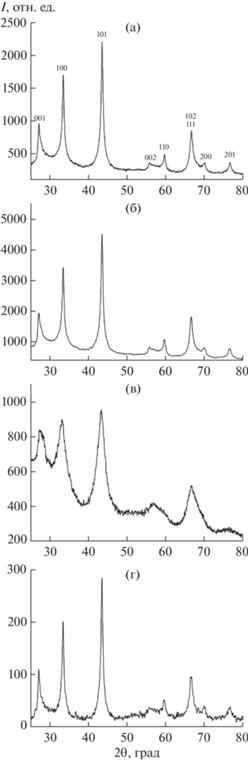
Таблица 2.
Результаты исследования взаимодействия NbCl5 с NaBH4 по реакции (1) при различных температурах и времени в атмосфере аргона в ионных расплавах (мол. %) или без них
| Ионный расплав | T, K | τ, ч | Химический состав* |
Фазовый состав |
a, нм | c, нм |
|---|---|---|---|---|---|---|
| KCl | 1073 | 15 | NbB1.99O0.02 | NbB2 | 0.3115 | 0.3278 |
| KBr | 1023 | 8 | NbB2.01O0.02 | NbB2 | 0.3117 | 0.3271 |
| 1073 | 15 | NbB2.00O0.02 | NbB2 | 0.3125 | 0.3294 | |
| 50NaCl–50KCl | 948 | 10 | NbB1.99O0.01 | NbB2** | – | – |
| 1023 | 8 | NbB2.02O0.02 | NbB2 | 0.3110 | 0.3281 | |
| 1073 | 8 | NbB2.01O0.02 | NbB2 | 0.3107 | 0.3269 | |
| 58LiCl–42KCl | 873 | 10 | NbB2.02O0.01 | NbB2** | – | – |
| 923 | 8 | NbB1.99O0.01 | NbB2** | – | – | |
| 1073 | 8 | NbB2.02O0.02 | NbB2 | 0.3121 | 0.3290 | |
| Na2B4O7 | 1073 | 8 | NbB2.01O0.02 | NbB2 | 0.3105 | 0.3294 |
| – | 923 | 12 | – | NbB2*** | 0.3105 | 0.3277 |
* По данным РФЭС, кислород находится в поверхностных слоях наночастиц NbB2 в виде оксидов ниобия (V) и бора [24]. ** Периоды кристаллической решетки не рассчитывались ввиду недостаточного количества рефлексов. *** Взаимодействие NbCl5 с NaBH4 по реакции (1) осуществлялось в отсутствие ионных расплавов [12].
Из дифрактограмм, полученных при различных температурах (рис. 1а–1в), видно, что материал является однофазным и содержит наноразмерный диборид ниобия (пр. гр. P6/mmm). Значимого количества примесных фаз не обнаружено. Параметры элементарной ячейки наночастиц NbB2 (табл. 2) согласуются с результатами [30] и соответствуют дифракционной базе данных ICDD (PDF–2, Сard 000-35-0742). Как было отмечено выше, повышение температуры реакции (1) способствует образованию наночастиц NbB2, однако при этом происходит увеличение их размера (табл. 3). По данным СЭМ, полученные в температурном интервале 873–1073 K наночастицы NbB2 имеют различную форму, но преобладающая их часть имеет форму, близкую к сферической (рис. 2а–2в). Наночастицы NbB2 заметно агломерированы, о чем свидетельствует сравнение их размеров из данных СЭМ и из величин удельной поверхности.
Таблица 3.
Средний диаметр наночастиц NbB2, полученных при взаимодействии NbCl5 с NaBH4 по реакции (1) в ионных расплавах (мол. %) или без них при различных температурах
| Ионный расплав | Т, K | Dср, нм (СЭМ) | Размер ОКР, нм | Dср, нм (из данных Sуд) |
|---|---|---|---|---|
| 58LiCl–42KCl | 873 | ~12 | ~3 | ~16(Sуд = 53 м2/г) |
| 50NaCl–50KCl | 1023 | ~17 | ~9 | ~20(Sуд = 43 м2/г) |
| KBr | 1073 | ~17 | ~10 | ~19(Sуд = 45 м2/г) |
| – | 923 | ~50–600* | – | – |
* Наностержни диаметром 50–60 и длиной 600 нм [12].
Рис. 2.
Электронные микрофотографии наночастиц NbB2, полученных при 1073 K в ионном расплаве KBr (a), при 1023 K в ионном расплаве (мол. %) 50NaCl–50KCl (б), при 873 K в ионном расплаве 58LiCl–42KCl (в) и подвергнутых термообработке в политермическом режиме в аргоне до 1273 K (г).

В табл. 3 сопоставлены средние размеры частиц (кристаллитов) NbB2, оцененные из данных СЭМ, профильного анализа дифрактограмм и величин удельной поверхности. Видно, что независимо от природы ионного расплава средний размер частиц (кристаллитов) NbB2 определяется температурой синтеза и составляет от 12 до 17 нм. Применение ионных расплавов в реакции (1) позволяет получать не наностержни, а близкие к сферическим наночастицы NbB2 меньшего размера при более низкой температуре и меньшем времени взаимодействия компонентов по сравнению с рассмотренными выше твердофазными реакциями в отсутствие ионного расплава, например [12].
Термографические исследования, проведенные в атмосфере аргона в температурном интервале 293–1273 K, указывают на то, что наночастицы NbB2 не испытывают физико-химических превращений, связанных с выделением, поглощением тепла или изменением массы, а также сохраняют фазовый состав (рис. 1г) и морфологию (рис. 2г).
ЗАКЛЮЧЕНИЕ
Применение ионных расплавов различного химического состава при взаимодействии предварительно активированных механохимическим способом порошков NbCl5 и NaBH4, взятых в мольном соотношении 1 : 2.4, при температурах 873–1073 K и времени реакции 8–15 ч в атмосфере аргона позволяет получать близкие к сферическим наночастицы диборида ниобия со средним размером ~12–17 нм в более мягких условиях, чем при отсутствии расплавов.
Список литературы
Серебрякова Т.И., Неронов В.А., Пешев П.Д. Высокотемпературные бориды. Челябинск: Металлургия, 1991. 368 с.
Carenco S., Portehault D., Boissiere C., Mezailles N., Sanchez C. Nanoscaled Metal Borides and Phosphides: Recent Developments and Perspectives // Chem. Rev. 2013. V. 113. № 10. P. 7981–8065. https://doi.org/10.1021/cr400020d
Андриевский Р.А., Спивак И.И. Прочность тугоплавких соединений и материалов на их основе. Справочник. Челябинск: Металлургия, 1989. 367 с.
Прохоров А.М., Лякишев Н.П., Бурханов Г.С., Дементьев В.А. Высокочистые бориды переходных металлов – перспективные материалы современной техники // Неорган. материалы. 1996. Т. 32. № 11. С. 1365–1371.
Andrievski R.A., Khatchoyan A.V. Nanomaterials in Extreme Environments, Fundamentals and Applications. Berlin: Springer, 2016. 107 p.
Matsudaira T., Itoh H., Naka S. Synthesis of Niobium Boride Powder by Solid – State Reaction between Niobium and Amorphous Boron // J. Less-Common Met. 1989. V. 155. № 2. P. 207–214. https://doi.org/10.1016/0022-5088(89)90229-4
Кравченко С.Е., Винокуров А.А., Дремова Н.Н., Надхина С.Е., Шилкин С.П. Синтез наночастиц диборида ниобия взаимодействием аморфного бора с ниобием в ионных расплавах KCl и Na2B4O7 // ЖОХ. 2021. Т. 91. № 2. С. 326–328.
Кравченко С.Е., Ковалев Д.Ю., Винокуров А.А., Дремова Н.Н., Иванов А.В., Шилкин С.П. Синтез и термоокислительная устойчивость наноразмерного диборида ниобия // Неорган. материалы. 2021. Т. 57. № 10. С. 1063–1072.
Peshev P., Leyarovska L., Bliznakov G. On the Borothermic Preparation of Some Vanadium, Niobium and Tantalum Borides // J. Less Common Met.1968. V. 15. P. 259–267.
Jha M., Ramanujachary K.V., Lofland S.T., Gupta G., Ganguli A.K. Novel Borothermal Process for the Synthesis of Nanocrystalline Oxides and Borides of Niobium // J. Dalton Trans. 2011. V. 40. P. 7879–7888. https://doi.org/10.1039/c1dt10468c
Maeda H., Yoshikawa T., Kusakabe K., Morooka S. Synthesis of Ultrafine NbB2 Powder by Rapid Carbothermal Reduction in a Vertical Tubular Reactor // J. Alloys Compd. 1994. V. 215. P. 127–334. https://doi.org/10.1016/0925-8388(94)90829-X
Gai P., Yang Z., Shi L., Chen L., Zhao A., Gu Y., Qian Y. Low Temperature Synthesis of NbB2 Nanorods by a Solid – State Reaction Route // Mater. Lett. 2005. V. 59. P. 3550–3552. https://doi.org/10.1016/j.matlet.2005.07.051
Ma J., Du Y., Wu M., Li G., Feng Z., Guo M., Sun Y., Song W., Lin M., Guo X. A Simple Inorganic – Solvent Route to Nanocrystalline Niobium Diboride // J. Alloys Compd. 2009. V. 468. P. 473–476. https://doi.org/10.1016/j.jallcom.2008.01.021
Portehaut D., Devis S., Beaunier P., Gervais C., Giordano C., Sanchez C., Antonietti M. A General Solution Route toward Metal Boride Nanocrystals // Angew. Chem. 2011. V. 50. P. 3262–3265. https://doi.org/10.1002/ange.201006810
Jothi P.R., Yubuta K., Fokwa B.P.T.. A Simple, General Synthetic Route toward Nanoscale Transition Metal Borides // Adv. Mater. 2018. V. 30. № 14. P. 1704181-1–1704181-6. https://doi.org/10.1002/adma.201704181
Jafari M., Tajizadegan H., Golabgir M.H., Chami A., Torabio O. Investigation on Mechanochemical Behavior of Al/Mg–B2O3–Nb System Reactive Mixtures to Synthesize Niobium Diboride // J. Refract. Met. Hard Mater. 2015. V. 50. P. 86–92. https://doi.org/10.1016/j.ijrmhm.2014.10.017
Balci Ö., Aĝaoĝullari D., Övecoĝlu M.L., Duman I. Synthesis of Niobium Borides by Powder Metallurgy Methods using Nb2O5, B2O3 and Mg Blends // Trans. Nonferrous Met. Soc. China. 2016. V. 26. P. 747–758. https://doi.org/10.1016/S1003-6326(16)64165-1
Motojima S., Sugiyama K., Takahashi Y. Chemical Vapor Deposition of Niobium Diborie (NbB2) // J. Cryst. Growth. 1975. V. 30. P. 233–239. https://doi.org/10.1016/0022-0248(75)90094-9
Gupta A., Singhal V., Pandey O.P. Facile in-situ Synthesis of NbB2 Nanoparticles at Low Temperature // J. Alloys Compd. 2018. V. 736. P. 306–313. https://doi.org/10.1016/j.jallcom.2017.10.257
Кравченко С.Е., Торбов В.И., Шилкин С.П. Наноразмерный диборид циркония: синтез, свойства // Журн. неорган. химии. 2011. Т. 56. № 4. С. 546–549.
Andrievski R.A., Kravchenko S.E., Shilkin S.P. Some Properties of Ultrafine Zirconium Boride Powders and Films // Jpn. J. Appl. Phys. 1994. V. 10. P. 198–199.
Cheng Y., Choi S., Watanabe T. Synthesis of Niobium Boride Nanoparticle by RF Thermal Plasma // J. Phys.: Conf. Ser. 2013. V. 441. 012031. https://doi.org/10.1088/1742-6596/441/1/012031
Chen B., Yang L., Heng H., Chen J., Zhang L., Xu L., Qian Y., Yang J. Additive – Assisted Synthesis of Boride, Carbide and Nitride Micro/Nanocrystals // J. Solid State Chem. 2012. V. 194. P. 219–224. https://doi.org/10.1016/j.jssc.2012.05.032
Винокуров А.А., Дремова Н.Н., Надхина С.Е., Иванов А.В., Шилкин С.П. Образование наночастиц диборида ниобия при взаимодействии пентахлорида ниобия с борогидридом натрия в ионных расплавах галогенидов щелочных металлов // Журн. общ. химии. 2022. Т. 92. № 2. С. 312–316.
Фокин В.Н., Фокина Э.Э., Шилкин С.П. Синтез гидридов некоторых металлов в крупнокристаллическом состоянии // Журн. общ. химии. 1996. Т. 66. № 8. С. 1249–1252.
Семененко К.Н., Шилкин С.П., Бурнашева В.В., Волкова Л.С., Мозгина Н.Г. Взаимодействие некоторых интерметаллических соединений, образованных редкоземельными металлами и металлами триады железа, с азотом в присутствии водорода // Журн. общ. химии. 1987. Т. 57. № 4. С. 729–732.
Болгар А.С., Сербова М.И., Фесенко В.В., Серебрякова Т.И., Исаева Л.П. Высокотемпературная энтальпия и теплоемкость диборида ниобия // Теплофизика высоких температур. 1980. Т. 18. № 6. С. 1180–1183.
Burgess D.R., Jr. Thermochemical Data in NIST Chemistry WebBook, NIST Standard Reference Database № 69 / Eds. Linstrom P.J., Mallard W.G. Gaithersburg: National Inst of Standards and Technology. https://doi.org/10.18434/T4D303
Дымова Т.Н., Елисеева Н.Г., Михеева В.И. Термографическое изучение гидридобората натрия и некоторых родственных веществ // Журн. неорган. химии. 1967. Т. 12. № 9. С. 2317–2320.
Диаграммы состояния двойных металлических систем. Справочник / Под общ. ред. Лякишева Н.П. Т. 1. М.: Машиностроение, 1996. 992 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


