Неорганические материалы, 2022, T. 58, № 8, стр. 852-860
Катодные материалы состава LiFePO4/C/Ag, полученные методом Печини
С. А. Новикова 1, А. Б. Ильин 1, Д. Ю. Грызлов 2, Т. Л. Кулова 2, А. Б. Ярославцев 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, корп. 4, Россия
* E-mail: yaroslav@igic.ras.ru
Поступила в редакцию 26.03.2022
После доработки 01.04.2022
Принята к публикации 04.04.2022
- EDN: WKXJTJ
- DOI: 10.31857/S0002337X22070119
Аннотация
С помощью метода Печини синтезированы композиты на основе LiFePO4 со структурой оливина с углеродным покрытием. Полученные материалы аттестованы с помощью рентгенофазового анализа, сканирующей электронной микроскопии, термогравиметрического анализа и спектроскопии комбинационного рассеяния. Оптимизирован процесс термической обработки прекурсора LiFePO4. В результате получен LiFePO4 со структурой оливина с размером первичных частиц ~30 нм. Добавление к композиту 0.2 мас. % серебра приводит к получению катодного материала с улучшенными электрохимическими характеристиками. Полученный материал характеризуется значениями разрядной емкости 165, 85 и 53 мАч/г при плотности тока циклирования 20 (С/8), 1600 (10С) и 3200 (20С) мА/г.
ВВЕДЕНИЕ
Литий-ионные аккумуляторы (ЛИА) получили широкое распространение в качестве портативных источников энергии. LiFePO4 со структурой оливина является перспективным катодным материалом для ЛИА благодаря высокой теоретической емкости (170 мАч/г), низкой себестоимости, безопасности и практически постоянному рабочему потенциалу (3.5 В) [1]. Однако низкая электропроводность LiFePO4 существенно ограничивает его широкое применение. Электронная проводимость этого материала при комнатной температуре имеет порядок 10–9 См/см, а коэффициент диффузии ионов лития составляет ~10–14–10–16 см2/с [2–4].
Среди используемых способов модификации катодных материалов на основе LiFePO4, позволяющих преодолевать ограничения, связанные с их низкой электропроводностью, следует отметить получение наноматериалов [5–10], замещение части ионов лития [11, 12], железа [7, 13–17] или фосфора [12, 13], а также формирование композиционных материалов [18–29], в первую очередь посредством нанесения проводящих углеродных покрытий [25]. В результате уменьшения размера частиц увеличивается площадь поверхности материала, что улучшает контакт с электролитом и вызывает понижение длины диффузионного пути катионов лития в частице. Процессы переноса в межзеренном пространстве обычно протекают существенно быстрее [30, 31]. Помимо увеличения электропроводности, формирующееся углеродное покрытие препятствует спеканию частиц LiFePO4 при отжиге и способствует получению более мелкодисперсного материала. Дополнительное повышение электропроводности покрытия может быть достигнуто за счет внедрения в него наночастиц металлов [21, 32, 33].
В качестве электропроводящих добавок используются такие полимеры, как полианилин (PANI), полипиррол (PPy) или поли-3,4-этилендиокиситиофен (PEDOT) [18, 22, 34–37], а также различные формы углерода (аморфный углерод, графит, графен, углеродные нанотрубки) [20, 24, 27, 38–41]. Преимуществом углеродных добавок являются также низкая стоимость и доступность. Источниками углерода могут быть углеводы [42, 43], карбоновые кислоты [44, 45], поливиниловый спирт [23, 46], углеводороды [46], поливинилиденфторид [21, 23, 47], полианилин [48–50] и другие полимеры [51–53]. Покрытие углеродом частиц активного материала в большинстве случаев осуществляется за счет добавления источника углерода к катодному материалу с последующим термическим разложением в инертной среде [23, 42, 54]. Кроме того, возможно получение композитов с углеродом при использовании реагентов, которые одновременно являются источником щелочного и/или переходного металла и углерода [55–57].
В данной работе предложен подход к получению композитов LiFePO4/C/Ag, основанный на использовании метода Печини [58]. Цитратные комплексы железа и лития в процессе синтеза вступают в реакцию поликонденсации с этиленгликолем, используемым в качестве растворителя, с образованием полимерной матрицы, которая служит источником для получения углеродного покрытия на фосфате лития-железа со структурой оливина. Это позволяет получать частицы LiFePO4 нанометрового размера за счет образования полимерной матрицы, препятствующей их росту при отжиге [25]. Добавление к полученному с помощью данной методики композиту LiFePO4/C наночастиц серебра позволило получить катодный материал для ЛИА с улучшенными электрохимическими характеристиками.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. В смеси 10 мл этиленгликоля и 20 мл дистиллированной воды растворялись стехиометрические количества Fe(NO3)3⋅9H2O (10 ммоль), NH4H2PO4 (10 ммоль), LiNO3 (10 ммоль) и лимонной кислоты (40 ммоль). После растворения реагентов раствор помещался в печь (2 ч, 350°С). Полученный прекурсор гомогенизировали в планетарной мельнице, сушили от этанола и отжигали в атмосфере аргона в течение 5 ч при температурах 400–600°С. Шифр образцов: образец, обожженный в течение 5 ч при 400°С – LiFePO4/C-400, при 600°С – LiFePO4/C-600; в течение 5 ч при 400°С, а затем 1 ч при 600°С – LiFePO4/C-400-600.
Материалы, содержащие наночастицы серебра, состава LiFePO4/C/Ag получали аналогичным способом путем добавления AgNO3 (0.2% от массы LiFePO4) к раствору исходных реагентов.
Методы исследования. Рентгенофазовый анализ (РФА) образцов осуществлялся с использованием дифрактометра Rigaku D/MAX 2200, на излучении CuKα. Для обработки спектров использовался пакет программ Rigaku Application Data Processing. Обработка рентгенограмм проводилась в программе FullProf Suite (WinPlotr), уточнение параметров кристаллической решетки – с помощью дистрибутива Checkcell.
Размер частиц (L) полученных веществ рассчитывали на основании уширения линий рентгенограмм по формуле Дебая–Шеррера
где λ – длина волны рентгеновского излучения, θ – дифракционный угол, β – квадратный корень из разности квадратов полуширин дифракционных линий образца и стандарта. В качестве последнего использовали LaB6.Термогравиметрический анализ проводили на термовесах Netzsch TG 209 в платиновых тиглях на воздухе с последующим анализом состава газовой фазы с помощью масс-спектрометра Aeolos QMS 403C. Температурный интервал 25–800°С, скорость нагрева 10 К/мин, навески 20–30 мг.
Эксперименты по спектроскопии комбинационного рассеяния (КР) проводились на спектрометре DXRxi Raman Imaging Microscope (Thermo Fisher Scientific). Лазер 532 нм был сфокусирован на поверхности порошков при помощи линзы микроскопа с пятидесятикратным увеличением (диаметр луча ~1 мкм). Мощность лазера была установлена в диапазоне 0.2–0.6 мВт на поверхности образцов, чтобы избежать теплового разрушения катодных материалов. Для каждого образца было сделано 50 накоплений, каждое накопление в течение 0.5 с.
Анализ микроструктуры полученных образцов проводили с помощью сканирующего электронного микроскопа (СЭМ) Carl Zeiss NVision 40, ускоряющее напряжение 1–2 кВ.
Исследование электрохимических характеристик композитов с углеродом и/или полианилином проводили в трехэлектродных герметичных электрохимических ячейках с литиевым вспомогательным и литиевым электродом сравнения. Рабочие электроды изготовлены по стандартной намазной технологии. В качестве токоотвода использовали сетку из нержавеющей стали. Активная масса была приготовлена смешением порошка нанокомпозита, сажи (Timcal) и поливинилиденфторида (Aldrich), предварительно растворенного в N-метилпирролидиноне (Aldrich). Количество активного вещества на электроде составляло около 10–15 мг/см2. Электроды прессовали под давлением 100 МПа с последующей сушкой под вакуумом при температуре 120°С. Сборку электрохимических ячеек проводили в перчаточном боксе с атмосферой сухого аргона. В качестве электролита использовали 1 М LiPF6 в смеси этиленкарбонат + диэтилкарбонат + диметилкарбонат (1 : 1 : 1) (все компоненты электролита имели квалификацию extra dry, Aldrich). Содержание воды в электролите не превышало 20 м.д. В качестве сепаратора использовали нетканый полипропилен толщиной 25 мкм (НПО “Уфим”). Тестирование проводили в гальваностатическом режиме при плотностях тока 20–3200 мА/г при комнатной температуре. Значение емкости расcчитывали на содержание активного катодного материала.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
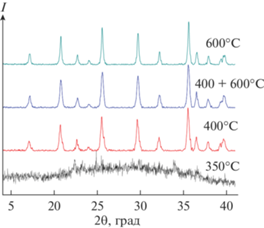
Состав и морфология. По данным РФА, полученный после выдерживания прекурсора при 350°С образец является рентгеноаморфным. При повышении температуры отжига до 400°С и выше происходит формирование орторомбической модификации LiFePO4 со структурой оливина (рис. 1). Параметры элементарной ячейки образцов, полученных при различных режимах термической обработки, приведены в табл. 1. В целом они близки друг к другу в пределах точности измерения. Можно отметить лишь некоторый рост параметра a при увеличении конечной температуры отжига до 600°С, что может быть связано с укрупнением частиц или с изменением степени окисления железа.
Таблица 1.
Параметры элементарной ячейки и размеры областей когерентного рассеяния (ОКР) для материалов, полученных с использованием различных режимов отжига
| Материал | a, Å | b, Å | c, Å | V, Å3 | ОКР, нм |
|---|---|---|---|---|---|
| LiFePO4/C-400 | 10.317(6) | 6.005(3) | 4.688(3) | 290.4(5) | 25 |
| LiFePO4/C-600 | 10.330(3) | 6.004(2) | 4.692(1) | 291.0(4) | 50 |
| LiFePO4/C-400-600 | 10.331(6) | 6.003(3) | 4.692(3) | 291.0(4) | 30 |
По данным электронной микроскопии, средний размер частиц материала LiFePO4/С-400 составляет ~30 нм (рис. 2а, 2б), что коррелирует со значением ОКР ~25 нм (табл. 1), рассчитанным из данных рентгеновской дифракции. Это позволяет заключить, что агломерации первичных частиц не происходит и материал характеризуется высокой дисперсностью. Увеличение температуры конечного отжига до 600°С приводит к получению более крупнодисперсного материала LFP/C-600, характеризующегося средним размером частиц ~150 нм по данным СЭМ (рис. 2в, 2г) и размером ОКР ~50 нм (табл. 1). При оптимизации процесса синтеза и термической обработки прекурсора был подобран ступенчатый режим отжига, позволяющий получать хорошо закристаллизованный LiFePO4 с сохранением размера первичных частиц ~30 нм по данным РФА (рис. 2д, 2е, табл. 1).
Рис. 2.
СЭМ-изображения образцов LiFePO4/C-400 (а, б), LiFePO4/C-600 (в, г) и LiFePO4/C-400-600 (д, е).

Характерные кривые потери массы при нагревании LiFePO4/C приведены на рис. 3. При нагревании LiFePO4/C на воздухе при температуре выше 50°С на термогравиметрической кривой наблюдается потеря массы, которая сопровождается выделением воды (m/z = 18), сорбированной на поверхности. При температурах выше 250°С, по данным масс-спектрометрии, начинает выделяться СО2 (m/z = 44), что сопровождается увеличением массы. Это свидетельствует о том, что значительная часть выделяющегося СО2 сорбируется на поверхности LiFePO4 [21, 33]. Выделение СО2 имеет несколько максимумов. Наибольшая интенсивность соответствует температурному интервалу 300–450°С. При температурах выше 350–400°С масса начинает уменьшаться. В интервале 450–520°С вновь наблюдается набор массы, обусловленный окислением LiFePO4. Согласно данным РФА, при нагревании LiFePO4, синтезированного золь–гель-методом, выше 500°С происходит окисление двухвалентного железа, которое сопровождается образованием Fe2O3 и Li3Fe2(PO4)3 [59].
Рис. 3.
Потеря массы и интенсивности выделения газовых потоков в зависимости от температуры, полученные при нагревании образцов LiFePO4/C-400 (а) и LiFePO4/C-400-600 (б) (цифры у кривых указывают массовое число (m/z) для соответствующего иона).
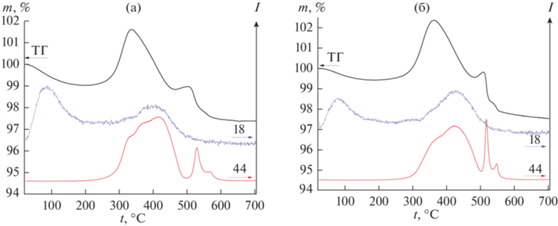
Также зафиксировано дополнительное выделение СО2 при 520–560°С. Можно предположить, что это обусловлено удалением остатков углерода при срастании частиц или при его окислении. Интересно, что для материалов, подвергавшихся термообработке при 600°С, интегральная интенсивность пиков, соответствующих выделению СО2 при более высоких температурах, растет. Это может свидетельствовать о том, что часть углеродного покрытия при высокотемпературном отжиге в инертной атмосфере локализуется на границах раздела первичных частиц в агломератах и становится труднодоступной для окисления.
В газообразных продуктах отжига на воздухе для всех исследованных образцов LiFePO4/C помимо СО2 наблюдается выделение воды при температуре 300–500°С. Полученные данные свидетельствуют о незавершенности процессов пиролиза при 600°С. Согласно данным [23], пиролиз различных органических соединений полностью не завершается и при 800°С, однако при этой температуре происходит увеличение размера первичных частиц, что оказывает негативное влияние на электрохимическую емкость. Поэтому температура синтеза исследуемых материалов была ограничена 600°С.
Содержание углерода в полученных композитах рассчитывалось по данным ТГА по массе остатка при нагревании на воздухе до постоянной массы с учетом окисления LiFePO4 и составило ~6–7 мас. %.
В КР-спектрах исследуемых материалов интенсивную полосу с максимумом при ~1590 см–1 можно отнести к G-полосе кристаллического графита (sp2-гибридизация углерода), а полосу при ~1360 см–1 – к D-полосе разупорядоченного графита (рис. 4) [60, 61]. Наряду с ними можно выделить еще 2 широких полосы в областях около 1240 и 1500 см–1 (рис. 4б), соответствующих углеродным фрагментам, отличающимся по строению, например полосу при 1500 см–1 относят к колебаниям углерода в состоянии sp3-гибридизации [33, 60]. Для LiFePO4/C-400 и LiFePO4/C-400-600 вклад дополнительных полос в интегральную интенсивность спектра составил 45 и 43% соответственно, что свидетельствует о том, что углеродное покрытие представлено преимущественно структурой графита, для которой характерна высокая электронная проводимость [62, 63]. Для оценки качества углеродного покрытия в литературе также применяется соотношение интегральных интенсивностей линий D и G графита (ID/IG): чем меньше это соотношение, тем выше содержание упорядоченного высокопроводящего графита [64]. Для LiFePO4/C-400 и LiFePO4/C-400-600 соотношение ID/IG составило 1.75 и 1.52 соответственно. Можно заключить, что при повышении температуры конечного отжига до 600°С наблюдается некоторое совершенствование структуры графита, о чем можно судить по увеличению соотношения интегральных интенсивностей пиков, соответствующих углероду в sp2-гибридизации, к пикам углерода, отличающегося по строению, и повышению содержания упорядоченного графита.
Рис. 4.
Спектры КР образцов LiFePO4/C-400 (1) и LiFePO4/C-400-600 (2) (а); на примере образца LiFePO4/C-400 представлено разложение спектра на компоненты (б).
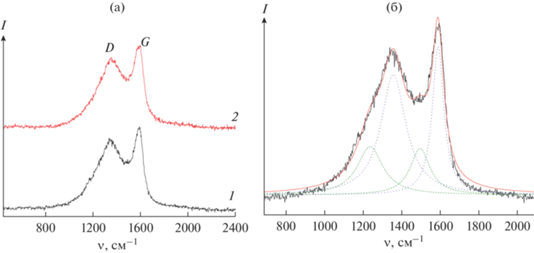
Следует отметить, что при довольно низком содержании углерода в композитах в КР-спектре отсутствует линия в области 950 см–1, соответствующая колебаниям групп ${\text{PO}}_{4}^{{3 - }}.$ Это, видимо, свидетельствует о том, что полученное в результате пиролиза полимерной матрицы углеродное покрытие является равномерным и препятствует проникновению луча к поверхности LiFePO4.
Электрохимическое тестирование. Наименьшим размером частиц характеризуется материал LiFePO4/C-400 (рис. 2а, 2б, табл. 1). Это позволяло ожидать от данного материала улучшенных электрохимических характеристик за счет сокращения длины диффузионного пути носителей заряда до межзеренного пространства, в котором осуществляется более быстрый ионный перенос [30]. Однако удельная разрядная емкость LiFePO4/C-400 при заряде/разряде током плотностью 20 мА/г (~С/8) оказалась крайне низкой (~44 мАч/г) и уменьшалась при циклировании. При этом разница потенциалов заряда и разряда была высока и составляла 0.67 В, а форма зарядно-разрядных кривых отличалась от формы, характерной для катодных материалов на основе LiFePO4 (рис. 5, кривая 1). Наблюдаемая картина свидетельствует о том, что температура конечного отжига 400°С является недостаточной для получения хорошо закристаллизованного LiFePO4 с качественным углеродным покрытием. Действительно, согласно литературным данным, на электрохимические характеристики материалов со структурой оливина влияют многие взаимозависимые факторы: параметры кристаллической структуры, концентрация дефектов обмена (FeLi), наличие примесей Fe3+, присутствие и эффективность углеродного покрытия, морфология и т.д., которые определяются выбранным методом и условиями синтеза [65–67].
Рис. 5.
Зарядные и разрядные кривые образцов LiFePO4/C-400 (1), LiFePO4/C-600 (2), LiFePO4/C-400-600 (3) и LiFePO4/C/Ag-400-600 (4) (плотность тока 20 мА/г (~С/8)).
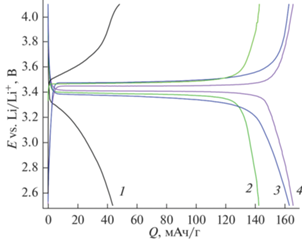
При увеличении температуры синтеза до 600°С на зарядно-разрядных кривых LiFePO4/C-600 появляются характерные для LiFePO4 плато и наблюдается увеличение удельной разрядной емкости до 143 мАч/г при заряде/разряде током 20 мА/г (рис. 5, кривая 2). Удельная разрядная емкость более дисперсного LiFePO4/C-400-600 составила 163 мАч/г (рис. 5, кривая 3). При этом разница между средними потенциалами на плато заряда и разряда уменьшается до 0.09–0.12 В. Этот показатель, согласно [68], определяется омическими потерями при переносе катионов лития через углеродное покрытие и заряженный (разряженный) слой катодного материала, формирующийся на поверхности образца. Внедрение в состав композита небольшого количества наночастиц серебра (0.2 мас. %) способствует увеличению электропроводности материала. Для образца LiFePO4/C/Ag-400-600 разница потенциалов на плато заряда и разряда составила 0.04 В, что гораздо ниже по сравнению с другими исследованными в данной работе материалами и с аналогичным материалом, синтезированным золь–гель-методом с использованием сахарозы в качестве источника углерода [14]. При этом разрядная емкость LiFePO4/C/Ag-400-600 при токе 20 мА/г составила 166 мАч/г.
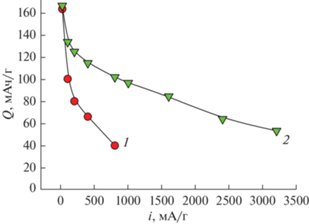
При увеличении скорости заряда/разряда разрядная емкость исследуемых образцов закономерно уменьшается (рис. 6). Уменьшение емкости при увеличении плотности тока связано с кинетическими факторами, а не с деградацией материала, поскольку значение емкости на малых токах восстанавливается практически до исходной величины после проведения циклирования большими токами. Наиболее высоких значений емкости при быстром заряде/разряде удалось добиться при внедрении небольшого количества наночастиц серебра в LiFePO4/C-400-600. Образец LiFePO4/C/Ag-400-600 показал значения разрядной емкости 166, 85 и 53 мАч/г при плотности тока циклирования 20 (С/8), 1600 (10С) и 3200 (20С) мА/г соответственно (рис. 6, кривая 2).
ЗАКЛЮЧЕНИЕ
С помощью простого и недорогого метода Печини получены наноразмерные композиты на основе LiFePO4 со структурой оливина с углеродным покрытием. При оптимизации процесса синтеза и термической обработки прекурсора LiFePO4 подобран ступенчатый режим отжига, позволяющий получать хорошо закристаллизованный LiFePO4 со структурой оливина с сохранением размера первичных частиц (~30 нм). Содержание углерода в композите составило около 6–7 мас. %. По данным КР-спектроскопии углеродное покрытие является хорошо сформированным и имеет преимущественно sp2-гибридизацию. Добавление к композиту 0.2 мас. % наночастиц серебра приводит к получению катодного материала с улучшенными электрохимическими характеристиками. Полученный материал LiFePO4/C/Ag-400-600 показал значения разрядной емкости 165, 85 и 53 мАч/г при плотности тока циклирования 20 (С/8), 1600 (10С) и 3200 (20С) мА/г соответственно.
Список литературы
Padhi A.K., Nanjundaswamy K.S., Goodenough J.B. Phospho-Olivines as Positive-Electrode Materials for Rechargeable Lithium Bbatteries // J. Electrochem. Soc. 1997. V. 144. № 4. P. 1188–1194. https://doi.org/10.1149/1.1837571
Amin R., Maier J., Balaya P., Chen D.P., Lin C.T. Ionic and Electronic Transport in Single Crystalline LiFePO4 Grown by Optical Floating Zone Technique // Solid State Ionics. 2008. V. 179. № 27–32. P. 1683–1687. https://doi.org/10.1016/j.ssi.2008.01.079
Zhang S.M., Zhang J.X., Xu S.J., Yuan X.J., He B.C. Li Ion Diffusivity and Electrochemical Properties of FePO4 Nanoparticles Acted Directly as Cathode Materials in Lithium Ion Rechargeable Batteries // Electrochim. Acta. 2013. V. 88. P. 287–293. https://doi.org/10.1016/j.electacta.2012.10.029
Xu X.L., Zhao X.X., Hui K.S., Dinh D.A., Hui K.N. Rechargeable Batteries: Regulating Electronic and Ionic Transports for High Electrochemical Performance // Adv. Mater. Technol. https://doi.org/10.1002/admt.202101107
Eftekhari A. LiFePO4/C Nanocomposites for Lithium-Ion Batteries // J. Power Sources. 2017. V. 343. P. 395–411. https://doi.org/10.1016/j.jpowsour.2017.01.080
Zaghib K., Guerfi A., Hovington P., Vijh A., Trudeau M., Mauger A., Goodenough J.B., Julien C.M. Review and Analysis of Nanostructured Olivine-Based Lithium Recheargeable Batteries: Status and Trends // J. Power Sources. 2013. V. 232. P. 357–369. https://doi.org/10.1016/j.jpowsour.2012.12.095
Novikova S.A., Yaroslavtsev A.B. Cathode Materials Based on Olivine Lithium Iron Phosphates for Lithium-Ion Batteries // Rev. Adv. Mater. Sci. 2017. V. 49. № 2. P. 129–139.
Tian X.N., Chen W.H., Jiang Z.Q., Jiang Z.J. Porous Carbon-Coated LiFePO4 Nanocrystals Prepared by in situ Plasma-Assisted Pyrolysis as Superior Cathode Materials for Lithium Ion Batteries // Ionics. 2020. V. 26. № 6. P. 2715–2726. https://doi.org/10.1007/s11581-019-03422-6
El-Shinawi H., Cussen E.J., Corr S.A. Morphology-Directed Synthesis of LiFePO4 and LiCoPO4 from Nanostructured Li1+2xPO3+x // Inorg. Chem. 2019. V. 58. № 10. P. 6946–6949. https://doi.org/10.1021/acs.inorgchem.9b00517
Stenina I.A., Yaroslavtsev A.B. Nanomaterials for Lithium-Ion Batteries and Hydrogen Energy // Pure Appl. Chem. 2017. V. 89. № 8. P. 1185–1194. https://doi.org/10.1515/pac-2016-1204
Chen Z.Y., Zhang Z., Zhao Q.F., Duan J.F., Zhu H.L. Understanding the Impact of k-Doping on the Structure and Performance of LiFePO4/C Cathode Materials // J. Nanosci. Nanotechnol. 2019. V. 19. № 1. P. 119–124. https://doi.org/10.1166/jnn.2019.16449
Wang H.Q., Lai A.J., Huang D.Q., Chu Y.Q., Hu S.J., Pan Q.C., Liu Z.H., Zheng F.H., Huang Y.G., Li Q.Y. Y‑F co-Doping Behavior of LiFePO4/C Nanocomposites for High-Rate Lithium-Ion Batteries // New J. Chem. 2021. V. 45. № 12. P. 5695–5703. https://doi.org/10.1039/d0nj06081j
Wang L., Wei R., Zhang H., Zhang K., Liang F., Yao Y., Li Y. B-Mg Co-doping Behavior of LiFePO4 Cathode Material: Balance of Oxygen Vacancy and Enhancement of Electrochemical Performance // Ionics. 2022. V. 28. № 2. P. 593–600. https://doi.org/10.1007/s11581-021-04349-7
Novikova S., Yaroslavtsev S., Rusakov V., Kulova T., Skundin A., Yaroslavtsev A. (LiFe1–x${\text{M}}_{x}^{{{\text{II}}}}$PO4)/C (MII = = Co, Ni, Mg) as Cathode Materials for Lithium-Ion Batteries // Electrochim. Acta. 2014. V. 122. P. 180–186. https://doi.org/10.1016/j.electacta.2013.08.11810.1016/j.electacta.2013.08.118
Liu W.M., Huang Q.Z., Hu G.R. A Novel Preparation Route for Multi-Doped LiFePO4/C from Spent Electroless Nickel Plating Solution // J. Alloys Compd. 2015. V. 632. P. 185–189. https://doi.org/10.1016/j.jallcom.2015.01.110
Drozhzhin O.A., Sumanov V.D., Karakulina O.M., Abakumov A.M., Hadermann J., Baranov A.N., Stevenson K.J., Antipov E.V. Switching between Solid Solution and Two-Phase Regimes in the Li1–xFe1–yMnyPO4 Cathode Materials during Lithium (de)insertion: Combined Pitt, in situ XRPD and Electron Diffraction Tomography Study // Electrochim. Acta. 2016. V. 191. P. 149–157. https://doi.org/10.1016/j.electacta.2016.01.018
Yaroslavtsev S., Novikova S., Rusakov V., Vostrov N., Kulova T., Skundin A., Yaroslavtsev A. LiFe1–xMgxPO4/C as Cathode Materials for Lithium-Ion Batteries // Solid State Ionics. 2018. V. 317. P. 149–155. https://doi.org/10.1016/j.ssi.2018.01.011
Huang Y.H., Goodenough J.B. High-Rate LiFePO4 Lithium Rechargeable Battery Promoted by Electrochemically Active Polymers // Chem. Mater. 2008. V. 20. № 23. P. 7237–7241. https://doi.org/10.1021/cm8012304
Li H.Q., Zhou H.S. Enhancing the Performances of Li-Ion Batteries by Carbon-Coating: Present and Future // Chem. Commun. 2012. V. 48. № 9. P. 1201–1217. https://doi.org/10.1039/c1cc14764a
Kucinskis G., Bajars G., Kleperis J. Graphene in Lithium Ion Battery Cathode Materials: A Review // J. Power Sources. 2013. V. 240. P. 66–79. https://doi.org/10.1016/j.jpowsour.2013.03.160
Gryzlov D., Novikova S., Kulova T., Skundin A., Yaroslavtsev A. Behavior of LiFePO4/Cpvdf/Ag-Based Cathode Materials Obtained Using Polyvinylidene Fluoride as the Carbon Source // Mater. Design. 2016. V. 104. P. 95–101. https://doi.org/10.1016/j.matdes.2016.05.040
Li L., Wu L., Wu F., Song S.P., Zhang X.Q., Fu C., Yuan D.D., Xiang Y. Review-Recent Research Progress in Surface Modification of LiFePO4 Cathode Materials // J. Electrochem. Soc. 2017. V. 164. № 9. P. A2138–A2150. https://doi.org/10.1149/2.1571709jes
Kapaev R.R., Novikova S.A., Chekannikov A.A., Gryzlov D.Y., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. Effect of Carbon Sources and Synthesis Conditions on the LiFePO4/C Cathode Properties // Rev. Adv. Mater. Sci. 2018. V. 57. № 2. P. 183–192. https://doi.org/10.1515/rams-2018-0063
Стенина И.А., Минакова П.В., Кулова Т.Л., Десятов А.В., Ярославцев А.Б. Композиты LiFePO4 с углеродными наноматериалами для катодов литий-ионных аккумуляторов высокой мощности // Неорган. материалы. 2021. Т. 57. № 6. С. 649–657. https://doi.org/10.31857/S0002337X21060105
Yaroslavtsev A.B., Stenina I.A. Carbon Coating of Electrode Materials for Lithium-Ion Batteries // Surf. Innov. 2021. V. 9. № 2–3. P. 92–110. https://doi.org/10.1680/jsuin.20.00044
Meng F.B., Xiong X.Y., Tan L., Yuan B., Hu R.Z. Strategies for Improving Electrochemical Reaction Kinetics of Cathode Materials for Subzero-Temperature Li-Ion Batteries: A Review // Energy Stor. Mater. 2022. V. 44. P. 390–407. https://doi.org/10.1016/j.ensm.2021.10.032
He L.P., Zha W.K., Chen D.C. Fabrication and electrochemical properties of 3d Nano-Network LiFePO4@Multiwalled Carbon Nanotube Composite Using Risedronic Acid as the Phosphorus Source // Prog. Nat. Sci.-Mater. Int. 2019. V. 29. № 2. P. 156–162. https://doi.org/10.1016/j.pnsc.2019.02.005
Khan S., Raj R.P., Mohan T.V.R., Selvam P. Electrochemical Performance of Nano-Sized LiFePO4-Embedded 3d-Cubic Ordered Mesoporous Carbon and Nitrogenous Carbon Composites // RSC Adv. 2020. V. 10. № 51. P. 30406–30414. https://doi.org/10.1039/d0ra04754f
Mwizerwa J.P., Liu C., Xu K., Zhao N., Chen Z., Shen J. In-situ Solution Phase Synthesis of LiFePO4@VSe2 Composite as Highly Active Cathode for Li-Ion Batteries // J. Alloys Compd. 2022. V. 901. https://doi.org/10.1016/j.jallcom.2022.163639
Christmann K. Introduction to Surface Physical Chemistry. N. Y.: Steinkopff, 1991.
Peng J.M., Chen Z.Q., Li Y., Hu S.J., Pan Q.C., Zheng F.H., Wang H.Q., Li Q.Y. Conducting Network Interface Modulated Rate Performance in LiFePO4/C Cathode Materials // Rare Met. 2022. V. 41. № 3. P. 951–959. https://doi.org/10.1007/s12598-021-01838-6
Wang K.-X., Li X.-H., Chen J.-S. Surface and Interface Engineering of Electrode Materials for Lithium-Ion Batteries // Adv. Mater. 2015. V. 27. № 3. P. 527–545. https://doi.org/10.1002/adma.201402962
Стенина И.А., Соболев А.Н., Кузьмина А.А., Кулова Т.Л., Скундин А.М., Табачкова Н.Ю., Ярославцев А.Б. Электрохимические свойства наноматериалов Li4Ti5O12/C и Li4Ti5O12/C/Ag // Неорган. материалы. 2017. Т. 53. № 10. С. 1063–1069. https://doi.org/10.7868/S0002337X17100062
Gao Y., Xiong K., Xu H., Zhu B.F. Enhanced High-Rate and Low-Temperature Electrochemical Properties of LiFePO4/Polypyrrole Cathode Materials for Lithium-Ion Batteries // Int. J. Electrochem. Sci. 2019. V. 14. № 4. P. 3408–3417. https://doi.org/10.20964/2019.04.01
Fedorkova A., Orinakova R., Orinak A., Talian I., Heile A., Wiemhofer H.D., Kaniansky D., Arlinghaus H.F. PPy Doped PEG Conducting Polymer Films Synthesized on LiFePO4 Particles // J. Power Sources. 2010. V. 195. № 12. P. 3907–3912. https://doi.org/10.1016/j.jpowsour.2010.01.003
Vicente N., Haro M., Cintora-Juarez D., Perez-Vicente C., Tirado J.L., Ahmad S., Garcia-Belmonte G. LiFePO4 Particle Conductive Composite Strategies for Improving Cathode Rate Capability // Electrochim. Acta. 2015. V. 163. P. 323–329. https://doi.org/10.1016/j.electacta.2015.02.148
Озерова В.В., Стенина И.А., Кузьмина А.А., Кулова Т.Л., Ярославцев А.Б. Катодные материалы для литий-ионных аккумуляторов на основе композитов фосфата лития-железа и PEDOT // Неорган. материалы. 2020. Т. 56. № 6. С. 681–689. https://doi.org/10.31857/S0002337X20050103
Wang S.Y., Cao K.W., Xu L.H., Zhao D.L., Tong Y.J. Carbon nanotubes/reduced graphene oxide composites as electrode materials for supercapacitors // Appl. Phys. Mater. Sci. Proces. 2022. V. 128. № 1. https://doi.org/10.1007/s00339-021-05231-z
Dong J., Lin Y., Zong H., Yang H., Wang L., Dai Z. Three-Dimensional Architecture Reduced Graphene Oxide-LiFePO4 Composite: Preparation and Excellent Microwave Absorption Performance // Inorg. Chem. 2019. V. 58. № 3. P. 2031–2041. https://doi.org/10.1021/acs.inorgchem.8b03043
Cao H., Wen L., Guo Z.-q., Piao N., Hu G.-j., Wu M.-j., Li F. Application and Prospects for Using Carbon Materials to Modify Lithium Iron Phosphate Materials Used at Low Temperatures // New Carbon Mater. 2022. V. 37. № 1. P. 46–58. https://doi.org/10.1016/s1872-5805(22)60584-5
Cao J. Liu, Ruoxuan Guo H., Tian S., Zhang K., Ren X., Wang Y., Liang G. High-Temperature Solid-Phase Synthesis of Lithium Iron Phosphate Using Polyethylene Glycol Grafted Carbon Nanotubes as the Carbon Source for Rate-Type Lithium-Ion Batteries // J. Electroanal. Chem. 2022. V. 907. https://doi.org/10.1016/j.jelechem.2022.116049
Liang G.C., Wang L., Ou X.Q., Zhao X., Xu S.Z. Lithium Iron Phosphate with High-Rate Capability Synthesized through Hydrothermal Reaction in Glucose Solution // J. Power Sources. 2008. V. 184. № 2. P. 538–542. https://doi.org/10.1016/j.jpowsour.2008.02.056
Wang J., Shao Z.B., Ru H.Q. Influence of Carbon Sources on LiFePO4/C Composites Synthesized by the High-Temperature High-Energy Ball Milling Method // Ceram. Int. 2014. V. 40. № 5. P. 6979–6985. https://doi.org/10.1016/j.ceramint.2013.12.025
Fey G.T.K., Lu T.L. Morphological Characterization of LiFePO4/C Composite Cathode Materials Synthesized via a Carboxylic Acid Route // J. Power Sources. 2008. V. 178. № 2. P. 807–814. https://doi.org/10.1016/j.jpowsour.2007.09.039
Kuzmanovic M., Jugovic D., Mitric M., Jokic B., Cvjeticanin N., Uskokovic D. The Use of Various Dicarboxylic Acids as a Carbon Source for the Preparation of LiFePO4/C Composite // Ceram. Int. 2015. V. 41. № 5. P. 6753–6758. https://doi.org/10.1016/j.ceramint.2015.01.121
Ornek A., Bulut E., Ozacar M. The Chemical, Physical and Electrochemical Effects of Carbon Sources on the Nano-Scale LiFePO4 Cathode Surface // Ceram. Int. 2014. V. 40. № 10. P. 15727–15736. https://doi.org/10.1016/j.ceramint.2014.07.096
Wang X.F., Feng Z.J., Hou X.L., Liu L.L., He M., He X.S., Huang J.T., Wen Z.H. Fluorine Doped Carbon Coating of LiFePO4 as a Cathode Material for Lithium-ion Batteries // Chem. Eng. J. 2020. V. 379. https://doi.org/10.1016/j.cej.2019.122371
Avci E., Mazman M., Uzun D., Bicer E., Sener T. High Performance LiFePO4/CN Cathode Material Promoted by Polyaniline as Carbon-Nitrogen Precursor // J. Power Sources. 2013. V. 240. P. 328–337. https://doi.org/10.1016/j.jpowsour.2013.04.030
Du J., Kong L.B., Liu H., Liu J.B., Liu M.C., Zhang P., Luo Y.C., Kang L. Template-Free Synthesis of Porous-LiFePO4/C Nanocomposite for High Power Lithium-Ion Batteries // Electrochim. Acta. 2014. V. 123. P. 1–6. https://doi.org/10.1016/j.electacta.2013.12.157
Yan X., Yang Y., Li C., Liu J., Wang J., Xi F., Wang T., He W. The Synthesis of LiFePO4/C with Polyaniline as Coated Carbon Source and Sucrose as Reducing Carbon Source // Ionics. 2022. https://doi.org/10.1007/s11581-021-04430-1
Chen Z.Y., Du B.L., Xu M., Zhu H.L., Li L.J., Wang W.H. Polyacene Coated Carbon/LiFeO4 Cathode for Li Ion Batteries: Understanding the Stabilized Double Coating Structure and Enhanced Lithium Ion Diffusion Kinetics // Electrochim. Acta. 2013. V. 109. P. 262–268. https://doi.org/10.1016/j.electacta.2013.07.159
Mo Y.D., Liu J.C., Meng C., Xiao M., Ren S., Sun L.Y., Wang S.J., Meng Y.Z. Stable and Ultrafast Lithium Storage for LiFePO4/C Nanocomposites Enabled by Instantaneously Carbonized Acetylenic Carbon-Rich Polymer // Carbon. 2019. V. 147. P. 19–26. https://doi.org/10.1016/j.carbon.2019.02.049
Shi M., Li R.W., Liu Y.L. In situ Preparation of LiFePO4/C with Unique Copolymer Carbon Resource for Superior Performance Lithium-Ion Batteries // J. Alloys Compd. 2021. V. 854. 157162. https://doi.org/10.1016/j.jallcom.2020.157162
Chen Z.Y., Zhu H.L., Ji S., Fakir R., Linkov V. Influence of Carbon Sources on Electrochemical Performances of LiFePO4/C Composites // Solid State Ionics. 2008. V. 179. № 27–32. P. 1810–1815. https://doi.org/10.1016/j.ssi.2008.04.018
Dimesso L., Spanheimer C., Jacke S., Jaegermann W. Synthesis and Characterization of Three-Dimensional Carbon Foams-LiFePO4 Composites // J. Power Sources. 2011. V. 196. № 16. P. 6729–6734. https://doi.org/10.1016/j.jpowsour.2010.11.015
Stenina I.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. High Grain Boundary Density Li4Ti5O12/anatase-TiO2 Nanocomposites as Anode Material for Li-Ion Batteries // Mater. Res. Bull. 2016. V. 75. P. 178–184. https://doi.org/10.1016/j.materresbull.2015.11.050
Chekannikov A., Kapaev R., Novikova S., Tabachkova N., Kulova T., Skundin A., Yaroslavtsev A. Na3V2(PO4)3/C/Ag Nanocomposite Materials for Na-Ion Batteries Obtained by the Modified Pechini Method // J. Solid State Electrochem. 2017. V. 21. № 6. P. 1615–1624. https://doi.org/10.1007/s10008-017-3524-4
Pechini M.P. Method of Preparing Lead and Alkaline Earth Titanates and Niobates and Coating Method Using the Same to Form a Capacitor. 1967.
Svitan'ko A., Scopets V., Novikova S., Yaroslavtsev A. The Effect of Composite Formation with Oxides on the Ion Conductivity of Nasicon-Type LiTi2(PO4)3 and Olivine-Type LiFePO4 // Solid State Ionics. 2015. V. 271. P. 42–47. https://doi.org/10.1016/j.ssi.2014.10.022
Wilcox J.D., Doeff M.M., Marcinek M., Kostecki R. Factors Influencing the Quality of Carbon Coatings on LiFePO4 // J. Electrochem. Soc. 2007. V. 154. № 5. P. A389–A395. https://doi.org/10.1149/1.2667591
Vidano R.P., Fischbach D.B., Willis L.J., Loehr T.M. Observation of Raman Band Shifting with Excitation Wavelength for Carbons and Graphites // Solid State Commun. 1981. V. 39. № 2. P. 341–344. https://doi.org/10.1016/0038-1098(81)90686-4
Стенина И.А., Букалов С.С., Кулова Т.Л., Скундин А.М., Табачкова Н.Ю., Ярославцев А.Б. Влияние углеродного покрытия на электрохимические свойства наноразмерных материалов на основе титаната лития // Российские нанотехнологии. 2015. Т. 10. № 11–12. С. 55–61.
Doeff M.M., Hu Y.Q., McLarnon F., Kostecki R. Effect of Surface Carbon Structure on the Electrochemical Performance of LiFePO4 // Electrochem. Solid State Lett. 2003. V. 6. № 10. P. A207–A209. https://doi.org/10.1149/1.1601372
Song J., Sun B., Liu H., Ma Z., Chen Z., Shao G., Wang G. Enhancement of the Rate Capability of LiFePO4 by a New Highly Graphitic Carbon-Coating Method // ACS Appl. Mater. Interfaces. 2016. V. 8. № 24. P. 15225–15231. https://doi.org/10.1021/acsami.6b02567
Sharikov F.Y., Drozhzhin O.A., Sumanov V.D., Baranov A.N., Abakumov A.M., Antipov E.V. Exploring the Peculiarities of LiFePO4 Hydrothermal Synthesis Using in situ Calvet Calorimetry // Cryst. Growth Design. 2018. V. 18. № 2. P. 879–882. https://doi.org/10.1021/acs.cgd.7b01366
Yen H., Rohan R., Chiou C.-Y., Hsieh C.-J., Bolloju S., Li C.-C., Yang Y.-F., Ong C.-W., Lee J.-T. Hierarchy Concomitant in situ Stable Iron(II)-Carbon Source Manipulation Using Ferrocenecarboxylic Acid for Hydrothermal Synthesis of LiFePO4 as High-Capacity Battery Cathode // Electrochim. Acta. 2017. V. 253. P. 227–238. https://doi.org/10.1016/j.electacta.2017.09.065
Kosova N.V., Podgornova O.A., Gutakovskii A.K. Different Electrochemical Responses of LiFe0.5Mn0.5PO4 Prepared by Mechanochemical and Solvothermal Methods // J. Alloys Compd. 2018. V. 742. P. 454–465. https://doi.org/10.1016/j.jallcom.2018.01.242
Сафронов Д.В., Новикова С.А., Скундин А.М., Ярославцев А.Б. Интеркаляция и деинтеркаляция лития из титаната лития и двойного фосфата лития-железа // Неорган. материалы. 2012. Т. 48. № 1. С. 63–68.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы