Неорганические материалы, 2022, T. 58, № 8, стр. 861-867
Синтез, кристаллическая структура и высокотемпературная теплоемкость апатитов Pb10 – xSmx(GeO4)2 + x(VO4)4 – x (x = 0.2, 0.5, 0.7, 1.0) в области 350–1000 K
Л. Т. Денисова 1, *, М. С. Молокеев 1, 2, Ю. Ф. Каргин 3, Е. О. Голубева 1, Н. В. Белоусова 1, В. М. Денисов 1
1 Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
2 Институт физики им. А.В. Киренского ФИЦ КНЦ СО Российской академии наук
660036 Красноярск, Академгородок, 50, Россия
3 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
* E-mail: ldenisova@sfu-kras.ru
Поступила в редакцию 30.01.2022
После доработки 26.03.2022
Принята к публикации 28.03.2022
- EDN: DSKJWO
- DOI: 10.31857/S0002337X22070089
Аннотация
Обжигом на воздухе стехиометрических смесей оксидов PbO, Sm2O3, GeO2 и V2O5 в интервале температур 773–1073 K синтезированы соединения Pb10 – xSmx(GeO4)2 + x(VO4)4 – x (x = 0.2, 0.5, 0.7, 1.0) со структурой апатита. С использованием рентгеновской дифракции исследована их кристаллическая структура. Методом дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость (350–1000 K). На основании этих данных рассчитаны термодинамические свойства.
ВВЕДЕНИЕ
Сложные оксидные соединения, имеющие структуру апатита, привлекают внимание возможностями их практического применения в качестве лазерных, люминесцентных и оптических материалов [1–7]. Важной особенностью соединений семейства апатитов является способность их структурных единиц к замещению другими ионами, что приводит к образованию твердых растворов, состав которых может изменяться в достаточно широких пределах [4, 7–10]. Так, например, замещением части свинца в Pb5(GeO4)(VO4)2 на лантан или празеодим получены соответственно апатиты составов Pb8La2(GeO4)4(VO4)2 [6] и Pb8Pr2(GeO4)4(VO4)2 [11]. Свойства подобных соединений, имеющих общий вид Pb10 – xRx(GeO4)2 + x(VO4)4 – x (R = РЗМ, x = 0–3), исследованы крайне мало. Имеются данные о структуре Pb10(GeO4)2(VO4)4 (x =0) [12, 13], Pb10 – xLax(GeO4)2 + x(VO4)4 – x [6, 11], Pb10 ‒ xPrx(GeO4)2 + x(VO4)4 – x [11, 14] и Pb10 ‒ xNdx(GeO4)2 + x(VO4)4 – x [15] (x = 0–3). Кроме того, исследована высокотемпературная теплоемкость этих соединений, содержащих La [16], Pr [14] и Nd [15].
Целью настоящей работы является синтез, исследование кристаллической структуры и высокотемпературной теплоемкости апатитов Pb10 – xSmx(GeO4)2 + x(VO4)4 – x (x = 0.2, 0.5, 0.7 и 1.0).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы Pb10 – xSmx(GeO4)2 + x(VO4)4 – x (x = 0.2, 0.5, 0.7 и 1.0) получали твердофазным синтезом из предварительно прокаленных исходных оксидов PbO, Sm2O3, V2O5 “ос.ч” и GeO2 (99.99%). Стехиометрические смеси гомогенизировали в агатовой ступке и прессовали в таблетки. Их обжигали на воздухе при 773, 873, 973 K (по 10 ч) и при 1073 K (200 ч). Через каждые 10 ч таблетки перетирали и снова прессовали.
Контроль фазового состава полученных образцов проводили с использованием рентгенофазового анализа. Порошковые рентгенограммы получены при комнатной температуре на дифрактометре Bruker D8 ADVANCE (CuKα-излучение) с использованием линейного детектора VANTEC. Шаг сканирования составлял 0.016°, время экспозиции на каждый шаг 2 с. Уточнение Ритвельда проведено в программе TOPAS 4.2 [17].
Теплоемкость образцов Pb10 ‒ xSmx(GeO4)2 + x(VO4)4 – x (x = 0.2, 0.5, 0.7 и 1.0) измеряли методом дифференциальной сканирующей калориметрии при помощи термоанализатора STA 449 C Jupiter (NETZSCH, Германия). Методика экспериментов описана нами ранее [18]. Погрешность измерений не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгенофазовый анализ показал, что однофазные соединения со структурой апатита образуются в области составов 0 ≤ x ≤ 1. Однофазные образцы с x = 2 получить не удалось. Подобное наблюдалось при синтезе Pb8 – xGdxNa2(VO4)6Ox/2 (примесь GdVO4) [4] и Pb8 – xEuxNa2(VO4)6Ox/2 (примесь EuVO4) [19]. В нашем случае фазовую принадлежность примеси установить не удалось.
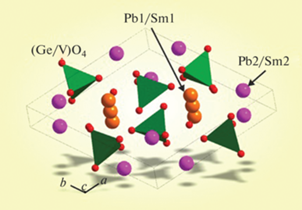
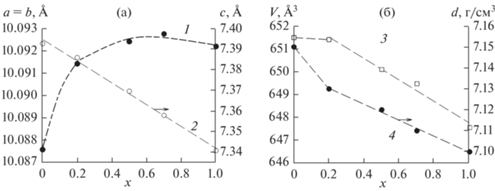
Для однофазных образцов все рефлексы проиндицированы в гексагональной сингонии (пр. гр. P63/m) с параметрами, близкими к апатиту Pb5(GeO4)(VO4)2 [12, 13]. Поэтому эта структура была взята в качестве стартовой модели уточнения. В обе независимые позиции ионов свинца (Pb1 и Pb2) (рис. 1) были помещены ионы Pb/Sm с фиксированными значениями заселенностей позиций согласно предполагаемой химической формуле. Уточнить заселенность Sm не представлялось возможным из-за малого значения концентраций. Для единственной позиции Ge/V было рассчитано соотношение между ионами Ge и V, учитывая химическую формулу, и эти заселенности также были фиксированы в ходе уточнения. Тепловые параметры всех атомов уточнены в изотропном приближении. Уточнение шло стабильно и дало низкие величины R-факторов (табл. 1, рис. 2). Координаты атомов и основные длины связей представлены в табл. 2 и 3 соответственно. На рис. 3 показано влияние состава образцов Pb10 – xSmx(GeO4)2 + x(VO4)4 – x на параметры элементарной ячейки. Параметры элементарной ячейки незамещенного образца (х = 0) взяты из работы [13].
Таблица 1.
Основные параметры съемки и уточнения структуры Pb10 – xSmx(GeO4)2 + x(VO4)4 – x
| x | 0.2 | 0.5 | 0.7 | 1.0 |
| Пр. гр. | P63/m | P63/m | P63/m | P63/m |
| a, Å | 10.09143(6) | 10.09242(6) | 10.09276(6) | 10.0922(5) |
| c, Å | 7.38601(6) | 7.36970(6) | 7.35802(6) | 7.3410(1) |
| V, Å3 | 651.397(10) | 650.086(9) | 649.08(1) | 648.53(2) |
| Z | 1 | 1 | 1 | 1 |
| d, г/см3 | 7.13 | 7.12 | 7.11 | 7.10 |
| Δ2θ, град | 7.5–120 | 7.5–120 | 7.5–120 | 7.5–110 |
| Rwp, % | 6.10 | 6.61 | 5.54 | 5.53 |
| Rp, % | 4.79 | 4.38 | 5.54 | 5.54 |
| Rexp, % | 3.86 | 3.71 | 3.61 | 3.60 |
| RB, % | 1.96 | 1.84 | 1.83 | 1.80 |
| χ2 | 1.58 | 1.51 | 1.53 | 1.52 |
Рис. 2.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограммы Pb9Sm(GeO4)3(VO4)3 после уточнения методом минимизации производной разности.
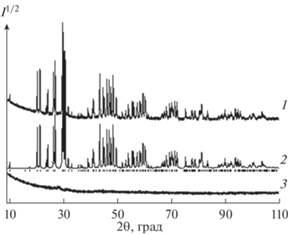
Таблица 2.
Атомные координаты и изотропные тепловые параметры (Å2) образцов Pb10 – xSmx(GeO4)2 + x(VO4)4 – x
| Атом | x | y | z | Biso | Occ |
|---|---|---|---|---|---|
| x = 0.2 | |||||
| Pb1 | 1/3 | 2/3 | 0.0047(5) | 1.50(5) | 0.98 |
| Sm1 | 1/3 | 2/3 | 0.0047(5) | 1.50(5) | 0.02 |
| Pb2 | 0.25310(15) | 0.0027(3) | 1/4 | 1.52(5) | 0.98 |
| Sm2 | 0.25310(15) | 0.0027(3) | 1/4 | 1.52(5) | 0.02 |
| Ge | 0.3992(4) | 0.3827(4) | 1/4 | 0.33(9) | 11/30 |
| V | 0.3992(4) | 0.3827(4) | 1/4 | 0.33(9) | 29/30 |
| O1 | 0.2950(17) | 0.4719(17) | 1/4 | 2.2(2) | 1 |
| O2 | 0.5899(16) | 0.4966(16) | 1/4 | 2.2(2) | 1 |
| O3 | 0.3541(11) | 0.2591(11) | 0.0712(13) | 2.2(2) | 1 |
| x = 0.5 | |||||
| Pb1 | 1/3 | 2/3 | 0.0060(5) | 1.41(6) | 0.95 |
| Sm1 | 1/3 | 2/3 | 0.0060(5) | 1.41(6) | 0.05 |
| Pb2 | 0.25459(14) | 0.0041(2) | 1/4 | 1.31(5) | 0.95 |
| Sm2 | 0.25459(14) | 0.0041(2) | 1/4 | 1.31(5) | 0.05 |
| Ge | 0.4014(4) | 0.3832(4) | 1/4 | 0.30(9) | 5/12 |
| V | 0.4014(4) | 0.3832(4) | 1/4 | 0.30(9) | 7/12 |
| O1 | 0.3036(15) | 0.4778(16) | 1/4 | 2.2(2) | 1 |
| O2 | 0.5909(15) | 0.4946(14) | 1/4 | 2.2(2) | 1 |
| O3 | 0.3575(10) | 0.2625(1) | 0.0712(12) | 2.2(2) | 1 |
| x = 0.7 | |||||
| Pb1 | 1/3 | 2/3 | 0.0062(5) | 1.63(6) | 0.93 |
| Sm1 | 1/3 | 2/3 | 0.0062(5) | 1.^3(6) | 0.07 |
| Pb2 | 0.25523(13) | 0.0049(2) | 1/4 | 1.45(5) | 0.93 |
| Sm2 | 0.25523(13) | 0.0049(2) | 1/4 | 1.45(5) | 0.07 |
| Ge | 0.4022(4) | 0.3832(4) | 1/4 | 0.30(9) | 0.45 |
| V | 0.4022(4) | 0.3832(4) | 1/4 | 0.30(9) | 0.55 |
| O1 | 0.3032(16) | 0.4790(16) | 1/4 | 2.8(2) | 1 |
| O2 | 0.5944(15) | 0.4994(15) | 1/4 | 2.8(2) | 1 |
| O3 | 0.3610(11) | 0.2642(11) | 0.0672(12) | 2.8(2) | 1 |
| x = 1 | |||||
| Pb1 | 1/3 | 2/3 | 0.0089(3) | 0.0287(5) | |
| Sm1 | 1/3 | 2/3 | 0.0089(3) | 0.0287(5) | |
| Pb2 | 0.25610(12) | 0.00575(19) | 0.25000 | 0.0377(5) | |
| Ge | 0.4042(4) | 0.3844(4) | 0.25000 | 0.0249(9) | |
| V | 0.4042(4) | 0.3844(4) | 0.25000 | 0.0249(9) | |
| O1 | 0.3244(14) | 0.4992(13) | 0.25000 | 0.034(2) | |
| O2 | 0.5999(13) | 0.4878(13) | 0.25000 | 0.041(2) | |
| O3 | 0.3516(8) | 0.2656(8) | 0.0619(9) | 0.038(2) | |
Таблица 3.
Основные длины связей (Å) в Pb10 – xSmx(GeO4)2 + x(VO4)4 – x
| x = 0.2 | |||
| (Pb1/Sm1)–O1 | 2.556(10) | (Ge/V)–O1 | 1.692(11) |
| (Pb1/Sm1)–O2I | 2.851(11) | (Ge/V)–O2 | 1.677(11) |
| (Pb1/Sm1)–O3II | 2.909(13) | (Ge/V)–O3 | 1.714(1) |
| (Pb2/Sm2)–O1III | 2.703(15) | ||
| (Pb2/Sm2)–O2IV | 2.215(14) | ||
| (Pb2/Sm2)–O3 | 2.615(10 | ||
| (Pb2/Sm2)–O3V | 2.581(1) | ||
| x = 0.5 | |||
| (Pb1/Sm1)–O1 | 2.527(10) | (Ge/V)–O1 | 1.682(10) |
| (Pb1/Sm1)–O2I | 2.835(9) | (Ge/V)–O2 | 1.665(10) |
| (Pb1/Sm1)–O3II | 2.882(9) | (Ge/V)–O3 | 1.721(9) |
| (Pb2/Sm2)–O1III | 2.790(14) | ||
| (Pb2/Sm2)–O2IV | 2.218(12) | ||
| (Pb2/Sm2)–O3 | 2.644(9) | ||
| (Pb2/Sm2)–O3V | 2.558(9) | ||
| x = 0.7 | |||
| (Pb1/Sm1)–O1 | 2.514(10) | (Ge/V)–O1 | 1.703(10) |
| (Pb1/Sm1)–O2I | 2.849(10) | (Ge/V)–O2 | 1.692(10) |
| (Pb1/Sm1)–O3II | 2.854(9) | (Ge/V)–O3 | 1.710(9) |
| (Pb2/Sm2)–O1III | 2.796(14) | ||
| (Pb2/Sm2)–O2IV | 2.170(13) | ||
| (Pb2/Sm2)–O3 | 2.64710) | ||
| (Pb2/Sm2)–O3V | 2.570(9) | ||
| x = 1.0 | |||
| (Pb1/Sm1)–O1 | 2.418(10) | (Ge/V)–O1 | 1.709(17) |
| (Pb1/Sm1)–O2I | 2.747(12) | (Ge/V)–O2 | 1.712(12) |
| (Pb1/Sm1)–O3II | 2.945(9) | (Ge/V)–O3 | 1.729(7) |
| Pb2–O2III | 2.249(11) | ||
| Pb2–O3 | 2.681(7) | ||
| Pb2–O3IV | 2.490(7) | ||
Рис. 3.
Влияние состава образцов Pb10 – xSmx(GeO4)2 + x(VO4)4–x на параметры элементарной ячейки: a = b (1), c (2), V (3) и d (4).
Ванадат-германат свинца можно отнести к лакунарным апатитам [10, 20]. В апатитах с данной структурой отсутствуют анионы в каналах вдоль оси с элементарной ячейки. При этом стабилизация структуры осуществляется за счет стехиометрически активных катионов, имеющих 6s2-пары электронов (в нашем случае Pb2+) и находящихся в положении Pb2.
Из рис. 3 и табл. 1 следует, что при замещении свинца самарием в области составов 0.2 ≤ x ≤ 1 происходит линейное уменьшение параметров с, V и d элементарной ячейки. При этом параметры а и b практически не изменяются. Можно отметить, что в координационном полиэдре Pb1 средние межатомные расстояния Pb1–O1 (2, 3) уменьшаются, а в полиэдре Pb2 средние расстояния Pb2—O1 (2, 3) почти не меняются. Возможно, это объясняется увеличением концентрации не только ионов самария, но и ионов Ge4+, замещающих V5+ в тетраэдрах Ge(V)O4. Уменьшение объема элементарной ячейки с ростом концентрации Sm согласуется с меньшим ионным радиусом Sm3+ по сравнению с таковым для Pb2+ [21].
Влияние температуры в области 350–1000 K на теплоемкость образцов Pb10 – xSmx(GeO4)2 + x(VO4)4 – x показано на рис. 4. Видно, что значения Cp увеличиваются как с ростом температуры от 350 до 1000 K, так и при увеличении концентрации самария. Заметим, что наблюдается близость значений теплоемкости для образцов с x = 0.5 и 0.7. Учитывая это, в дальнейшем в качестве примера будем рассматривать образец Pb9Sm(GeO4)3(VO4)3. Установлено, что температурные зависимости теплоемкости хорошо описываются уравнением Праусница, Рида, Шервуда [22]
которое лучше, чем уравнение Майера-Келли [23] описывает экспериментальные результаты. Уравнение (1) для Pb9Sm(GeO4)3(VO4)3 имеет следующий вид:(3)
$\begin{gathered} {{C}_{p}} = \left( {766.9 \pm 5.9} \right) + \left( {512.3 \pm 28.7} \right) \times {{10}^{{ - 3}}}T-- \\ --\,\,\left( {38.24 \pm 4.43} \right) \times {{10}^{{ - 5}}}{{T}^{2}} + \left( {1.79 \pm 0.22} \right) \times {{10}^{{ - 7}}}{{T}^{3}}. \\ \end{gathered} $Рис. 4.
Влияние температуры на молярную теплоемкость Pb10 – xSmx(GeO4)2 + x(VO4)4 — x: x = 1.0 (1), 0.7(2), 0.5 (3), 0.2 (4), 0 [15] (5).
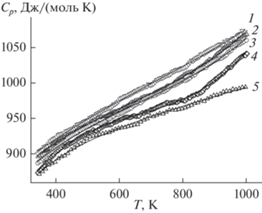
Следует отметить, что подобное наблюдалось при исследовании теплоемкости образцов Pb10 – xEux(GeO4)2 + x(VO4)4 – x (x = 0.1, 0.2, 0.3) [24]. Используя соотношение (3) и уравнения для расчета термодинамических функций [22], рассчитали изменения энтальпии, энтропии и энергии Гиббса. Результаты приведены в табл. 4.
Таблица 4.
Термодинамические свойства Pb9Sm(GeO4)3(VO4)3
| T, K | Cp, Дж/(моль К) |
H°(T) – H°(350 K), кДж/моль |
S°(T) – S°(350 K), Дж/(моль К) |
–ΔG/T*, Дж/(моль К) |
|---|---|---|---|---|
| 350 | 904.8 | – | – | – |
| 400 | 919.2 | 45.61 | 121.8 | 7.76 |
| 450 | 932.7 | 91.91 | 230.8 | 26.59 |
| 500 | 945.4 | 138.9 | 329.8 | 52.04 |
| 550 | 957.4 | 186.4 | 420.4 | 81.46 |
| 600 | 968.9 | 234.6 | 504.2 | 113.2 |
| 650 | 980.0 | 283.3 | 582.2 | 146.4 |
| 700 | 990.8 | 332.6 | 655.2 | 180.1 |
| 750 | 1001 | 382.4 | 724.0 | 214.1 |
| 800 | 1012 | 432.7 | 788.9 | 248.0 |
| 850 | 1023 | 483.6 | 850.6 | 281.7 |
| 900 | 1034 | 535.1 | 909.4 | 314.9 |
| 950 | 1046 | 587.1 | 965.6 | 347.7 |
| 1000 | 1058 | 639.6 | 1020 | 380.0 |
ЗАКЛЮЧЕНИЕ
Из исходных оксидов твердофазным синтезом получены твердые растворы Pb10–xSmx(GeO4)2+x(VO4)4–x (x = 0.2, 0.5, 0.7, 1.0). Впервые определена их кристаллическая структура (координаты атомов и их изотропные тепловые параметры, основные длины межатомных связей). Методом дифференциальной сканирующей калориметрии измерены их высокотемпературные теплоемкости. На основании экспериментальных данных рассчитаны термодинамические свойства фазы состава Pb9Sm(GeO4)3(VO4)3.
Список литературы
Каназава Т. Неорганические фосфатные материалы. Киев: Наук. Думка, 1998. 298 с.
Yano T., Nabeta Y., Watanabe A. A New Crystal Pb5(GeO4)(VO4)2 for Acousto-optic Device Applications // Appl. Phys. Lett. 1971. V. 18. № 12. P. 570–571.
Gospodinov M., Sveshtarov P. Growth of Large Pb5(GeO4)(VO4)2 Crystals // Cryst. Res. Technol. 1990. V. 25. № 3. P. K58–K61.
Игнатов А.В., Савинкова Г.М., Дидоренко Е.Г. и др. Изоморфное замещение в системе Pb(8–x)GdxNa2(VO4)6O(x/2) // Вести. Донец. нац. ун-та. Сер. А. Естеств. науки. 2014. № 1. С. 152–156.
Kovács L., Péter Á., Gospodinov M., Capelleti R. Hydroxyl Ions in Acousto-optic Pb5(GeO4)(VO4)2 and Bi2(MoO4)3 Single Crystals // Phys. Status. Solid. 2005. V. 2. № 1. P. 689–692. https://doi.org/10.1002/pssc.200460267
Журавлев В.Д., Великодный Ю.А. Ванадатогерманаты свинца-лантана и стронция-лантана со структурой апатита и оксоапатита // Журн. неорган. химии. 2009. Т. 54. № 10. С. 1626–1627.
Savankova T.M., Akselrud L.G., Ardanova L.I. et al. Synthesis, Crystal Structure Refinement and Electrical Conductivity of Pb(8–x)Na2Smx(VO4)6O(x/2) // J. Chem. 2014. P. 1–7. https://doi.org/10.1155/2014/263548
Chakroun-Ouadhour E., Ternane R., Ben Hassen-Chehimi D., Trabelsi-Ayadi M. Synthesis, Characterization and Electrical Properties of a Lead Sodium Vanadate Apatite // Mater. Res. Bull. 2008. V. 43. P. 2451–2456. https://doi.org/10.1016/j.materresbull.2007.07.030
Pasero M., Kampf A.R., Ferraris C. et al. Nomenclature of the Apatite Super Group Minerals // Eur. J. Mineral. 2010. V. 22. P. 163–179. https://doi.org/10.1127/0935-1221/2010/0022-2022
Ptáćek P., Opravil T., Šoukal F. et al. Formation of Strontium-Yttrium Germanium Anionic Lacunar Apatite (Sr2+δY6.67+(2δ/3)[GeO4]6O2δ) as the Intermediate Phase of Oxygen-Rich Yttrium-Germanium Apatite (Y9.333+ε[GeO4]6O2+3/2ε) // Ceram. Int. 2017. V. 43. P. 7827–7838. https://doi.org/10.1016/j.ceramint.2017.03.097
Яблочкова Н.В. Синтез и уточнение кристаллической структуры Pb8Pr2(GeO4)4(VO4)2 // Журн. неорган. химии. 2013. Т. 58. № 7. С. 871–874. https://doi.org/10.7868/S0044457X1307026X
Иванов С.А. Уточнение кристаллической структуры Pb5(GeO4)(VO4)2 по профилю порошковых рентгенограмм // Журн. структур. химии. 1990. Т. 31. № 4. С. 80–84.
Иванов С.А., Заводник В.Е. Особенности кристаллической структуры Pb5GeV2O12 // Кристаллография. 1989. Т. 34. № 4. С. 824–828.
Денисова Л.Т., Каргин Ю.Ф., Голубева Е.О. и др. Синтез, структура и термодинамические свойства апатитов Pb10 –xPrx(GeO4)2 +x(VO4)4– x (x = 0, 1, 2, 3) в области 350–1000 K // Неорган. материалы. 2020. Т. 56. № 10. С. 1081–1087. https://doi.org/10.31857/S0002337X20100036
Денисова Л.Т., Голубева Е.О., Белоусова Н.В. и др. Высокотемпературная теплоемкость апатитов Pb10–xNdx(GeO4)2+x(VO4)4–x (x = 0–3) // Физика твердого тела. 2019. Т. 61. № 7. С. 1397–1400. https://doi.org/10.21883/0000000000
Денисова Л.Т., Каргин Ю.Ф., Голубева Е.О. и др. Теплоемкость апатитов Pb10 –xLax(GeO4)2 +x(VO4)4 –x (x = 0, 1, 2, 3) в области 320–1000 K // Неорган. материалы. 2019. Т. 55. № 2. С. 182–186. https://doi.org/10.1134/S0002337X19020027
Bruker AXS TOPAS V4: General profile and structure analysis software for powder diffraction data. Karlsruhe Bruker: 2008.
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Высокотемпературная теплоемкость и термодинамические свойства Tb2Sn2O7 // Неорган. материалы. 2017. Т. 53. № 1. С. 71–73. https://doi.org/S0001331X17010043
Саванкова Т.М., Игнатов А.В., Уточкин Д.М., Гетьман Е.И. Синтез и исследование твердых растворов Pb(8–x)EuxNa2(VO4)6O(x/2) // Наук. працi i хiм. техн. 2014. № 2. С. 78–82.
Koumiri M.E., Oishi S., Sato S. et al. The Crystal Structure of Lacunar Apatite NaPb4(PO4)3 // Mater. Res. Bull. 2000. V. 35. P. 503–513.
Shannon R.D. Revised Effective Ionic Radii and Systematic Studies of Interatomic Distance in Halides and Chalcogenides // Acta Crystallogr., Sect. A. 1976. V. 32. P. 751–767.
Чудненко К.В. Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: Гео, 2010. 287 с.
Maier C.G., Kelley K.K. An Equation for the Representation of High Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243–3246. https://doi.org/10.1021/ja01347a029
Денисова Л.Т., Молокеев М.С., Александровский А.С. и др. Кристаллическая структура, люминесцентные и термодинамические свойства замещенных апатитов Pb10–xEux(GeO4)2+x(VO4)4–x (x = 0.1, 0.2, 0.3) // Неорган. материалы. 2021. Т. 57. № 11. С. 1226–1234. https://doi.org/10.31857/S0002337X21110038
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы