Неорганические материалы, 2022, T. 58, № 8, стр. 844-851
Исследование нанокомпозитов, полученных термическим разложением гидроксостанната кальция CaSn(OH)6
А. В. Логинов 1, 2, *, А. И. Апарнев 1, Н. Ф. Уваров 1, 2
1 Новосибирский государственный технический университет
630073 Новосибирск,
пр. К. Маркса, 20, Россия
2 Институт химии твердого тела и механохимии СО Российской
академии наук
630128 Новосибирск, ул. Кутателадзе, 18, Россия
* E-mail: loginov@corp.nstu.ru
Поступила в редакцию 07.02.2022
После доработки 26.05.2022
Принята к публикации 27.05.2022
- EDN: GMIJCM
- DOI: 10.31857/S0002337X22080085
Аннотация
Методами термического и рентгенофазового анализа, ИК-спектроскопии, низкотемпературной адсорбции азота и электронной микроскопии охарактеризованы продукты термического разложения CaSn(OH)6. На основании результатов измерений ионной проводимости композитов CaSnO3–SnO2–CsNO2 сделан вывод о перспективности использования станната кальция в качестве гетерогенной добавки в композиционные твердые электролиты.
ВВЕДЕНИЕ
В последнее время нанокомпозиты на основе диоксида олова с различными добавками привлекают большое внимание исследователей, занимающихся разработкой функциональных материалов для различного рода электрохимических устройств. Известно, что нанокомпозиты обладают свойствами, отличающимися от свойств индивидуальных веществ, в частности повышенной ионной проводимостью и электрохимической активностью. К числу перспективных материалов на основе станнатов и диоксида олова относятся композиты и нанокомпозиты типа МSnO3–SnO2 и М2SnO4–SnO2 (М = Mg, Ca, Sr, Zn, Cd, Cu, Mn, Fe, Co, Ni). Последние находят широкое применение в качестве компонентов для электроники [1–7], оптоэлектроники [8–10], газовых сенсоров [11–13], различных катализаторов [14–20], а также в качестве анодных материалов для Li-ионных аккумуляторов и различных устройств автономной энергетики для накопления и преобразования энергии [21–26]. Как правило, композиты станнатов металлов (М(II)) получают из прекурсоров МSn(OH)6, синтезируемых различными методами [27–36]. Ранее в работах [4, 22, 28] было показано, что при термолизе CaSn(OH)6 образуются кубические наночастицы станната кальция с узким распределением по размерам. Наряду с CaSnO3 при термолизе наблюдается образование примесной фазы нанокристаллического диоксида олова (10–15%). Такие материалы могут быть использованы в качестве гетерогенной добавки для синтеза нанокомпозитных электролитов с контролируемой морфологией. В качестве ионного проводника был взят нитрит цезия CsNO2 – соединение, обладающее высокой проводимостью по ионам цезия [37, 38].
Цель настоящей работы заключалась в исследовании свойств нанокомпозитов CaSnO3–SnO2, полученных термическим разложением прекурсора СаSn(OH)6.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовались следующие реактивы: CaCl2⋅6Н2О (ГОСТ 4140-73 “ч.”, SnCl4⋅5H2О (ТУ 2623-02-40897595-99, “ч. д. а.”), NH4OH (ГОСТ 24147-80, “ос. ч.”) (все производства ОАО “Реактив”). Для приготовления одномолярных растворов солей и аммиака использовалась бидистиллированная вода, полученная с помощью системы очистки бидистиллятора БЭ-2 лабораторного.
Гидроксостаннат кальция СаSn(OH)6 был синтезирован методом химического осаждения из растворов CaCl2⋅6H2O и SnCl4⋅5H2О раствором аммиака NH4OH, добавляемого при постоянной скорости (2.5 мл/мин) с помощью перистальтического насоса марки ЛАБ-НП-1 при интенсивном перемешивании до рН 9.8–10. Реакцию осаждения проводили при комнатной температуре в течение 4 ч путем взаимодействия стехиометрических количеств соответствующих предшественников (атомное соотношение Sn : Ca = 1 : 1). Полученные свежеосажденные осадки отделяли центрифугированием от маточного раствора, промывали дистиллированной водой до достижения отрицательной качественной реакции на присутствие ионов Cl– в растворе и сушили при температуре 100°С в течение 1 ч. Термическую обработку порошка проводили в муфельной печи SNOL 6.7/1300 при 300, 500 и 700°С в течение 4 ч при каждой температуре.
Микроструктуру и фазовый состав образцов определяли методом рентгенофазового анализа (РФА). Регистрацию рентгенограмм проводили при комнатной температуре на дифрактометре Bruker D8 Advance с использованием CuKα-излучения в диапазоне 2θ от 10° до 70°. Идентификацию образующихся в системе фаз проводили с помощью программы Crystallographica Search-Match, Version 2.1 и базы данных PDF4. Средний размер зерен кристаллических фаз оценивали по уширению рефлексов на дифрактограммах с помощью формулы Шеррера
где d – средний размер кристаллов, λ – длина волны рентгеновского излучения (для CuKα λ = 1.54051 Å), β – ширина пика на половине высоты, θ – угол дифракционного пика, k = 0.9.Термический анализ высушенных порошков проводили на синхронном термоанализаторе NETZSCH Jupiter 449С STA, сопряженном с масс-спектрометром QMS 403C Aëolos (TG-QMS) в потоке аргона при температурах в диапазоне 20–700°С при скорости нагрева 10 К/мин.
Микроструктуру образцов изучали методом сканирующей электронной микроскопии (СЭМ) с полевой эмиссией (FE-SEM) на электронном микроскопе Hitachi SU8000. Съемку изображений вели в режиме регистрации вторичных электронов при ускоряющем напряжении 2–30 кВ и рабочем расстоянии 8–10 мм. C помощью энергодисперсионного спектрометра (ЭДС) Oxford Instruments X-max проведено ЭДС-исследование образцов. Оптимизация аналитических измерений была проведена в рамках описанного ранее подхода [39]. Перед съемкой образцы помещали на поверхность алюминиевого столика диаметром 25 мм, фиксировали при помощи проводящей графитовой липкой ленты. Морфология образцов исследовалась в нативных условиях, чтобы исключить поверхностные эффекты от напыления проводящего слоя [40].
Удельную поверхность (Sуд) рассчитывали по методу БЭТ. Удельную поверхность пор, оставшихся после заполнения адсорбатом микропор и объем микропор рассчитывали сравнительным t‑методом де-Бура (de Boor) и Липпенса (Lippens), статистическую толщину адсорбционной пленки рассчитывали по уравнению де-Бура. Метод основан на сопоставлении приращений величин адсорбции на исследуемой изотерме адсорбции и стандартной изотерме адсорбции, полученной на хорошо охарактеризованных непористых материалах. В области полимолекулярной адсорбции после заполнения микропор и других специфических центров эти приращения адсорбции пропорциональны поверхности вне зависимости от ее детальной химической природы. Подробнее метод описан в [41, 42].
Инфракрасные спектры записывали на ИК-спектрометре Carry 660 (Agilent Technologies) с приставкой нарушенного полного внутреннего отражения PIKE Technologies GladiATR (алмазный кристалл) в диапазоне 500–4000 см–1. Образцы готовили в виде таблеток с прокаленным КBr.
Ионную проводимость измеряли на таблетированных образцах с серебряными электродами по двухэлектродной схеме в вакууме (5 × 10–2 мм рт. ст.) в интервале температур от 40 до 200°C на переменном токе с помощью измерителя электрических параметров Hewlett Packard НР 4284А в области частот 20 Гц–1 МГц. Значения проводимости рассчитывали исходя из геометрических параметров таблетки и значений ее объемного сопротивления, определенных методом комплексного импеданса с помощью анализа годографов импеданса Z " = f(Z ') в программе Origin 6.1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
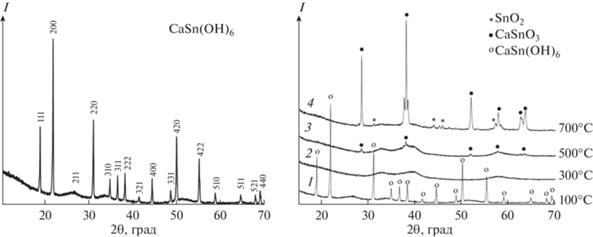
По данным РФА, в результате химического осаждения образуется гексагидроксостаннат кальция СаSn(OH)6 со структурой буртита (пр. гр. Pn3m), аналогичной структуре шенфлисита с кубической элементарной ячейкой. Дифрактограмма образца приведена на рис. 1. Значение параметра решетки, определенное методом Ритвельда с помощью программы Topas v. 4.2, составляет 0.814633 ± 0.00016 нм, что хорошо согласуется с литературными данными: а = 0.8128 [9] и a = = 0.8135 нм [43, 44] (файлы PDF4 № 09–0030). Процесс образования смешанного гидроксида описывается уравнением реакции
(1)
$\begin{gathered} {\text{CaC}}{{{\text{l}}}_{{\text{2}}}}{\text{ + SnC}}{{{\text{l}}}_{{\text{4}}}}{\text{ + 6N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} \to \\ \to \,\,{\text{CaSn(OH}}{{{\text{)}}}_{{\text{6}}}}{\text{ + 6N}}{{{\text{H}}}_{{\text{4}}}}{\text{Cl}}{\text{.}} \\ \end{gathered} $Рис. 1.
Дифрактограммы СаSn(OH)6 (1) и продуктов термолиза, полученных при температурах 300 (2), 500 (3) и 700°С (4).
По данным электронной микроскопии (рис. 2), свежеосажденные образцы CaSn(OH)6 состоят из кубических частиц размерами 1–5 мкм, сросшихся в агрегаты размером до 20 мкм. По результатам химического микроанализа, проведенного методом ЭДС, атомное отношение Ca : Sn : O лежит в пределах (10 ± 1) : (12 ± 2) : (65 ± 3), т.е. близко к стехиометрическому соотношению для CaSn(OH)6. Незначительный избыток олова (не более 10%) можно объяснить параллельно протекающей реакцией гидролиза хлорида олова в присутствии гидроксида аммония
(2)
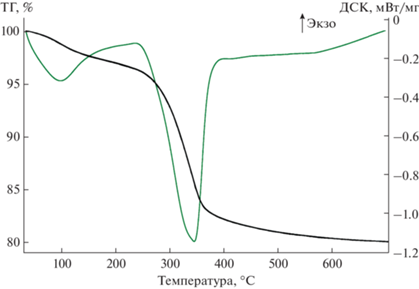
$\begin{gathered} {\text{SnC}}{{{\text{l}}}_{{\text{4}}}} + {\text{ }}х{{{\text{Н}}}_{{\text{2}}}}{\text{О + 4N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} \to \\ \to \,\,{\text{Sn}}{{{\text{О}}}_{{\text{2}}}}{\kern 1pt} \cdot {\kern 1pt} х{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 4{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{Cl,}} \\ \end{gathered} $В результате термической обработки образца при 300°С происходит дегидратация CaSn(OH)6. Данные термического анализа свежеосажденного образца CaSn(OH)6 свидетельствуют о протекании последовательных процессов, сопровождающихся изменениями массы, структуры и фазового состава, что согласуется с результатами РФА. При температурах 150–380°С наблюдается потеря массы (~20.7%), сопровождающаяся эндотермическим эффектом, обусловленным дегидратацией образца (рис. 3) в соответствии с уравнениями реакций
(3)
${\text{CaSn}}{{\left( {{\text{OH}}} \right)}_{6}} \to {\text{CaSn}}{{{\text{O}}}_{{\text{3}}}}{\text{ + 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(4)
${\text{Sn}}{{{\text{О}}}_{2}}\cdotх{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to {\text{Sn}}{{{\text{O}}}_{2}} + х{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$По данным РФА, образец, полученный в результате термической обработки при 300–500°С в течение 4 ч, представляет собой рентгеноаморфный продукт (рис. 1, кривые 2, 3).
По данным СЭМ продукт дегидратации представляет собой псевдоморфозу, сохраняющую форму исходных частиц и состоящую из сросшихся наночастиц аморфной фазы. При дальнейшей термической обработке (выше 500°С) образца наблюдается переход аморфной фазы в смесь кристаллических фаз станната кальция CaSnO3 и диоксида олова SnO2, что подтверждается результатами РФА (рис. 1, кривая 4). Кристаллический CaSnO3 обладает структурой типа ильменита с ромбической структурой (пр. гр. P212121) и характеризуется малыми размерами областей когерентного рассеяния (от 20 до 80 нм). На дифрактограмме также наблюдаются уширенные пики примесной фазы нанокристаллического диоксида олова – продукта термолиза фазы SnO2⋅хH2O, соосажденной с CaSn(OH)6 из исходного раствора.
По данным СЭМ, после прогрева при 700°С псевдоморфоза сохраняется (рис. 4), форма и размер частиц не изменяются. При этом большие кубические агрегаты состоят из малых слабо агрегированных частиц CaSnO3, на поверхности которых находятся частицы диоксида олова.
Текстурные характеристики образцов были исследованы с помощью низкотемпературной адсорбции азота при 77 К на анализаторе газовой сорбции. В табл. 1 приведены результаты исследований текстурных свойств полученных образцов, прокаленных при различных температурах в течение 4 ч. Видно, что псевдоморфоза, образующаяся при термолизе CaSn(OH)6, характеризуется высокими значениями удельной поверхности и наличием мезопор с размерами около 3 нм. С ростом температуры термообработки удельная поверхность монотонно уменьшается, а размеры пор возрастают.
Таблица 1.
Удельная поверхность и размеры пор образцов в зависимости от температуры обработки
| t, °С | 100 | 300 | 500 | 700 |
|---|---|---|---|---|
| Фазовый состав | CaSn(OH)6 | Аморфный | Аморфный | CaSnO3–SnO2 |
| Sуд, м2/г | 67 | 90 | 43 | 35 |
| Размер пор, нм | 2.5 | 2.8 | 3.2 | 5.0 |
Уменьшение удельной поверхности композитов при термообработке связано с ростом размера зерен. Размер кристаллитов L можно оценить по известным значениям удельной поверхности Sуд с помощью упрощенного выражения, полученного для сферических или кубических частиц:
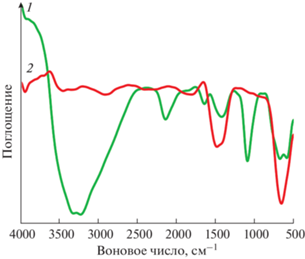
где ρ – плотность вещества (для CaSnO3 ρ = = 7.28 г/см3). Оценка показывает, что при увеличении температуры выше 500°С размер частиц CaSnO3, увеличивается от 20 до 80 нм, что близко к аналогичным значениям, оцененным по уширению дифракционных пиков.Анализ ИК-спектров синтезированных соединений позволяет подтвердить их состав и некоторые особенности строения. Результаты ИК-спектроскопии полученных образцов гидроксистанната кальция (рис. 5, кривая 1) и станната кальция (рис. 5, кривая 2) согласуются с полученными ранее [13, 15, 45], при этом отнесение характеристических полос в спектрах проводили на основе данных [46, 47].
На наличие гидроксильных групп в составе прекурсора указывает сильная полоса валентных колебаний ν(ОН) с максимумами при 3331 и 3231 см–1, которые свидетельствуют о неравноценности гидроксильных групп в структуре соединения CaSn(OH)6, также в спектре регистрируются полосы деформационных колебаний δ(ОН), проявляющиеся в виде острой сильной полосы с максимумом при 1094 см–1 [15]. На наличие адсорбционной воды указывают слабая полоса ножничного деформационного колебания δs(ОН) воды при 1634 см–1 [43, 44], а также уширение полосы валентных колебаний ν(ОН) в области 3500–3250 см–1.
В ИК-спектре CaSnO3, полученного при выдерживании CaSn(OH)6 при температуре 700°С, не регистрируются полосы валентных ν(ОН) и деформационных δ(ОН) колебаний гидроксильных групп. Наличие широкой полосы в области 3500–3250 см–1 соответствует антисимметричным νas(ОН) и симметричным νs(ОН) валентным колебаниям адсорбированной на поверхности наночастиц станната кальция воды, в области 1600–1500 см–1 также сохраняются полосы ножничного деформационного колебания δs(ОН) воды.
В области более длинных волн 900–400 см–1, характерных для связей металл–кислород, в ИК-спектре CaSnO3 наблюдается сильная полоса при 643 см–1, относящаяся к симметричным валентным колебаниям связи Sn–O, а также сильная полоса симметричных колебаний октаэдров SnO6 с максимумом при 501 см–1 [9, 48–50]. Валентным колебаниям Sn–O в спектре прекурсора соответствует сильная полоса с максимумом при 685 см–1 и плечом при 670 см–1, что также указывает на различную прочность рассматриваемых связей [13, 44, 48–50].
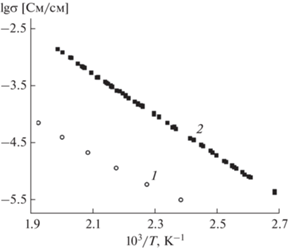
Композит, полученный при 700°С, был использован в качестве гетерогенной добавки для получения композиционных твердых электролитов на основе ионных солей. Нанокомпозитные твердые электролиты были получены путем смешения порошков CaSnO3–SnO2 с солью цезия в соотношении 50 : 50 мол. % с последующей термообработкой при температуре 350°C в течение 2 ч. На рис. 6 представлены температурные зависимости проводимости чистого нитрита цезия и нанокомпозита 0.50CsNO2–0.50(CaSnO3–SnO2). Видно, что добавка CaSnO3–SnO2 приводит к существенному, более чем на порядок величины, увеличению проводимости. При этом на годографах импеданса в области низких частот наблюдается вклад электродной поляризации, что указывает на ионный характер проводимости композита. Проводимость композита CsNO2–CaSnO3–SnO2 описывается уравнением Аррениуса σ = (A/T)exp(–Ea/kT) и изменяется в пределах от 4 × 10–6 См/см при 97°C до 1.3 × 10–3 См/см при 350°C. Из анализа экспериментальных данных определены параметры аррениусовой зависимости проводимости: энергия активации Eа = 0.77 ± 0.02 эВ и предэкспоненциальный множитель lg A [См К/см] = = 7.49 ± 0.04. Увеличение проводимости обусловлено дополнительным вкладом межфазных границ CsNO2/оксид в общую проводимость ионной соли. Этот эффект наблюдался ранее во многих композиционных электролитах типа ионная соль–оксид [51]. Полученные композиционные твердые электролиты обладают относительно высокой ионной проводимостью.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что при осаждении гидроксидов олова(IV) и кальция из солянокислых растворов образуется гидроксостаннат кальция CaSn(OH)6 в виде хорошо ограненных кубических кристаллов. Установлено, что в результате термолиза CaSn(OH)6 в температурном диапазоне 300–700°С образуются нанокомпозиты CaSnO3–SnO2, состоящие из наночастиц размером 20–80 нм, объединенных в псевдоморфозу исходного соединения.
Полученные функциональные материалы на основе продуктов термолиза CaSnO3–SnO2 перспективны для использования в качестве гетерогенных добавок в композиционные твердые электролиты.
Список литературы
Lei B., Li B., Zhang H., Li W. Preparation and Luminescence Properties of CaSnO3:Sm3+ Phosphor Emitting in the Reddish Orange Region // Opt. Mater. 2007. T. 29. № 11. P. 1491–1494.
Gaudona M., Saleka G., Kandea M., Androna I., Frayretb C., Duranda E., Penina N., Duttinea M., Wattiauxa A., Jubera V. CaSn(OH)6 hydroxides, CaSnO3 Oxides and CaSnF6 Fluorides: Synthesis and Structural Filiation. Cationic Environment Impact on Pr3+ Doped Compounds Luminescence // J. Solid State Chem. 2018. V. 265. P. 291–298. https://doi.org/10.1016/j.jssc.2018.06.017
Liu T., Ma X., Yang L., Li H., Li H., Lee S.W., Wang Y. Highly Enhanced Photocatalytic Activity of CaSn(OH)6 through Tuning CaSn(OH)6/SnO2 Heterostructural Interaction and Optimizing Fe3+ Doping Concentration // Appl. Catal., B: Environ. 2017. V. 217. P. 256–264. https://doi.org/10.1016/j.apcatb.2017.05.080
Wang W., Bi J., Wu L., Li Z., Fu X. Hydrothermal Synthesis and Catalytic Performances of a New Photocatalyst CaSnO3 with Microcube Morphology // Scr. Mater. 2009. V. 60. № 3. P. 186–189. https://doi.org/10.1016/j.scriptamat.2008.10.001
Dong L., Su Y., Qiao Y., Li R., Xu J., Chen Y., Ma H. Structure Regulation of Boron-Doped Calcium Hydroxystannate and Its Enhancement on Flame Retardancy and Mechanical Properties of PVC // Polym. Adv. Technol. 2021. V. 32. № 4. P. 1831–1843.
Zhang C., Lu R., Liu C., Yuan L., Wang J., Zhao Y., Yu C. High Yield Electrosynthesis of Hydrogen Peroxide from Water Using Electrospun CaSnO3@Carbon Fiber Membrane Catalysts with Abundant Oxygen Vacancy // Adv. Funct. Mater. 2021. V. 31. № 26. P. 2100099–2100099.
Park S.Y., Abroshan H., Shi X., Jung H.S., Siahrostami S., Zheng X. CaSnO3: An Electrocatalyst for Two-Electron Water Oxidation Reaction to Form H2O2 // ACS Energy Lett. 2019. V. 4. № 1. P. 352−357. https://doi.org/10.1021/acsenergylett.8b02303
Ochoa-Munoz Y.H., Rodriguez-Paez J.E., Mejia de Gutierrez R. Structural and Optical Study of Perovskite Nanoparticles MSnO3 (M = Ba, Zn, Ca) Obtained by a Wet Chemical Route // Mater. Chem. Phys. 2021. V. 266. P. 124557. https://doi.org/10.1016/j.matchemphys.2021.124557
Zhang W., Tang J., Ye J. Structural, Photocatalytic, and Photophysical Properties of Perovskite MSnO3 (M = = Ca, Sr, and Ba) Photocatalysts // J. Mater. Res. 2007. V. 22. № 7. P. 1859–1871. https://doi.org/10.1557/JMR.2007.0259
Zhu K., Lv H., Wang Y., Pan Z. Synthesis and Luminescent Property of Sm3+ Doped and (Sm3+, Zr4+) co-Doped Calcium Stannate Phosphors via Co-precipitation and Sintering // Opt. Mater. 2021. V. 120. 111456. https://doi.org/10.1016/j.optmat.2021.111456
Marikutsa A., Rumyantseva M., Baranchikov A., Gaskov A. Nanocrystalline BaSnO3 as an Alternative Gas Sensor Material: Surface Reactivity and High Sensitivity to SO2 // Materials. 2015. V. 8. P. 6437–6454. https://doi.org/10.3390/ma8095311
Cheng H., Lu Z. Synthesis and Gas-Sensing Properties of CaSnO3 Microcubes // Solid State Sci. 2008. V. 10. № 8. P. 1042–1048.
Dong L., Su Y., Wang C., Qiao Y., Chen Y., Ma H. Synthesis of Micro- to Nano-Scale Perovskite Calcium Hydroxytinate and Its Performance as a Flame Retardant in Epoxy Resin // Chem. J. Chin. Univ. 2021. V. 42. № 3. P. 937–945. https://doi.org/10.7503/cjcu20200470
Meng S., Li D., Sun M., Li W., Wang J., Chen J., Fu X., Xiao G. Sonochemical Synthesis, Characterization and Photocatalytic Properties of a Novel Cube-Shaped CaSn(OH)6 // Catal. Commun. 2011. V. 12. № 11. P. 972–975. https://doi.org/10.1016/j.catcom.2011.02.026
Sandesh S., Kristachar P.K.R., Manjunathan P., Halgeri A.B., Shanbhag G.V. Synthesis of Biodiesel and Acetins by transesterification Reactionsusing Novel CaSn(OH)6 Heterogeneous Base Catalyst // Appl. Catal., A: General. 2016. V. 523. P. 1–11. https://doi.org/10.1016/j.apcata.2016.05.006
Gomez-Solis C., Oliva J., Diaz-Torres L.A., Bernal-Alvarado J., Reyes-Zamudio V., Abidov A., Torres-Martinez L.M. Efficient Photocatalytic Activity of MSnO3 (M: Ca, Ba, Sr) Stannates for Photoreduction of 4-Nitrophenol and Hydrogen Production under UV Light Irradiation // J. Photochem. Photobiol., A: Chem. 2019. V. 371. P. 365–373. https://doi.org/10.1016/j.jphotochem.2018.11.039
Inagaki M., Kuroishi T., Yamashita Y., Urata M. Syntheses of MSn(OH)6 by Coprecipitation and of MSnO3 by Thermal Decomposition (M = Mg, Co, Zn, Mn, Cd, Ca, Sr, Ba) // Z. Anorg. Allg. Chem. 1985. V. 527. P. 193–202.
Baeissa E.S. Novel Pd/CaSn(OH)6 Nanocomposite Prepared by Modified Sonochemical Method for Photocatalytic Degradation of Methylene Blue Dye // J. Alloys Compd. V. 590. P. 303–308. https://doi.org/10.1016/j.jallcom.2013.12.131
Huang D., Fu X., Long J., Jiang X., Chang L., Meng S., Chen S. Hydrothermal synthesis of MSn(OH)6 (M = Co, Cu, Fe, Mg, Mn, Zn) and Their Photocatalytic Activity for the Destruction of Gaseous Benzene // Chem. Eng. J. 2015. V. 269. P. 168–179. https://doi.org/10.1016/j.cej.2015.01.133
Honorio L.M.C., Santos M.V.B., Da Silva Filho E.C., Osajima J.A., Maia A.S., Santos I.M.G. Alkaline Earth Stannates Applied in Photocatalysis: Prospection and Review of Literature // Ceramica. 2018. V. 64. № 372. P. 559–569. https://doi.org/10.1590/0366-69132018643722480
Dai Q., Gu C., Xu Y., Zhang Y., Hong Y., Woo Joo S., Huang J. Self-Sacrificing Template Method to Controllable Synthesize Hollow SnO2@C Nanoboxes for Lithium-Ion Battery Anode //J. Electroanal. Chem. 2021. V. 898. P. 115653. https://doi.org/10.1016/j.jelechem.2021.115653
Jena H., Kutty K.V.G., Kutty T.R.N. Ionic Transport and Structural Investigations on MSn(OH)6 (M = Ba, Ca, Mg, Co, Zn, Fe, Mn) Hydroxide Perovskites Synthesized by Wet Sonochemical Methods // Mater. Chem. Phys. 2004. V. 88. № 1. P. 167–179. https://doi.org/10.1016/j.matchemphys.2004.07.003
Kim H.S., Park S.S., Kang S.H., Sung Y.E. Effect of Particle Shape on the Electrochemical Properties of CaSnO3 as an Anode Material for Lithium-Ion Batteries // J. Appl. Electrochem. 2014. V. 44. № 7. P. 789–796. https://doi.org/10.1007/s10800-014-0698-7
Зима Т.М., Малыгин И.В. Гидротермальный синтез и исследование наноструктурированного диоксида олова, легированного кобальтом // Неорган. материалы. 2019. Т. 55. № 3. С. 290–297. https://doi.org/10.1134/S0002337X19020155
Loginov A.V., Aparnev A.I., Uvarov N.F. Study of Thermal Decomposition of Hexahydroxostannates(IV) MSn(OH)6, (M = Mg, Sr, Ca) // Mater. Today. 2020. V. 25. № 3. P. 477–479. https://doi.org/10.1016/j.matpr.2019.12.242
Kumar A., Khan B., Singh G., Dixit A., Kumar U., Singh M.K. Structural, Microstructure, Optical, and Electrical Properties of Ti-Doped CaSnO3 Prepared by Sol-Gel Chemical Route // Phys. Scr. 2020. V. 95. № 10. P. 105807.
Aparnev A.I., Afonina L.I., Loginov A.V., Uvarov N.F. Synthesis of Nanocomposite Materials Based on Cobalt-Doped Tin Oxide and Study of Their Physicochemical Properties // Russ. J. Appl. Chem. 2016. V. 89 № 2. P. 212−215.
Lu Z., Liu J., Tang Y., Li Y. Hydrothermal Synthesis of CaSnO3 Cubes // Inorg. Chem. Commun. 2004. V. 7. № 6. P. 731–733. https://doi.org/10.1016/j.inoche.2004.03.030
Rashad M.M., El-Shall H. Effect of Synthesis Conditions on the Preparation of MgSnO3 Powder via co-Precipitation Method // Powder Technol. 2008. V. 183. P. 161–168. https://doi.org/10.1016/j.powtec.2007.07.019
Yong Z.J., General A. Sonochemical Approach to Rapid Synthesis of 1D Single-crystalline MSn(OH)6 (M = Ba, Ca, Sr) Nanostructures // Adv. Mater. Res. 2011. V. 295–297. P. 1554–1559.
Kramer J.W., Isaacs S.A., Manivannan V. Microwave-assisted Metathesis Synthesis of Schoenfliesite-Type MSn(OH)6 (M = Mg, Ca, Zn, and Sr) Materials // J. Mater. Sci. 2009. V. 44. № 13. P. 3387–3392.
Kramer J.W., Kelly B., Manivannan V. Synthesis of MSn(OH)6 (where M = Mg, Ca, Zn, Mn, or Cu) Materials at Room Temperature // Cent. Eur. J. Chem. 2010. V. 8. № 1. P. 65–69.
Strunz H., Contag B. Hexahydroxostannates Fe, Mn, Co, Mg, CaSn(OH)6 and their Crystal structures // Acta Crystallogr., Sect. B. 1960. № 13. P. 601–603.
Stanulis A., Sakirzanovas S., Van Bael M., Kareiva A. Sol–gel (Combustion) Synthesis and Characterization of Different Alkaline Earth Metal (Ca, Sr, Ba) Stannates // J. Sol-Gel Sci. Technol. 2012. V. 64. P. 643–652https://doi.org/10.1007/s10971-012-2896-2
Hu X., Lv G., Jia Z., Jiang J., Xiao T., Yuan M., Tang Y. A General Sonochemical Approach to Rapid Synthesis of 1D Single-Crystalline MSn(OH)6 (M = Ba, Ca, Sr) Nanostructures // Appl. Surf. Sci. 2011. V. 257. № 21. P. 9008–9013. https://doi.org/10.1016/j.apsusc.2011.05.088
Логинов А.В., Апарнев А.И., Уваров Н.Ф. Синтез нанокомпозитов SrSnO3/SnO2 методом термического разложения прекурсора // Неорган. материалы. 2022. Т. 58. № 4. С. 437–441. https://doi.org/10.31857/S0002337X22040091
Mateyshina Yu.G., Iskakova A.A., Ulihin A.S., Uvarov N.F. Transport Properties of Cesium Nitrite // Russ. J. Electrochem. 2015. V. 51. № 7. P. 615–618.
Mateyshina Yu., Uvarov N. Ionic Conductivity of Alkali Nitrites // Solid State Ionics. 2017. V. 302. P. 77–82. https://doi.org/10.1016/j.ssi.2016.11.023
Kachala V.V., Khemchyan L.L., Kashin A.S., Orlov N.V., Grachev A.A., Zalesskiy S.S., Ananikov V.P. Target-Oriented Analysis of Gaseous, Liquid, and Solid Chemical Systems with mass Spectrometry, Nuclear Magnetic Resonance Spectroscopy, and Electron Microscopy // Russ. Chem. Rev. 2013.V. 82. № 7. P. 648–685.
Kashin A.S., Ananikov V.P. A SEM Study of Nanosized Metal Films and Metal Nanoparticles Obtained by Magnetron Sputtering // Russ. Chem. Bull. Int. Ed. 2011. V. 60. P. 2602–2607.
Lowell S., Shields J.E., Thomas M.A., Thommes M. Characterization of Porous Solids and Powders: Surface Area, Pore Size and Density. Netherlands: Springer, 2006. P. 339.
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. Новосибирск: Наука, 1999. 470 с.
Faust G.T., Schaller W.T. Schoenfliesite, MgSn(OH)6 // Z. Kristallogr. 1971. V. 134. P. 116–141.
Strunz H., Contag B. Hexahydroxostannate Fe, Mn, Co, Mg, Ca[Sn(OH)6] und deren Kristallstruktur // Acta Crystallogr. 1960. V. 13. № 8. P. 601–603. https://doi.org/10.1107/S0365110X60001436
Socrates G. Infrared and Raman Characteristic Group Frequencies Contents // Tables and Charts. Wiley, 2001.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. New York: Wiley, 1997. P. 479.
Moshtaghia S., Ghanbarib D., Salavati-Niasaria M. Characterization of CaSn(OH)6 and CaSnO3 Nanostructures Synthesized by a New Precursor // J. Nanostruct. 2015. № 5. P. 169–174.
Zheng H.L., Zhang Z.C., Zhou J.G., Yang S.S., Zhao J. Vibrational Spectra of CaGa2O4, Ca2GeO4, CaIn2O4 and CaSnO3 Prepared by Electrospinning // Appl. Phys. Mater. Sci. Process. 2012. V. 108. P. 465–473. https://doi.org/10.1007/s00339-012-6916-4
Maul J., Erba A., Santos I.M.G., Sambrano J.R., Dovesi R. In Silico Infrared and Raman Spectroscopy under Pressure: The case of CaSnO3 Perovskite // J. Chem. Phys. 2015. V. 142. P. 014505. https://doi.org/10.1063/1.4905143
Zheng H.L., Reaney I.M., Csete de Györgyfalva G.D.C., Ubic J.R., Yarwood M.P., Seabra V.M. Ferreira: Raman Spectroscopy of CaTiO3-Based Perovskite Solid Solutions // J. Mater. Res. 2004. V. 19. № 2. P. 488–495.
Уваров Н.Ф. Композиционные твердые электролиты. Новосибирск: Изд. СО РАН, 2008. 254 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы