Неорганические материалы, 2022, T. 58, № 8, стр. 836-843
Электропроводность фаз на основе сульфата натрия
Н. И. Сорокин 1, В. Ю. Пройдакова 2, В. В. Воронов 2, С. В. Кузнецов 2, П. П. Федоров 2, *
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография
и фотоникa” Российской академии наук
119333 Москва, Ленинский пр., 59, Россия
2 Институт общей физики им. А.М. Прохорова Российской
академии наук
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 10.01.2022
После доработки 16.04.2022
Принята к публикации 19.04.2022
- EDN: BOKHFN
- DOI: 10.31857/S0002337X22080115
Аннотация
Синтезированы и исследованы материалы на основе сульфата натрия с ионной проводимостью по катионам Na+: Na2SO4, Na2SO4:3.5% Yb и Na3Ga(SO4)3. Введение гетеровалентных катионов Yb3+ приводит к существенному возрастанию электропроводности Na2SO4 (в ~240 раз при 573 К) в результате образования вакансий в натриевой подрешетке и стабилизации высокотемпературной гексагональной модификации (пр. гр. P63/mmc). Концентрация вакансий натрия и их подвижность для твердого раствора (Na0.895Yb0.035)2SO4 равны: nvac = 7.93 × 1020 см−3 и μvac = 2.7 × 10−5 см2/(сВ) (573 К) соответственно.
ВВЕДЕНИЕ
Материалы с высокой ионной проводимостью интересны как с фундаментальной точки зрения, так и для разработки различных электрохимических устройств [1, 2]. Материалы с высокой подвижностью катионов натрия рассматриваются как возможная альтернатива литиевых ионных батарей [3–7]. Сульфаты представляют собой оригинальный класс материалов, для которых был предложен специфический механизм “мельничного колеса”, когда подвижность катионов дополнительно стимулируется вращательной динамикой сульфат-ионов ${\text{SO}}_{4}^{{2 - }}$ [8, 9].
Особый интерес для исследователей представляет высокотемпературная фаза Na2SO4-I, которая имеет гексагональную сингонию с пр. гр. P63/mmc [10]. Несмотря на долгую историю изучения полиморфизма (существуют фазы I–V [11–15]) и ионной проводимости сульфата натрия [16–20], в последнее время с точки зрения ионного транспорта привлекают внимание кристаллические и аморфные материалы на основе Na2SO4 [21–23].
Согласно структурным данным [11–15], в режиме нагревания при 513 К фаза V (минерал тенардит, пр. гр. Fddd, Z = 8) переходит в фазу I (пр. гр. P63/mmc, Z = 2). При охлаждении ниже 508 К фаза I переходит в метастабильную фазу II (пр. гр. Pbnm, Z = 4), а затем в метастабильную фазу III (пр. гр. Cmcm, Z = 4).
При исследовании поликристаллических образцов сульфата натрия [16, 20] обнаружено, что при нагревании фазы V до 513 К величина проводимости плавно возрастает с температурой, увеличиваясь в 6 раз. При повторном температурном циклировании этого же образца обнаружен скачок проводимости при фазовом переходе III–I. Проводимость фазы V больше, чем фазы III. Карим и Мелландер [19] показали, что абсолютная величина электропроводности сульфата натрия сильно зависит от чистоты поликристаллических образцов и существенный вклад в общее сопротивление образцов вносят границы зерен.
Фазу Na2SO4-I можно стабилизировать, если в анионную подрешетку вводить анионы больших размеров или в катионную подрешетку вводить одно-, двух- и трехвалентные катионы. В [10] сообщается, что ионная проводимость твердых растворов на основе стабилизированной гексагональной высокотемпературной модификации Na2SO4-I определяется концентрацией вакансий натрия (дефектов $V_{{{\text{Na}}}}^{'}$) и практически не зависит от природы модифицирующих катионов. Проводимость твердых растворов возрастает, если в подрешетке Na+ увеличить концентрацию катионов Zn2+, Ni3+, Sr2+ или Y3+ до 7%. Максимальная ионная проводимость твердых растворов составляет 1.5 × × 10−2 См/см при 773 К [10], что в два раза выше, чем у чистого сульфата натрия.
При низкой концентрации вакансий натрия существует линейная зависимость между величиной проводимости и концентрацией вакансий $V_{{{\text{Na}}}}^{'}$, поскольку нет значительного взаимодействия между подвижными катионами Na+ и кристаллической решеткой.
Существенно более высокая ионная проводимость зафиксирована для монокристаллов Na2SO4:Nd3+ [24]. Шаши и Пракаш [25] изучали твердые растворы в системах Na2SO4–M2(SO4)3 с M3+ = La3+, Dy3+ и Sm3+. Гетеровалентными замещениями удалось стабилизировать высокотемпературную фазу I сульфата натрия. Наибольшая проводимость твердого раствора была получена при содержании 4 мол. % La2(SO4)3. В [26, 27], частично замещали сульфат-анионы изовалентными анионами ${\text{CO}}_{3}^{{2 - }}$, ${\text{MoO}}_{4}^{{2 - }}$, ${\text{WO}}_{4}^{{2 - }}$, ${\text{SiO}}_{4}^{{2 - }}$ и катионы Na+ катионами Cd2+, Rb+, K+ с целью выяснить механизм ионной проводимости высокотемпературной модификации (фазы I) сульфата натрия. Большинство полученных твердых растворов демонстрировали повышение ионной проводимости. Максимальная проводимость получена при введении гетеровалентных катионов Cd2+. В отличие от катионов K+ и Rb+ при введении Cd2+ образуются вакансии $V_{{{\text{Na}}}}^{'}$.
Также увеличение проводимости и стабилизация фазы I при комнатной температуре обнаружены при замещениях анионов ${\text{SiO}}_{4}^{{2 - }}$ на ${\text{WO}}_{4}^{{2 - }}$ и ${\text{MoO}}_{4}^{{2 - }}$. Предполагается [26, 27], что на величину проводимости не влияет вращательное движение тетраэдрических анионов [SO4]2−, поскольку при введении более тяжелых анионов это движение затрудняется. Существенным фактором является то, что анионы [MoO4]2− и [WO4]2− больше по размеру, чем [SO4]2−. Тем самым при образовании твердого раствора увеличивается свободный объем кристаллической решетки, что облегчает миграцию катионов Na+ в соответствии с перколяционной моделью [28].
Дхармасена и Фреч [29] при замещении катионов в Na2SO4 обнаружили, что даже при их низких концентрациях наиболее стабильными фазами Na2SO4 при комнатной температуре являются I и III (тип фазы зависит от концентрации дефектов). Обнаружено, что стабилизация конкретной фазы, по-видимому, не зависит от заряда замещающих катионов. Все примесные катионы с ионными радиусами, аналогичными натриевому, стабилизируют обе фазы – I и III. При замещении натрия на кальций в сульфате натрия при комнатной температуре стабилизируется фаза III.
Если рассмотреть общий аспект изоморфизма и аллотропии соединений A2XO4 (A – катион и X – анион), то к высокой подвижности катионов Na+ приводит высокая концентрация $V_{{{\text{Na}}}}^{'}$ (до ~30%), образующаяся в гетеровалентных твердых растворах на основе высокотемпературной фазы Na2SO4-I.
В [30] предложено использовать твердые электролиты на основе Na2SO4 для сенсоров на определение SOx. Леушина и Мамонтова [31] использовали транспортные свойства твердого раствора сульфата галлия в Na2SO4 для электрохимического легирования теллурида свинца галлием.
Целью работы является исследование электропроводности фаз на основе сульфата натрия с добавками гетеровалентных катионов Yb3+ и Ga3+ на примере твердого раствора (Na1−3xYbx)2SO4 и соединения Na3Ga(SO4)3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактив сульфата натрия Na2SO4 квалификации “х. ч.” (Химмед, Россия) дополнительно очищали перекристаллизацией из воды. Двойную перекристаллизацию проводили по методике, описанной в [32, 33]. Для выращивания монокристаллов Na2SO4:Yb3+ была использована механическая смесь сульфата натрия (96.5 мол. %) и сульфата иттербия (3.5 мол. %). Реактив Yb2(SO4)3 был получен по методике, описанной ниже. Для синтеза безводного сульфата иттербия были использованы оксид иттербия “х. ч.”, серная кислота “х. ч.” и бидистиллированная вода. В стакан объемом 200 мл с мешалкой помещали 10 г (0.01576 моля) оксида иттербия и 10 мл H2O, затем постепенно прикапывали 10%-ную серную кислоту до почти полной нейтрализации (~31.5 мл H2SO4). После нейтрализации раствор отстаивали и фильтровали. Фильтрат упаривали до объема 20 мл. Выпавшие кристаллы Yb2(SO4)3⋅8H2O отделяли на воронке Бюхнера и сушили при 400°C.
Монокристаллы гетеровалентного твердого раствора Na2SO4:Yb3+ были выращены на воздухе методом Чохральского [34]. Соединение Na3Ga(SO4)3 получено по методике, описанной в [35].
Полученные образцы исследовали методом рентгенофазового анализа на дифрактометре Bruker D8 Advanced (CuK-излучение) в интервале углов 2θ = 10°−75° (шаг сканирования 0.01°, время выдержки на шаге 0.3 с). Спектры обрабатывали с помощью программы EVA (версия 2.1). Расшифровку рентгенограмм проводили с помощью базы данных PDF-2 (версия 2011 г.). Параметры решетки рассчитывались в программе TOPAS v.4.2.
Электропроводность σ образцов измеряли методом импедансной спектроскопии на приборе Tesla BM-507 на частотах 5 Гц–500 кГц в вакууме ~1 Па в интервале температур 298–705 К. Погрешность при определении значений σ составляла 5%. Керамические образцы представляли собой поликристаллические таблетки толщиной 1 и диаметром 5 мм ((Na0.895Yb0.035)2SO4) и 9 мм (Na2SO4-V, Na3Ga(SO4)3). Монокристалл перед измерением измельчали в агатовой ступке. Керамические образцы готовили прессованием при комнатной температуре. В качестве электродов использовали графитовую пасту DAG-580.
Наличие в спектрах импеданса блокирующего эффекта от инертных (графитовых) электродов на низких частотах указывает на ионную природу электротранспорта в исследуемых образцах. Объемное сопротивление Rcer образцов находили из частотных зависимостей комплексного импеданса электрохимических ячеек C|керамика|C по пересечению годографа импеданса с осью активных сопротивлений.
Электропроводность на постоянном токе керамических образцов рассчитывали по формуле
где h – толщина образца, S – площадь электрода. Величина σ включает в себя в целом все процессы электропереноса внутри кристаллических зерен и на межзеренных границах.Температурные зависимости образцов обрабатывали в соответствии с уравнением Аррениуса-Френкеля
где A – предэкспоненциальный множитель электропроводности, Ea – энергия активации ионного переноса.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
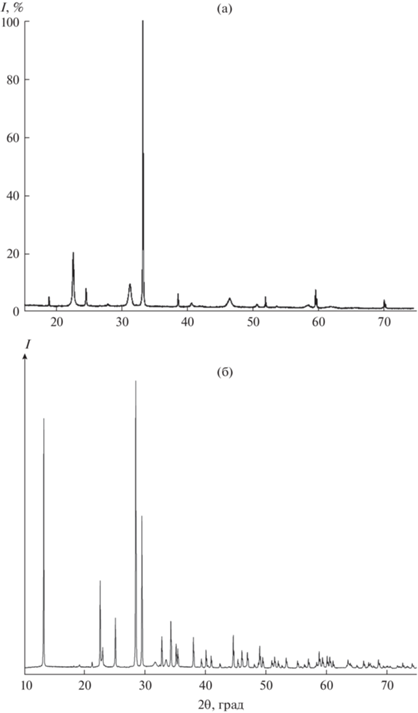
Результаты рентгенофазового исследования сульфата натрия представлены на рис. 1. При комнатной температуре (298 К) кристаллическая структура образца Na2SO4 относится к ромбической сингонии (пр. гр. Fddd), что согласуется с большинством работ [12, 15]. При измерении ионной проводимости образца Na2SO4 с нагревом до 705 К и с последующим охлаждением не наблюдается существенных изменений на дифрактограмме (рис. 1в). Индицирование показывает присутствие двух фаз: тенардита – основная фаза и графита – примесная фаза (помечена стрелками).
Рис. 1.
Дифрактограммы образца Na2SO4 при 298 К: a – JCPDS сard 00-037-1465, б – до измерения ионной проводимости, в – после измерения ионной проводимости при нагреве до 705 К.
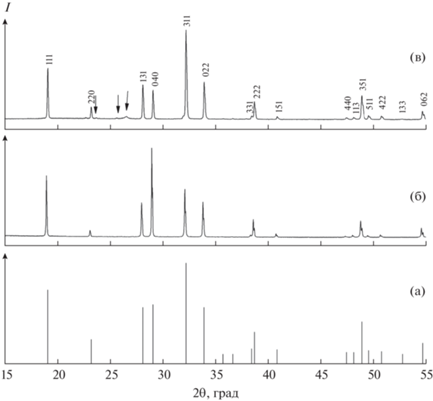
Результаты рентгенофазового исследования (Na0.895Yb0.035)2SO4 (рис. 2а) показали, что он относится к гексагональной высокотемпературной модификации типа Na2SO4-I (пр. гр. P63/mmc). Рассчитанные параметры решетки равны: а = 5.3381(1) и с = 7.156(4) Å. Параметры решетки монокристалла (Na0.895Yb0.035)2SO4 меньше, чем чистого сульфата натрия (JCPDS, Сard 86-0800: а = 5.393 Å, с = 7.246 Å), что свидетельствует о вхождении иттербия в решетку с образованием твердого раствора. Уменьшение параметров а и с можно объяснить меньшим ионным радиусом Yb3+ по сравнению с Na+ (${{r}_{{{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}}$ = 0.116 нм, ${{r}_{{{\text{Y}}{{{\text{b}}}^{{3 + }}}}}}$ = 0.1008 нм для к.ч. 6 [36]) и образованием катионных вакансий.
Наши результаты по стабилизации высокотемпературной α-модификации Na2SO4-I согласуются с фазовой диаграммой системы Na2SO4–Yb2(SO4)3 [37, 38], согласно которой стабилизировать высокотемпературную фазу I можно в области твердого раствора (Na1−3xYbx)2SO4 при x = = 0.02−0.08 (от 2 до 8 мол. % Yb2(SO4)3).
Результаты рентгенофазового исследования Na3Ga(SO4)3 показаны на рис. 2б. Это соединение относится к тетрагональной сингонии с параметрами решетки a = 9.451(3) и c = 7.097(3) Å. Результаты индицирования приведены в [35].
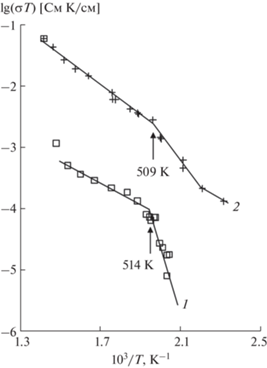
На рис. 3 показана температурная зависимость ионной проводимости Na2SO4 в координатах lg(σT)–1/T. При нагревании на графике (кривая 1) имеет место перегиб при 514 ± 5 К, связанный с фазовым переходом из фазы V в фазу I, что хорошо согласуется с данными [10, 11, 13]. В этот момент начинает кардинально перестраиваться кристаллическая структура сульфата натрия за счет разупорядочения натриевой подрешетки. Величина σ при 573 К равна 4.0 × 10−7 См/см и энергия активации ионного переноса составляет Ea = 0.30 эВ (530−650 К). Выше 650 К проводимость образца резко увеличивается, достигая 8.3 × 10−5 См/см при 705 К. По-видимому, это связано с высокотемпературным отжигом керамики.
При охлаждении сульфата натрия (кривая 2) на графике присутствует неявный перегиб при 509 ± 5 К, который может свидетельствовать о начале фазового перехода из фазы I в фазу II, что согласуется с нашими термоаналитическими исследованиями [32]. При охлаждении для фазы I величина σ при 573 К равна 1.4 × 10−5 См/см и энергия активации ионного переноса составляет Ea = 0.49 эВ (509−705 К).
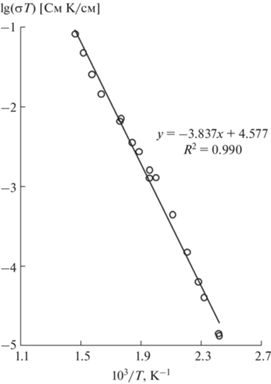
Температурная зависимость ионной проводимости для соединения Na3Ga(SO4)3 показана на рис. 4. В температурном интервале 412−682 К электропроводность увеличивается от 3.1 × 10−8 до 1.2 × 10−4 См/см (3.9 × 103 раз), кондуктометрические данные удовлетворяют уравнению Френкеля–Аррениуса. График демонстрирует линейную зависимость в координатах lg(σT)–1/T. При 573 К ионная проводимость Na3Ga(SO4)3 равна 1.4 × × 10−5 См/см и совпадает со значением σ для керамического образца Na2SO4. Энергия активации электропереноса в Na3Ga(SO4)3 равна Ea = 0.76 эВ.
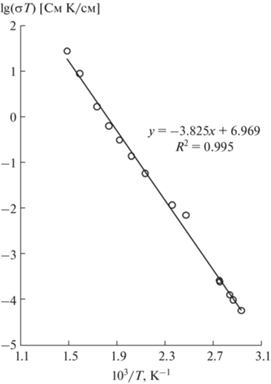
Температурная зависимость σ для твердого раствора (Na0.895Yb0.035)2SO4 показана на рис. 5. В температурном интервале 341−669 К электропроводность увеличивается от 1.7 × 10−7 до 4.0 × 10−2 См/см, т.е. более чем на 5 порядков. График демонстрирует линейную зависимость в координатах lg(σT)–1/T, кондуктометрические данные удовлетворяют уравнению Френкеля–Аррениуса. Величина σ при 573 К для (Na0.895Yb0.035)2SO4 равна 3.4 × 10−3 См/см, что превышает значение σ для Na2SO4 в ~240 раз. Энергия активации электропереноса в (Na0.895Yb0.035)2SO4 равна Ea = 0.76 эВ и совпадает со значением Ea для образца Na3Ga(SO4)3.
Рис. 5.
Температурная зависимость ионной проводимости твердого раствора (Na0.895Yb0.035)2SO4 (режим нагрева).
Изученные сульфаты, как и фосфаты, арсенаты и молибдаты, обладают гетеродесмическими структурами. В структуре сульфата натрия изолированные тетраэдры [SO4] соединяются через искаженные октаэдры [NaO6]. Наиболее прочными являются химические связи в тетраэдрических анионах [SO4]2−, что связано с высокой валентностью центрального катиона S6+. Ионные связи между катионами натрия и сульфат-анионами оказываются относительно слабыми, что обуславливает подвижность катионов Na+ и значительное тепловое расширение сульфатов [33, 39].
При гетеровалентном замещении Na+ на Yb3+ в сульфате натрия образуются две вакансии натрия $V_{{{\text{Na}}}}^{'}$. Структурную формулу твердого раствора можно записать в виде
(3)
${{\left( {{\text{N}}{{{\text{a}}}_{{1 - 3x}}}{\text{Y}}{{{\text{b}}}_{x}}{{\square }_{{2x}}}} \right)}_{2}}{\text{S}}{{{\text{O}}}_{4}},$(4)
${{n}_{{vac}}} = 2xZ{\text{/}}0.866{{a}^{2}}c = 7.93\,\, \times \,\,{{10}^{{20}}}\,\,{\text{с}}{{{\text{м}}}^{{ - 3}}},$(5)
${{\mu }_{{vac}}} = \sigma {\text{/}}q{{n}_{{vac}}} = 2.7\,\, \times \,\,{{10}^{{ - 5}}}{\text{ с}}{{{\text{м}}}^{2}}{\text{/(с В}}).$В системе Na2SO4–Yb2(SO4)3 на кривых плавления твердого раствора (Na1−3xYbx□2x)2SO4 имеет место максимум [37, 38]. Как отмечено в [40–42], такое явление, присущее только гетеровалентным твердым растворам с изменением числа ионов элементарной ячейке, коррелирует с высокой ионной проводимостью. Проведенное исследование подтверждает эту корреляцию.
ЗАКЛЮЧЕНИЕ
Для проведения рентгенографического и электрофизического исследований синтезированы керамические образцы Na2SO4, Na3Ga(SO4)3 и (Na0.895Yb0.035)2SO4 (Na2SO4:3.5% Yb).
Для соединения Na3Ga(SO4)3 введение гетеровалентных катионов Ga3+ не приводит к существенному возрастанию электропроводности по сравнению с Na2SO4.
Введение гетеровалентных катионов Yb3+ приводит к возрастанию электропроводности Na2SO4 при 573 К в ~240 раз. Причинами этого являются образование вакансий в натриевой подрешетке и стабилизация высокотемпературной гексагональной модификации (пр. гр. P63/mmc). Для твердого раствора (Na0.895Yb0.035)2SO4 рассчитаны концентрация вакансий натрия и их подвижность.
Список литературы
Иванов-Щиц А.К., Мурин И.В. Ионика твердого тела. СПб: Изд-во. СПбУ, 2010.
Ярославцев А.Б. Основные направления разработки и исследования твердых электролитов // Успехи химии. 2016. Т. 85. № 11. С. 1255–1276.
Скундин А.М., Кулова Т.Л., Ярославцев А.Б. Натрий-ионные аккумуляторы // Электрохимия. 2018. Т. 54. № 2. С. 131–174.
Новикова С.А., Ларкович Р.В., Чеканников А.А., Кулова Т.Л., Скундин А.М., Ярославцев А.Б. Проводимость и электрохимические характеристики материалов на основе Na3V2(PO4)3 со структурой NASICON // Неорган. материалы. 2018. Т. 54. № 8. С. 839–849.
Buzlukov A.L., Baklanova Y.V., Arapova I.Yu., Savina A.A., Morozov V.A., Bardet M., Lazoryak B.I., Khaikina E.G., Denisova T.A., Medvedeva N.I. Na9In(MoO4)6: Synthesis, Crystal Structure, and Na+ Ion Diffusion // Ionics. 2021. V. 27. P. 4281–4293. https://doi.org/10.1007/s11581-021-04226-3
Солодовников С.Ф., Гуляева О.А., Савина А.А., Юдин В.Н., Бузлуков А.Л., Солодовникова З.А., Золотова Е.С., Спиридонова Т.С., Хайкина Е.Г., Стефанович С.Ю., Медведева Н.И., Бакланова Я.В., Денисова Т.А. Молибдаты и вольфраматы семейства аллюдита: кристаллохимия, состав и ионная подвижность // Журн. структур. химии. 2022. Т. 63. № 7. С. 975–1010. https://doi.org/10.26902/JSC_id96516
Heed B., Lunden A., Schroeder K. Sulphate-Based Solid Electrolytes: Properties and Applications // Electrochem. Acta. 1977. V. 22. P. 705–707.
Lunden A. Ion Transport in Lithium, Sodium, and Silver Sulphates // Solid State Ionics: New Developments / Eds. Chowdari B.V.R. et al. Singapure: World Scientific, 1996. P. 23–42.
Lunden A. Enhancement of Cation Mobility in Some Sulphate Phases Due to a Paddle Wheel Mechanism // Solid State Ionics. 1998. V. 28–30. P. 163–167. https://doi.org/10.1016/S0167-2738(98)80026-2
Eysel W., Hofer H.H., Keester K.L., Hahn Th. Crystal Chemistry and Structure of Na2SO4(I) and its Solid Solutions // Acta Crystallogr., Sect. B. 1985. V. 41. P. 5–11.
Bobade S.M., Gopalan P., Kulkarni A.R. Phase Transition in Na2SO4: All Five Polymorphic Transformations in DSC // Ionics. 2009. V. 15. P. 353–355.
Rasmussen S.E., Jorgensen J.-E., Lundtoft B. Structures and Phase Transitions of Na2SO4 // J. Appl. Crystallogr. 1996. V. 29. P. 42–47.
Kracek F.C., Ksanda C.J. The Polymorphism of Sodium Sulfate: X-ray Analysis // J. Phys. Chem. 1930. V. 34. P. 1741–1744.
Mehorta B.N. The Crystal Structure of Na2SO4 III // Z. Kristallogr. 1981. B. 155. S. 159–163.
Nord A.G. Refinement of the Crystal Structure of Thenardite Na2SO4(V) // Acta Chem. Scand. 1973. V. 27. P. 814–822.
Ahmad M.M. Ionic Conduction and Dielectric Relaxation in Polycrystalline Na2SO4 // Solid State Ionics. 2006. V. 177. P. 21–28. https://doi.org/10.1016/j.ssi.2005.10.007
Choi B.C. Ionic Conductivity of Na2SO4(I) Crystals // Solid State Ionics. 1992. V. 58. P. 133–138. https://doi.org/10.1016/0167-2738(92)90020-P
Choi B.C., Lockwood D.J. Ionic Conductivity and the Phase Transitions in Na2SO4 // Phys. Rev. B. 1989. V. 40. P. 4683–4689.
Careem M.A., Mellander B.E. Electrical Conductivity of Na2SO4(I) // Solid State Ionics. 1985. V. 15. P. 327–330. https://doi.org/10.1016/0167-2738(85)90136-5
Saito Y., Kobayashi K., Maruyama T. Phase Transition and Electrical Properties of Na2SO4 // Solid State Ionics. 1981. V. 3–4. P. 393–396. https://doi.org/10.1016/0167-2738(81)90119-3
Diosa J., Lara D.P., Vargas R. Origin of Dielectric Relaxations in Na2SO4 in the Intermediate Temperature Regime // J. Phys. Chem. Solids. 2013. V. 74. № 7. P. 1017–1020. https://doi.org/1016/j.jpcs.2013.02.024
Iqbal M.Z., Rafiuddin. Preparation, Characterization, Electrical Conductivity and Dielectric Studies of Na2SO4 and V2O3 Composite Solid Electrolytes // Measurement. 2016. V. 81. P. 102–112. https://doi.org/10.1016/j.measurement.2015.12.008
Sujatha B., Viswanatha R., Chethana B., Nagabhushana H., Narayana Reddy C. Electrical Conductivity and Dielectric Relaxation Studies on Mirowave Synthesized Na2SO4–NaPO3–MoO3 Glasses // Ionics. 2016. V. 24. № 4. P. 563–571. https://doi.org/10.1007/S11581-015-1580-2
Федоров П.П., Полховская Т.М., Соболев Б.П., Иванов-Щиц А.К., Сорокин Н.И. Выращивание монокристалла Na2SO4:Nd3+ и исследование его электропроводности // Кристаллография. 1983. Т. 28. № 3. С. 598–599.
Shahi K., Prakash G. Some Na2SO4-Based Fast Ion Conductors // Solid State Ionics 1986. V. 18. P. 544–548. https://doi.org/10.1016/0167-2738(86)90175-X
Gomathy S., Gopalan P., Kulkarn A.R. Effect of Homovalent Anion Doping on the Conductivity and Phase Transitions in Na2SO4 // J. Solid State Chem. 1999. V. 146. № 6. P. 6–12.
Leblanc M.D., Gundsharma U.M., Secco E.A. Electrical Conductivity of Superionic Solid Solutions of Na2SO4 with Mx(XO4)y [M = Na, K, Rb, Cd, Gd and X=W, Mo, S, Si; x = 1, 2, 4 and y = 1, 3] // Solid State Ionics. 1986. V. 20. P. 61–68. https://doi.org/10.1016/0167-2738(86)90035-4
Secco E.A., Usha M.G. Cation Conductivity in Mixed Sulfate-based Composition of Na2SO4, Ag2SO4, and Li2SO4 // Solid State Ionics. 1994. V. 68. P. 213–219. https://doi.org/10.1016/0167-2738(94)90178-3
Dharmasena G., Frech R. The Stabilization of Phase III and Phase I in Sodium Sulfate by Aliovalent Cation Substitution // J. Chem. Phys. 1993. V. 99. P. 8929–8935.
Rao N., Schoonman J., Sorensen O.T. Na2SO4-Based Solid Electrolytes for SOx Sensors // Solid State Ionics. 1992. V. 57. P. 159–168. https://doi.org/10.1016/0167-2738(92)90079-5
Леушина А.П., Мамонтова Е.В. Синтез, транспортные свойства твердого электролита (Na2SO4)1–x(Ga2(SO4)3)x и легирование галлием теллурида свинца // Известия вузов. Прикладная химия и биотехнология. 2017. Т. 7. № 2. С. 33–42.
Пройдакова В.Ю., Воронов В.В., Пыненков А.А., Кузнецов С.В., Зыкова М.П., Нищев К.Н., Федоров П.П. О полиморфизме сульфата натрия // Журн. неорган. химии. 2022. Т. 67. № 7. С. 916–924.
Fedorov P.P., Proydakova V.Yu., Kuznetsov S.V., Voronov V.V., Pynenkov A.A., Nishchev K.N. Phase Diagram of the Li2SO4–Na2SO4 System // J. Am. Ceram. Soc. 2020. V. 103. № 5. P. 3390–3400. https://doi.org/10.1111/jace.16996
Цветков В.Б., Пройдакова В.Ю., Кузнецов С.В., Субботин К.А., Лис Д.А., Япрынцев Д.А., Иванов В.К., Федоров П.П. Выращивание монокристаллов Yb:Na2SO4 и исследование их спектрально-люминесцентных характеристик // Квантовая электроника. 2019. Т. 49. № 11. С. 1008–1011. https://doi.org/10.1070/QEL17107
Федоров П.П., Пройдакова В.Ю., Кузнецов С.В., Воронов В.В. Фазовые равновесия в системах сульфата галлия с сульфатами лития и натрия // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1513–1518. https://doi.org/10.1134/S0036023617110067
Shannon R.D. Revised Effective Ionic Radii and Systematic Studies of Interatomic Distances in Halides and Chalcogenides // Acta Crystallogr., Sect. A. 1976. V. 32. № 5. P. 751–767.
Чижов С.М. Физико-химическое исследование двойных сульфатов натрия и редкоземельных элементов: Дис. … канд. хим. наук. М.: МГУ, 1980. 171 с.
Покровский А.Н. Синтез, структуры и свойства безводных двойных сульфатов лантанидов и элементов Ia группы: Дис. … докт. хим. наук. М.: МГУ, 1981. 327 с.
Филатов С.К. Высокотемпературная кристаллохимия. Теория, методы и результаты исследований. Л.: Недра, 1990. 288 с.
Федоров П.П., Соболев Б.П. Об условиях образования максимумов на кривых плавления твердых растворов в солевых системах // Журн. неорган. химии. 1979. Т. 24. № 4. С. 1038–1040.
Fedorov P.P., Sobolev B.P. Connection of the Fast Ionic Conductivity with the Maxima on the Melting Curves of the Heterovalent Solid Solutions // Abstracts. IV Int. Conf. on Solid State Ionics (July 4–8). Grenoble. 1983. P. 63.
Fedorov P.P. Heterovalent isomorphism and Solid Solutions with a Variable Number of Ions in the Unit Cell // Russ. J. Inorg. Chem. 2000. V. 45. Suppl. 3. P. S268–S291.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы