Журнал неорганической химии, 2019, T. 64, № 2, стр. 153-158
Термическая стабильность и продукты разложения гидроксиламинатных комплексов уранила
А. Г. Бейрахов 1, *, А. В. Ротов 1, Н. Н. Ефимов 1, Е. Г. Ильин 1, А. Е. Гехман 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: abey@igic.ras.ru
Поступила в редакцию 29.06.2018
После доработки 06.07.2018
Принята к публикации 02.07.2018
Аннотация
Исследовано термическое поведение гидроксиламинатных комплексов уранила [UO2(NH2O)2(H2O)2] ⋅ H2O, [UO2(NH2O)2], [UO2(i-C3H7NHO)2(H2O)2] ⋅ 2H2O. Разложение комплексов происходит при низкой температуре (<200°C) с образованием наноразмерных порошков диоксида урана. Состав твердых продуктов разложения для каждого комплекса определен методом рентгенофазового анализа. Для комплекса с изопропилгидроксиламином определен состав газообразных продуктов разложения. Предложены схемы окислительно-восстановительных реакций, которые могут проходить при термическом разложении комплексов. Высказано предположение о зависимости окислительно-восстановительных реакций от заместителей при атоме азота гидроксиламинатных лигандов.
ВВЕДЕНИЕ
Комплексные соединения переходных элементов применяются в качестве исходных веществ при получении оксидов металлов различного состава, которые используются в сенсорах, сверхпроводниках, солнечных батареях [1–3], являются катализаторами в различных химических процессах [4–9] или компонентами топлива в ядерной энергетике [10]. При этом большое значение приобретает разработка методов получения металлооксидных наноструктур [11–13]. Например, добавление незначительного количества (до 0.3 мас. %) наночастиц (10–80 нм) диоксида урана позволяет изготовить керамический материал для ТВЭЛ необычной микроструктуры с высокой плотностью и теплопроводностью [14]. Весьма перспективным методом получения исходных оксидов для данных материалов является термическое разложение координационных соединений, состав которых характеризуется наличием пары окислитель–восстановитель. Преимущества этого метода – низкая температура разложения комплекса из-за отсутствия побочных реакций, очень маленький размер получаемых частиц оксида и возможность влиять на процесс разложения, изменяя структуру лиганда.
В [15] было предложено использовать координационные соединения уранила с гидроксиламином (UO2(NH2O)2 ⋅ nH2O, где n = 0, 3) для получения диоксида урана. Малая растворимость исходных соединений в воде в сочетании с низкой температурой разложения делает их идеальными прекурсорами для получения керамических компонентов ТВЭЛ на основе оксидов урана.
Соединения урана(VI) c N-замещенными гидроксиламинами имеют сходный состав и строение [16]. Однако искажения в системе внутри- и межмолекулярных водородных связей, создаваемые заместителями при атоме азота лиганда, существенно влияют на их растворимость. В твердом виде нам удалось выделить только соединения с N-изопропил- и N,N-диметилгидроксиламинами, причем плохо растворяется в воде только изопропилгидроксиламинат уранила, термолиз которого не изучен.
В настоящей работе исследовано термическое поведение комплекса урана(VI) с N-изопропилгидроксиламином [UO2(i-C3H7NHO)2(Н2О)2] ⋅ 2H2O в сравнении с гидроксиламинатами уранила [UO2(NH2O)2(H2O)2] ⋅ H2O и [UO2(NH2O)2] с целью изучения механизма разложения и условий получения оксидов урана определенного качества.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Моногидрат диаквадигидроксиламината уранила [UO2(NH2O)2(H2O)2] ⋅H2O (I), дигидроксиламинат уранила [UO2(NH2O)2] (II) и дигидрат диаква-бис-N-изопропилгидроксиламината уранила [UO2(i-C3H7NHO)2(Н2О)2] ⋅ 2H2O (III) синтезировали по методике [16].
Термические свойства I–III исследовали на пирометре НТР 75, Pt/Pt–Rh-термопара, скорость нагрева образцов ~10 град/мин.
Термическое разложение комплексов I–III проводили следующим образом: 0.2–0.5 г исходных веществ помещали в кварцевую трубку с фильтром из минеральной ваты. Разложение вели при 500°C в токе аргона в течение 1.5–2 с. За это время твердый остаток в виде очень мелкой пыли черного цвета удалялся из зоны нагрева и задерживался фильтром.
Рентгенофазовый анализ проводили на дифрактометре Bruker D8 Advance (CuKα-излучение, Ni-фильтр, LYNXEYE детектор, геометрия на отражение) в ЦКП ИОНХ РАН.
Сканирующая электронная микроскопия поверхности образцов твердых остатков разложения была выполнена на микроскопе Carl Zeiss NVision 40. Ускоряющее напряжение 1 кВ.
Магнитные измерения проводили на установке PPMS-9 (Quantum Design, USA) в интервале температур 1.8–300 K в магнитном поле 5 Тл. Образцы смешивали с минеральным маслом для предотвращения ориентации кристаллов под воздействием магнитного поля и помещали в полиэтиленовые контейнеры. Парамагнитную восприимчивость определяли с учетом диамагнитного вклада, определенного из констант Паскаля, а также вклада полиэтиленового контейнера и минерального масла.
Летучие продукты реакции идентифицировали хромато-масс-спектрометрически по совпадению масс-спектров компонентов с библиотечными данными NIST 98. Использовали хромато-масс-спектрометр Automass 150 (Delsi-Nermag) с колонкой CPSil-5 (Chrompack) (0.15 мм × 25 м × 1.2 мкм, 50°C (5 мин)–10 град/мин–250°C, tинж = = 220°C, Ринж = 2.2 бар, деление потока 1 : 100). Ионизация электронным ударом 70 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
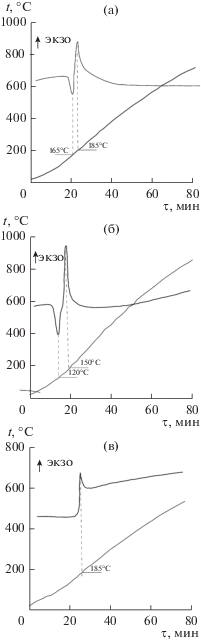
Термограммы [UO2(NH2O)2(H2O)2] ⋅ H2O (I) и [UO2(i-C3H7NHO)2(Н2О)2] ⋅ 2H2O (III) сходны, о чем свидетельствует наличие на них двух пиков. Эндопики при 165 (для I) и 120°C (для III) соответствуют удалению молекул кристаллизационной воды, а экзопики при 185 (для I) и 150°C (для III) – полному разложению комплексов (рис. 1а, 1б). Термолиз же безводного комплекса [UO2(NH2O)2] (II) практически одностадийный и сопровождается на термограмме только одним экзопиком при 185°C (рис. 1в).
Твердые остатки разложения комплексов I–III – порошки черного цвета, состоящие из очень мелких частиц, оформленных в пористые агрегаты (>100 нм, рис. 2). В случае комплекса III пористые агрегаты объединяются в более крупные образования (>10 мкм, рис. 3б).
Рис. 3.
Микрофотографии поверхности твердого остатка разложения комплексов II (а) и III (б) при низком разрешении.

На дифрактограммах твердых остатков термического разложения комплексов I–III присутствуют только линии, отвечающие диоксиду урана(IV) (рис. 4).
Рис. 4.
Дифрактограммы твердых остатков термического разложения в аргоне комплексов I (1), II (2), III (3) и эталонного образца UO2 (PDF 01-071-6416) (4).
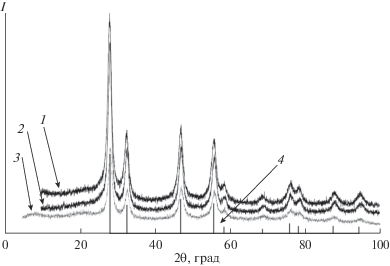
По данным РФА образцов, полученных термолизом I–III, размер кристаллитов стехиометрического диоксида урана, вычисленный по формуле Шеррера [17], составляет ~6 нм.
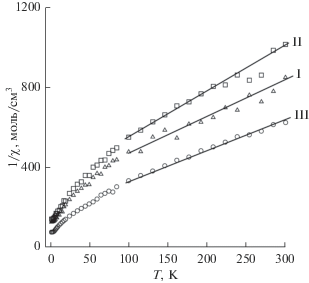
Магнитные моменты атомов урана(IV) продуктов разложения комплексов в диапазоне температур 100–300 K определяли аппроксимацией линейного участка зависимости 1/χ(Т) уравнением Кюри–Вейса χ = C/(T – ϑ), где С – константа Кюри, ϑ – асимптотическая температура Кюри (рис. 5). Эффективные магнитные моменты атомов U(IV) продуктов разложения соединений I и III – 2.31 и 2.32 М.Б. соответственно – ниже магнитных моментов атомов урана микрокристаллического диоксида урана – 3.12 М.Б. [18]. Магнитные свойства парамагнетиков зависят от многих факторов, включая размеры частиц образцов [19, 20], поэтому отличие магнитных свойств исследованных продуктов разложения комплексов I–III от свойств диоксида урана [18], возможно, связано с их дисперсностью.
Рис. 5.
Температурные зависимости обратной магнитной восприимчивости продуктов разложения соединений I–III.
В газообразных и жидких продуктах термолиза комплекса III в анаэробных условиях найдены изопропиламин, ацетоксим, вода, а также следовые количества изопропилового спирта и ацетона. Летучих металлоорганических соединений и продуктов глубокого окисления органического лиганда не обнаружено.
Состав продуктов разложения указывает на протекание при термолизе III двух реакций: первую можно схематически представить как двухэлектронное восстановление атома U(VI) комплекса до диоксида урана(IV) органическим лигандом, при этом изопропилгидроксиламиновый фрагмент окисляется до ацетоксима, вторая реакция представляет собой дипропорционирование двух изопропилгидроксиламинатных лигандов с образованием ацетоксима и изопропиламина:
Учитывая, что в бескислородной среде кроме UO2 других оксидов урана не обнаружено, а содержание продуктов глубокого окисления органического лиганда мало, термолиз комплекса III можно описать брутто-реакцией:
Особенностью термического разложения комплекса III является участие в окислительно-восстановительных процессах третичного атома углерода алкильного радикала лиганда. Аналогичные процессы протекают при разложении изопропилгидроксиламината Mo(IV) [MoO2(i-C3H7NHO)2] [21].
При термолизе гидроксиламинатных комплексов I и II также образуются стехиометрические порошки UO2 [15], дисперсность которых, по данным РФА, сопоставима с размерами частиц образца, полученного при разложении III (рис. 4). Но если при термолизе III восстановителем является третичный атом углерода алкильного радикала лиганда, то в случае I и II центральный атом восстанавливается атомом азота в степени окисления –1 гидроксиламинатных групп.
Таким образом, проведенное исследование показало, что термическое поведение комплексов I–III во многом сходно. Это связано в первую очередь с составом комплексов (U : лиганд = 1 : 2), температурой и характером разложения, а также со свойствами образующихся оксидов. Однако состав летучих продуктов термолиза, а в конечном итоге реакции, протекающие при разложении каждого конкретного гидроксиламинатного комплекса, зависят от строения заместителей при атоме азота лиганда.
БЛАГОДАРНОСТЬ
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований. Авторы выражают благодарность А.Б. Илюхину за помощь в интерпретации экспериментальных данных и А.Д. Япрынцеву за проведение растровой электронной микроскопии образцов твердых продуктов разложения.
Список литературы
Debecker D.P., Stoyanova M., Colbeau-Justin F. et al. // Angew. Chem. Int. Ed. 2012. V. 51. P. 2129.
Yu J., Ippolito S.J., Shafiei M. et al. // Appl. Phys. Lett. 2009. V. 94. P. 013504.
Brezesinski T., Wang J., Tolbert S.H. et al. // Nat. Mater. 2010. V. 9. P. 146.
Cattin L., Dahou F., Lare Y. et al. // J. Appl. Phys. 2009. V. 105. P. 034507.
Dong Y., Liao W., Suo Zh. // Fuel Process. Technol. 2015. V. 137. P. 164.
Venezia A.M., Liotta L.F., Pantaleo G. et al. // Cat. Sci. Series. 2013. V. 12. P. 813.
Amrute A.P., Krumeich F., Mondelli C. et al. // Chem. Sci. 2013. V. 4. P. 2209.
Ismagilov Z.R., Lazareva S.V. // Cat. Rev. 2013. V. 55. P. 135.
Taylor S.H. // Metal Oxide Catalysis / Eds. Jackson S.D., Hargreaves J.S.J. Weinheim, Germany: Wiley-VCH, 2009. V. 2. P. 539.
Громов Б.В. Введение в химическую технологию урана. М.: Атомиздат, 1978.
Comini E. // Sens. Actuators, B. 2013. V. 179. P. 3.
Ismagilov Z.R., Lazareva S.V., Shikina N.V. et al. // Mendeleev Commun. 2011. V. 21. P. 209.
Appel L., Leduc J., Webster C.L. et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 2209.
Курина И.С., Попов В.В., Румянцев В.Н. // Атомная энергия. 2006. Т. 101. № 5. С. 347.
Бейрахов А.Г., Ильин Е.Г., Куляко Ю.М. и др. Пат. РФ № 2415084 // Бюл. изобр. 2011. № 9. С. 15.
Бейрахов А.Г., Орлова И.М., Ильин Е.Г. и др. // Журн. неорган. химии. 2009. Т. 54. № 8. С. 1282. [Russ. J. Inorg. Chem. 2009. V. 54. № 8. P. 1217. doi 10.1134/S0036023609080087]
Advanced X-ray Techniques in Research and Industries / Ed. Singh A.K. // Ios Pr Inc. 2005. ISBN 1586035371
Hinatsu Y., Fujno T. // J. Solid State Chem. 1985. P. 195.
Ракитин Ю.В., Калинников В.Т. Современная магнетохимия. СПб.: Наука, 1994. 276 с.
Арбузова Т.И., Наумов С.В., Арбузов В.А. и др. // Физика твердого тела. 2003. № 2. С. 290.
Beirakhov A.G., Il’in E.G., Rotov A.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 6. P. 750. doi 10.1134/S0036023616060036 [Бейрахов А.Г., Ильин Е.Г., Ротов А.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 6. С. 787. doi 10.7868/S0044457X16060039]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



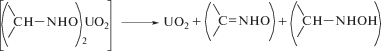
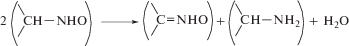 .
.
