Журнал неорганической химии, 2019, T. 64, № 2, стр. 172-180
Синтез, строение, оптические и электрохимические свойства комплексов иридия(III) с 2-арилфенантроимидазолами и дибензоилметаном
А. А. Билялова 1, 2, С. В. Татарин 2, П. Калле 1, 2, Д. Е. Смирнов 1, 2, И. С. Жаринова 1, 2, Ю. М. Киселев 2, В. Д. Долженко 2, С. И. Беззубов 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1/3, Россия
* E-mail: bezzubov@igic.ras.ru
Поступила в редакцию 14.03.2018
После доработки 06.07.2018
Принята к публикации 10.04.2018
Аннотация
Синтезирована серия новых циклометаллированных нейтральных комплексов иридия(III) [Ir(L)2(dbm)], где L – 2-арилфенантроимидазолы с различными электронодонорными/акцепторными заместителями, dbm – дибензоилметан. Состав и строение лигандов и комплексов изучены с помощью рентгеноструктурного анализа и масс-спектрометрии высокого разрешения. В спектрах поглощения комплексов наблюдается батохромный сдвиг максимумов поглощения при увеличении электронодонорных свойств лигандов. Все комплексы демонстрируют обратимое окислительно-восстановительное поведение, а редокс-потенциалы находятся в диапазоне 0.8–1.6 В. Совокупность полученных результатов позволяет рассматривать синтезированные соединения в качестве потенциальных фотосенсибилизаторов в солнечных элементах.
ВВЕДЕНИЕ
В последние два десятилетия циклометаллированные комплексы иридия(III) прочно удерживают первенство в качестве стабильных и ярко люминесцирующих компонентов органических светоизлучающих диодов [1–4]. Уникальные фотофизические свойства данных соединений обусловливают повышенный интерес к ним в свете их применения в качестве фотокатализаторов генерации водорода [5, 6] и фотосенсибилизаторов для солнечных элементов [7–11]. В последнем случае комплекс-краситель должен обладать заметным светопоглощением в видимой области спектра и обратимым редокс-поведением [12]. Синтез и всестороннее изучение комплексов Ir(III) с “антенными” 2-арилбензимидазольными лигандами, содержащими электронодонорные или акцепторные заместители, в совокупности с анализом литературных данных позволили нам выявить закономерности влияния природы “антенных” лигандов на электронное строение иридиевых комплексов, их оптические и электрохимические свойства [13–16]. Показано, что свойства комплексов можно варьировать в довольно широких пределах, однако существенный эффект, по всей вероятности, может быть достигнут лишь при замене традиционного “якорного” лиганда – 4,4'-дикарбокси-2,2'-бипиридина. В этой связи перспективными выглядят ароматические β-дикетоны [17], так как они выступают как отрицательно заряженные лиганды, что может приводить к заметному снижению окислительно-восстановительных потенциалов иридиевых комплексов. В настоящей работе для синтеза целевых соединений использовали 2-арилфенантроимидазолы как “антенные” лиганды (их сопряженная система существенно расширена по сравнению с 2-арилбензимидазолами, в результате можно ожидать повышения коэффициентов экстинкции в спектрах поглощения [18, 19]) и дибензоилметан в качестве модельного β-дикетона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
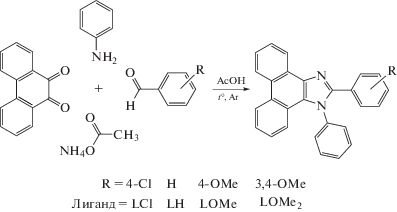
В работе использовали коммерчески доступные реагенты марки “ч. д. а.” или выше, которые дополнительно не очищали. Анилин перегоняли непосредственно перед синтезом лигандов. Дибензоилметан (dbm) перекристаллизовывали из бензола. Растворители перегоняли и высушивали согласно стандартным методикам. Лиганды 1,2-дифенилфенантроимидазол (LH), 1-фенил-2-(4-хлорфенил)фенантроимидазол (LCl), 1-фенил-2-(4-метоксифенил)фенантроимидазол (LOMe) и 1-фенил-2-(3,4-диметоксифенил)-фенантроимидазол (LOMe2) получали согласно [19] (схема 1 ).
Схема 1 . Синтез 2-арилфенантроимидазолов и расшифровка аббревиатур лигандов.
1,2-Дифенилфенантроимидазол (LH). Смесь фенантренхинона (0.515 г, 2.5 ммоль), бензальдегида (0.25 мл, 2.5 ммоль), ацетата аммония (0.783 г, 10.2 ммоль) и анилина (1 мл, 11.0 ммоль) в ледяной уксусной кислоте (15 мл) кипятили в атмосфере аргона в течение 3 ч. После охлаждения к раствору добавляли холодную воду. Выпавший темно-зеленый осадок отфильтровывали и промывали водой до нейтральной реакции. Остаток на фильтре растворяли в минимальном количестве ацетона и нагревали. К кипящему раствору добавляли небольшое количество воды, а образующийся белый осадок отфильтровывали и промывали смесью воды и этилового спирта (1 : 1 по объему). Очистку вещества проводили с помощью колоночной хроматографии (SiO2, CH2Cl2 : петролейный эфир (1 : 1 по объему) → CH2Cl2). Получили белый порошок. Выход 64%. Спектр ПМР, δ, м. д. (CDCl3): 7.19 (д, J = 7.8 Гц, 1Н), 7.25–7.35 (м, 4Н), 7.49–7.55 (м, 3Н), 7.57–7.69 (м, 6Н), 7.75 (т, J = 8.1 Гц, 1Н), 8.72 (д, J = 8.2 Гц, 1Н), 8.78 (д, J = 8.2 Гц, 1Н), 8.89 (д, J = 8.3 Гц, 1Н).
1-Фенил-2-(4-хлорфенил)фенантроимидазол (LCl). Смесь фенантренхинона (0.517 г, 2.5 ммоль), 4-хлорбензальдегида (0.337 г, 2.4 ммоль), ацетата аммония (0.783 г, 10.2 ммоль) и анилина (1 мл, 11.0 ммоль) в ледяной уксусной кислоте (15 мл) кипятили в атмосфере аргона в течение 3 ч. Образовавшийся красный раствор охлаждали и приливали к нему холодную воду. Выпавший темно-зеленый осадок отфильтровывали, промывали водой, а затем несколько раз проводили перекристаллизацию из смеси ацетон:вода (2 : 1 по объему). Получили белый порошок. Выход 70%. Спектр ПМР, δ, м. д. (CDCl3): 7.17 (д, J = 8.0 Гц, 1Н), 7.24–7.31 (м, 3Н), 7.48–7.55 (м, 5Н), 7.59–7.68 (м, 4Н), 7.75 (т, J = 8.2 Гц, 1Н), 8.71 (д, J = 8.0 Гц, 1Н), 8.77 (д, J = 8.2 Гц, 1Н), 8.85 (д, J = 8.1 Гц, 1Н).
1-Фенил-2-(4-метоксифенил)фенантроимидазол (LOMe). Смесь фенантренхинона (0.513 г, 2.5 ммоль), 3,4-диметоксибензальдегида (0.395 г, 2.4 ммоль), ацетата аммония (0.782 г, 10.1 ммоль) и анилина (1 мл, 11.0 ммоль) в ледяной уксусной кислоте (15 мл) кипятили в атмосфере аргона в течение 3 ч. Далее синтез проводили аналогично LCl. Получили бесцветные кристаллы. Выход 65%. Спектр ПМР, δ, м. д. (CDCl3): 3.80 (с, 3Н), 6.82 (д, J = 8.0 Гц, 1Н), 7.17 (м, 1Н), 7.25 (м, 1Н), 7.48–7.67 (м, 9Н), 7.74 (т, J = 8.0 Гц, 1Н), 8.71 (д, J = 8.3 Гц, 1Н), 8.77 (д, J = 8.2 Гц, 1Н), 8.87 (д, J = = 8.0 Гц, 1Н).
1-Фенил-2-(3,4-диметоксифенил)фенантроими-дазол (LOMe2). Смесь фенатренхинона (0.513 г, 2.5 ммоль), 3,4-диметоксибензальдегида (0.395 г, 2.4 ммоль), ацетата аммония (0.782 г, 10.1 ммоль) и анилина (1 мл, 11.0 ммоль) в ледяной уксусной кислоте (15 мл) кипятили в атмосфере аргона в течение 3 ч. Далее синтез проводили аналогично LCl. Получили белый порошок. Выход 75%. Спектр ПМР, δ, м.д. (CDCl3): 3.73 (с, 3Н), 3.88 (с, 3Н), 6.79 (д, J = 7.9 Гц, 1Н), 7.14 (м, 1Н), 7.16–7.21 (м, 2Н), 7.27 (м, 1Н), 7.48–7.57 (м, 3Н), 7.60–7.69 (м, 4Н), 7.75 (т, J = 7.8 Гц, 1Н), 8.72 (д, J = 8.3 Гц, 1Н), 8.78 (д, J = 8.4 Гц, 1Н), 8.89 (д, J = 8.3 Гц, 1Н).
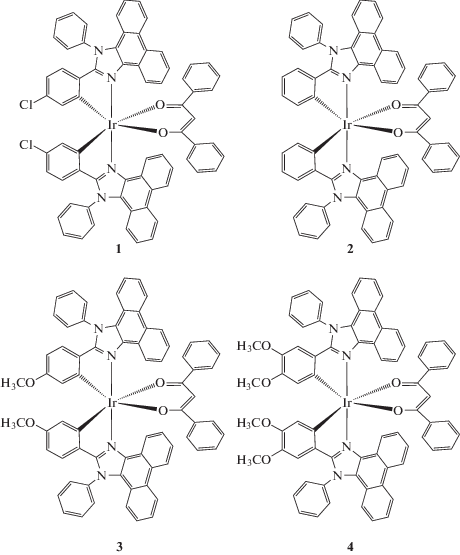
Комплексы [Ir(L)2(dbm)] (1–4) синтезировали в две стадии. На первой стадии IrCl3 · 3H2O (0.050 г, 0.14 ммоль) и избыток 2-арилфенантроимидазола L (0.50 ммоль) в смеси 2-этоксиэтанол : вода (3 : 1 по объему) кипятили в течение 24 ч в атмосфере аргона (t = 135°C). Затем к горячему раствору добавляли дистиллированную воду, осадок отфильтровывали, промывали H2O и этанолом, экстрагировали продукт дихлорметаном, растворитель упаривали и остаток высушивали в вакууме при 50°C в течение 12 ч. Полученные димерные комплексы [Ir(L)2Cl]2 не охарактеризовывали и использовали далее без дополнительной очистки.
На второй стадии 0.03 ммоль димера, 16.8 мг (0.075 ммоль) дибензоилметана и 33.1 мг (0.24 ммоль) K2CO3 смешивали в ацетонитриле (10 мл) и кипятили с обратным холодильником при перемешивании в атмосфере аргона в темноте 16 ч. Затем охлаждали, отфильтровывали выпавший осадок, который содержал целевой продукт, небольшой избыток дикетона и карбоната калия, а также примеси из исходного димера. Осадок промывали водой, растворяли в CH2Cl2 и хроматографировали (SiO2, элюент CH2Cl2 : петролейный эфир (1 : 1 по объему) → CH2Cl2). Первая фракция представляла собой избыток дикетона, вторая окрашенная фракция – продукт, остальные примеси задерживались на сорбенте. Продукт высушивали в вакууме в течение 10–12 ч.
Комплекс [Ir(LCl)2(dbm)] (1). Выход 34%. Спектр ПМР, δ, м.д. (dmso-d6): 6.06 c (1H), 6.18 м (4H), 6.59 м (2H), 6.90 м (2H), 7.11 м (2H), 7.21–7.33 м (8Н), 7.40 м (2Н), 7.52 м (2H), 7.66 д (4H, J = = 8.0 Гц), 7.73 д (2H, J = 7.9 Гц), 8.05 м (8H), 8.63 д (2H, J = 8.4 Гц), 8.78 д (2H, J = 8.3 Гц), 9.02 д (2H, J = 8.3 Гц). Масс-спектр высокого разрешения (ESI) m/z: [M]+ для C69H43IrN4O2Cl$_{2}^{ + }$ вычислено 1222.2393, найдено 1222.2397.
Комплекс [Ir(LH)2(dbm)] (2). Выход 54%. Спектр ПМР, δ, м. д. (dmso-d6): 5.98 c (1H), 6.34 д (2H, J = 7.7 Гц), 6.53 т (2H, J = 7.8 Гц), 6.58 т (2H, J = 7.6 Гц), 6.79 т (2H, J = 8.0 Гц), 7.06 м (4H), 7.24–7.31 м (8Н), 7.38 м (2Н), 7.52 д (2H, J = 8.0 Гц), 7.62 д (4H, J = 8.1 Гц), 7.69 д (2H, J = 7.9 Гц), 7.94–8.05 м (6H), 8.10 м (2H), 8.65 д (2H, J = 8.2 Гц), 8.80 д (2H, J = 8.1 Гц), 9.01 д (2H, J = 8.3 Гц). Масс-спектр высокого разрешения (ESI) m/z: [M]+ для C69H45IrN4O$_{2}^{ + }$ вычислено 1154.3194, найдено 1154.3201.
Комплекс [Ir(LOMe)2(dbm)] (3). Выход 47%. Спектр ПМР, δ, м. д. (dmso-d6): 3.31 c (6H), 6.01 c (1H), 6.26 м (4H), 6.49 м (2H), 6.82 т (2H, J = 7.9 Гц), 7.06 т (2H, J = 7.9 Гц), 7.22–7.32 м (8Н), 7.38 м (2Н), 7.51 т (2H, J = 8.0 Гц), 7.63 д (4H, J = 8.2 Гц), 7.69 д (2H, J = 7.9 Гц), 7.93–8.07 м (8H), 8.65 д (2H, J = 8.3 Гц), 8.80 д (2H, J = 8.4 Гц), 9.05 д (2H, J = = 8.2 Гц). Масс-спектр высокого разрешения (ESI) m/z: [M]+ для C71H49IrN4O$_{4}^{ + }$ вычислено 1214.3405, найдено 1214.3419.
Комплекс [Ir(LOMe2)2(dbm)] (4). Выход 20%. Спектр ПМР, δ, м. д. (dmso-d6): 3.02 c (6H), 3.19 c (6H), 5.93 c (2H), 6.05 c (1H), 6.51 с (2H), 6.86 т (2H, J = 7.8 Гц), 7.15 д (2H, J = 7.7 Гц), 7.31 т (6H, J = 7.7 Гц), 7.38 м (2Н), 7.43–7.53 м (4H), 7.66 д (4H, J = 7.9 Гц), 7.76 д (2H, J = 7.9 Гц), 7.95–8.03 м (8H), 8.66 д (2H, J = 8.3 Гц), 8.81 д (2H, J = 7.9 Гц), 9.10 д (2H, J = 8.0 Гц). Масс-спектр высокого разрешения (ESI) m/z: [M]+ для C73H54IrN4O$_{6}^{ + }$ вычислено 1275.3695, найдено 1275.3654.
Спектры ПМР регистрировали при 25°C на спектрометре Bruker Avance 400, химсдвиги приведены в миллионных долях (м. д.) относительно сигналов остатков растворителя. Масс-спектры высокого разрешения измеряли на масс-спектрометре Brukermicro TOF-QTM ESI-TOF (электроспрей-ионизация/времяпролетный детектор). Электронные спектры поглощения (ЭСП) растворов комплексов в диметилформамиде (ДМФА) измеряли на спектрофотометре СФ-2000 в кварцевых кюветах (1 см) при комнатной температуре. Циклические вольтамперограммы измеряли на полярографе Экотест-ВА в трехэлектродной ячейке с углеситалловым рабочим электродом, платиновым вспомогательным электродом и стандартным хлорсеребряным электродом сравнения. Комплексы растворяли в 0.01 M растворе (н-Bu4N)ClO4 в ДМФА, насыщенном аргоном. Измерения проводили при развертке потенциала 25 мВ/с в переменнотоковом режиме (амплитуда модуляции 30 мВ, частота 20 Гц), ферроцен использовали в качестве внешнего стандарта.
Монокристаллы лиганда LOMe получены при его перекристаллизации из спирта. Сбор экспериментальных данных проведен на дифрактометре Bruker SMART APEX II при температуре 100 K с использованием MoKα-излучения (λ = 0.71073 Å, графитовый монохроматор) в режиме ω-сканирования. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [20]. Кристаллы комплекса 3 получены медленным упариванием раствора комплекса в хлористом метилене. Рентгеноструктурный анализ (РСА) кристалла комплекса 3 выполнен на автоматическом дифрактометре Enraf-Nonius CAD4 при 150 K с использованием MoKα-излучения (λ = = 0.71073 Å, графитовый монохроматор). Экспериментальные данные скорректированы с учетом факторов Лоренца и поляризации. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [20]. Обе структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов [21]. Атомы водорода помещены в рассчитанные позиции и уточнены с использованием модели “наездника”. Кристаллографические данные, детали эксперимента и уточнения структур приведены в табл. 1. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных: CCDC 1828295 (лиганд LOMe) и 1828296 (комплекс 3) (http://www.ccdc.cam.ac.uk).
Таблица 1.
Кристаллографические данные для лиганда LOMe и комплекса 3
| Параметр | LOMe | 3 |
|---|---|---|
| Брутто-формула | C28H20N2O | C71H49IrN4O4 · CH2Cl2 |
| M | 400.46 | 1299.27 |
| Размер кристалла, мм | 0.08 × 0.15 × 0.50 | 0.35 × 0.35 × 0.40 |
| Сингония | Орторомбическая | Орторомбическая |
| Пр. гр. | Pbca | Pbca |
| a, Å | 8.5356(6) | 21.897(8) |
| b, Å | 18.8806(13) | 22.12(2) |
| c, Å | 24.9462(16) | 23.090(10) |
| V, Å3 | 4020.3(5) | 11 184(12) |
| Z | 8 | 8 |
| ρвыч, г/см3 | 1.323 | 1.543 |
| μ, мм–1 | 0.081 | 2.541 |
| F(000) | 1680 | 5232 |
| Область θ, град | 2.16–27.00 | 2.04‒25.00 |
| Интервалы индексов | ‒10 ≤ h ≤ 10 ‒24 ≤ k ≤ 24 ‒31 ≤ l ≤ 31 |
‒3 ≤ h ≤ 26 ‒3 ≤ k ≤ 26 ‒3 ≤ l ≤ 27 |
| Всего отражений | 27 214 | 15 449 |
| Независимых отражений | 4390 | 9813 |
| Полнота сбора данных до θ, % | 100 | 99.9 |
| Количество переменных | 281 | 748 |
| Добротность по F 2 | 1.038 | 0.973 |
| R1 по I > 2σ(I) | 0.0406 | 0.0351 |
| wR2 (все данные) | 0.0961 | 0.0744 |
| Δρmax / Δρmin, e/Å3 | 0.225/‒0.204 | 0.797/‒0.628 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Состав и строение лигандов и комплексов 1–4 установлены по данным ПМР и масс-спектроскопии высокого разрешения. Структурные формулы полученных в работе комплексов иридия(III) показаны на схеме 2 .
Схема 2 . Синтезированные комплексы иридия(III) (1–4).
В спектрах ПМР оба координированных циклометаллированных лиганда химически идентичны и дают один набор сигналов, на который накладываются сигналы депротонированного дибензоилметана. В масс-спектрах помимо сигналов комплексов 1–4 наблюдаются пики, соответствующие фрагментам [Ir(L)2]+, т.е. циклометаллированным остаткам комплексов, полученным, по всей вероятности, при отрыве дибензоилметана в ходе ионизации. Это свидетельствует о существенно большей прочности связей катиона Ir(III) с циклометаллированными, чем с дополнительными O- или N-донорными лигандами.
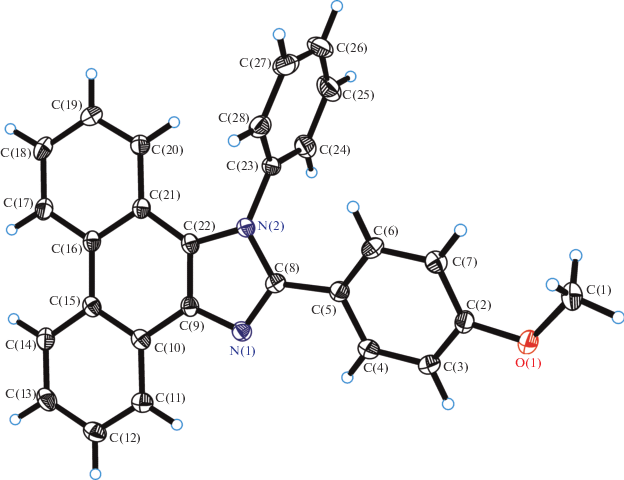
Строение одного из лигандов (LOMe), а также комплекса 3 удалось исследовать с помощью РСА. В молекуле лиганда (рис. 1) фенантреновый и имидазольный фрагменты находятся в одной плоскости, тогда как 4-метоксифенильное кольцо наклонено к этой плоскости на угол ~23°. В свою очередь, N-фенильное кольцо практически ортогонально (угол ~88°) фенантроимидазольной части молекулы.
Рис. 1.
Молекулярная структура 1-фенил-2-(4-метоксифенил)фенантроимидазола (LOMe). Эллипсоиды тепловых колебаний атомов приведены с 50%-ной вероятностью.
Координационное окружение атома иридия в комплексе 3 представляет собой сильно искаженный октаэдр (рис. 2, табл. 2), образованный атомами углерода и азота двух 2-арилфенантроимидазолов и двумя атомами кислорода депротонированного дибензоилметана. Длины связей Ir–O в данной структуре существенно короче (на ~0.04 Å) таковых в ранее исследованном нами комплексе Ir(III) с 1,2-дифенилбензимидазолом и dbm [22], тогда как расстояния Ir–N, наоборот, длиннее на ~0.03 Å. Кроме того, сами циклометаллированные лиганды не вполне плоские. Так, в одном из них фенантреновый фрагмент наклонен относительно имидазольного на ~7°, тогда как последний наклонен на ~6° по отношению к 4-метоксифенильному кольцу. Во втором координированном к иридию лиганде отклонения еще более заметны: сам фенантреновый фрагмент не является плоским, и два бензольных кольца образуют угол ~24°. В свою очередь, плоскость, наиболее близко соответствующая фенантреновому фрагменту (согласно МНК), образует угол ~12° с плоскостью имидазольного кольца, которое наклонено по отношению к 4-метоксифенильному кольцу на ~26°. В обоих координированных лигандах N-фенильные кольца, как и в свободных лигандах, практически ортогональны (угол ~85°) фенантроимидазольным частям молекул. В отличие от комплекса Ir(III) с 1,2-дифенилбензимидазолом, где молекула имеет симметрию C2, комплекс 3 из-за крайне сильных геометрических различий между химически идентичными циклометаллированными лигандами симметрией не обладает. В целом, рентгеноструктурное исследование показывает, что молекула комплекса 3 существует в весьма напряженном состоянии и, по всей вероятности, обладает меньшей устойчивостью, чем, например, аналогичные комплексы с производными 2-арилбензимидазолов. Поскольку циклометаллированные лиганды всех синтезированных комплексов содержат фенантреновый фрагмент, можно с высокой вероятностью утверждать, что молекулы этих соединений напряженные и имеют относительно низкую стабильность, что согласуется с данными масс-спектрометрии.
Рис. 2.
Молекулярная структура комплекса 3. Атомы водорода не показаны. Эллипсоиды тепловых колебаний атомов приведены с 50%-ной вероятностью.
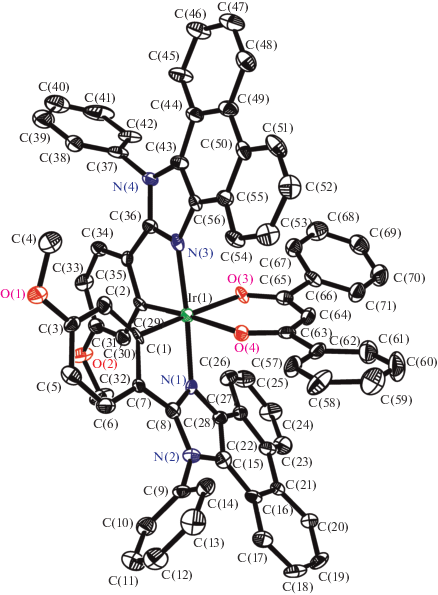
Таблица 2.
Основные межатомные расстояния и углы в структуре 3
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Ir(1)–C(1) | 1.989(5) | Ir(1)–N(3) | 2.091(5) |
| Ir(1)–C(29) | 1.982(5) | Ir(1)–O(3) | 2.138(4) |
| Ir(1)–N(1) | 2.061(4) | Ir(1)–O(4) | 2.129(4) |
| Угол | ω, град | Угол | ω, град |
| С(1)Ir(1)C(29) | 92.7(2) | N(1)Ir(1)O(3) | 99.99(17) |
| С(1)Ir(1)N(3) | 96.8(2) | N(1)Ir(1)O(4) | 78.05(15) |
| C(1)Ir(1)O(4) | 88.19(18) | N(1)Ir(1)N(3) | 176.02(16) |
| С(1)Ir(1)O(3) | 174.20(18) | N(3)Ir(1)O(3) | 83.49(16) |
| С(29)Ir(1)N(1) | 97.80(19) | N(3)Ir(1)O(4) | 104.24(16) |
| С(29)Ir(1)O(3) | 93.00(18) | С(29)Ir(1)O(4) | 175.52(17) |
Кристаллическая упаковка комплекса 3 образована за счет многочисленных слабых направленных взаимодействий типа C–H···π и π···π. Молекула растворителя дихлорметана удерживается в структуре посредством слабых C–H···π контактов с фенантреновыми фрагментами двух соседних молекул комплексов.
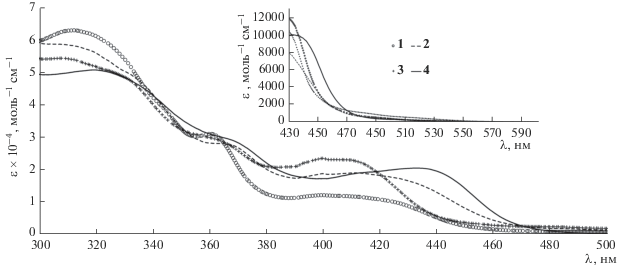
После высушивания комплексы демонстрировали заметную растворимость только в диметилформамиде или диметилсульфоксиде. ЭСП комплексов 1–4 измеряли в ДМФА при 25°C (рис. 3) и интерпретировали согласно квантово-химическим расчетам подобных комплексов [13, 14]. Электронные переходы π → π*, локализованные на циклометаллированных лигандах, обусловливают интенсивное поглощение комплексов в УФ-области (табл. 3). Полосы поглощения в диапазоне 350–450 нм вызваны переносом заряда с металла на лиганды и между фенантроимидазольными лигандами и дибензоилметаном (ε ≈ ≈ 10 000–30 000 л моль–1 см–1). Коэффициенты экстинкции выше таковых для соответствующих комплексов с 2-арилбензимидазолами. При этом полосы претерпевают существенный батохромный сдвиг при замене хлора на метоксигруппы в арильном фрагменте лигандов. Длинноволновые полосы поглощения (>450 нм) комплексов имеют молярные коэффициенты поглощения в интервале 300–2000 л моль–1 см–1, что может быть вызвано неплоской структурой лигандов и, как следствие, нарушением сопряжения и снижением вероятности отдельных электронных переходов с переносом заряда.
Таблица 3.
Оптические и редокс-характеристики комплексов 1–4
| Соединение | λпогл, нм (ε × 10–3, моль–1 см–1)а | Eox, Вб |
|---|---|---|
| 1 | 313 (64), 362 (31), 405 (12), 490 (0.6) | 1.24, 1.60 |
| 2 | 310 (59), 367 (28), 415 (19), 516 (0.3) | 1.05, 1.30 |
| 3 | 311 (54), 360 (30), 410 (23), 485 (1.0), 518 (0.5) | 1.03, 1.26 |
| 4 | 322 (51), 368 (29), 436 (21), 515 (0.3) | 0.82, 1.05в, 1.22, 1.34в |
а Измерены в диметилформамиде при 25°С. б Измерены в диметилформамиде, насыщенном аргоном, при 25°С. Электролит 0.01 М (н-Bu4N)ClO4, развертка потенциала 25 мВ/с, частота 10 Гц, амплитуда 30 мВ. Ферроцен использовали в качестве внешнего стандарта перед измерением комплексов. Значения потенциалов приведены относительно стандартного водородного электрода.
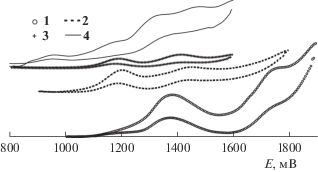
По данным переменнотоковой циклической вольтамперометрии (рис. 4, табл. 3), комплексы 1–3 демонстрируют обратимое редокс-поведение, причем для каждого из этих соединений наблюдаются две волны окисления-восстановления. Обе волны претерпевают заметное воздействие от варьирования заместителей в циклометаллированных лигандах. Так, введение хлора в арильный фрагмент лигандов приводит к существенному повышению редокс-потенциалов. В свою очередь, метоксигруппа в том же положении оказывает лишь незначительное влияние на потенциалы. По-видимому, играет роль то, что метоксигруппа – мезомерный донор и в то же время индуктивный акцептор. При нахождении метоксигруппы в мета-положении к металлированному атому углерода оба ее эффекта ослабевают и ее воздействие на молекулярные орбитали комплекса снижается. Напротив, введение второй метоксигруппы в комплекс 4 (в пара-положение к металлированному углероду) заметно снижает редокс-потенциал. Одновременно с этим для комплекса 4 появляются необратимые волны окисления-восстановления. Это объясняется тем, что увеличение электронодонорных свойств лигандов приводит к снижению доли d-орбиталей иридия в занятых граничных молекулярных орбиталях комплекса и электроны при окислении теряются необратимо окисляющимися лигандами. Мы неоднократно наблюдали подобное и интерпретировали на основании квантово-химических расчетов [13–15]. Наиболее важен тот факт, что замена 4,4'-дикарбокси-2,2'-бипиридина в комплексах иридия на дибензоилметан позволила значительно снизить редокс-потенциал комплексов.
ЗАКЛЮЧЕНИЕ
В работе получено четыре новых циклометаллированных комплекса Ir(III) c различными по природе 2-арилфенантроимидазолами. За счет расширения сопряженной системы лигандов удалось повысить коэффициенты экстинкции комплексов в диапазоне 350–450 нм, а применение дибензоилметана в качестве вспомогательного лиганда позволило снизить окислительно-восстановительный потенциал комплексов на ~0.5 В по сравнению с комплексами с лигандами на основе 2,2'-бипиридина. Полученные комплексы демонстрируют оптические и электрохимические характеристики, сравнимые с таковыми для эффективных фотосенсибилизаторов.
Список литературы
Lamansky S., Djurovich P., Murphy D. et al. // J. Am. Chem. Soc. 2001. V. 123. P. 4304. https://doi.org/ 10.1021/ja003693s.
Zysman-Colman E. (Ed.). Iridium(III) in Optoelectronic and Photonics Applications. Wiley, 2017. 736 p. https://doi.org/10.1002/9781119007166.
Бочкарев М.Н., Витухновский А.Г., Каткова М.А. Органические светоизлучающие диоды (OLED). Н.Н.: ДЕКОМ, 2011. 359 с.
Platonova E.O., Pushkarev A.P., Bochkarev L.N. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 8. P. 491. [ Платонова Е.О., Пушкарев А.П., Бочкарев Л.Н. и др. // Коорд. химия. 2017. Т. 43. № 8. С. 451. https://doi.org/10.1134/S107032841708005X.]
Mills I.N., Porras J.A., Bernhard S. // Acc. Chem. Res. 2018. V. 51. № 2. P. 352. https://doi.org/ 10.1021/acs.accounts.7b00375.
Lentz C., Schott O., Elias B. et al. // Inorg. Chem. 2017. V. 56. № 18. P. 10875. https://doi.org/10.1021/acs.inorgchem.7b00684.
Sinopoli A., Wood C.J., Gibson E.A., Elliott P.I.P. // Eur. J. Inorg. Chem. 2016. № 18. P. 2887. https://doi.org/ 10.1002/ejic.201600242.
Porras J.A., Mills I.N., Transue W.J., Bernhard S. // J. Am. Chem. Soc. 2016. V. 138. № 30. P. 9460. https://doi.org/10.1021/jacs.6b03246.
Sinopoli A., Wood C.J., Gibson E.A., Elliott P.I.P. // Inorg. Chim. Acta. 2017. № 457. P. 81. https://doi.org/ 10.1016/j.ica.2016.12.003.
Sinopoli A., Wood C.J., Gibson E.A., Elliott P.I.P. // Dyes and Pigments. 2017. № 140. P. 269. https://doi.org/10.1016/j.dyepig.2017.01.011.
Wright I.A. // Polyhedron. 2018. № 140. P. 84. https://doi.org/10.1016/j.poly.2017.11.050.
Hagfeldt A., Boschloo G., Sun L. et al. // Chem. Rev. 2010. V. 110. P. 6595. https://doi.org/10.1021/cr900356p.
Bezzubov S.I., Doljenko V.D., Troyanov S.I., Kiselev Yu.M. // Inorg. Chim. Acta. 2014. V. 415. P. 22. https://doi.org/ 10.1016/j.ica.2014.02.024.
Bezzubov S.I., Dolzhenko V.D., Kiselev Yu.M. // Russ. J. Inorg. Chem. 2014. V. 59. № 6. P. 571. [Беззубов С.И., Долженко В.Д., Киселев Ю.М. // Журн. неорган. химии. 2014. Т. 59. № 6. С. 749. https://doi.org/ 10.1134/S0036023614060047.]
Bezzubov S.I., Doljenko V.D., Kiselev Yu.M. et al. // Eur. J. Inorg. Chem. 2016. № 3. P. 347. https://doi.org/ 10.1002/ejic.201501068.
Bezzubov S.I., Bilyalova A.A., Dolzhenko V.D. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 8. P. 1085. [Беззубов С.И., Билялова А.А., Долженко В.Д. и др. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1087. https://doi.org/10.1134/S0036023617080046.]
Baranoff E., Grätzel M., Nazeeruddin M.K. et al. // Chem. Asian J. 2010. V. 5. P. 496. https://doi.org/ 10.1002/asia.200900429.
Francke R., Little R.D. // J. Am. Chem. Soc. 2014. V. 136. № 1. P. 427. https://doi.org/10.1021/ja410865z.
Yuan Y., Li D., Wang Y. et al. // New J. Chem. 2011. V. 35. P. 1534. https://doi.org/10.1039/C1NJ20072K.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen: Univ. of Göttingen. Germany, 1997.
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2008. V. 64. P. 112. https://doi.org/10.1107/S0108767307043930.
Bezzubov S.I., Doljenko V.D., Kiselev Yu.M. et al. // IUCrDATA. 2016. V. 1. № 12. P. x161915. https://doi.org/ 10.1107/S2414314616019155.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии