Журнал неорганической химии, 2019, T. 64, № 2, стр. 165-171
Биядерный комплекс ртути(I) с D-глюконовой кислотой
И. Г. Конкина 1, *, С. П. Иванов 1, Ю. И. Муринов 1
1 Уфимский институт химии УфИЦ РАН
450054 Уфа, пр-т Октября, 71, Россия
* E-mail: irkonk@anrb.ru
Поступила в редакцию 22.03.2018
После доработки 06.07.2018
Принята к публикации 23.05.2018
Аннотация
Для получения комплекса ртути с D-глюконовой кислотой (Gl) проведена реакция оксида ртути(II) с Gl в водном растворе при мольном соотношении реагентов 1 : 2. Выделенный продукт, по данным элементного анализа, молярной электропроводности, ИК-, электронной, ЯМР-спектроскопии и РСА, отвечает формуле Hg2(C6H11O7)2 (I) и содержит биядерный катион (Hg2)2+. Установлено, что комплекс имеет хелатное строение. Каждый атом ртути в I связан с двумя атомами кислорода: от атома углерода карбоксильной группы и от гидроксильной группы при втором атоме углерода в молекуле Gl. Два глюконат-иона в комплексе имеют разные конфигурации. Токсичность I в десятки раз меньше, чем токсичность исходного соединения ртути. Использование Gl при взаимодействии с оксидом двухвалентной ртути в водной среде привело к снижению токсичности соединения ртути вследствие ее восстановления до формально одновалентного состояния. Полученные результаты могут быть полезны для изучения процессов детоксикации ртути и применения Gl.
ВВЕДЕНИЕ
D-Глюконовая кислота, (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексановая (Gl), относится к группе альдоновых кислот и находит широкое применение в пищевой и фармацевтической промышленности, в производстве косметических продуктов, средств бытовой химии и строительных материалов [1–3].
Соли глюконовой кислоты – глюконаты калия [4], магния [5], кальция [6], железа [7, 8], цинка [9, 10] – применяются в виде препаратов в медицинской и ветеринарной практике при лечении недостаточности ионов соответствующих металлов и для активизации иммунитета.
D-глюконовая кислота, содержащая помимо карбоксильной группы пять атомов кислорода гидроксигрупп, способных образовывать донорно-акцепторные связи, уже десятки лет привлекает внимание ученых в качестве полидентатного лиганда, который может координировать ионы металлов при участии различных комбинаций донорных атомов [11–17].
Исследование комплексообразования тяжелых металлов, особенно ртути, весьма актуально с точки зрения более глубокого изучения их свойств в связи с прогрессирующим проникновением в среду обитания человека [18–21], представляющим опасность для живых организмов [22–26], а также с целью подбора реагентов для терапевтического хелатирования [27–30].
В литературе описаны варианты синтеза глюконата ртути(II), продукты которых отличались по составу в зависимости от условий получения. Так, в работе [31] комплекс иона двухвалентной ртути, связанный с двумя глюконат-ионами через атомы кислорода карбоксильной группы и гидроксигруппы при атоме С(2) с предполагаемым КЧ(Hg) = 4 (Hg(D-gluconate)2), был получен в водном растворе при взаимодействии карбоната ртути(II) с δ-глюконолактоном.
Авторы [32] из нитрата ртути(II) и глюконата натрия в щелочной среде получили соединение, отвечающее формуле Hg(D-gluconate)OH. Строение этих комплексов не было доказано.
Цель настоящей работы – синтез комплекса ртути с D-глюконовой кислотой при взаимодействии оксида ртути(II) с Gl, установление его состава и структуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали желтый оксид ртути(II) квалификации “ч. д. а.” и водный раствор глюконовой кислоты [11], концентрацию которого устанавливали титриметрическим методом.
Синтез проводили в водной среде при дробном добавлении к 10 мл раствора, содержащего 0.98 г глюконовой кислоты (5.0 ммоль), 0.54 г (2.5 ммоль) HgO. Реакционную смесь перемешивали в течение нескольких часов при температуре 50–55°С. Наблюдение за ходом реакции осуществляли методом ИК-спектроскопии по уменьшению интенсивности полосы поглощения валентных колебаний ν(СО) карбоксильной группы и увеличению интенсивности полос поглощения симметричных и асимметричных колебаний карбоксилат-аниона. По окончании реакции реакционную смесь фильтровали и маточный раствор оставляли для кристаллизации. Через 7–8 нед. чувствительные к свету и влажности бесцветные игольчатые кристаллы отделяли декантацией и хранили в защищенном от света эксикаторе в атмосфере cухого N2. Выход составил 0.82 г. Ниже приведены данные элементного анализа, на основании которых было высказано предположение об образовании соединения с катионом (Hg2)2+. В этом случае выход комплекса составил 85% от теоретического.
| С | Н | Hg | |
| Найдено, мас. %: | 17.95; | 3.12; | 49.75. |
| Для Hg2(C6H7O11)2 (I) | |||
| вычислено, мас. %: | 18.2; | 2.81; | 50.69. |
ИК-спектры соединения I регистрировали на Фурье-спектрометре IR Prestige-21 Shimadzu, отнесение полос проводили по данным [33].
Электронные спектры поглощения (ЭСП) регистрировали на спектрофотометре Specоrd-M40 (Германия) в кварцевых кюветах (l = 1.0 см) при 20°С. Спектры ЯМР 1H, 13C записывали на спектрометре Bruker Avance III (рабочая частота 500.1 и 125.7 МГц соответственно). Пробы готовили с концентрацией 30–40 мг для 13С и 10–15 мг для 1Н на 0.5 мл растворителя (D2О). Химические сдвиги приведены в м.д. для ЯМР 13С и 1Н относительно внутреннего стандарта тетраметилсилана (ТМС).
Электропроводность водных растворов I измеряли на приборе ОК-102/1 Radelkis. Величину молярной электропроводности оценивали при разведении 1000 л/моль по формуле:
РСА кристалла соединения I выполняли на четырехкружном автоматическом дифрактометре Siemens-PS при 100 K [34]. Структуру расшифровывали прямым методом и последовательными синтезами электронной плотности. Все расчеты проводили с помощью комплекса программ SHELXTL [35]. Полная кристаллографическая информация соединения I депонирована в Кембриджской базе рентгеноструктурных данных (CCDC 1830013).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезированный комплекс I исследован методами элементного анализа, ИК-, электронной и ЯМР-спектроскопии. Согласно данным элементного анализа, в результате реакции оксида ртути(II) с Gl образуется комплекс состава 1 : 1, предположительно, с катионом (Hg2)2+. На основании ИК-спектров (табл. 1) установлено, что Gl в комплексе I находится в форме анионов, так как наблюдается исчезновение полосы поглощения валентных колебаний связи C=O c максимумом поглощения при 1728 см–1 и появление полос поглощения, соответствующих валентным асимметричным (1622 см–1) и симметричным (1394 см–1) колебаниям ионизированных карбоксильных групп СОО–. Известно [36], что разность частот асимметричных и симметричных колебаний ионизированной карбоксильной группы (∆(νas – νs)) используется для определения способа ее координации с металлом. Если ее значение больше 200 см–1, как в данном случае, то карбоксильная группа координируется монодентатно (симметрия Cs).
Таблица 1.
Основные полосы поглощения в ИК-спектрах Gl и I (см–1)
| Отнесение полос | Gl | I |
|---|---|---|
| ν(О–Н) | 3234 с | 3272 с |
| ν(С=О[COOH]) | 1728 с | – |
| Смешанные валентно-деформационные колебания ν(С–О(H)), δ(О–CН), δ(C–CН) |
1144 ср
1210 ср 1232 ср 1245 пл |
1127 ср 1203 ср 1240 ср 1275 ср |
| Гибридные колебания ν(С–О(H)), ν(С–С) |
1102 с 1075 ср 1045 с |
1091 с 1053 с 1032 с |
| νas(СOO–) | – | 1622 с |
| νs(СOO–) | – | 1394 с |
В ЭСП комплекса I наблюдаются полосы поглощения с максимумами при 235 нм (2500 л моль–1 см–1) и 355 нм (650 л моль–1 см–1). Первая полоса, очевидно, относится к n → π* переходу в карбонильной группе, вторая – к n → σ* переходу в насыщенной части молекулы Gl [37]. Следует отметить, что в спектре глюконата кальция интенсивность первой полосы в несколько раз меньше, а вторая полоса практически не наблюдается, что может свидетельствовать об изменении электронной конфигурации лиганда при взаимодействии с ионами ртути.
В спектре ЯМР 13С (D2O) максимальное изменение химических сдвигов ядер соответствующих атомов углерода в спектре комплекса по сравнению со спектром реагента наблюдается для атомов С(1)(С(7)) и С(2)(С(8)) (в скобках указаны атомы углерода для второго глюконат-иона в молекуле I) и указывает на координацию через донорные атомы кислорода при этих атомах углерода (табл. 2).
Таблица 2.
Параметры спектров ЯМР 13С Gl и I (D2О, ТМС)
| Атом углерода | Химический сдвиг, δ, м.д. | Изменение химического сдвига, ∆δ, м.д. | |
|---|---|---|---|
| H–C6H11O7 | Hg2(C6H11O7)2 | ||
| 1, 7 | 174.54 | 177.26 | 2.72 |
| 2, 8 | 71.05 | 73.43 | 2.38 |
| 3, 9 | 70.31 | 71.64 | 0.64 |
| 4, 10 | 69.87 | 70.95 | 1.08 |
| 5, 11 | 69.43 | 70.81 | 1.38 |
| 6, 12 | 61.45 | 62.52 | 1.07 |
В спектре ЯМР 1Н I присутствуют сигналы, подтверждающие структуру координированного лиганда: 3.57–3.60 м (1H, Ha–С6; Ha–С12), 3.70–3.80 м. (3Н, Н–С4; H–С10, Н–С5; Н–С11, Нb-6; Нb-12), 4.04 д. д (1Н, Н–С3; С9), 4.34 д (1Н, Н–С2; Н–С8), 4.79 уш. с (6Н, 6ОН).
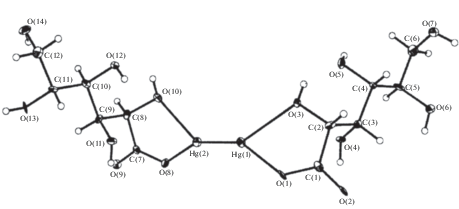
Результаты РСА подтвердили соотношение реагентов в комплексе I Hg : Gl = 1 : 1 и способ координации лиганда, а также показали, что при образовании соединения I произошло восстановление двухвалентной ртути до формально одновалентной и образовался биядерный комплекс состава Hg2(C6H7O11)2 (рис. 1 ). В литературе есть примеры восстановления ртути(II) при комплексообразовании: в реакции амидохлорида ртути(II) с производным фосфоновой кислоты [38], при взаимодействии нитрата ртути(II) с полидентатным 18-членным макроциклом [39]. В природной среде наблюдается восстановление ртути в присутствии минерала сидерита (FeCO3) [40]. Восстановление ртути(II) при взаимодействии с органическими кислотами было отмечено ранее лишь для муравьиной кислоты, которая фактически содержит альдегидную группу [41].
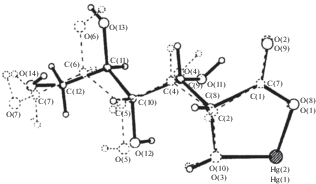
При расшифровке данных РСА было выяснено, что молекулы комплекса I образуют слои путем взаимодействия атомов ртути с атомами кислорода карбоксильных групп соседних молекул (рис. 2 ). Молекулы при этом имеют S-образное строение.
Рис. 2.
Координирование атомов ртути в слое. Расстояния Hg(1)...O(3') 2.831(5), Hg(2)...O(8') 2.701(5), Hg(2)...O(10') 2.887(5) Å.
Авторы [42] при изучении структуры глюконата калия показали возможность существования глюконат-ионов в двух конформациях – “straight-chain” и “bent-chain”.
Представляло интерес оценить конформацию глюконат-ионов в комплексе I. В табл. 3 и 4 для сравнения приведены длины связей и углы между связями для обоих лигандов комплекса I и двух описанных в [42] конформаций. Как показало проведенное сравнение, один из глюконат-ионов в молекуле I имеет усредненную конформацию между straight-chain и bent-chain, а конформация второго более соответствует bent-chain.
Таблица 3.
Сравнение длин связей в глюконат-ионах в составе комплекса I с двумя известными конформациями глюконат-ионов в KGl
| Связь | Длина связи, n (Å) | ∆, Å | |||
|---|---|---|---|---|---|
| в I (табл. 3) | в KGl [15] c конформациeй | ∆ = n(I) – – n(KGl straight) | ∆ = n(I) – – n(KGl bent) | ||
| straight-chain | bent-chain | ||||
| O(1)–C(1) O(2)–C(1) O(3)–C(2) O(4)–C(3) O(5)–C(4) O(6)–C(5) O(7)–C(6) |
1.289 1.226 1.432 1.431 1.436 1.411 1.436 |
1.259 1.246 1.420 1.413 1.429 1.414 1.418 |
1.263 1.232 1.409 1.426 1.418 1.429 1.414 |
0.030 0.020 0.012 0.008 0.007 0.003 0.018 |
0.026 0.006 0.023 0.005 0.023 0.018 0.022 |
| ∆cp = 0.012 | ∆cp = 0.018 | ||||
| O(8)–C(7) O(9)–C(7) O(10)–C(8) O(11)–C(9) O(12)–C(10) O(13)–C(11) O(14)–C(12) |
1.288 1.229 1.458 1.436 1.433 1.434 1.422 |
1.259 1.246 1.420 1.413 1.429 1.414 1.418 |
1.263 1.232 1.409 1.426 1.418 1.429 1.414 |
0.029 0.017 0.008 0.023 0.004 0.020 0.004 |
0.023 0.003 0.019 0.010 0.015 0.005 0.008 |
| ∆cp = 0.015 | ∆cp = 0.012 | ||||
| C(1)–C(2) C(2)–C(3) C(3)–C(4) C(4)–C(5) C(5)–C(6) |
1.511 1.540 1.520 1.532 1.502 |
1.534 1.533 1.537 1.531 1.519 |
1.535 1.531 1.529 1.540 1.518 |
0.023 0.007 0.017 0.002 0.017 |
0.024 0.009 0.009 0.008 0.016 |
| ∆cp = 0.013 | ∆cp = 0.013 | ||||
| C(7)–C(8) C(8)–C(9) C(9)–C(10) C(10)–C(11) C(11)–C(12) |
1.524 1.519 1.526 1.542 1.526 |
1.534 1.533 1.537 1.531 1.519 |
1.535 1.531 1.529 1.540 1.518 |
0.010 0.014 0.013 0.011 0.007 |
0.011 0.012 0.005 0.002 0.008 |
| ∆cp = 0.011 | ∆cp = 0.007 | ||||
Таблица 4.
Сравнение углов между связями в глюконат-ионах в составе комплекса I с соответствующими углами в двух известных конформациях глюконат-иона в KGl
| Угол | φ, град | |∆|φ, град | |||
|---|---|---|---|---|---|
| в I (табл. 3) |
в KGl [15] с конформацией | φ(I) – φ (KGl straight) | φ(I) – φ (KGl bent) | ||
| straight-chain | bent-chain | ||||
| C(1)C(2)C(3) C(4)C(3)C(2) C(3)C(4)C(5) C(6)C(5)C(4) |
111.0 113.1 111.4 112.1 |
112.0 110.8 114.8 110.4 |
108.2 114.5 115.7 115.0 |
2.0 2.8 3.4 2.7 |
1.8 1.4 4.3 2.9 |
| ∆cp = 2.7 | ∆cp = 2.6 | ||||
| C(7)C(8)C(9) C(8)C(9)C(10) C(9)C(10)C(11) C(10)C(11)C(12) |
108.3 114.2 111.3 113.1 |
112.0 110.8 114.8 110.4 |
108.2 114.5 115.7 115.0 |
3.7 3.4 3.5 3.7 |
0.1 0.3 4.4 1.9 |
| ∆cp = 3.6 | ∆cp = 1.7 | ||||
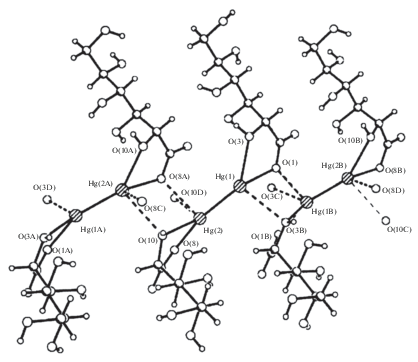
Различие в конформациях лигандов графически продемонстрировано на рис. 3 по данным РСА.
В соответствии с результатами РСА состав комплекса был косвенно подтвержден величиной молярной электропроводности. Если для глюконата кальция эта величина составляет 185 см2 Ом–1 моль–1, что находится в соответствии с характерными значениями для 1 : 2 электролитов в воде, то для I она составляет только 115 см2 Ом–1 моль–1, т.е. величину, характерную для 1 : 1 электролитов.
Известно, что соединения формально одновалентной ртути в значительной степени менее токсичны, чем соответствующие по составу соединения ртути(II). Если, например, сулема относится к классу высокоопасных соединений (ЛД50 37 мг/кг) [43], то малотоксичная каломель используется в медицинской практике для внутреннего употребления [44 ] .
ЛД50 I для мышей при внутрижелудочном способе введения составила 680 мг/кг, что соответствует (по классификации ГОСТ 12.1.007.76) классу умеренно опасных соединений. Комплекс I существенно отличается по токсичности от соединений ртути(II) с органическими кислотами (например, в паспорте безопасности ацетата ртути указано: смертельно опасный при вдыхании, проглатывании или попадании на кожу [45]) и почти в 40 раз менее токсичен, чем исходное соединение [46].
ЗАКЛЮЧЕНИЕ
Взаимодействие D-глюконовой кислоты с оксидом двухвалентной ртути в водной среде привело к снижению токсичности реакционной массы вследствие восстановления ртути до формально одновалентного состояния и к образованию биядерного комплекса Hg2(C6H7O11)2, в молекулах которого два координированных глюконат-иона имеют разные конфигурации.
БЛАГОДАРНОСТЬ
Выражаем глубокую признательность бывшему сотруднику ИНЭОС РАН З.А. Стариковой за выполнение РСА кристалла Hg2(C6H7O11)2, а также сотрудникам лаборатории новых лекарственных средств УфИХ УфИЦ РАН за определение острой токсичности соединения Hg2(C6H7O11)2. ИК- и ЯМР-спектры записаны на оборудовании ЦКП “Химия” УфИХ РАН.
Список литературы
Dinc S., Kara M., Oqut M. et al. // Hacettepe J. Biol. Chem. 2017. V. 45. № 4. P. 603. doi 10.15671/HJBC.2018.203
Pandey A., Negi S., Soccol C.R. Current Developments in Biotechnology and Bioengineering: Production, Isolation and Purification of Industrial Products. Elsevier, 2016. 886 p.
Ramachandran S., Fontanille P., Pandey A., Larroche C. // Food Technol. Biotechnol. 2006. V. 44. № 2. P. 185. doi 10.1007/s12010-008-8209-0
Wang Y., Nomura N., Zeniya M. et al. // J. Med. Dent. Sci. 2018. V. 65. № 1. P. 35. doi 10.11480/jmds.650105
TrivedI M.K., Dixit N., Panda P. et al. // J. Pharm. Analysis. 2017. V. 7. № 5. P. 332. doi 10.1016/ j.jpha.2017.03.006
Chen X., Yang Z., Metric P.X. // Am. J. Emerg. Med. 2017. V. 35. № 8. P. 1209e1. doi 10.1016/ j.ajem.2017.04.006
Rajakaruna R.M.P.I., Ariyarathna I.R., Karunaratne D.N. // Ceylon J. Sci. 2016. V. 45. № 2. P. 3. doi 10.4038/cjs.v45i2.7384
Lanzkowsky's Manual of Pediatric Hematology and Oncology / Eds. Lanzkowsky P., Lipton J., Fish J. Elsevier, 2016. 788 p.
Hemilä H., Chalker E. // Cochrane Database of Systematic Reviews. 2017. № 9. Art. № CD012808. doi 10.1002/14651858.CD012808
Elseweidy M.M., Ali A-M.A., Elabidine N.Z., Mursey M. // Biomed. Pharmacother. 2017. V. 95. P. 317. doi 10.1016/j.biopha.2017.08.081
Фиалков Я.А., Перышкина Н.Г. // Журн. неорган. химии. 1957. Т. 2. № 4. С. 749.
Angyal S.J. // Pure Appl. Chem. 1973. V. 35. P. 131. doi 10.1351/pac197335020131
Ashtan J.F., Pickering W.F. // Austral. J. Chem. 1976. V. 23. P. 1367. doi 10.1071/CH9701367
Amin M.A., Refat M.S. // Arabian J. Chem. 2013. V. 6. P. 165. doi 10.1016/j.arabjc.2010.09.030
Konkina I.G., Ivanov S.P., Murinov Yu.I. et al. // Pharm. Chem. J. 2002. V. 36. № 1. P. 18. [Конкина И.Г., Иванов С.П., Муринов Ю.И. и др. // Хим.-фарм. журн. 2002. № 1. С. 18. doi 10.1023/A:101579262].
Konkina I.G., Ivanov S.P., Murinov Yu.I. et al. // Russ. J. Inorg. Chem. 2003. V. 48. № 6. P. 880. [Конкина И.Г., Иванов С.П., Муринов Ю.И. и др. // Журн. неоргaн. химии. 2003. Т. 48. № 6. С. 979.]
Князева О.А., Уразаева С.И., Конкина И.Г. и др. // Казанский мед. журн. 2018. Т. 99. № 2. С. 255. doi 10.17816/KMJ2018-255
Gray J.E., Theodorakos P.M., Fey D. L., Krabbenhoft D.P. // Environ. Geochem. Health. 2015. V. 37. P. 35. doi 10.1007/s10653-014-9628-1
Wang S., Zhong T., Chen D., Zhang X. // Sustainability. 2016. № 8. P. 795. doi 10.3390/su8080795
Луковникова Л.В., Сидорин Г.И., Аликбаева Л.А., Галошина А.В. // Токсикологический вестник. 2017. № 5. С. 2.
Кипер Р.А. Экология и токсикология ртути. [Электронный ресурс]. http://chemister.ru/Toxicology/ecologija-i-toxicologija-rtuti.htm.
Genchi G., Sinicropi M.S., Carocci A. et al. // Int. J. Environ. Res. Public Health. 2017. V. 14. № 1. P. 74. doi 10.3390/ijerph14010074
Peregrina-Chávez A.G., Ramírez-Galindo M.del-R., Chávez-Martínez R. et al. // Int. J. Environ. Res. Public Health. 2018. V. 15. № 4. P. 657. doi 10.3390/ijerph15040657
Шинетова Л.Е., Бекеева С.А. // Вестн. Казахского национ. мед. ун-та. 2017. № 1. С. 370.
Hassan S.A., Abbott L.C. // J. Vet. Anat. 2017. V. 10. № 1. P. 49.
Morcillo P., Esteban M.A., Cuesta A. // AIMS Environmental Science. 2017. V. 4. № 3. P. 386. doi 10.3934/environsci.2017.3.386
Bjørklund G., Mutter J., Aaseth J. // Arch. Toxicol. 2017. V. 91. P. 3787. doi 10.1007/s00204-017-2100-0
Aaseth J., Skaug M.S., Cao Y., Andersen O. // J. Trace Elem. Med. Biol. 2015. V. 31. P. 260. doi 10.1016/j.jtemb.2014.10.001
Cao Y., Skaug M.A., Andersen O., Aaseth J. // J. Trace Elem. Med. Biol. 2015. V. 31. P. 188. doi 10.1016/j.jtemb.2014.04.010
Aaseth J., Ajsuvakova O.P., Skalny A.V. et al. // Coord. Chem. Rev. 2018. V. 358. № 1. P. 1. doi 10.1016/j.ccr.2017.12.011
Tajmir-Reahi H.A. // Can. J. Chem. 1989. V. 67. P. 651. doi 10.1139/v89-098
Escandar G.M., Salas Peregrin J.M., Sierra M.G. et al. // Polyhedron. 1996. V. 15. № 13. P. 2251. doi 10.1016/0277-5387(95)00478-5
Svehla G., Wilson C.L. Analytical Infrared Spectroscopy (Comprehensive Analytical Chemistry. 6) / Ed. Svehla G. Elsevier Science, 1976.
Konkina I.G., Starikova Z.A., Lybeckyi D.V., Murinov Yu.I. // Russ. J. Phys. Chem. 2005. V. 79. № 12. P. 1987. [Конкина И.Г., Старикова З.А., Любецкий Д.В., Муринов Ю.И. // Журн. физ. химии. 2005. Т. 79. № 11. С. 2227.]
Sheldrick G.M. SHELXTL 5.10. Bruker AXS. Madison. Wisconsin, USA, 1998.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений: Пер с англ. М.: Мир, 1991. 536 с.
Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии. М.: Изд-во Моск. ун-та, 1979. 240 с.
Somov N.V., Chausov F.F., Zakirova R.M. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 2. P. 109. [Сомов Н.В., Чаусов Ф.Ф. Закирова Р.М. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 20. doi 10.7868/SO132344X18010036]
Sujin Seo S., Ju H., Kim S. // Inorg. Chem. 2016. V. 55. № 21. P. 11028. doi 10.1021/acs.inorgchem.6b01583
Ha J., Zhao X., Yu R. et al. // Appl. Geochem. 2017. V. 78. P. 211. doi 10.1016/j.apgeochem.2016.12.017
Берль-Лунге Э. Химико-технические методы исследования. Т. 3. Ленинград: ОНТИ “Химтеорет”, 1941. 582 с.
Panagiotopoulos N.C., Hamilton W.C. // Acta Crystallogr. 1974. V. 30B. P. 1421. doi 10.1107/S0567740874005012
Яды, противоядия. Доза яда. Характеристики токсичности. [Электронный ресурс]. http://www.kristallikov.net/page53.html.
Машковский М.Д. Лекарственные средства: пособие для врачей. М.: Новая волна, 2011. 1216 с.
Паспорт безопасности в соответствии с Постановлением (ЕU) № 1907/2006. Ртуть(II) уксуснокислая. http://www.merckmillipore.com/…/web.
Material Safety Data Sheet Mercuric oxide MSDS. http://www.sciencelab.com/msds.php?msdsId=9924619.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии