Журнал неорганической химии, 2019, T. 64, № 3, стр. 229-236
Синтез композита TiO2/C пиролизом глицеролата титана
Г. С. Захарова 1, *, З. А. Фаттахова 1, 2, Е. И. Андрейков 3, И. С. Пузырев 2, 3
1 Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
3 Институт органического синтеза им. И.Я. Постовского УрО РАН
620137 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: volkov@ihim.uran.ru
Поступила в редакцию 23.05.2018
После доработки 15.08.2018
Принята к публикации 18.06.2018
Аннотация
Термическим разложением глицеролата титана в инертной атмосфере в интервале температур 360–850°С синтезирован композит на основе диоксида титана TiO2/C. Показано, что структура соединения определяется условиями термообработки Ti(C3H7O3)4. Формирование композита (до 400°C) происходит через образование рентгеноаморфной фазы с характерным для анатазной модификации ближним порядком. Повышение температуры пиролиза (400−600°C) приводит к образованию TiO2/C со структурой анатаза. Композит TiO2/C, полученный при температуре выше 600°C, представляет собой смесь анатаза с рутилом. Частицы TiO2/C имеют морфологию стержней диаметром 100–250 нм и длиной до 6.5 мкм, сохраняющуюся до 850°С. Наличие углерода в образцах подтверждено спектроскопией КР и термогравиметрией.
ВВЕДЕНИЕ
Диоксид титана относится к группе широко востребованных многофункциональных материалов, отличающихся высокой химической стабильностью, экологической безопасностью, технологической простотой получения и низкой стоимостью. В настоящее время диоксид титана используется в качестве фотокатализаторов [1], пигментов [2], функциональных компонентов газовых сенсоров [3] и солнечных батарей [4], анодных материалов литиевых источников тока [5]. Однако широкое практическое применение TiO2 сдерживается его низкой проводимостью. Поэтому многочисленные исследования направлены на ее повышение за счет допирования диоксида титана атомами серы [6], азота [7], иода [8], а также за счет формирования углеродсодержащего композита на его основе [9].
В последние годы синтез и использование композитного материала на основе диоксида титана с контролируемой кристаллической структурой и морфологией вызывают повышенный интерес. Известно множество способов получения композита TiO2/С. Один из распространенных методов синтеза – карбонизация углеродной компоненты титансодержащего соединения в токе инертного газа при температуре 700–900°С [10, 11]. Широко используется введение углерода при осаждении TiO2 из паровой фазы на подложку активированного углерода [12]. Снизить температуру синтеза композита позволяет карбонизация реакционной смеси, например глюкозы и гликолята титана, в гидротермальных условиях [13]. При этом формируется TiO2/С со структурой анатаза. Композит TiO2/С со смешанной структурой анатаза и рутила может быть получен окислением карбида титана при температуре 350–600°С [14].
Перспективным направлением в развитии подходов к синтезу композитных материалов является использование алкоксидов металлов в качестве твердофазных прекурсоров, являющихся одновременно источником углерода и оксида металла [15]. В результате термического разложения в токе инертного газа или воздуха алкоксиды металлов превращаются в композиты оксид металла/углерод или оксиды металлов соответственно. Морфологию, химический состав и кристаллическую структуру конечного продукта можно контролировать выбором подходящего алкоксида. Глицеролат титана, относящийся к классу алкоксидов, эффективно может быть использован в качестве прекурсора для получения наночастиц TiO2 стержневой морфологии [16, 17].
В настоящей работе пиролизом глицеролата титана синтезирован композит TiO2/C, исследована морфология, структура и последовательность фазовых превращений в процессе его синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных соединений использовали тетрабутоксититан марки “ч.” и свежеперегнанный под вакуумом глицерин марки “ч. д. а.”. Глицеролат титана (ГТ) синтезировали следующим образом: к 150 мл глицерина добавляли 15 мл тетрабутоксититана в атмосфере аргона, смесь перемешивали и выдерживали в течение 24 ч при 190°С. Затем реакционную массу охлаждали до комнатной температуры. Полученный осадок отделяли центрифугированием, промывали этанолом и сушили при 100°C до постоянной массы. Синтезированный ГТ использовали в качестве прекурсора для получения композита TiO2/C. Для этого ГТ прокаливали в токе азота со скоростью 5 град/мин при температуре 360–850°С в течение 0.5–2 ч. Продукты прокаливания обозначены как TiO2/C-X, где X – температура.
Рентгенофазовый анализ (РФА) образцов выполняли на дифрактометре Shimadzu XRD-7000 в CuKα-излучении (λ = 1.5418 Å). Исследование морфологии образцов проводили с помощью сканирующего электронного микроскопа (СЭМ) JEOL JSM 6390 LA, совмещенного с энергодисперсионным рентгеновским анализатором EX-23010BU. ИК-спектры образцов регистрировали на ИК-Фурье-спектрометре Spectrum One B (Perkin–Elmer). Удельную поверхность образцов измеряли на анализаторе удельной поверхности и пористости Gemini VII (Micromeritics). Термический анализ выполняли c использованием термоанализаторов TGA/DSC1 (Mettler Toledo) и STA 449 F3 Jupiter (Netzsch), совмещенного с квадрупольным масс-спектрометром QMS 403, при скорости нагрева 10 град/мин в атмосфере воздуха до 850°С (ТГ-ДСК-МС). Спектры комбинационного рассеяния (КР) регистрировали на КР-спектрометре U1000 (Renishaw) с помощью Не-Ne лазера мощностью 40 мВт и длиной волны 532 нм в диапазоне частот 50–4000 см–1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1а приведена дифрактограмма синтезированного ГТ, полностью совпадающая с литературными данными для глицеролата титана, индицированного в пр. гр. P2/c с параметрами элементарной ячейки: a = 8.37515, b = 15.33781, c = = 5.57151 Å, β = 99.824° [16]. Согласно СЭМ (рис. 1б), порошок ГТ состоит из слабо агломерированных частиц стержневой морфологии диаметром 20–40 нм и длиной 300–500 нм. Исследования текстурных свойств методом низкотемпературной адсорбции азота показали, что, согласно классификации IUPAC, изотермы адсорбции ГТ относятся к IV типу с петлей гистерезиса Н3 (рис. 1в). Петля гистерезиса наблюдается в области высоких относительных давлений (P/Po > 0.8), что указывает на наличие в ГТ мезопористой структуры. Удельная поверхность и преимущественный диаметр пор ГТ, вычисленные с использованием дифференциальной кривой десорбционной ветви полной изотермы сорбции азота, равны 47.6 м2/г и 38 нм соответственно.
Рис. 1.
Дифрактограмма и позиции брегговских пиков по данным [16] (а), СЭМ-изображение (б), изотермы сорбции и кривая распределения пор по размерам (в), кривые ТГ-ДСК-МС в токе азота порошка глицеролата титана (г).
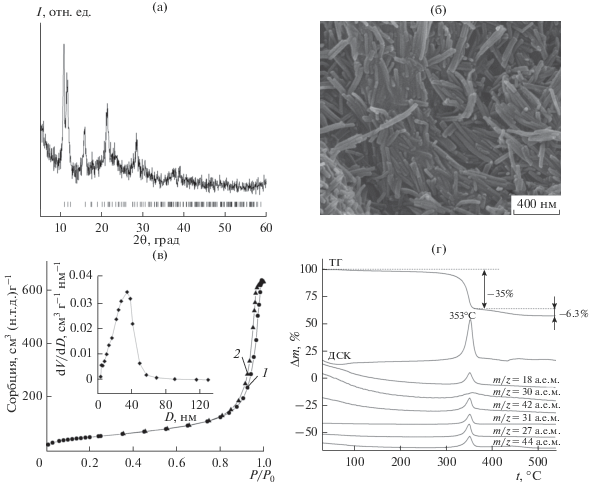
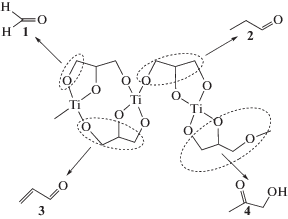
Термический анализ, совмещенный с масс-спектроскопией, позволил подробно исследовать термическое разложение ГТ. Термолиз ГТ в токе азота проходит в две стадии (рис. 1г). Согласно ТГ-кривой, в температурном интервале 300–355°С наблюдается значительная потеря массы (~35 мас. %), обусловленная термической деструкцией ГТ. Процесс сопровождается сильным экзотермическим эффектом с максимумом при 353°С, отвечающим образованию фазы TiO2. По данным масс-спектроскопии, при этом выделяется вода (m/z = 18 a.е.м.), диоксид углерода СО2 (m/z = = 44 a.e.м.), ацетальдегид С2Н4О (m/z = 42 a.e.м.), акролеин С3Н4О (m/z = 27 a.e.м.), формальдегид СН2О (m/z = 30 a.e.м.) и гидроксиацетон С3Н6О3 (m/z = 31 a.e.м.). Образование летучих органических продуктов пиролиза ГТ в инертной атмосфере может быть представлено в виде схемы (рис. 2). Помимо выделения углекислого газа и воды, происходит разрыв связей C–C углеродной цепи глицеринового остатка, приводящий к формированию углеродной составляющей композита и образованию низкомолекулярных органических соединений (формальдегида, ацетальдегида, акролеина, гидроксиацетона), осколочные ионы которых наблюдаются на соответствующих масс-спектрах.
Рис. 2.
Схема образования формальдегида (1), ацетальдегида (2), акролеина (3), гидроксиацетона (4) при термодеструкции глицеролата титана.
В интервале температур 355–570°С происходит дальнейшая убыль массы (~6.3 мас. %), связанная с выделением остатков органической составляющей ГТ в виде диоксида углерода. Интересно отметить, что деструкция органической составляющей ГТ продолжается и после образования диоксида титана. Поэтому можно предположить, что вторая стадия термического разложения ГТ обусловлена разложением кислородсодержащих группировок углеродной составляющей композита.
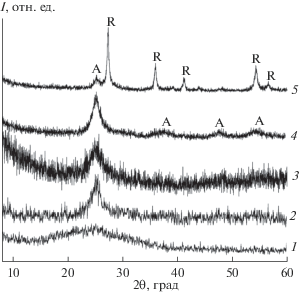
Формирование композита на основе кристаллической структуры диоксида титана в процессе термической обработки ГТ детально изучено методами РФА, КР- и ИК-спектроскопии. Согласно данным РФА (рис. 3), термическая обработка ГТ в токе азота при температуре ниже 400°С приводит к образованию рентгеноаморфной фазы. Очевидно, что выбранные условия термолиза являются недостаточными для формирования кристаллической структуры диоксида титана. Увеличение температуры термообработки до 600°С сопровождается формированием TiO2 со структурой анатаза. Дальнейшее повышение температуры пиролиза ГТ до 850°С приводит к появлению на рентгенограмме анатазной формы диоксида титана дополнительных пиков, относящихся к рутильной модификации TiO2.
Рис. 3.
Дифрактограммы композитов TiO2/C-360 (1), TiO2/C-400 (2), TiO2/C-500 (3), TiO2/C-600 (4), TiO2/C-850 (5). Анатазная и рутильная модификации диоксида титана отмечены символами A и R соответственно.
Установлено, что с ростом температуры пиролиза глицеролата титана размер кристаллитов TiO2/С увеличивается, о чем свидетельствуют увеличение интенсивностей и уменьшение полуширин дифракционных пиков. С использованием уравнения Шеррера (1) была проведена оценка среднего размера частиц композита TiO2/C, синтезированного при 500 и 600°С:
где D – размер частиц в направлении, перпендикулярном плоскости (hkl), от которой получен рефлекс, k – безразмерный коэффициент формы частиц (постоянная Шеррера), Δ(2θ) – полуширина угла дифракции, θ – брегговский угол, λ – длина волны рассеянного излучения. Расчет вели по интенсивному и хорошо разрешенному дифракционному пику (101). Средний размер частиц композита TiO2/C, полученного термолизом ГТ при 500 и 600°С, равен 4.1 и 4.8 нм соответственно.Согласно данным КР-спектроскопии (рис. 4), композит TiO2/C-X, полученный в интервале температур 300–600°С, демонстрирует активные моды, соответствующие анатазной модификации TiO2 [18]. Очевидно, что формирование структуры диоксида титана, которое начинается при 300°С, протекает через образование в интервале температур 300–400°С рентгеноаморфной фазы TiO2 с характерным для структуры анатаза ближним порядком. По мере увеличения температуры термолиза ГТ интенсивность пиков значительно возрастает, что указывает на повышение степени кристалличности TiO2. На колебательном спектре композита, синтезированного при 850°C, наблюдаются дополнительные пики при 255, 421 и 608 см–1, соответствующие рутильной модификации TiO2 [19]. Таким образом, данные спектроскопии КР, описывающие последовательность фазовых превращений ГТ в процессе получения композита TiO2/C-X, хорошо коррелируют с результатами РФА (рис. 3).
Рис. 4.
КР-спектры композитов TiO2/C-300 (1), TiO2/C-360 (2), TiO2/C-400 (3), TiO2/C-600 (4), TiO2/C-850 (5).
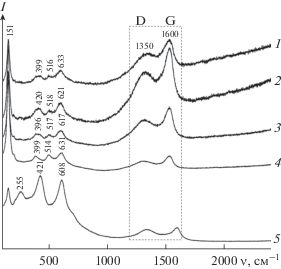
Наличие углерода в композите TiO2/C-X подтверждено методом спектроскопии КР (рис. 4). В высокочастотной области КР-спектра наблюдаются две достаточно интенсивные полосы при 1350 и 1600 см–1, характерные для мелкокристаллического графита [20]. Полоса при 1350 см–1 соответствует D-линии, которая обусловлена колебаниями связей С–С с sp3-типом гибридизации, а также ответственна за структурное разупорядочение и служит характеристикой степени дефектности углеродсодержащей компоненты. Значительное уширение данной линии, а также ее высокая интенсивность указывают на то, что углерод, присутствующий в данном образце, находится в аморфном состоянии. Положение и интенсивность G-линии при 1600 см–1 позволяют определить степень графитизации углерода. Данная линия превышает по интенсивности D-линию и соответствует колебаниям атомов углерода в sp2-гибридизации, что свидетельствует о наличии в образце не только аморфного, но и графитоподобного углерода [21].
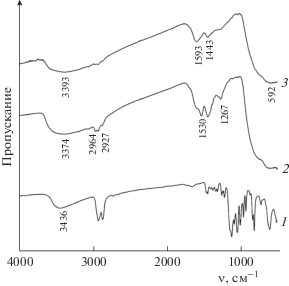
С помощью ИК-спектроскопии подробно изучено термическое разложение ГТ и превращение его в композит TiO2/C (рис. 5). В ИК-спектре ГТ сохраняются основные полосы поглощения связей С–О глицерина, первичных гидроксилов при 1043 см–1 и вторичного гидроксила при 1111 см–1. Колебания связей C–O–Ti описываются полосой поглощения при 1079 см–1 и плечом при 1131 см–1. Интенсивная полоса при 598 см–1 может быть отнесена к валентным колебаниям связи ν(С–O–Ti). Широкая интенсивная полоса с максимумом при 3436 см–1 характеризует валентные колебания ОН-групп. Поглощение при 2921 и 2863 см–1 соответствует колебаниям –СН2-связей. Деформационные колебания воды проявляются в виде очень слабой полосы при 1633 см–1. Колебания титан-кислородных связей проявляются в виде сильного поглощения в интервале 500–800 см−1, характерного для диоксида титана [22]. Термообработка ГТ при 300°С приводит к исчезновению основных полос поглощения связей С–О, характерных для структуры глицерина, и появлению сильного поглощения валентных колебаний ν(Ti–O) в октаэдре TiO6 в интервале 500–800 см–1. При этом остается слабое поглощение колебаний –СН2-связей, которое практически исчезает при дальнейшем повышении температуры прокаливания. Слабовыраженные полосы поглощения вблизи 1444 см–1 можно отнести к мостиковым колебаниям δ(≡Ti–O(H)–Ti≡)-связей [23]. Полоса поглощения в интервале 3100–3600 см–1, характеризующая валентные колебания гидроксильных групп, координированных титаном, после термообработки становится более интенсивной, наблюдается сдвиг ее максимума в низкочастотную область.
На рис. 6 представлены типичные СЭМ-изображения композита TiO2/C-X. Независимо от температуры синтеза частицы композита имеют стержневую морфологию, сохраняющуюся до 850°С. Наностержни TiO2/C-X склонны к агрегации с образованием ансамблей, напоминающих по форме хризантемы. Длина отдельных наностержней равна 3.5–6.5 мкм, диаметр – 100–250 нм, что значительно больше по сравнению с частицами ГТ, используемого в качестве прекурсора.
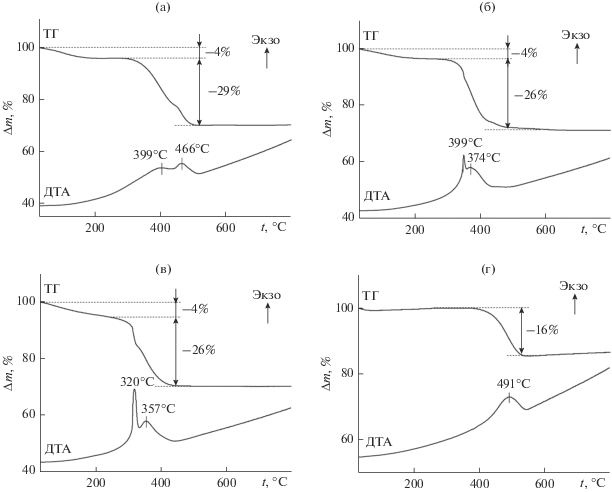
Термогравиметрический анализ (ТГА) в окислительной атмосфере был использован для определения содержания углерода в композите TiO2/C и получения информации о его реакционной способности (рис. 7). В интервале температур 20–220°С для композитов TiO2/C-X (X < 600) наблюдается незначительная убыль массы (~4%), которую можно отнести к потере адсорбционной воды. В интервале температур 220–500°С происходит убыль массы, связанная с окислением углерода, входящего в состав композита. При этом на кривых ДТА фиксируются два экзотермических эффекта, интенсивность и положение которых зависят от температуры получения композита. Очевидно, что в композите TiO2/C присутствует углерод с различной реакционной способностью к газообразному кислороду. Окисление углерода композита TiO2/C-850 протекает в одну стадию с экзоэффектом при температуре 491°С. По данным ТГА, в токе воздуха содержание углерода в композитах составляет 29, 26, 26 и 16 мас. % для TiO2/C-360, TiO2/C-480, TiO2/C-600 и TiO2/C-850 соответственно. Значительное снижение содержания углерода в образце TiO2/C-850 объясняется карботермическим восстановлением TiO2 за счет наиболее реакционноспособного углерода [24].
Рис. 7.
Кривые ТГ-ДТА композитов TiO2/C-360 (а), TiO2/C-480 (б), TiO2/C-600 (в), TiO2/C-850 (г) в атмосфере воздуха.
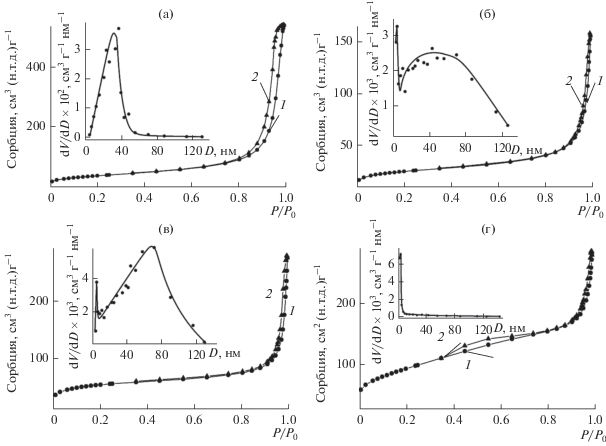
На рис. 8 представлены результаты исследования удельной поверхности и пористости композитного материала на основе диоксида титана, полученного термическим разложением ГТ при различных температурах. В соответствии с классификацией ИЮПАК [25], изотермы сорбции композита TiO2/C-X относятся к IV типу с петлей гистерезиса H3 (X = 360, 480, 600) и H4 (X = 850). Удельная поверхность композитов TiO2/C-360, TiO2/C-480, TiO2/C-600 и TiO2/C-850 равна 30.2, 33.4, 78.5 и 305.6 м2/г соответственно. Резкое увеличение площади удельной поверхности композита TiO2/C-850, по-видимому, связано с образованием дефектов в структуре композитного материала при карботермическом восстановлении TiO2. Распределение пор по размерам композитов TiO2/C-X происходит в широком диапазоне (рис. 8, вставки). Для TiO2/C-360 характерно мономодальное распределение пор с преимущественным размером ~35 нм. Бимодальное распределение пор наблюдается для композитов TiO2/C-480 и TiO2/C-600. Наряду с макропорами (преимущественный размер пор ~70 нм) в указанных композитах присутствуют мезопоры с преимущественным диаметром 3–5 нм. В композите TiO2/C-850 преобладают мезопоры диаметром ~4 нм. Существование неоднородной пористой структуры композита TiO2/C-X, возможно, связано с микрорастрескиванием образца при нагревании, которое может происходить на границе раздела двух фаз, обладающих разным химическим составом и, следовательно, коэффициентом термического расширения.
ЗАКЛЮЧЕНИЕ
Рис. 8.
Изотермы сорбции (1 – адсорбция, 2 – десорбция) и кривые распределения пор по размерам (вставки) композита TiO2/C-360 (а), TiO2/C-480 (б), TiO2/C-600 (в), TiO2/C-850 (г).
Таким образом, установлено, что термическим разложением в инертной атмосфере ГТ как твердофазного прекурсора может быть получен композитный материал TiO2/C. Формирование композита протекает через образование рентгеноаморфной фазы с последующей ее кристаллизацией в анатазной модификации. Повышение температуры синтеза до 850°С приводит к образованию в композите примеси рутила в смеси с анатазом как основной фазы. Частицы TiO2/C имеют стержневую морфологию, которая сохраняется до температуры 850°С. Содержание углерода в образцах зависит от температуры пиролиза ГТ и составляет 16–29 мас. %.
Список литературы
Dagan G., Tomkiewicz M. // J. Phys. Chem. 1993. V. 97. № 49. P. 12651.
Hsu W.P., Yu R., Matijevic E. // J. Colloid Interface Sci. 1993. V. 156. № 1. P. 56.
Abdullah M., Kamarudin S.K. // Renewable Sustainable Energy Rev. 2017. V. 76. P. 212.
Gratzel M.J. // J. Photochem. Photobiol. C. 2003. V. 4. № 2. P. 145.
Yaroslavtsev A.B., Kulova T.L., Skundin A.M. // J. Russ. Chem. Rev. 2015. V. 84. № 8. P. 826.
Park C-S., Bangi K.H., Park H-H. // Mater. Lett. 2013. V. 106. P. 401.
Peng F., Cai L., Huang L. et al. // J. Phys. Solids. 2008. V. 69. № 7. P. 1657.
Wang W., Shi Q., Wang Y. et al. // Appl. Surf. Sci. 2011. V. 257. № 8. P. 3688.
Leary R., Westwood A. // Carbon. 2011. V. 49. № 3. P. 741.
Tryba B., Morawski A.W., Inagaki M. // Appl. Catal. B. 2003. V. 46. № 1. P. 203.
Kang K-Y., Lee Y-G., Kim S. et al. // Mater. Chem. Phys. 2012. V. 137. № 1. P. 169.
Puma G.L., Bono A., Krishnaiah D., Collin J.G. // J. Hazard. Mater. 2008. V. 157. № 2–3. P. 209.
Cheng G., Stadler F.J. // J. Colloid Interface Sci. 2015. V. 438. P. 169.
Zhang L., Tse M.S., Tan O.K. et al. // J. Mater. Chem. A. 2013. V. 1. № 14. P. 4497.
Zhao J., Liu Y., Fan M. // Inorg. Chem. Front. 2015. V. 2. № 3. P. 198.
Das J., Freitas F.S., Evans I.R. et al. // J. Mater. Chem. 2010. V. 20. № 21. P. 4425.
Захарова Г.С., Андрейков Е.И., Осипова В.А. и др. // Неорган. материалы. 2013. Т. 49. № 11. С. 1127. [Zakharova G.S., Andreikov E.I., Osipova V.A. et al. // J. Inorg. Mater. 2013. V. 49. № 11. Р. 1127. doi 10.1134/S0020168513100154]
Taziwa Z., Meyer E.L., Chinyama K.G. // J. Mater. Sci. 2012. V. 47. № 3. P. 1531.
Balachandran U., Eror N.G. // Solid State Chem. 1982. V. 42. № 3. P. 276.
Bai X., Li T., Qi Y-X. et al. // Electrochim. Acta. 2015. V. 169. P. 241.
Ferrari A.C., Robetson J. // Phys. Rev. B. 2001. V. 64. № 7. P. 075414.
Viana B.C., Ferreira O.P., Filho A.G. et al. // Vibrational Spectroscopy. 2011. V. 55. № 2. P. 183.
Кострикин А.В., Кузнецова Р.В., Кузнецова О.В. и др. // Вопросы современной науки и практики. 2007. Т. 8. № 2. С. 181.
Zhang H., Li F., Jia Q. // J. Sol-Gel Sci. Technol. 2008. V. 46. № 2. P. 217.
Rouquerol J., Avnir D., Fairbridge C.W. et al. // Pure Appl. Chem. 1994. V. 66. № 8. P. 1739.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии