Журнал неорганической химии, 2019, T. 64, № 4, стр. 379-388
Теоретическое моделирование структуры и стабильности комплексов додекааланового аниона Al12$H_{{12}}^{{2-}}$ с молекулами борана, алана, диборана и диалана
1 Институт проблем химической физики РАН
142432 Московской обл., Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: charkin@icp.ac.ru
Поступила в редакцию 02.08.2018
После доработки 11.09.2018
Принята к публикации 17.09.2018
Аннотация
В рамках метода функционала плотности выполнены расчеты структурных, энергетических и спектроскопических характеристик комплексных анионов состава ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12}}^{{}}({\text{L}})_{n}^{{}}$ с икосаэдрическим дианионом ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12}}^{{2 - }},$ последовательно “сольватированным” молекулами борана, алана, диборана и диалана (L = BH3, AlH3, B2H6 и Al2H6). Показано, что при вхождении в координационную сферу дианиона молекулы ВН3 и В2Н6 трансформируются и координируются как бидентатные лиганды ВН4 и В2Н7, а их алановые аналоги − как монодентатные группы AlH4 и Al2H7 с образованием тетрагидроборанатных и тетрагидроаланатных комплексов типа ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12 - n}}^{{}}\left( {{\text{B}}{{{\text{H}}}_{4}}} \right)_{n}^{{2 - }}$ и ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12 - n}}^{{}}\left( {{\text{Al}}{{{\text{H}}}_{4}}} \right)_{n}^{{2 - }}$ соответственно. Гидроборанатные комплексы энергетически стабильны к распаду с отщеплением молекулы диборана в пределах ~15−17 ккал/моль во всем интервале изменения n = 1−12. Их аланатные аналоги ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12 - n}}^{{}}\left( {{\text{Al}}{{{\text{H}}}_{4}}} \right)_{n}^{{2 - }}$ более слабо связаны, но первые члены серии (с n = 2−4) также характеризуются ощутимой стабильностью к отщеплению молекулы диалана в пределах ~7−10 ккал/моль. Предсказана принципиальная возможность существования наиболее стабильных из рассматриваемых комплексов в изолированном состоянии или в условиях матричной изоляции. Результаты могут быть полезны при квантово-химическом моделировании структуры и стабильности наноразмерных алюмоборогидридных соединений с высоким содержанием водорода.
ВВЕДЕНИЕ
Гидриды алюминия и их производные, играющие важную роль в производстве высокоэффективного топлива, в качестве восстанавливающих агентов, накопителей водорода, источников водорода для топливных элементов и т.д., являются предметом интенсивных исследований последние 60 лет (см., например, обзоры [1–5] и библиографию в них). В отличие от многочисленных гидридов бора, исследования гидридов алюминия долгое время ограничивались узким кругом соединений типа алана AlH3, диалана Al2H6 и аланатов щелочных металлов LAlH4. Благодаря развитию методов молекулярных пучков, масс-спектрометрии, фотоэлектронной спектроскопии (ФЭС), колебательной спектроскопии в инертных матрицах в сочетании с использованием квантово-химических расчетных методов были обнаружены десятки новых изолированных кластеров и молекулярных ионов гидридов алюминия различного состава и рассчитаны их равновесные структурные, энергетические и колебательные характеристики.
Особенно информативными оказались результаты ФЭС-исследований отрицательных ионов в сочетании с расчетами в рамках метода функционала плотности (DFT) [6–13]. В работе [6] c помощью DFT-расчетов сравнивали структуры и относительную стабильность линейных и циклических форм серии полимерных кластеров (AlH3)n (n = 3−7). В работах [7, 8] проведены ФЭС-исследования ионов серии Aln${\text{H}}_{m}^{ - }$ (4 < n < 8, 0 < m < 10). Рассчитанные тетраэдрическая (Td) структура нейтральной молекулы Al4H4 и возмущенно-тетраэдрическая (D2d) структура Al4H6 интерпретированы в рамках теории полиэдральных скелетных электронных пар. Авторы [9] установили, что ион Al4${\text{H}}_{7}^{ - }$ обладает высокой стабильностью, и предположили, что его соединения с щелочными металлами типа LAl4H7 могут представлять интерес в качестве суператомов или строительных блоков для кластерной сборки более сложных гидридов алюминия. В работе [10] исследованы ионы Aln${\text{H}}_{{3n + 1}}^{ - }$ (n = 5–8) с цепочечной и (или) бициклической структурой и обнаружен ион Al4${\text{H}}_{{14}}^{ - }$ с высоким содержанием водорода. На основании DFT-расчетов олигомеров (AlH3)n в интервале n = 1−8 авторы [11] нашли, что при увеличении n > 4 у этих систем предпочтительными становятся структуры с шестикоординационными атомами алюминия. Кластер Al6H18, обладающий повышенной стабильностью и напоминающий элементарную ячейку кристаллической модификации гидрида γ-AlH3, был интерпретирован в [11] как “baby-crystal”. В работе [12] измерены ФЭС простых гидридных ионов Al${\text{H}}_{n}^{ - }$ (n = 2, 3), Al2${\text{H}}_{6}^{ - },$ Al3${\text{H}}_{9}^{ - }$ и Al4${\text{H}}_{{12}}^{ - }$ и оценены значения вертикального сродства к электрону их нейтральных аналогов. В работе [13] исследованы ФЭС ионов смешанных бороалюмогидридов BxAly${\text{H}}_{z}^{ - }$ и проанализированы изменения структуры при замещении алюминия бором. Не вызывает сомнений, что дальнейшие исследования в этой области позволят существенно расширить наши представления о разнообразии состава, структуры и стабильности молекул, радикалов и ионов алюмогидридов и их производных в газовой фазе.
Не менее интересны исследования полиатомных металлических кластеров Mn и их “покрытых” производных MnRm, в которых внутренний металлический каркас Mn выполняет роль суператома, а его поверхность покрыта объемными лигандами R типа N(SiMe3)2, Si(t-Bu)3, Si(SiMe3)3, C5H5 и др., защищающими кластеры от “слипания” и препятствующими их ассоциации в более крупные частицы. Покрытые кластеры могут служить строительными блоками для кластерной сборки более сложных систем с различными полезными свойствами, зависящими от размеров каркаса Мn и характера объемных лигандов R [14, 15]. В работах [16, 17] были синтезированы и исследованы структуры покрытых алюминиевых кластеров AlnRm (n = 7, 12, 14, 18, 20, 69, 77; R = N(SiMe3)2) и, в частности, показано, что кластерам стехиометрического cостава Al22X20 · 12L (X = Cl и Br; L = = THP – тетрагидрофуран) отвечает равновесная структура Al12(AlX2THP)10 c правильным полым икосаэдром (суператомом) Al12, окруженным десятью замещенными алановыми группами AlX2THP.
Для полиядерных наноразмерных и субнаноразмерных алюмогидридов, где экспериментальные подходы на молекулярном уровне сталкиваются с трудностями, аналогичная информация получена в основном с помощью квантово-химических расчетов. Ранее в [18–20] были выполнены DFT-расчеты структурных, энергетических и спектроскопических характеристик дианиона Al12${\text{H}}_{{12}}^{{2 - }},$ его нейтральных солей L2Al12H12 с щелочными металлами L во внешней и внутренней сферах икосаэдрического каркаса и эндоэдральных дианионов Ng@Al12${\text{H}}_{{12}}^{{2 - }}$ с атомами инертных газов в центре каркаса.
В настоящем сообщении аналогичные DFT-расчеты выполнены для двух серий ранее не изучавшихся комплексных анионов формального состава ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12}}^{{2 - }}$(BH3)n и ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12}}^{{2 - }}$(AlH3)n с анионом ${\text{A}}{{{\text{l}}}_{{12}}}{\text{H}}_{{12}}^{{2 - }},$ к которому последовательно присоединяются n молекул борана BH3 и алана AlH3:
Целью работы является (помимо традиционных расчетов равновесной геометрии и частот нормальных колебаний) оценка энергий последовательного присоединения молекул BH3 и AlH3 к дианиону с увеличением n, оценка энергетической стабильности комплексов к распаду (в том числе с отщеплением диборана В2Н6 у ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }}$(BH3)n и диалана Al2Н6 у ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }}$(AlH3)n) и принципиальной возможности существования комплексов в изолированном состоянии или в условиях матричной изоляции. С той же целью аналогичные DFT-расчеты были распространены нами еще на две серии более сложных аналогов формального состава ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }}$(B2H6)m и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }}$(Al2H6)m с небольшим числом m внешнесферных диборановых и диалановых лигандов. Особый интерес представляет анализ отличий в структуре и стабильности у гидроборановых и гидроалановых комплексов.
Оптимизация геометрии изомеров и расчеты частот их нормальных колебаний выполнены с использованием программы GAUSSIAN-9 [21] в рамках приближения B3LYP [22, 23] со стандартным базисом 6-31G*. Энергетические характеристики везде уточняли с расширенным базисом 6-311+G* с учетом энергий нулевых колебаний (ZPE), рассчитанных на уровне B3LYP/6-31G*.
Каждому комплексу с фиксированным значением n может отвечать множество перестановочных изомеров с разным расположением внешнесферных лигандов. В поисках предпочтительного изомера для каждого значения n мы ограничились оптимизацией группы из 5−6 интуитивно наиболее выгодных изомеров и выборкой того из них, которому отвечает самая низкая полная энергия. На рис. 1 изображены равновесные структуры 1-1–1-12 предпочтительных изомеров боранового семейства, а в табл. 1 приведены их рассчитанные геометрические, энергетические и колебательные характеристики. На рис. 2 и в табл. 2 даны аналогичные структуры 2-1–2-5 и молекулярные характеристики их алановых аналогов. На рис. 3 и 4 изображены структуры 3-1–3-3 и 4-1–4-3 предпочтительных изомеров диборатных и диаланатных комплексов ${\text{A}}{{{\text{l}}}_{{12}}}{{{\text{H}}}_{{12 - m}}}{\text{(}}{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{6}})_{m}^{{2 - }}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - m}}}({\text{Al}}_{2}^{'}{{{\text{H}}}_{6}})_{m}^{{2 - }}$ вместе с равновесными значениями геометрических параметров.
Рис. 1.
Структуры гидроборанатных комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}(B{{{\text{H}}}_{4}})_{n}^{{2 - }}.$
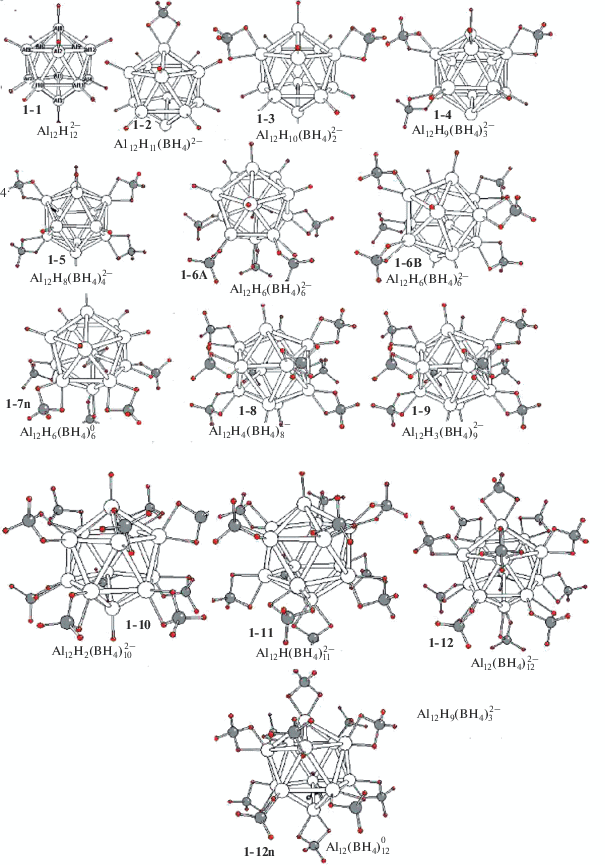
Таблица 1.
Рассчитанные характеристики тетрагидроборатных комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}(B{{H}_{4}})_{n}^{{2 - }}$
| ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}(B{{H}_{4}})_{n}^{{2 - }}$ | E nBH3 |
E 2BH3 |
R1 AlAl |
R2 AlB |
R3 BHb |
R4 AlHb |
φ | ν1 (BHt)2 |
ν2 (BHb)2 |
|---|---|---|---|---|---|---|---|---|---|
| 1-1, Al12${\text{H}}_{{12}}^{{2 - }}$ | |||||||||
| 1-2, Al12H11(BH4)2− | 19 | 2.68−2.70 | 2.31 | 1.245 | 1.89 | 65 | 2508−2568 | 2252−2276 | |
| 1-3, Al12H10$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{2}^{{2 - }}$ | 44 | 44 | 2.68−2.72 | 2.30 | 1.247 | 1.89 | 65.5 | 2512−2574 | 2245−2274 |
| 1-4, Al12H9$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{3}^{{2 - }}$ | 70 | 49 | 2.65−2.73 | 2.29 | 1.247−1.248 | 1.88 | 66 | 2516−2581 | 2235−2572 |
| 1-5, Al12H8$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{4}^{{2 - }}$ | 93 | 49 | 2.70−2.73 | 2.28 | 1.247 | 1.88 | 66 | 2520−2523 | 2232−2267 |
| 1-6A, Al12H7$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{6}^{{2 - }}$ | 141 | 48 | 2.67−2.75 | 2.28 | 1.248 | 1.87 | 67 | 2530−2596 | 2220−2260 |
| 1-6B, Al12H6$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{6}^{{2 - }}$ | 140 | 2.68−2.77 | 2.28 | 1.250−1.253 | 1.87 | 67 | 2530−2604 | 2210−2258 | |
| 1-7n, Al12H6(BH4)6 | – | – | 2.71−2.85 | 2.20 | 1.79 | 70 | 2531−2584 | 2049−2150 | |
| 1-8, Al12H4$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{8}^{{2 - }}$ | 188 | 47 | 2.65−2.75 | 2.27 | 1.251−1.254 | 1.85 | 67 | 2534−2606 | 22206−2254 |
| 1-9, Al12H3$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{9}^{{2 - }}$ | 210 | 2.70−2.74 | 2.25 | 1.85 | 67 | 2536−2612 | 2196−2261 | ||
| 1-10, Al12H2$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{{10}}^{{2 - }}$ | 233 | 45 | 2.70 | 2.26 | 1.252−1.254 | 1.88 | 66 | 2541−2614 | 2190−2249 |
| 1-11, Al12H$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{{11}}^{{2 - }}$ | 256 | 46 | 2.61−2.76 | 2.25 | 1.85 | 67 | 2542−2618 | 2190−2248 | |
| 1-12, Al12$\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{{12}}^{{2 - }}$ | 276 | 46 | 2.63−2.78 | 2.25 | 1.2521.255 | 1.85 | 68 | 2545−2621 | 2182−2246 |
| 1-12n, Al12(BH4)12 | – | – | 2.60−2.78 | 2.20 | 1.76 | 71 | 2595−2636 | 2070−2253 |
Примечание. Энергии Е, расстояния и угол φ = φ(HbAlHb) выражены в ккал/моль, ангстремах и градусах. Обозначения: E(nBH3) − усредненная энергия oтрыва n молекул ВН3 от комплекса Al12H12–n$\left( {{\text{В }}{{{\text{H}}}_{4}}} \right)_{n}^{{2 - }}$ с n лигандами. Расстояния R1(AlAl), R2(AlB) и R3(AlHb) отвечают связям атома Al с соседними атомами Al, B и мостиковым Hb. Частоты ν1(BHt)2, ν2(BHb)2 и ν3(AlH) соответствуют валентным колебаниям терминального и мостикового фрагментов ортоборатного аниона и двухцентровой связи Al–H соответственно. Для расстояния R(AlAl) и частот ν приведены интервалы Δ изменений между их минимальными и максимальными значениями. У систем 1-7n и 1-12n данные относятся к нейтральным кластерам Al12H6(BH4)6 и Al12(BH4)12. Оптимизированные структуры 1-1−1-12 изображены на рис. 1.
Рис. 2.
Структуры гидроаланатных комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - 2n}}}({\text{Al}}{{{\text{H}}}_{4}})_{n}^{{2 - }}.$
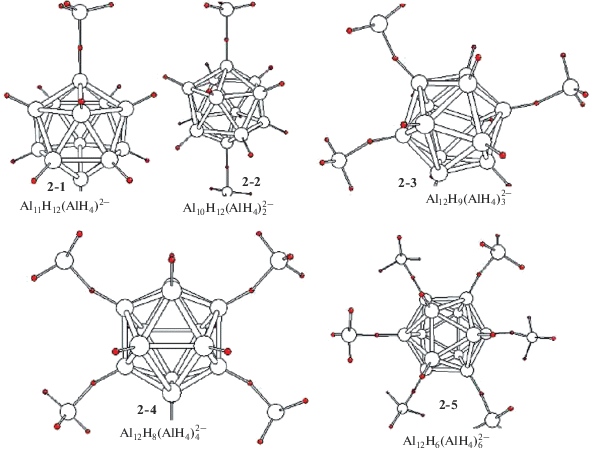
Таблица 2.
Рассчитанные характеристики тетрагидроаланатных комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{Al'}}{{{\text{H}}}_{4}})_{n}^{{2 - {\text{a}}}}$
| Al12H12−n(AlH4)$_{n}^{{2 - }}$ | E nAlH3 |
E 2AlH3 |
R1 AlAl |
R2 AlHb |
R3 Al'Hb |
φ1 | φ2 | ν1 | ν2 |
|---|---|---|---|---|---|---|---|---|---|
| 2-1, Al12H11(AlH4)2− | 16.7 | 2.67−2.73 | 1.66 | 1.76 | 180 | 115 | 1820−1857 | 632 | |
| 2-2, Al12H10$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{2}^{{2 - }}$ | 39.1 | 39.1 | 2.67−2.73 | 1.65 | 1.77 | 180 | 116 | 1831−1871 | 6656−713 |
| 2-3, Al12H9$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{3}^{{2 - }}$ | 57.6 | 40.9 | 2.68−2.73 | 1.65 | 1.79 | 160, 166 | 116 | 1833−1886 | 646−683 |
| 2-4, Al12H8$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{4}^{{2 - }}$ | 74.3 | 35.2 | 2.67−2.72 | 1.64 | 1.79 | 160 | 116 | 1842−1901 | 660−1678 |
| 2-6, Al12H6$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{6}^{{2 - }}$ | 87.0 | 36.1 | 2.65−2.71 | 1.63 | 1.82 | 150 | 117 | 1910−1963 | 681−730 |
| Al12H4$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{8}^{{2 - }}$ | 106.8 | 19.8 | 2.66−2.72 | 1.62 | 1.84 | 142 | 118 | 1913−1955 | |
| Al12H2$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{{10}}^{{2 - }}$ | 128.8 | 22.0 | 2.66−2.71 | 1.62 | 1.84 | 140 | 118 | 1909−1955 | |
| Al12$\left( {{\text{Al}}{{{\text{H}}}_{{\text{4}}}}} \right)_{{12}}^{{2 - }}$ | 156 | 2.68−2.71 | 1.61 | 1.86 | 135 | 118 | 1927 |
Примечание. См. примечания к табл. 1. Атомы Аl (без штриха) относятся к икосаэдрическому каркасу Al12, атомы A' (со штрихом) – к алановым лигандам. Е(nAl'H3) обозначает суммарную энергию отрыва n молекул Al'Н3 от комплекса ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{Al'}}{{{\text{H}}}_{4}})_{n}^{{2 - }}.$ Расстояние R1(AlAl) отвечает связям между каркасными атомами Al, а R2(AlHb) и R3(Al'Hb) − связям атомов Al’ и Al с мостиковым атомом Hb. Углы φ1 = φ(AlHbAl') и φ2 = φ(Al'HbAl'). Частота ν1 соответствует в основном валентным колебаниям терминальных связей Al−H, а ν2 − колебаниям AlHbAl' со смещениями атома Hb в направлениях, перпендикулярных линиям Al−Al'. Для расстояния R(AlAl) и частот ν приведены интервалы Δ их изменений между минимальными и максимальными значениями. Оптимизированные структуры 2-1−2-5 изображены на рис. 2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Тетрагидроборатные комплексы ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{B}}{{{\text{H}}}_{4}})_{n}^{{2 - }}$
Согласно расчетам, у равновесных структур изомеров 1-1–1-12 (рис. 1) все внешнесферные лиганды имеют форму бораната ВН4, каждый из которых связан с ближайшим атомом алюминиевого каркаса двумя водородными мостиками B−Hb−Al. Монодентатные структуры с плоскими внешнесферными молекулами ВН3, координированными одним мостиком H3B−(Hb)−Al, не отвечают особым точкам поверхности потенциальной энергии (ППЭ) и в процессе оптимизации без барьера трансформируются в бидентатно-координированные структуры ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{B}}{{{\text{H}}}_{4}})_{n}^{{2 - }}$ с выигрышем энергии, пропорциональым числу лигандов n. Эти трансформации сопровождаются сравнительно слабыми деформациями икосаэдра Al12. Адекватное описание таких комплексов можно получить с помощью боранатных структур ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{B}}{{{\text{H}}}_{4}})_{n}^{{2 - }}.$ Последний член этой серии (с n = = 12) может рассматриваться как комплекс полого металлического кластера Al12 c двенадцатью внешнесферными боратными группами ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}({\text{B}}{{{\text{H}}}_{4}})_{{12}}^{{2 - }}$ (1-12). Геометрические параметры и частоты валентных колебаний терминальных и мостиковых связей внешних фрагментов H2B−(Hb)2−Al приведены в табл. l .
Из табл. 1 следует, что равновесные параметры мостиков H2B−(Hb)2−Al у кластеров ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{B}}{{{\text{H}}}_{4}})_{n}^{{2 - }}$ близки к соответствующим параметрам мостиков свободной молекулы AlВH4(b) с бидентатной координацией ортоборатного аниона (наш расчет). Различия их длин связей и валентных углов не превышают 0.02 Å и 5°. Столь же отчетливое соответствие отмечается и у частот валентных колебаний группы ВН4. Частоты асимметричного и симметричного колебаний терминальных связей νвал(B−Ht) у всего семейства кластеров (n = 1−12) лежат в области спектра ~2510−2635 см–1 с разницей между верхним и нижним значениями частот Δν ~ 125 см–1. У каждого члена семейства его индивидуальный интервал Δνn медленно и монотонно уменьшается с увеличением числа ВН4-групп от ~60 см–1 при n = = 1 до ~40 см–1 при n = 12 симбатно укорочению длины связи R(BНt) на ~0.01 Å в том же ряду. Указанные частоты νвал(B−Ht) (~2510−2635 см–1) систематически занижены на ~60−100 см–1 по сравнению с частотами колебаний В2 (~2610 см–1) и А1 (~2625 см–1) у молекулы AlВH4(b). Для мостиковых связей, частоты νвал(B−Hb) которых лежат в интервале ~2070−2250 см–1, характерны противоположные тенденции. Их частоты νвал(B−Hb) систематически завышены по сравнению с частотами В1 (~2000 см–1) и А1 (~2160 см–1) молекулы AlВH4(b). Их индивидуальные частотные интервалы Δνn монотонно возрастают с увеличением n oт ~20 см–1 при n = 1 до ~180 см–1 при n = 12 симбатно удлинению длины связи R(BНt) на ~0.01 Å в том же ряду. Расстояние R(AlB) и длина мостиковой связи R(AlHb) укорачиваются с ростом n на ~0.06 и ~0.04 Å. Еще одно различие состоит в том, что у кластеров бидентатная координация ВН4-групп отвечает локальному миниму ППЭ, в то время как у свободной молекулы AlВH4(b) она имеет мнимую частоту В1 и соответствует переходному состоянию на пути миграции катиона Al с грани на грань через ребро с барьером ~6 ккал/моль (наш расчет). Заметим также, что у последнего члена ряда ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}({\text{B}}{{{\text{H}}}_{4}})_{{12}}^{{2 - }}$ (1-12) борогидридные группы имеют отрицательный, а алюминиевый каркас − положительный эффективные заряды Z(BH4) ~ ~ −0.20 е и Z(Al12) ~ +0.36 е соответственно. Согласно данным анализа заселенностей, присоединение 12 молекул ВН3 к ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }}$ сопровождается переносом ~0.40 е с каркаса на лиганды.
Для оценки влияния взаимного расположения ВН4-групп мы оптимизировали несколько групп перестановочных изомеров у кластеров ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{H}_{{10}}}({\text{B}}{{{\text{H}}}_{4}})_{2}^{{2 - }},$ ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{H}_{9}}({\text{B}}{{{\text{H}}}_{4}})_{3}^{{2 - }}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{H}_{6}}({\text{B}}{{{\text{H}}}_{4}})_{6}^{{2 - }}.$ У первого кластера все структуры, в которых лиганды координированы к общему ребру или разделены одним или двумя промежуточными атомами Al, квазивырождены в пределах ~1 ккал/моль. Структурные различия их фрагментов H2B−(Hb)2−Al малоощутимы. Аналогичная картина имеет место у системы ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{H}_{9}}({\text{B}}{{{\text{H}}}_{4}})_{3}^{{2 - }}$ с тремя ВН4-группами. У кластера ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{H}_{6}}({\text{B}}{{{\text{H}}}_{4}})_{6}^{{2 - }}$ симметричная структура 1-6а (рис. 1) с тремя парами ВН4-групп, координированных к противоположным вершинам икосаэдра Al12, лежит на ~1 ккал/моль выше несимметричного изомера 1-6b, в котором все шесть ВН4-групп координированы к общему “полушарию” икосаэдра. Учитывая малую величину этих неаддитивных эффектов, мы полагаем, что последовательное присоединение молекул ВН3 к аниону ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}H_{{12}}^{{2 - }}$ имеет характер, близкий стохастическому, и что взаимное расположение боратных групп не сказывается существенно на энергиях образования комплексов, (за возможным исключением последних членов ряда). Для кластеров с n = 7−12 мы ограничились оптимизацией структур 1-7–1-12 с тесным расположением ВН4-групп.
На рис. 1 помимо дианионов изображены структуры двух изомеров, соответствующих нейтральным комплексам Al12H6(BH4)6 (7n) и Al12(BH4)12 (12n). Они отвечают локальным минимумам ППЭ и имеют только действительные частоты колебаний. Их равновесная геометрия не очень сильно деформируется по сравнению с геометрией дианионов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{H}_{6}}({\text{B}}{{{\text{H}}}_{4}})_{6}^{{2 - }}$ (6а) и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}({\text{B}}{{{\text{H}}}_{4}})_{{12}}^{{2 - }}$ (12). Для обоих интермедиатов характерны высокие значения сродства к присоединению пары электронов (~6.8 эВ у Al12H6(BH4)6 (7n) и ~5.5 эВ Al12(BH4)12 (12n)) с образованием дианионов.
Во второй и третьей колонках табл. 1 приведены рассчитанные суммарные энергии E(nBH3) распада боранатных комплексов на компоненты
(1)
${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12--n}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{n}^{{2 - }} \to {\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }} + n\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)$(2)
$\begin{gathered} {\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12--}}n}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{n}^{{2 - }} \to \\ \to {\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - \left( {n - 2} \right)}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)_{{n - 2}}^{{2 - }} + \left( {{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{6}}} \right) \\ \end{gathered} $Тетрагидроаланатные комплексы состава ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}{\text{(Al'}}{{{\text{H}}}_{4}})_{n}^{{2 - }}$
При переходе к аланатным комплексам картина существенно меняется. При сравнении структур, изображенных на рис. 1 и 2, видно, что, в отличие от бидентатно координированных гидроборанатов, внешнесферная группа Al′H3 связывается с каркасным атомом Al посредством одного несимметричного мостика Al−Нb−Al' с более коротким расстоянием R(AlHb) и более длинным R(Al'Hb) и образует группу Al'H4. (Здесь и ниже атомы Al относятся к каркасу Al12, а атомы Al' − к алановым группам). У начальных членов серии 2-1 и 2-2 эту группу удобно рассматривать как монодентатный аланатный лиганд (подобно бидентатной группе ВН4 у боратов), однако у следующих членов серии такой подход является ограниченным и упрощенным из-за особенностей радиальной нежесткости мостика Al−Нb−Al'. По мере увеличении числа лигандов n короткое расстояние R(AlHb) монотонно укорачивается, а длинное R(Al'Hb) удлиняется, вследствие чего разница в длинах мостиковых фрагментов R(AlHb)−R(Al'Hb) возрастает почти вдвое. Иными словами, с увеличением n мостиковый атом Hb возвращается к каркасу, упрочняя связь Al−Hb, и удаляется от координированной группы AlH3, ослабляя связь Hb−AlH3. Тот же вывод следует из анализа частот колебаний аланатных комплексов (табл. 2), хотя их подробная интерпретация осложнена из-за смешанного характера колебаний. У первого члена ряда (2-1) верхние значения частоты ν2(AlH) в основном отвечают симметричому колебанию группы Al′H4, так что у комплекса (2-1) адекватной может считаться аланатная структура Al12H11(Al'H4)2–. Напротив, у комплекса (2-5) и следующих членов ряда с n > 6 верхние значения ν2(AlH) соответствуют симметричному колебанию каркасных связей Al−Нt, и у таких комплексов более адекватными становятся структуры ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12}}}({\text{Al'}}{{{\text{H}}}_{3}})_{n}^{{2 - }}.$ В ряду комплексов от 2-1 до 2-5 происходит непрерывная трансформация ортоаланатной структуры Al12H11(Al'H4)2− в структуру слабосвязанного молекулярного комплекса ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12}}}({\text{Al'}}{{{\text{H}}}_{3}})_{2}^{{2 - }}.$
Как и следовало ожидать, у аланатных комплексов стабильность к распаду значительно ниже, чем у боранатных. Из табл. 2 следует, что энергия Е(2Al'H3), необходимая для отрыва двух групп Al'H3 от комплекса ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{10}}}({\text{Al'}}{{{\text{H}}}_{4}})_{2}^{{2 - }}$ (2-2), составляет ∼39 ккал/моль. Эта величина на 7–10 ккал/моль больше энергии димеризации двух молекул Al'H3 в диалан ${\text{Al}}_{2}^{'}{{{\text{H}}}_{6}},$ рассчитанной нами в приближениях B3LYP/6-311+G*+ZPE и CCSD(T)/6-311++G** (29 и 32 ккал/моль соответственно). У комплекса Al12H8$\left( {{\text{Al'}}{{{\text{H}}}_{4}}} \right)_{4}^{{2 - }}$ (2-4) энергия Е(2Al'H3) остается примерно на том же уровне (∼37 ккал/моль), но уже у Al12H6(Al′H3)$_{6}^{{2 - }}$ (2-5) с шестью лигандами она уменьшается до ~29 ккал/моль, приближаясь к энергии димеризации алана, и продолжает снижаться с ростом n. Можно надеяться, что аланатные комплексы типа 2-2 и 2-4 с небольшим числом AlH4-групп могут быть стабильными к распаду с отрывом диалана и обнаружены экспериментально в условиях пониженных температур и матричной изоляции. Cледующие члены ряда с n > 6 должны быть энергетически нестабильными к отрыву Al2H6.
Диборановые комплексы ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12--n}}}({{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{7}})_{n}^{{2 - }}$
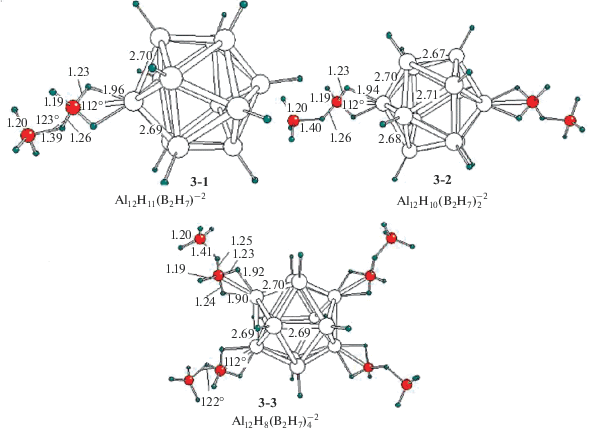
До сих пор рассматривались комплексы с моноядерными лигандами ВН4 и AlH4. В качестве следующего шага нами были оптимизированы структуры диборановых и диалановых комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12--n}}}({{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{7}})_{n}^{{2 - }}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12--n}}}({{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{6}})_{n}^{{2 - }}$ с биядерными лигандами В2Н6 и Al2H6.
Стартовая структура комплекса ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}H_{{12}}^{{2 - }}$(B2H6)n с внешнесферной молекулой В2Н6 тоже не отвечает локальной точке ППЭ и при оптимизации без барьера трансформируется в равновесную структуру 3-1 (рис. 3) с лигандом В2Н7. Для адекватного описания 3-1 более удобно использовать формулу Al12H11(B2H7)2–. В ходе трансформации разрывается внутренний мостик В−Нb−В в диборане и образуются два внешних мостика Al−Hb−B. В результате группа ВН4 в лиганде В2Н7 оказывается бидентатно координированной к атому Al и связанной с внешней молекулой ВН3. По сравнению с изолированным анионом ${{{\text{В }}}_{2}}{\text{Н }}_{7}^{ - },$ имеющим симметрию С2 (наш расчет), координированный лиганд В2Н7 характеризуется уменьшением эффективного заряда Z(B2H7) до ~−0.45 е и значительной геометрической деформацией. Его внутренний мостик В−Н−В становится асимметричным с длинами фрагментов R(B−H) ~ ~1.26 Å и R(H−B) ~ 1.39 Å, угол φ(ВНВ) уменьшается на ~20°, частоты колебаний терминальных связей νвал(BHt) сдвигаются в коротковолновую область на ~100−120 см–1.
Энергия, необходимая для распада комплекса 3-1 с отщеплением диборана:
(3а)
${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{11}}}{{\left( {{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{7}}} \right)}^{{2--}}}\left( {{\mathbf{3}}{\kern 1pt} - {\kern 1pt} 1} \right) \to {\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }} + {{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{6}},$Оптимизированные структуры 3-2 и 3-3 комплексов с двумя и четырьмя биядерными лигандами избражены на рис. 3, из которого видно, что при увеличении n от 1 до 4 геометрия групп B2H7 меняется слабо. Расстояние R(AlHb) укорачивается от 1.96 до 1.90 Å, R(${\text{В H}}_{{\text{b}}}^{'}$) удлиняется на 0.02 Å, а изменения остальных расстояний и валентных углов не превышают 0.01 Å и 1°. Рассчитанные энергии распада
(3б)
${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{10}}}\left( {{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{7}}}}} \right)_{2}^{{2 - }}({\mathbf{2}}{\text{ - }}{\mathbf{2}}) \to {\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }} + 2{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{6}},$(3в)
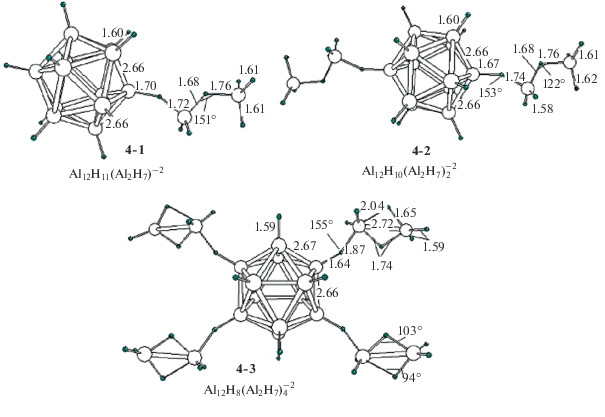
${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{\text{8}}}}\left( {{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{7}}}}} \right)_{4}^{{2 - }}({\mathbf{2}}{\text{ - }}{\mathbf{3}}) \to {\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }} + 4{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{6}},$Диалановые комплексы ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12 - n}}}({\text{Al}}_{2}^{'}{{{\text{H}}}_{7}})_{n}^{{2 - }}$
Стартовая структура комплекса ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12}}}{{({\text{Al}}_{2}^{'}{{{\text{H}}}_{6}})}^{{2 - }}}$ с внешнесферной молекулой ${\text{Al}}_{2}^{'}{{{\text{H}}}_{6}}$ тоже не отвечает локальной точке ППЭ и при оптимизации без барьера трансформируется в равновесную структуру 4-1, которая лучше всего описывается формулой Al12H11(${\text{Al}}_{2}^{'}{{{\text{H}}}_{7}}$)2– с лигандом ${\text{Al}}_{2}^{'}{{{\text{H}}}_{7}}.$ В отличие от бидентатного аналога B2H7, лиганд ${\text{Al}}_{2}^{'}{{{\text{H}}}_{7}}$ координируется монодентатно. В нем группа Al'Н4 связана одним асимметричным внешним мостиком Al−Н−Al' с каркасным атомом Al и одним внутренним мостиком Al−Н−Al' с молекулой Al'Н3. По сравнению с изолированным анионом ${\text{Al}}_{2}^{'}{\text{H}}_{7}^{ - },$ имеющим симметрию D3d (наш расчет), координированный лиганд ${\text{Al}}_{2}^{'}{{{\text{H}}}_{7}}$ имеет эффективный заряд Z(${\text{Al}}_{2}^{'}{{{\text{H}}}_{7}}$) ~ −0.41 е и асимметричный мостик Al'−Н−Al' с длинами фрагментов ~1.68 и ~1.769 Å, у которого внутренний угол φ(Al'НAl') уменьшается на ~50°.
Еще одно отличие между диборановым и диалановым аналогами проявляется в том, что комплекс Al12H11(B2H7)2– (3-1) на ~12 ккал/моль менее выгоден, чем Al12H10$({\text{B}}{{{\text{H}}}_{4}})_{2}^{{2 - }}$ (1-3) с двумя группами ВН4, в то время как комплекс 4-1 на ~3 ккал/моль более выгоден, чем 2-2 с двумя группами AlH4. Энергия распада комплекса 4-1 с отщеплением молекулы диалана (Al12H11(Al2H7)2– → → ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}H_{{12}}^{{2 - }}$ + Al2H6) оценивается в ~17 ккал/моль, что на ~3.5 ккал/моль больше энергии отрыва молекулы AlH3 от лиганда Al2H7(Al12H11(Al2H7)2– → → Al12H11(AlH4)2– + AlH3).
ЗАКЛЮЧЕНИЕ
Согласно расчетам, энергии отрыва молекул диборана и диалана невелики. Из-за приближенного характера метода B3LYP абсолютные величины этих энергий следует рассматривать как оценки с погрешностями порядка нескольких ккал/моль. Попытки уточнить результаты в рамках метода связанных кластеров CCSD(t)/6-311+G** оказались безуспешными из-за оганиченных возможностей нашего компьютера. Тем не менее можно надеяться, что эти погрешности не изменят качественные выводы настоящего сообщения, в том числе предсказания о принципиальной возможности существования и экпериментального обнаружения наиболее стабильных из рассмотренных комплексов. На наш взгляд, полученные результаты могут быть полезными при квантово-химических моделировании и прогнозировании структуры и стабильности более сложных наноразмерных алюмоборогидридных соединений с высоким содержанием водорода.
Список литературы
Graetz J., Reilly J.J., Yartys V.A. et al. // J. Alloys Compd. 2011. V. 509(S2). P. S517.
Francombe T.J. // Chem. Rev. 2012. V. 112. P. 2164.
Lai Q., Paskevicius M., Sheppard D.A. et al. // ChemSusChem. 2015. V. 8. P. 2789. doi 10.1002/cssc.201500231
Тарасов Б.П., Лотоцкий М.В. // Рос. хим. журн. 2006. Т. 50. № 6. С. 5.
Андриевский Р.А. // Успехи физ. наук. 2007. Т. 177. № 7. С. 721.
Kawamura H., Kumar V., Sun Q., Kawazoe Y. // Phys. Rev. A. 2003. V. 67. P. 063205.
Li X., Grubisic A., Stokes S.T. et al. // Science. 2007. V. 315. P. 356. 10126/science/1133767
Grubisic A., Li X., Stokes S.T. et al. // J. Am. Chem. Soc. 2007. V. 129. P. 5969. doi 10.1021/ja0700404CCC
Roach P.J., Reber A.C., Hoodward W.H. et al. // Proc. Natt. Acad. Sci. US. 2007. V. 104. № 37. P. 14565. doi 10.1073/PNAS.07066113104
Li X., Grubistich A., Bowen K.H. et al. // J. Chem. Phys. 2010. V. 132. № 24. P. 241103. doi 10.1063/1.3458912
Kiran B., Kandalam A.K., Xu J. et al. // J. Chem. Phys. 2012. V. 137. № 13. P. 134303. doi 10.1063/1.4754506
Zhang X., Wang H., Collins E. et al. // J. Chem. Phys. 2013. V. 138. № 12. P. 124303. doi 10.1063/1.4796200
Wang H., Zhang X., Ko Y. et al. // J. Chem. Phys. 2014. V. 140. № 16. P. 164317. doi 10.1063/1.4871884
Corbett J.D. // Inorg. Chem. 2000. V. 39. P. 5178.
Seo D.K., Corbett J.D. // Science. 2001. V. 291. P. 841.
Schnepf A., Stosser G., Koppe R., Schnokel H. // Chem. Int. Ed. Engl. 2000. V. 39. P. 1637.
Schnepf A., Schnoekel H. // Angew. Chem. Int. Ed. Engl. 2001. V. 40. P. 712.
Charkin O.P., Klimenko N.M., Charkin D.O., Mebel A.M. // Faraday Discuss. 2003. V. 124. P. 215.
Charkin O.P., Klimenko N.M., Moran D. et al. // Inorg. Chem. 2001. V. 40. P. 6913.
Charkin O.P., Klimenko N.M., Moran D. et al. // J. Phys. Chem. A. 2002. V. 106. P. 11594.
Frisch M.J. et al. GAUSSIAN-03, Revision B.03 (Gaussian, Inc., Pittsburg, PA. 2003).
Becke A.D.J. // J. Chem. Phys. 1993. V. 98. P. 5648.
Lee C., Yang W., Parr R.G. // Phys. Rev. B: Condens. Mater. 1998. V. 37. P. 785.
Гурвич Л.В., Карачевцев Г.В., Кондратьев В.Н. и др. Энергии разрыва химических связей, потенциалы ионизации и сродство к электрону. М.: Наука, 1974. 351 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии