Журнал неорганической химии, 2019, T. 64, № 4, стр. 365-370
Синтез и кристаллическая структура биметаллических разнолигандных комплексов кобальта(II), никеля(II) и меди(II) [MHg(C6H6N2O)2(SCN)4]
Т. Г. Черкасова 1, *, Н. В. Первухина 2, 3, Н. В. Куратьева 2, 3, Д. А. Баранцев 1, Э. С. Татаринова 1, Е. В. Черкасова 1
1 Кузбасский государственный технический университет им. Т.Ф. Горбачева
650000 Кемерово, ул. Весенняя, 28, Россия
2 Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
3 Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: ctg.htnv@kuzstu.ru
Поступила в редакцию 13.06.2018
После доработки 31.07.2018
Принята к публикации 15.08.2018
Аннотация
Из водных растворов синтезированы и изучены методами химического анализа и ИК-спектроскопии биметаллические разнолигандные комплексы состава [MHg(C6H6ON2)2(SCN)4], где M2+ = Co (I), Ni (II), Cu (III); C6H6ON2 – никотинамид (NA). Молекула NA может быть как мостиковым, так и бидентатным лигандом, тиоцианатный лиганд является амбидентатным, поэтому кристаллы комплексов могут иметь как полимерное, так и молекулярное строение. Строение комплексов I, III определено методом рентгеноструктурного анализа. Кристаллы моноклинные, пр. гр. C2/c, Z = 8. Для комплекса I: a = 26.6385(5), b = 12.8622(2), c = 19.033(4) Å, β = 133.3779(4)°, V = 4739.9 Å3, ρвыч = 2.063 г/см3; для комплекса III: a = 26.2828(7), b = 12.7435(4), c = 18.9408(9) Å, β = 132.217(1)°, V = 4698.35 Å3, ρвыч = 2.094 г/см3. Пригодные для рентгеноструктурного анализа монокристаллы соединения никеля(II) получить не удалось, однако вещество исследовано методом рентгенофазового анализа. Сопоставление экспериментальной и расчетной дифрактограмм позволяет сделать вывод о схожем строении фаз [CoHg(C6H6N2O)2(SCN)4] и [NiHg(C6H6N2O)2(SCN)4]. Кристаллы комплексов I–III изоструктурны. Атомы серы четырех роданидных групп образуют тетраэдрическое координационное окружение атомов ртути. Октаэдрическое координационное окружение, характерное для соединения кобальта(II), в случае меди(II) преобразуется в тетрагонально-пирамидальное. Мостиковые роданидные группы объединяют единицы М(NA)2 и атомы ртути в 3D-каркас.
ВВЕДЕНИЕ
Важную роль в жизнедеятельности живых организмов играют гетероциклические соединения – компоненты некоторых витаминов [1]. К биологически активным веществам группы ниацина относятся никотиновая кислота и ее производные, в том числе никотинамид (3-пиридинкарбоксамид) – одна из форм витамина В3 (РР) [2]. Координационные соединения 3d-металлов – биоэлементов с никотинамидом (NA) – потенциально биологически активные вещества [3–5]. Молекула NA может быть как мостиковым, так и бидентатным лигандом. Синтез и характеристика комплексов токсичных металлов Cd(II), Hg(II), Pb(II) с NA представлены в [6], комплексов Au(III) – в [7], смешанолигандных соединений Co(II) – в [8–10], биметаллических комплексов Ni(II) и Cu(II) – в [11]. Известны соединения кобальта(II) и меди(II) с комплексными тетра(тиоцианато)меркурат(II)-анионами, описанные как двойные комплексные соли [12]. На основании данных ИК-спектроскопии и магнитных свойств соединений [M(NA)2X2], где M = Mn, Fe, Co, Ni, Cu; X = Cl, Br, сделан вывод о реализации полимерной октаэдрической структуры [13]. Методами электронной и ИК-спектроскопии показано, что кристаллические структуры комплексов Co(NA)2Cl2 и Ni(NA)2Cl2 относятся к гексагональным системам, а соединение Cu(NA)2Cl2 имеет кубическую структуру [14].
Цель работы – синтез и изучение структурных характеристик биметаллических разнолигандных комплексов состава [MHg(C6H6ON2)2(SCN)4], где M2+ = Co (I), Ni (II), Cu (III), содержащих по два полидентатных лиганда, поэтому кристаллы комплексов могут иметь как полимерное, так и молекулярное строение, что обусловливает интерес к изучению структурных характеристик соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Смешивали раздельно водные растворы 0.238 г (0.001 моль) гексагидрата хлорида кобальта(II), 0.238 г (0.001 моль) гексагидрата хлорида никеля(II), 0.242 г (0.001 моль) дигидрата хлорида меди(II) и 0.244 г (0.002 моль) NA, затем к каждой смеси добавляли 0.232 г (0.001 моль) водного раствора комплексной соли Na2[Hg(SCN)4], предварительно полученной в соответствии с [15] из смеси подкисленных водных растворов Hg(NO3)2 ⋅ ⋅ H2O и NaSCN. Для синтеза использовали реактивы марки “х. ч.” без дополнительной очистки. Смеси растворов выдерживали при комнатной температуре в течение 5 сут. В результате выпадали кристаллические осадки, которые промывали холодной водой, отфильтровывали и высушивали на воздухе. Выход составил 65% для I, 60% для II, 63% для III.
Монокристаллы I и III, пригодные для рентгеноструктурного анализа (РСА), выращены из смеси разбавленных водных растворов исходных веществ изотермическим испарением на воздухе при 298 K.
Химический анализ на содержание ионов M2+ выполнен методом оптической эмиссионной спектроскопии с индуктивно связанной плазмой на спектрометре ICAP 6500 Duo LA, элементный C,H,N,O,S-анализ – на приборе ThermoFlash 2000. Полученные результаты представлены в табл. 1.
Таблица 1.
Результаты элементного анализа комплексов I–III, %
| Элемент | C16H12CoHgN8O2S4 (I) | C16H12NiHgN8O2S4 (II) | C16H12CuHgN8O2S4 (III) | |||
|---|---|---|---|---|---|---|
| вычислено | найдено | вычислено | найдено | вычислено | найдено | |
| Co | 8.00 | 7.91 | ||||
| Ni | 7.98 | 7.91 | ||||
| Cu | 8.57 | 8.48 | ||||
| C | 26.10 | 26.20 | 26.11 | 26.12 | 25.94 | 25.87 |
| H | 1.64 | 1.60 | 1.64 | 1.58 | 1.63 | 1.56 |
| N | 15.22 | 15.10 | 15.23 | 15.20 | 15.13 | 15.02 |
| O | 4.34 | 4.30 | 4.35 | 4.30 | 4.32 | 4.30 |
| S | 17.42 | 17.40 | 17.43 | 17.45 | 17.32 | 17.20 |
ИК-спектры комплексов I–III снимали на ИК-Фурье-спектрометре Cary 630 FTIR фирмы Agilent в интервале 4000–400 см–1 в матрице KBr. Основные частоты полос поглощения (ν, см–1): 3342 (сл), 3180 (сл), 2131 (оч. с), 1662 (оч. с), 1606 (с), 1578 (ср), 1427 (ср), 1399 (ср), 1204 (сл), 1120 (оч. сл), 1053 (сл), 836 (сл), 797 (сл), 752 (ср), 702 (оч. с) для I; 3353 (сл), 3187 (сл), 2147 (оч. с), 1667 (оч. с), 1606 (с), 1580 (ср), 1427 (ср), 1399 (ср), 1210 (ср), 1120 (сл), 1059 (сл), 836 (оч. сл), 797 (сл), 707 (оч. с) для II; 3297 (сл), 3152 (сл), 2119 (оч. с), 1701 (ср), 1679 (оч. с), 1617 (с), 1584 (ср),1433 (ср), 1394 (с), 1210 (ср), 1120 (ср), 1065 (сл), 1003 (сл), 780 (ср), 696 (оч. с) для III.
РСА кристаллов I, III выполнен на дифрактометре Bruker APEX DUO с CCD-детектором (φ- и ω-сканирование) при 150(2) K. Поправки на поглощение введены по программе SADABS [16], использующей многократные измерения одних и тех же отражений при разных ориентациях кристалла. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по F 2 в анизотропном приближении для неводородных атомов (SHELXTL) [17]. Атомы водорода органических лигандов локализованы из карт разностной электронной плотности и уточнены в приближении жесткого тела. Атомы азота и углерода двух роданидных групп III разупорядочены по двум положениям каждый с фиксированным значением фактора заселенности 0.5. Согласно рентгеновской дифрактограмме поликристаллического образца II, строение этой фазы аналогично структуре I.
Кристаллографические данные и детали дифракционного эксперимента для соединений I, III приведены в табл. 2, основные длины связей – в табл. 3. Структурные данные депонированы в КБСД (ССDС 1834754 для I, 1834755 для III) и доступны на сайте www.ccdc.cam.ac.uk/data_reguest/cif.
Таблица 2.
Кристаллографические данные и условия дифракционного эксперимента для соединений I, III
| М, г/моль | 736.10 | 740.71 |
| Сингония | Моноклинная | |
| Пр. гр., Z | C2/c, 8 | |
| a, Å | 26.6385(5) | 26.2828(7) |
| b, Å | 12.8622(2) | 12.7435(4) |
| c, Å | 19.0336(4) | 18.9408(9) |
| β, град | 133.3779(4) | 132.217(1) |
| V, Å3 | 4740.1(2) | 4698.3(3) |
| ρвыч, г/см3 | 2.063 | 2.094 |
| μ, мм–1 | 7.553 | 7.819 |
| F(000) | 2808 | 2824 |
| Размер кристалла, мм | 0.34 × 0.16 × 0.08 | 0.16 × 0.08 × 0.08 |
| Диапазон сбора данных по θ, град | 1.90–27.53 | 1.91–27.51 |
| Диапазон индексов | –29 ≤ h ≤ 34, –16 ≤ k ≤ 14, –24 ≤ l ≤ 24 | –34 ≤ h ≤ 27, –16 ≤ k ≤ 16, –14 ≤ l ≤ 24 |
| Число измеренных Ihkl | 17 197 | 17 112 |
| Число Ihkl > 2σ (I) | 5453 (Rint = 0.0289) | 5395 (Rint = 0.0367) |
| Max, min пропускание | 0.5833, 0.1833 | 0.5735, 0.3676 |
| Число параметров | 289 | 326 |
| GOOF для $F_{{hkl}}^{2}$ | 1.034 | 1.000 |
| R(I > 2σ(I)) | R1 = 0.0183, wR2 = 0.0389 | R1 = 0.0237, wR2 = 0.0446 |
| R (все отражения) | R1 = 0.0225, wR2 = 0.0399 | R1 = 0.0320, wR2 = 0.0463 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.479/1.332 | –0.622/0.703 |
Таблица 3.
Основные межатомные расстояния (d) и валентные углы (φ) в комплексах I, III
| I | III | ||||||
|---|---|---|---|---|---|---|---|
| связь | d, Å | угол | φ, град | связь | d, Å | угол | φ, град |
| Co(1)–N(11) | 2.153(2) | N(11)Co(1)N(21) | 173.00(8) | Cu(1)–N(11) | 2.032(3) | N(11)Cu(1)N(21) | 172.7(1) |
| Co(1)–N(21) | 2.145(2) | N(11)Co(1)N(1) | 91.93(8) | Cu(1)–N(21) | 2.025(3) | N(11)Cu(1)N(1) | 92.0(1) |
| Co(1)–N(1) | 2.102(2) | N(11)Co(1)N(2)#1 | 91.33(7) | Cu(1)–N(1) | 2.129(3) | N(11)Cu(1)N(2)#3 | 92.2(1) |
| Co(1)–N(2)#1 | 2.087(2) | N(11)Co(1)N(3)#3 | 86.85(8) | Cu(1)–N(2)#3 | 2.103(3) | N(11)Cu(1)N(3B)#1 | 83.8(2) |
| Co(1)–N(3)#3 | 2.177(2) | N(11)Co(1)N(4)#2 | 89.54(7) | Cu(1)–N(3B)#1 | 1.924(5) | N(11)Cu(1)N(4A)#2 | 91.6(2) |
| Co(1)–N(4)#2 | 2.147(2) | N(21)Co(1)N(1) | 94.07(8) | Cu(1)–N(4A)#2 | 2.012(5) | N(21)Cu(1)N(1) | 94.1(1) |
| Hg(1)–S(1) | 2.5555(6) | N(21)Co(1)N(2)#1 | 91.80(7) | Hg(1)–S(1) | 2.5629(9) | N(21)Cu(1)N(2)#3 | 91.3(1) |
| Hg(1)–S(2) | 2.6479(7) | N(21)Co(1)N(3)#3 | 86.79(8) | Hg(1)–S(2) | 2.6456(9) | N(21)Cu(1)N(3B)#1 | 89.2 (2) |
| Hg(1)–S(3) | 2.4911(7) | N(21)Co(1)N(4)#2 | 87.13(8) | Hg(1)–S(3) | 2.4916(8) | N(21)Cu(1)N(4A)#2 | 83.7(2) |
| Hg(1)–S(4) | 2.5027(6) | N(1)Co(1)N(2)#1 | 94.52(8) | Hg(1)–S(4) | 2.5006(9) | N(1)Cu(1)N(2)#3 | 95.9(1) |
| N(1)Co(1)N(3)#3 | 173.62(8) | N(1)Cu(1)N(3B)#1 | 163.0(2) | ||||
| N(1)Co(1)N(4)#2 | 87.38(8) | N(1)Cu(1)N(4A)#2 | 95.9(2) | ||||
| N(2)#1Co(1)N(3)#3 | 91.77(8) | N(2)#3Cu(1)N(3B)#1 | 100.8(2) | ||||
| N(2)#1Co(1)N(4)#2 | 177.89(9) | N(2)#3Cu(1) N(4A)#2 | 167.6(2) | ||||
| N(4)#2Co(1)N(3)#3 | 86.35(8) | N(3B)#1Cu(1)N(4A)#2 | 67.9(2) | ||||
| S(3)Hg(1)S(4) | 131.91(3) | S(3)Hg(1)S(4) | 132.37(3) | ||||
| S(3)Hg(1)S(1) | 107.93(2) | S(3)Hg(1)S(1) | 106.01(3) | ||||
| S(4)Hg(1)S(1) | 105.85(2) | S(4)Hg(1)S(1) | 107.46(3) | ||||
| S(3)Hg(1)S(2) | 97.60(2) | S(3)Hg(1)S(2) | 97.74(3) | ||||
| S(4)Hg(1)S(2) | 99.85(2) | S(4)Hg(1)S(2) | 99.56(3) | ||||
| S(1)Hg(1)S(2) | 112.69(2) | S(1)Hg(1)S(2) | 112.63(3) | ||||
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексы состава [MHg(C6H6ON2)2(SCN)4], где M2+ = Co (I), Ni (II), Cu (III), представляют собой устойчивые на воздухе яркоокрашенные кристаллические порошки. Вещество I – красного цвета, соединение II имеет синюю окраску, а комплекс III зеленый. Вещества плохо растворимы в воде, н-углеводородах, спиртах (этиловом, бутиловом, изопропиловом, изобутиловом, бензиловом), толуоле, ацетоне, хорошо растворимы в диметилсульфоксиде (ДМСО) и диметилформамиде.
Согласно концепции “жестких–мягких кислот и оснований”, ионы Co2+ и Hg2+ относятся к “мягким” кислотам Льюиса. Ионы Cu2+ и Ni2+ являются кислотами, занимающими промежуточное положение [18–20]. На основании этого можно предположить образование соединений с тиоцианатными мостиками. Для таких веществ значения частот валентных колебаний выше 2100 см–1 [21], что и наблюдается в ИК-спектрах комплексов I, II, III: 2131, 2147, 2119 см–1 соответственно. Частоты ниже 797 см–1 характеризуют связи амбидентатных роданидных групп с металлами-комплексообразователями через атомы серы и азота. Молекула NA имеет три потенциальных донорных центра: азот пиридинового кольца, азот NH2-группы и кислород карбонильной группы [22]. В основном NA координируется монодентатно через пиридиновый атом азота [23, 24]. Отнесение полос поглощения NA в соединениях I–III выполнено в соответствии с [4, 25, 26]. Полосы валентных колебаний групп N–H первичных амидов регистрируются при 3342 и 3180 см–1 (I), 3353 и 3187 см–1 (II), 3297 и 3152 см–1 (III). Значения ν(NH) смещаются в высокочастотную область на 46, 48, 52 см–1 в комплексах I, II, III по сравнению с ν(NH) = 1532 см–1 в NA. Частота ν(CO) в NA (1679 см–1) смещается в соединениях I, II и III в низкочастотную область до 1662, 1667 и 1670 см–1 соответственно. В то же время значение ν(CN) в пиридиновом кольце NA, равное 1394 см–1, практически не меняется в комплексах I, II, III (1399, 1399, 1394 см–1). ИК-спектры комплексов достаточно сложны и не могут дать однозначный ответ о способе координации органических лигандов.
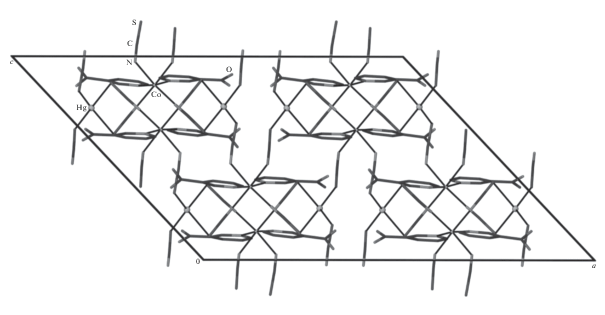
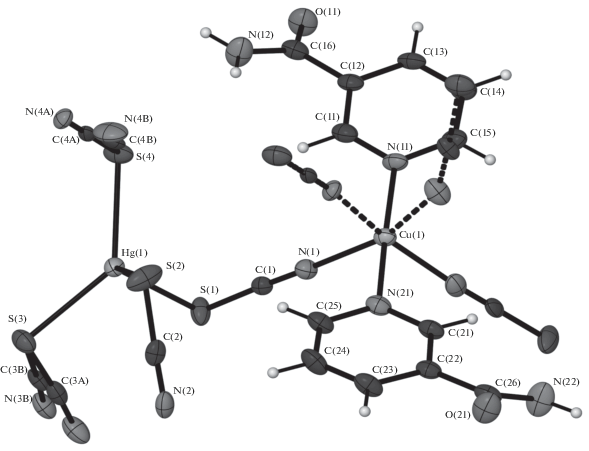
Кристаллы комплексов I–III изоструктурны. Атомы серы четырех роданидных групп образуют тетраэдрическое координационное окружение атомов ртути с расстояниями Hg–S 2.4911(7)–2.6479(7) и 2.4916(8)– 2.6456(9) Å для I и III соответственно. В связи с тем, что в III наблюдается позиционное разупорядочение двух роданидных анионов, октаэдрическое координационное окружение, характерное для соединения кобальта(II), в случае меди(II) преобразуется в тетрагонально-пирамидальное. Координационная сфера атомов металлов состоит из шести (или пяти) (рис. 1) донорных атомов азота двух монодентатно координированных молекул NA (Со–N 2.153(2) и 2.145(2) Å, Cu–N 2.032(3) и 2.025(3) Å) и четырех (или трех) роданид-ионов (Со–N 2.087(2)–2.177(2) Å, Cu–N 1.924(5)–2.129(3) Å). Таким образом, роданидные группы являются мостиковыми и объединяют единицы М(NA)2 и атомы ртути в 3D-каркас (рис. 2).
Рис. 1.
Строение и нумерация атомов в комплексном соединении [СuHg(C6H6ON2)2(SCN)4] (III). Штрихпунктиром обозначено разупорядоченное координационное окружение атома Cu.
Ранее нами были изучены структурные характеристики молекулярного комплекса [NiHg(ДМСО)2(SCN)4]n, кристаллы которого относятся к моноклинной сингонии [27]. Вещество представляет собой сетчатый полимер, сшитый роданидными группами. Атомы Ni(II), находящиеся в октаэдрическом окружении, координированы двумя молекулами ДМСО и четырьмя роданидными анионами с расстояниями Ni–N 1.99(2)–2.02(3) Å, атомы Hg(II) находятся в искаженном плоскоквадратном окружении четырех мостиковых роданидных групп с расстояниями Hg–S 2.484(1)–2.603(1) Å.
ЗАКЛЮЧЕНИЕ
Проведенные исследования структурных характеристик комплексов [MHg(C6H6ON2)2(SCN)4], где M2+ = Co (I), Ni (II), Cu (III), и [NiHg(C2H6SO)2(SCN)4] показали одинаковое строение соединений, различающихся лишь нейтральными органическими лигандами. Это свидетельствует о том, что структура в существенной степени определяется роданидным анионом. Такая зависимость структуры от природы противоиона отмечалась ранее для галогенидных комплексов с NA [28].
Список литературы
Kose D.A., Necefogly H. // J. Therm. Anal. Calorim. 2008. V. 93. № 2. P. 509.
https://www.vitamini.ru/vitamin_25.html.
Кокшарова Т.В., Гриценко И.С., Курандо С.В., Мандзий Т.В. // Вiсник ОНУ. 2009. Т. 14. № 12. С. 91.
Surendra Dilip C., Thangaraj V., Paul Raj A. // Arabian J. Chem. 2016. V. 9. P. S731. doi 10.1016/j.arabjc.2011.07.016
Lawal A., Obaleve J., Adediji J. et al. // J. Appl. Sci. Environ. Manage. 2014. V. 18. № 2. P. 205.
Sarker S., Ehsan M.Q. // J. Bangladesh. Acad. Sci. 2017. V. 41. № 1. P. 37.
Altun Q., Suozer M. // Jotcsa. 2017. № 4. P. 1. doi 10.18596/jotcsa.315233
Askin G.S., Necefoglu H., Ozkaya S. et al. // Acta Crystallogr. 2016. V. 72E. P. 888. doi 10.1107/ S2056989016008689
Xue J., Hua X., Yang L. et al. // J. Mol. Struct. 2014. V. 1059. P. 108. http//dx.doi.org/10.1016/j.molstruc.2013.11.001.
Cakir S., Bulut I., Naumov P. et al. // J. Mol. Struct. 2001. V. 560. P. 1. doi S0022-2860(00)00719-5
Gor K., Kurkcuoglu G.S., Yesilel O.Z., Buyukgungor O. // J. Mol. Struct. 2014. V. 1060. P. 166. http//dx.doi.org/ 10.1016/j.molstruc.2013.12.024.
Craciunescu D., Ben-Bassar A.H.I. // Bull. Soc. Chim. Belg. 1972. V. 81. № 3–4. P. 307.
Allan J.R., Baird N.D., Kassyk A.L. // J. Therm. Anal. Calorim. 1979. V. 16. № 1. P. 79.
Zhou B., Zhoun D., Cai W. // J. Harbin Inst. Technol. 2003. V. 35. № 2. P. 176.
Брауэр Г. // Руководство по неорганическому синтезу. 1985. Т. 4. 447 с.
Sheldrick G.M. SADABS. Version 2.01. Bruker AXS Inc. Madison, Wisconsin, USA, 2004.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71C. P. 3.
Кукушкин Ю.Н. Химия координационных соединений. М.: Высш. школа, 1985. 455 с.
Pearson R.G. // J. Chem. Educ. 1985. V. 45. P. 581.
Гарновский А.Д., Садименко А.П., Осипов О.А., Цинцадзе Г.В. Жестко-мягкие взаимодействия в координационной химии. Ростов-на-Дону: Изд-во Ростовск. ун-та, 1986. 272 с.
Химия псевдогалогенидов / Под ред. Голуба А.М., Келера Х., Скопенко В.В. Киев: Вища шк., 1971. 360 с.
Dziewulska-Kulaczkoska A., Mazur L., Ferenc W. // J. Therm. Anal. Calorim. 2009. V. 96. № 1. P. 255.
Bera J.K., Vo T.-T., Walton R.A., Dunbar K.R. // Polyhedron. 2003. V. 22. P. 3009.
Lian Z., Ning Z., Fengxia Y., Ping L. // Z. Kristallogr. 2011. B. 226. S. 289.
Jain S.C., Rivest R. // Can. J. Chem. 1969. V. 47. P. 2209.
Смит A. Прикладная ИК-спектроскопия. М.: Мир, 1982. 328 с.
Черкасова Т.Г., Золотухина Н.А. // Журн. неорган. химии. 2002. Т. 47. № 3. С. 433.
Jona E., Sirota A., Simon P., Kubranova M. // Thermochim. Acta. 1995. V. 258. P. 161.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии