Журнал неорганической химии, 2019, T. 64, № 7, стр. 707-713
Синтез наночастиц Pd(0) в ксерогеле TiO2–SiO2
А. Б. Шишмаков 1, *, Ю. В. Микушина 1, О. В. Корякова 1, Л. А. Петров 1
1 Институт органического синтеза УрО РАН
620990 Екатеринбург, ул. С. Ковалевской, 22/20, Россия
* E-mail: Mikushina@ios.uran.ru
Поступила в редакцию 22.11.2018
После доработки 28.12.2018
Принята к публикации 15.02.2019
Аннотация
Синтезированы ксерогели Pd/TiO2–SiO2 с содержанием палладия 0.15–0.75 мас. % из раствора Pd(NO3)2 · 2H2O в смеси тетрабутоксититана и тетраэтоксисилана в эксикаторе в атмосфере паров уксусная кислота–вода в стационарных условиях при 20°С с последующей сушкой и прокаливанием материала при 850°С. Методом ИК-спектроскопии установлено, что присутствие Pd(NO3)2 · 2H2O не оказывает влияния на количество образующихся связей Ti–O–Si в бинарном оксиде TiO2–SiO2 в исследованном диапазоне концентраций соли. Рентгенофазовый анализ показал, что палладий в прокаленных при 850°С ксерогелях присутствует в виде наночастиц Pd(0). С помощью электронной микроскопии исследована морфология полученных объектов – наночастицы Pd(0) имеют форму, близкую к сферической, их размер лежит в диапазоне 20–230 нм. Установлено, что, изменяя концентрацию соли палладия(II) на стадии растворения, можно варьировать размер наночастиц Pd(0) в материале.
ВВЕДЕНИЕ
Наночастицы палладия, нанесенные на различные носители, находят применение как эффективные катализаторы в процессах гидрирования ненасыщенных углеводородов, нефтеполимерных смол [1–5 ], в экологическом катализе [6–8].
В качестве носителей используют углеродные материалы: активированный уголь [9–11], углеродную ткань [12 ] , наноалмаз [13, 14], фуллереновую чернь [15], квазиграфитовые материалы [16], а также различные оксидные, полимерные и другие матрицы [5, 12, 16–21 ] .
Природа и текстура носителя влияют на дисперсность частиц палладия и равномерность их распределения в массе носителя, что определяет каталитические характеристики получаемых катализаторов.
Полный цикл процесса приготовления катализатора включает следующие стадии: формирование носителя, его пропитку раствором соли (комплекса) палладия, сушку, прокаливание и восстановление палладия(II). Восстановление палладия из окисленной формы в нульвалентное состояние можно проводить водородом при повышенных температурах [16, 21], тетрагидроборатом натрия NaBH4, гидразин гидратом N2H4H2O [5, 14, 19, 22, 23 ] или аммиаком из хлорида тетраамминпалладия(II) Pd(NH3)4Cl2 в щелочных средах в гидротермальных условиях [24].
Совмещение стадий синтеза упрощает процесс, что способствует получению палладиевых композиций с высокой воспроизводимостью характеристик и удешевлению их производства [25, 26].
Перспективным способом получения нанодисперсных фаз палладия является метод восстановительной сорбции. Он позволяет при использовании в качестве подложки активных углей [9] или гидридполисилоксана [20] получать нанесенные нанокластеры металла непосредственно при взаимодействии адсорбированных ионов с поверхностными восстановительными группами носителей, т.е. в одну стадию (in situ) в мягких условиях и без применения каких-либо дополнительных восстанавливающих реагентов. Гидридполисилоксан – пористый кремнеземный материал, синтезируемый гидролитической поликонденсацией триэтоксисилана HSi(OC2H5)3 с использованием золь-гель метода. Восстановление ионов палладия происходит на его поверхностных кремнийгидридных группах (≡Si–H).
Авторам работы [26] удалось совместить стадии формирования носителя и восстановления палладия(II), подвергая пиролизу березовые опилки, пропитанные раствором нитрата палладия.
В настоящей работе авторы предприняли попытку разработать малостадийную методику синтеза катализатора Pd/TiO2–SiO2. За основу взяли ранее разработанную методику синтеза ксерогелей TiO2–SiO2 и Cu(II)/TiO2–SiO2 [27, 28 ] . Гидролиз смеси тетрабутоксититана (C4H9O)4Ti (ТБТ), тетраэтоксисилана (C2H5O)4Si (ТЭОС) и хлорида меди(II) (в случае Cu(II)/TiO2–SiO2) проводили при комнатной температуре в отсутствие растворителя и без перемешивания реакционной смеси. В качестве гидролизующего агента выступали пары H2O, H2O + HCl или H2O + NH3.
В качестве прекурсора активного компонента в синтезе Pd/TiO2–SiO2 был выбран Pd(NO3)2 · · 2H2O, так как он может растворяться в ТБТ, что позволяет ввести палладиевую компоненту в смесь ТБТ + ТЭОС перед ее гидролизом. В результате гидролиза металлорганических прекурсоров соль палладия оказывается заключенной в порах сформированного ксерогеля вместе с органическими продуктами гидролиза (бутиловый и этиловый спирты). Следует отметить, что присутствующие на поверхности пор оксида гидроксильные группы могут создавать пространственные препятствия укрупнению кристаллов палладиевой соли при сушке ксерогеля [20].
Последующее прокаливание материала (850°С) вызывает карбонизацию органического вещества в порах ксерогеля [27 ] . Восстановительная атмосфера в порах создает благоприятные условия для перехода палладия в нульвалентное состояние.
Использование при гидролизе ТБТ + ТЭОС паров CH3COOH + H2O исключает выпадение соли палладия в осадок, что наблюдается в водно-аммиачной атмосфере.
Цель работы – выдержкой смеси ТБТ + ТЭОС + + Pd(NO3)2 · 2H2O в эксикаторе в атмосфере паров CH3COOH + H2O при 20°С сформировать ксерогель Pd/TiO2–SiO2 и исследовать состояние палладия в исходном и прокаленном материале.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гидролиз прекурсоров осуществляли в эксикаторе объемом 3000 см3 при температуре 20°С, уксуснокислую атмосферу обеспечивало присутствие 50 мл 50%-ного водного раствора уксусной кислоты. Смесь прекурсоров равномерно наливали в чашки Петри слоем 2 мм и помещали в эксикатор.
Для синтеза образца TiO2–SiO2 (содержание TiO2 7 мол. %) смешивали 1 мл ТБТ (Sigma-Aldrich titanium(IV)butoxide, reagent grade, 97%) и 9 мл ТЭОС (Alfa Aesar tetraethoxysilane, 98%).
Для синтеза палладийсодержащих образцов Pd/TiO2–SiO2 (1–3) в 1 мл ТБТ растворяли соответственно 0.01, 0.03, 0.05 г Pd(NO3)2 · 2H2O (Fluka Analytica palladium(II) nitrate dihydrate). В полученные растворы приливали по 9 мл ТЭОС и перемешивали. Образцы выдерживали в эксикаторе 1 сут, сушили на воздухе 1 сут и в сушильном шкафу 3 сут при 90°С. Затем образцы загружали в кварцевый реактор, нагревали до 850°С (скорость нагрева 10 град/мин) и прокаливали в токе воздуха (скорость подачи 0.075 м3/ч) в течение 1 ч при указанной температуре.
Содержание палладия в образцах Pd/TiO2–SiO2 (1–3) составило 0.15 (0.004), 0.45 (0.012) и 0.75 мас. % (0.020 г) соответственно. Выход Pd(0) стехиометрический.
ИК-спектры регистрировали на ИК-Фурье-спектрометре Spectrum One фирмы Perkin Elmer в диапазоне частот 4000–400 см–1 в виде твердых порошков с использованием приставки диффузного отражения (DRA). Обработку и расчет интенсивностей спектров проводили с использованием специальных программ прикладного программного обеспечения спектрометра.
Рентгенофазовый анализ (РФА) образцов выполняли на дифрактометре Rigaku D-MAX-2200V (Япония) с вертикальным гониометром в интервале углов 2θ = 10°–75°, скорость сканирования 1 град/мин. Использовали CuKα-излучение (40 кВ, 30 мА, λ = 1.54184 Å). Для автоматического поиска применяли базу данных PDF-2.
Электронные фотографии ксерогелей были сняты на электронном микроскопе GSM-5900LV.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По окончании гидролиза прекурсоров дно чашки Петри покрывала тонкая (~0.5 мм) блестящая прозрачная пленка, бесцветная – TiO2–SiO2, коричневого цвета – образцы 1–3. Интенсивность окраски растет в ряду образцов 1–3. По мере сушки на воздухе пленка отслаивается от дна чашки и покрывается сетью трещин с сохранением отдельных целых фрагментов до 2 см в поперечнике.
Следует отметить, что равномерная окраска и прозрачность Pd-содержащего материала наблюдается только в том случае, когда смесь прекурсоров при гидролизе находится в виде тонкого равномерного слоя (толщина ≤2 мм), что обеспечивает быстроту гидролиза ТБТ + ТЭОС. Если прекурсоры помещали в круглодонные чашки (диаметр – 60 мм, объем – 30 мл), как в [27, 28 ] , основная часть палладия концентрировалась в нижней части ксерогеля. Гелеобразование в чашке происходит значительно медленнее, чем в тонком слое, и соединения палладия “выдавливаются” из формирующегося сверху вниз на границе раздела фаз газ–жидкость ксерогеля.
В результате прокаливания при 850°С все пленки теряют прозрачность, окрашиваясь в черный цвет. Изменение окраски является результатом карбонизации органического вещества, “запертого” во внутренних порах материала, как это наблюдалось ранее в [27 ] .
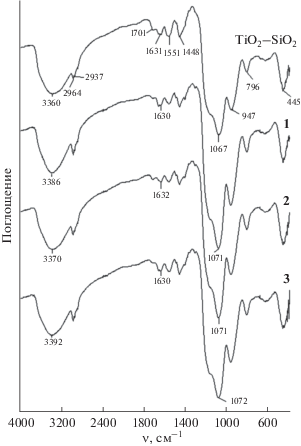
На рис. 1 представлены ИК-спектры образцов после их сушки при 90°С. Инфракрасные спектры всех пленок практически идентичны. Они имеют интенсивную полосу поглощения сложной формы с максимумом ~1067 см–1 и полосу поглощения с максимумом 796 см–1, соответствующие валентным колебаниям связей Si–O–Si. Полоса сложной формы соответствует асимметричным валентным, а полоса средней интенсивности – симметричным валентным колебаниям тетраэдров SiO4. Полоса поглощения с максимумом 947 см–1 характеризует симметричные валентные колебания немостиковых связей Si–O– и колебания групп Ti–O–Si, интенсивная полоса при 445 см–1 – деформационные колебания полиэдров кремнезема. В области 3700–3000 см–1 присутствуют полосы поглощения валентных колебаний поверхностных гидроксильных групп и воды. Широкая полоса средней интенсивности в области 1630 см–1 соответствует деформационным колебаниям воды. Не испарившиеся из внутренних областей пленок в процессе сушки органические вещества (уксусная кислота, этиловый и бутиловый спирты) проявляются в виде полос поглощения при 3000–2800 см–1 (валентные колебания С–Н) и 1550–1350 см–1 (деформационные колебания –CH2– и –СН3). Полоса поглощения при 1701 см–1 отвечает поглощению карбоксильных групп уксусной кислоты.
Соединения палладия(II) не проявляются в спектрах, очевидно, вследствие малого содержания в материале.
Таким образом, одинаковый вид ИК-спектров всех образцов свидетельствует о том, что присутствие нитрата палладия при гидролизе смеси ТБТ + ТЭОС не оказывает (либо оказывает незначительное) влияния на формирование бинарного оксида.
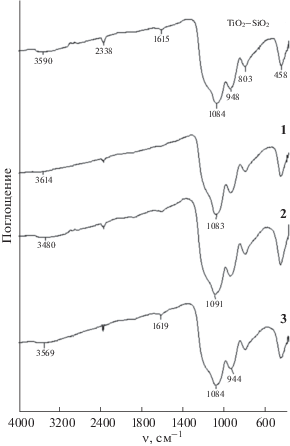
Прокаливание при 850°С вызывает практически полное дегидроксилирование кремнезема [27 ] . Таким образом, полоса поглощения при 948–944 см–1 (рис. 2) в спектрах прокаленного материала характеризует только колебания связи Ti–O–Si. Отношение интенсивностей полос поглощения Ti–O–Si и ассиметричных валентных колебаний Si–O–Si в спектрах всех четырех образцов одинаково и составляет 0.41.
Слабоинтенсивные полосы поглощения воды в спектрах (3700–3000 и 1619–1615 см–1) обусловлены, по-видимому, присутствием атмосферной влаги вследствие гигроскопичности образцов. Полоса поглощения с максимумом при 2338 см–1 соответствует сорбированному СО2.
Сходство ИК-спектров всех образцов указывает на отсутствие влияния примеси палладия на ксерогели в процессе их прокаливания.
По данным РФА (рис. 3), высушенные при 90°С ксерогель TiO2–SiO2 и образцы 1, 2 рентгеноаморфны. На дифрактограмме образца 3 видны рефлексы металлического палладия Pd(111) (2θ = 40.12°) и Pd(200) (2θ = 46.66°). Эти пики характеризуются незначительной интенсивностью.
Рис. 3.
Фрагмент дифрактограммы высушенных при 90°С ксерогелей TiO2–SiO2 и Pd/TiO2–SiO2 (образцы 1–3).
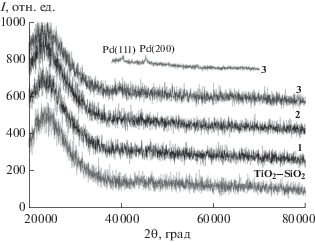
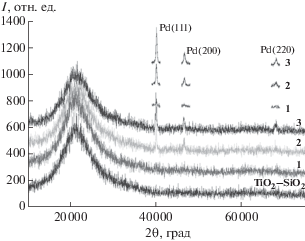
На дифрактограммах прокаленных образцов 1–3 фиксируются ярко выраженные пики, соответствующие отражениям (111), (200) и (220) палладия (рис. 4). С ростом содержания палладия в материале увеличивается интенсивность указанных рефлексов. Соотношение площадей пиков Pd(0) на дифрактограммах 1–3 соответствует соотношению концентраций палладия в образцах.
Рис. 4.
Фрагмент дифрактограммы прокаленных при 850°С ксерогелей TiO2–SiO2 и Pd/TiO2–SiO2 (образцы 1–3).
Оксидная фаза палладия (пики PdO проявляются в углах 2θ = 33.56°, 33.89° и 41.95°) рентгенографически не обнаружена.
Очевидно, при навеске 0.01–0.03 г Pd(NO3)2 · · 2H2O формирование частиц Pd(0) происходит в матрице TiO2–SiO2 при прокаливании ксерогеля. При введении 0.05 г соли образование Pd(0) начинается уже при сушке ксерогеля.
С использованием уравнения Дебая–Шеррера была проведена оценка среднего размера наночастиц палладия:
По результатам электронно-микроскопических исследований морфологии ксерогелей (рис. 5), частицы Pd(0) имеют форму, близкую к сферической. Значительная доля частиц представлена сростками кристаллов.
Рис. 5.
Микрофотографии прокаленных ксерогелей Pd/TiO2–SiO2: а – образец 1; б, в – образец 2; г – образец 3.

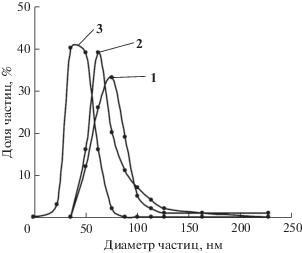
На основании данных электронной микроскопии было исследовано распределение частиц палладия по размерам. Полученные результаты приведены на рис. 6. В образцах 1–3 ~80% частиц палладия имеют размеры 76 ± 13, 64 ± 12 и 44 ± 8 нм соответственно. При этом в образцах 1, 2 не наблюдается присутствия частиц металла <36 нм, а в образце 3 – >89 нм.
Размер наночастиц палладия в образцах 1–3, рассчитанный по формуле Дебая–Шеррера, оказался меньше, чем размер, определенный с помощью электронной микроскопии. По-видимому, основной причиной является дисперсия распределения частиц по размерам. Кроме того, различия возможны и по другим причинам. Во-первых, если отдельная частица, наблюдаемая в электронном микроскопе, состоит из нескольких областей когерентного рассеяния (ОКР), т.е. является сростком монокристаллов, имеющих размер ОКР. Во-вторых, поскольку область когерентного рассеяния соответствует внутренней (упорядоченной) области частицы и не включает сильно искаженные границы.
Таким образом, в ряду образцов 1–3 наблюдается как повышение однородности размеров частиц палладия, так и увеличение их дисперсности.
В качестве возможного объяснения наблюдаемому явлению можно предположить следующее. Увеличение концентрации Pd(NO3)2 · 2H2O в смеси ТБТ + ТЭОС обеспечивает более плотное заполнение порового пространства солью палладия в сформированном ксерогеле. Это блокирует доступ кислорода в поры при прокаливании материала, что затрудняет выгорание органических продуктов гидролиза металлорганических прекурсоров. Органика карбонизируется, и углерод тем сильнее препятствует срастанию кристаллитов палладия, чем большее его количество образовалось в порах ксерогеля.
ЗАКЛЮЧЕНИЕ
Разработана малостадийная методика синтеза палладийсодержащего ксерогеля TiO2–SiO2, исключающая стадию пропитки неорганической матрицы солью палладия и не требующая использования дополнительных восстанавливающих агентов. Установлено, что, варьируя концентрацию Pd(NO3)2 · 2H2O в смеси ТБТ + ТЭОС, можно регулировать размеры частиц Pd(0) в прокаленном материале.
Список литературы
Borodziński A., Bond G.C. // Catalysis Rev. 2008. V. 50. № 3. P. 379.
Magdalinova N.A., Kalmykov P.A., Klyuev M.V. // Russ. J. Gen. Chem. 2014. V. 84. № 1. P. 33. [Магдалинова Н.А., Калмыков П.А., Клюев М.В. // Журн. общ. химии. 2014. Т. 84. № 1. С. 35.]
Yu L.J., Jiang D.H., Xu J. et al. // China Petroleum Processing & Petrochemical Technology. 2012. V. 14. № 3. P. 83.
Liu Shi-Yong, Li Han-Ying, Shi Min-Min et al. // Macromolecules. 2012. V. 45. № 22. P. 9004.
Захарян Е.М. Катализаторы гидрирования непредельных соединений на основе полиамидоаминных (РАМАМ) дендримеров и наночастиц палладия и родия. Дис. … канд. хим. наук. М., 2015. 148 с.
Kulazynski M., Ommen J.G., Trawczynski J., Walendziewski J. // Appl. Catal., B. 2002. V. 36. № 3. P. 239.
Jin M., Liu H., Zhang H. et al. // Nano Research. 2011. V. 4. № 1. P. 83.
Karakas G., Yetisemiyen P. // Top. Catal. 2013. V. 56. № 18–20. P. 1883.
Тарасенко Ю.А., Герасимюк И.П., Лапко В.Ф., Лысенко А.А. // Катализ и нефтехимия. 2001. № 9–10. С. 72.
Аль-Вадхав Х.А. // Вестн. МИТХТ. 2012. Т. 7. № 1. С. 3.
Kalmykov P.A., Klyuev M.V. // Pet. Chem. 2016. V. 56. № 1. С. 27 [Калмыков П.А., Клюев М.В. // Нефтехимия. 2016. Т. 56. № 1. С. 35.]
Аксенов И.А. Наноструктурированные катализаторы селективного гидрирования ацетиленовых и диеновых углеводородов. Дис. … канд. хим. наук. М., 2014. 150 с.
Kalmykov P.A., Magdalinova N.A., Klyuev M.V. // Pet. Chem. 2016. V. 56. № 1. P. 63. [Калмыков П.А., Магдалинова Н.А., Клюев М.В. // Нефтехимия. 2015. Т. 55. № 1. С. 66.]
Калмыков П.А. Гидрирование органических соединений в присутствии палладийсодержащих углеродных наноматериалов. Дис. … канд. хим. наук. Иваново, 2016. 133 с.
Kushch S.D., Kuyunko N.S., Tarasov B.P. // Russ. J. Gen. Chem. 2009. V. 79. № 6. P. 1106. [Кущ С.Д., Куюнко Н.С., Тарасов Б.П. // Журн. общ. химии. 2009. Т. 79. № 6. С. 934.]
Симонов П.А. Катализаторы Pd/C: изучение физико-химических процессов формирования активного компонента из H2PdCl4. Дис. … канд. хим. наук. Новосибирск, 2000. 159 с.
Галкин А.А., Туракулова А.О., Кузнецова Н.Н., Лунин В.В. // Вестн. Моск. ун-та. Сер. 2. Химия. 2001. Т. 42. № 5. С. 305.
Машковский И.С., Тарасов А.Л., Кустов Л.М. и др. // Катализ в промышленности. 2012. № 1. С. 33.
Еременко Н.К., Образцова И.И., Сименюк Г.Ю., Еременко А.Н. // Ползуновский вестник. 2014. № 3. С. 91.
Лапко В.Ф., Сварковская И.П., Каниболоцкий В.А., Герасимюк И.П. // Наносистемы, наноматериалы, нанотехнологии (Nanosystems, Nanomaterials, Nanotechnologies). 2015. Т. 13. № 4. С. 627.
Sovestnov A.E., Naberezhnov A.A., Kumzerov Y.A. et al. // Phys. Solid State. 2013. V. 55. № 4. P. 837. [Совестнов А.Е., Набережнов А.А., Кумзеров Ю.А. и др. // Физика тв. тела. 2013. Т. 55. № 4. С. 766.]
Исаева А.Н. // ХIII Ежегодная молодежная научная конференция студентов, аспирантов и молодых ученых “Исследования и разработки передовых научных направлений”. Тез. докл. Ростов-на-Дону. 17–27 апреля 2017. С. 89.
Xiao F., Zhang X., Li Y. et al. // Nanoscience and Nanotechnology Letters. 2017. V. 9. № 9. P. 1432.
Borisov R.V., Belousov O.V., Zhizhaev A.M., Dorokhova L.I. // Journal of Siberian Federal University. Chemistry. 2015. V. 8. № 3. P. 377. [Борисов Р.В., Белоусов О.В., Жижаев А.М., Дорохова Л.И. // Журнал Сибирского федерального университета. Химия. 2015. Т. 8. № 3. С. 377.]
Somboonthanakij S., Mekasuwandumrong O., Panpranot J. et al. // Catal. Lett. 2007. V. 119. № 3. P. 346.
Lokteva E.S., Klokov S.V., Golubina E.V. et al. // Russ. Chem. Bull. 2016. V. 65. № 11. P. 2618. [Локтева Е.С., Клоков С.В., Голубина Е.В. и др. // Изв. АН. Сер. хим. 2016. Т. 65. № 11. С. 2618.]
Shishmakov A.B., Mikushina Yu.V., Koryakova O.V. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 6. P. 787. [Шишмаков А.Б., Микушина Ю.В., Корякова О.В. и др. // Журн. неорган. химии. 2012. Т. 57. № 6. С. 857.]
Shishmakov A.B., Molochnikov L.S., Antonov D.O. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 3. P. 159. [Шишмаков А.Б., Молочников Л.С., Антонов Д.О. и др. // Журн. неорган. химии. 2014. Т. 59. № 3. С. 297.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии