Журнал неорганической химии, 2022, T. 67, № 9, стр. 1274-1282
Сорбция германия(IV) неорганическими оксидами, послойно модифицированными полигексаметиленгуанидином и тайроном
В. Н. Лосев a, О. В. Буйко a, *, С. Л. Дидух-Шадрина a, А. Ф. Шиманский a, А. М. Жижаев b
a Сибирский федеральный университет
660041 Красноярск, Свободный пр-т, 79, Россия
b Институт химии и химической технологии СО РАН – обособленное подразделение ФИЦ
“Красноярский научный центр СО РАН”
660036 Красноярск, Академгородок, 50, Россия
* E-mail: obuyko@sfu-kras.ru
Поступила в редакцию 09.02.2022
После доработки 21.03.2022
Принята к публикации 30.03.2022
- EDN: KXDZAM
- DOI: 10.31857/S0044457X22090070
Аннотация
Исследованы закономерности сорбции Ge(IV) сорбентами на основе оксидов алюминия и кремния, послойно модифицированных полигексаметиленгуанидином (ПГМГ) и тайроном (Al2O3-ПГМГ-тайрон, SiO2-ПГМГ-тайрон). Рассмотрено влияние льюисовских кислотных центров оксида алюминия на закрепление реагентов-модификаторов и извлечение Ge(IV). В отличие от оксида кремния, закрепление тайрона наблюдается и на не модифицированной ПГМГ поверхности оксида алюминия. Установлено, что на сорбенте Al2O3-ПГМГ-тайрон извлечение германия(IV) наблюдается как за счет взаимодействия с реагентом – тайроном, так и за счет взаимодействия с поверхностью оксида алюминия, а на SiO2-ПГМГ-тайрон только за счет комплексообразования с реагентом с образованием поверхностных соединений стехиометрии Ge : тайрон = 1 : 3. Количественное (99%) извлечение Ge(IV) сорбентом SiO2-ПГМГ-тайрон достигается в диапазоне pH 2.0–6.5, а сорбентом Al2O3-ПГМГ-тайрон – в диапазоне от 0.5М HCl до pH 8.5.
ВВЕДЕНИЕ
Германий широко используется при производстве оптоволоконных кабелей, датчиков инфракрасного излучения, устройств детектирования γ-излучения [1–3]. Несмотря на высокое содержание германия в земной коре, он относится к рассеянным элементам [4, 5]. В промышленности германий получают попутно при переработке полиметаллических и сульфидных руд меди, цинка, свинца, а также при сжигании некоторых каменных углей [1, 6, 7]. Залежи углей с высоким содержанием германия порядка 500–3000 г/т расположены в Китае и России [8–10]. К альтернативным углеродсодержащим источникам германия можно отнести лигниты, содержащие ценные микрокомпоненты: редкоземельные элементы и германий, и представляющие собой ископаемую углефицированную древесину.
Для концентрирования германия и отделения от сопутствующих макрокомпонентов наиболее широко применяют методы экстракции и сорбции. Среди экстрагентов наиболее часто используют анионообменные такие, как Alamine 336, Aliquat 336 и Cyanex 923, при этом германий(IV) необходимо переводить в анионные комплексы добавлением комплексообразователей таких, как оксалаты, цитраты, катехолы и т.д. [11–14].
Преимуществами сорбционного метода является возможность концентрирования микрокомпонентов из больших объемов растворов на небольшой массе сорбента, снижение относительных пределов их обнаружения и отсутствие токсичных органических растворителей [15, 16]. Для создания селективных сорбентов на поверхности твердой матрицы возможно закрепление реагентов, положительно зарекомендовавших себя при экстракционном выделении германия(IV).
Предложен способ получения сорбентов методом последовательного модифицирования неорганических оксидов полимерными полиаминами и сульфосодержащими органическими реагентами, селективными по отношению к извлекаемому иону металла [17]. В настоящей работе для сорбционного концентрирования Ge(IV) предложено использовать оксиды кремния и алюминия, послойно модифицированные полигексаметиленгуанидином (ПГМГ) и органическим реагентом – тайроном (SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон). Выбор оксидов кремния и алюминия обоснован их механической прочностью, высокой гидролитической устойчивостью в слабокислых, нейтральных и слабощелочных средах, отсутствием явления набухания [18, 19].
Промежуточный модификатор – полигексаметиленгуанидин имеет в составе протонированые в широком диапазоне pH гуанидиновые группы, что обеспечивает возможность его электростатического закрепления на поверхности неорганического оксида и взаимодействие с сульфогруппами органического реагента. В качестве реагента использовали тайрон (пирокатехин-3,5-дисульфокислоту), образующий устойчивые комплексы с германием(IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Исходный раствор германия(IV) c концентрацией 200 мг/л готовили растворением точной навески GeO2 (≥99.99%) в 6 М HCl. Растворы германия с меньшей концентрацией готовили разбавлением растворами хлороводородной кислоты, соответствующей концентрации.
Исходные растворы щелочных, щелочноземельных элементов, а также Fe(III) и Cu(II) получали растворением соответствующих солей квалификации х. ч. в 0.1 M HCl. Исходные растворы Se(IV) и As(V) готовили растворением H2SeO3 и Na2HAsO4 ⋅ 7H2O квалификации х. ч. в 0.1 M HCl.
Растворы ПГМГ и пирокатехин-3,5-дисульфокислоты (тайрон) с концентрацией 7.5 и 0.1% мас./об. соответственно готовили растворением точной навески реагентов квалификации х. ч. в деионизированной воде. Растворы тайрона с меньшей концентрацией готовили разбавлением исходного раствора деионизированной водой.
Для приготовлений растворов хлороводородной и азотной кислот использовали HCl и HNO3 классификации ос. ч., которые дополнительно очищали перегонкой с использованием кислотного дистиллятора distillacidTM BSB-939-IR (Berghof, Германия). Растворы кислоты с более низкими концентрациями готовили разбавлением деионизированной водой.
В качестве основы для синтеза сорбентов использовали кремнезем марки Силохром С-120 (фракция 0.1–0.2 мм, удельная поверхность 120 м2/г, средний диаметр пор 45 нм, насыпная плотность 0.33 г/см3) и оксид алюминия (размер частиц 0.063–0.160 мм; удельная площадь поверхности 256 м2/г, средний диаметр пор 15 нм, насыпная плотность 1.01 г/см3).
Методы. Спектры поглощения и оптическую плотность растворов тайрона регистрировали на спектрофотометре Lambda 35 (Perkin-Elmer, США). Распределением металлов контролировали анализом водной фазы методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой на спектрометре iCAP 6500 DUO (Thermo Scientific, США). рН растворов контролировали при помощи иономера SevenMulti (Mettler-Toledo, Швейцария). Для пропускания растворов через колонку, заполненную сорбентом, использовали перистальтический насос Masterflex (Cole-Parmer Instruments Company, США).
Микрофотографии сорбентов получали с помощью сканирующего электронного микроскопа S5500 (Hitachi, Япония) в обратно-отраженных электронах при ускоряющем напряжении 3 кэВ.
Модифицирование оксидов кремния и алюминия ПГМГ и тайроном. Перед модифицированием проводили предварительную активацию поверхности кремнезема, для этого навеску кремнезема выдерживали в растворе NaOH при рН 9 в течение 2 ч, затем промывали деионизированной водой до рН 7. Исходный оксид алюминия был активирован, поэтому его промывали только деионизированной водой.
Модифицирование поверхности оксида кремния или алюминия ПГМГ проводили следующим образом: к навеске (5 г) кремнезема или оксида алюминия при постоянном перемешивании в течение 30 мин по каплям добавляли 100 мл раствора ПГМГ с концентрацией 25 г/л. Данный способ позволяет закреплять максимальное количество полиамина на поверхности неорганических оксидов. Полученный сорбент (SiO2-ПГМГ, Al2O3-ПГМГ) промывали деионизованной водой до отсутствия положительной реакции на полиамин в промывной воде и высушивали при 60°С. Присутствие ПГМГ в промывной воде определяли визуально по его реакции с бромфеноловым синим.
Эффективность модифицирования тайроном неорганических оксидов, в том числе предварительно модифицированных ПГМГ, исследовали обработкой их поверхности растворами реагента с различной концентрацией.
Исследование зависимости степени извлечения тайрона от времени контакта фаз и рН изучали в статическом режиме при комнатной температуре. В градуированную пробирку с притертой пробкой вводили раствор 1 мл 1.5 × 10–3 М раствора тайрона, добавляли HCl или NaOH для создания необходимого значения рН и деионизованную воду до общего объема 10 мл. Вносили 0.1 г сорбента, пробирку закрывали пробкой и перемешивали в течение 1–30 мин в зависимости от поставленной задачи.
Для построения изотерм сорбции тайрона сорбентами SiO2-ПГМГ, Al2O3-ПГМГ и исходным Al2O3 при комнатной температуре в пробирки вместимостью 10 мл вводили от 0.5 до 6.0 мл исходного раствора тайрона при рН 2, доводили до 10 мл водой, вносили 0.1 г сорбента, пробирки закрывали пробками и перемешивали 10 мин.
После сорбции растворы декантировали и определили в них содержание тайрона фотометрическим методом по характеристичной полосе поглощения реагента при 290 нм.
Исследование сорбции германия(IV) проводили с использованием сорбентов с максимальной поверхностной концентрацией тайрона. Синтез сорбентов осуществляли добавлением к 5 г SiO2-ПГМГ или Al2O3-ПГМГ 50 мл раствора тайрона с концентрацией 0.1% при pH 2–4. Полученный сорбент (SiO2-ПГМГ-тайрон, Al2O3-ПГМГ-тайрон) отделяли от раствора декантацией, промывали деионизированной водой и высушивали при комнатной температуре.
Сорбционное концентрирование и десорбция Ge(IV) с использованием SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон. Сорбцию Ge(IV) сорбентами на основе оксида кремния и алюминия, послойно модифицированных ПГМГ и тайроном, изучали в статическом и динамическом режимах при комнатной температуре. В статическом режиме в градуированную пробирку с притертой пробкой вводили раствор ионов Ge(IV) в 0.1 М HCl, добавляли NaOH для создания необходимого значения рН и деионизованную воду до общего объема 10 мл. Вносили 0.1 г сорбента, пробирку закрывали пробкой и перемешивали в течение 1–30 мин в зависимости от поставленной задачи.
При исследовании сорбции в динамическом режиме через стеклянную миниколонку (высотой 10 см и внутренним диаметром 3 мм), содержащую 0.1 г сорбента SiO2-ПГМГ-тайрон (высота слоя сорбента в колонке 60 мм) или Al2O3-ПГМГ-тайрон (высота слоя сорбента в колонке 30 мм), пропускали раствор Ge(IV) со скоростью 1–5 мл/мин.
Содержание Ge(IV) в растворах до и после сорбции определяли атомно-эмиссионным с индуктивно-связанной плазмой методом.
Для десорбции Ge(IV) через миниколонку пропускали 10 мл 1–2 М раствора HCl (HNO3) со скоростью 1 мл/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Сорбенты SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон
При послойном модифицировании закрепление реагентов на поверхности неорганических оксидов происходит за счет образования различных межмолекулярных связей [20].
На поверхности кремнезема присутствуют силанольные и силоксановые группы (рис. 1а). Силанольные группы более активны и легче вступают в химические реакции, чем силоксановые группы, так как протон силанольной группы имеет слабокислый характер и способен вступать в реакции обмена. На поверхности оксида кремния находятся основные центры и бренстедовские кислотные центры, при взаимодействии с которыми происходит закрепление промежуточного слоя ПГМГ за счет электростатического взаимодействия и образования водородных связей (рис. 1а). Непосредственное закрепление тайрона на поверхности кремнезема невозможно из-за взаимного отталкивания депротонированных сульфогрупп реагента и поверхностных силанольных групп.
Рис. 1.
Активные центры на поверхности оксидов кремния (а) и алюминия (б) (1 – основные центры; 2 – бренстедовские кислотные центры; 3 – льюисовские кислотные центры).

Поверхность оксида алюминия химически неоднородна, на ней присутствуют бренстедовские кислотные и основные, а также льюисовские кислотные активные центры (рис. 1б), что обусловливает возможность взаимодействия поверхности оксида алюминия с различными соединениями по разным механизмам [21, 22]. Одним из основных факторов, влияющих на сорбцию органических веществ на поверхности оксида алюминия, является кислотность среды. С увеличением кислотности среды растет число льюисовских кислотных центров поверхности и возрастает общий положительный заряд. Таким образом, сорбция отрицательно заряженных органических соединений за счет электростатических взаимодействий должна увеличиваться при уменьшении рН среды. При рН > 7 поверхность оксида алюминия приобретает отрицательный заряд и сорбция отрицательно заряженных форм невозможна. Тайрон может закрепляться как непосредственно на поверхности оксида алюминия за счет взаимодействия с положительно заряженными льюисовскими кислотными центрами, так и на поверхности оксида алюминия, модифицированного полиамином, за счет электростатического взаимодействия с протонированными аминогруппами ПГМГ и образования водородных связей (рис. 2а).
Рис. 2.
Зависимость степень извлечения тайрона модифицированными и немодифицированными неорганическими оксидами от кислотности среды (а) и изотермы сорбции тайрона (б). V = 10 мл, m(сорбента) = 0.1 г, τ = 10 мин, C(тайрон) = 0.5 ммоль/л (a), pH 2 (б). 1 – Al2O3-ПГМГ, 2 – Al2O3, 3 – SiO2-ПГМГ, 4 – SiO2.

Максимальная степень извлечения тайрона (95–99%) сорбентами SiO2-ПГМГ, Al2O3-ПГМГ и исходным Al2O3 достигается при времени контакта фаз равном 5 мин в диапазоне pH 2.5–5.0 для сорбента SiO2-ПГМГ, pH 1.5–7.0 для Al2O3-ПГМГ, pH 2.5–6.0 для Al2O3. На немодифицированном SiO2 сорбция тайрона отсутствует во всем исследованном диапазоне рН (рис. 2а). Увеличение времени контакта фаз до 30 мин не приводит к изменению степени извлечения реагента. Сорбционная емкость сорбентов SiO2-ПГМГ, Al2O3 и Al2O3-ПГМГ по тайрону составляет 35, 61 и 75 мкмоль/г соответственно (рис. 2б).
Различие в диапазонах pH количественного извлечения тайрона и сорбционной емкости модифицированных и немодифицированных оксидов кремния и алюминия по тайрону обусловлено наличием различных сорбционных центров на их поверхности.
На рис. 3 приведены микрофотографии оксидов кремния и алюминия, послойно модифицированные ПГМГ и тайроном. Видно, что в результате обработки оксидов кремния и алюминия растворами ПГМГ и тайроном на СЭМ-изображениях поверхности наблюдается уплотнение поверхностного слоя реагентов и уменьшение их пористости.
Рис. 3.
СЭМ-фотографии поверхности SiO2 (а), Al2O3 (б), SiO2-ПГМГ-тайрон (в), Al2O3-ПГМГ-тайрон (г).

Поскольку реагенты закреплены на поверхности неорганических оксидов посредством слабых водородных связей и электростатического взаимодействия, исследовано влияние разбавленных растворов HCl и NaCl на устойчивость закрепления тайрона на поверхности SiO2-ПГМГ и Al2O3-ПГМГ (табл. 1). С увеличением кислотности среды происходит протонирование сульфогрупп тайрона и, как следствие, десорбция молекулярной формы реагента с поверхности исследуемых сорбентов. Сорбент на основе оксида алюминия более устойчив к солевому фону (табл. 1), что связано с присутствием на его поверхности льюисовских кислотных центров.
Условия концентрирования Ge(IV) модифицированными и немодифицированными неорганическими оксидами в статическом режиме сорбции
Сорбент SiO2-ПГМГ-тайрон количественно (99%) извлекает Ge(IV) в диапазоне pH 2.0–6.5, а сорбент и Al2O3-ПГМГ-тайрон – pH 1.0–8.5 (рис. 4).
Рис. 4.
Зависимость степени извлечения Ge(IV) модифицированными и немодифицированными неорганическими оксидами от кислотности среды. C(Ge) = 0.5 мкг/мл, V = 10 мл, m(сорбента) = 0.1 г, τ = = 10 мин. 1 – Al2O3-ПГМГ-тайрон, 2 – Al2O3-ПГМГ, 3 – Al2O3, 4 – SiO2-ПГМГ-тайрон, 5 – SiO2-ПГМГ, 6 – SiO2.

При оптимальных значениях рН количественное извлечение Ge(IV) сорбентами SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон достигается при времени контакта фаз равном 10 мин. Дальнейшее увеличение времени контакта фаз не приводит к изменению степени извлечения Ge(IV) данными сорбентами.
Исходный и модифицированный полигексаметиленгуанидином оксиды кремния не извлекают Ge(IV) во всем исследуемом диапазоне pH (рис. 4). Таким образом, можно заключить, что извлечение Ge(IV) сорбентом SiO2-ПГМГ-тайрон происходит по комплексообразующему механизму за счет образования комплексных соединений с тайроном. Степень извлечения Ge(IV) немодифицированным оксидом алюминия составляет 85% при pH > 3, а модифицированным ПГМГ – 81% при рН > 4.
В водных растворах в диапазоне pH 2–8 Ge(IV) существует в виде Ge(OH)4 [13, 23]. При увеличении рН растворов происходит увеличение степени извлечения Ge(IV) оксидом алюминия за счет образования мостиковых OH-групп, при этом алюминий выступает как акцептор гидроксильных групп, а германий как донор. Модифицирование Al2O3 полигексаметиленгуанидином существенно не снижает степень извлечения микроколичеств Ge(IV), что вероятно связано с тем, что полиамин не полностью покрывает поверхность оксида алюминия и остается возможность сорбции Ge(IV) на свободной от полиамина поверхности.
При использовании сорбента Al2O3-ПГМГ-тайрон наблюдается снижение степени извлечения Ge(IV) до 80% в диапазоне pH 3.0–5.0, поскольку при pH > 4 германий(IV) извлекается за счет взаимодействия с поверхностью оксида алюминия вместо комплексообразования с тайроном.
Изотермы сорбции Ge(IV) на сорбентах Al2O3-тайрон, Al2O3-ПГМГ-тайрон, SiO2-ПГМГ-тайрон (рис. 5) имеют L-образный вид, что свидетельствует о высоком сродстве сорбентов к низким концентрациям элемента, а начальные участки изотерм сорбции (область Генри) практически совпадающие с осью ординат, свидетельствуют о высоких значениях коэффициентов (1.5 × 104 см3/г) распределения, характерных для процессов комплексообразования извлекаемого иона с функциональными группами сорбентов. Более низкие значения коэффициентов распределения (1.2 × 102 см3/г) соответствуют начальному участку изотермы сорбции Ge(IV) на Al2O3-ПГМГ (рис. 5б).
Рис. 5.
Изотермы сорбции Ge(IV) модифицированными неорганическими оксидами общий вид (а) и начальный участок (б). V = 10 мл, m(сорбента) = 0.1 г, τ = 10 мин, pH 2. 1 – Al2O3-ПГМГ-тайрон, 2 – Al2O3-ПГМГ, 3 – SiO2-ПГМГ-тайрон, 4 – Al2O3-тайрон.
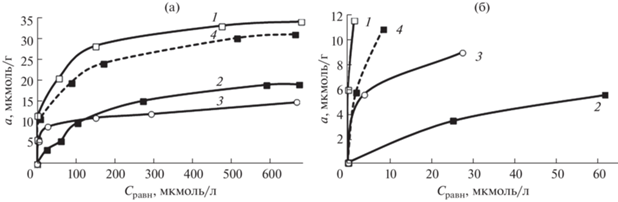
Сорбционная емкость сорбентов SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон, определенная из горизонтальных участков изотерм сорбции, по отношению к Ge(IV) составляет 13 и 30 мкмоль/г соответственно. Сопоставление количества тайрона, закрепленного на поверхности сорбентов SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон, с количеством сорбированного Ge(IV), определенного из горизонтальных участков изотерм сорбции, позволяет сделать вывод об образовании на поверхности данных сорбентов комплексов стехиометрии Ge(IV) : тайрон = 1 : 3. Комплексы Ge(IV) с пирокатехином и его производными аналогичной стехиометрии образуются в водных растворах [24, 25], что подтверждает комплексообразующий механизм извлечения германия сорбентами SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон.
Условия концентрирования Ge(IV) модифицированными неорганическими оксидами в динамическом режиме сорбции
Изучены условия сорбционного концентрирования ионов Ge(IV) в динамическом режиме сорбентами Al2O3-тайрон, Al2O3-ПГМГ, Al2O3-ПГМГ-тайрон, SiO2-ПГМГ-тайрон (рис. 6).
Рис. 6.
Динамические выходные кривые сорбции Ge(IV) на модифицированных неорганических оксидах. С(Ge) = 1 мкг/мл, m(сорбента) = 0.1 г, τ = 10 мин, pH 2, υ = 1 мл/мин. 1 – Al2O3-ПГМГ-тайрон, 2 – Al2O3-ПГМГ, 3 – SiO2-ПГМГ-тайрон, 4 – Al2O3-тайрон.
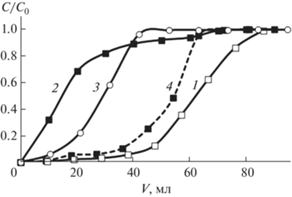
Как видно из рис. 6 сорбент Al2O3-ПГМГ практически не извлекает Ge(IV). Сорбент SiO2-ПГМГ-тайрон также характеризуется невысокой динамической сорбционной емкостью по Ge(IV) в силу низкой поверхностной концентрации реагента. Максимальная динамическая сорбционная емкость по Ge(IV) наблюдается для сорбента Al2O3-ПГМГ-тайрон, который использовали для дальнейших исследований.
Увеличение скорости потока раствора от 0.5 до 1.5 мл/мин не приводит к изменению степени извлечения германия(IV) из 40 мл раствора с концентрацией 1 мкг/мл сорбентом Al2O3-ПГМГ-тайрон составляющей 99%. При увеличении скорости потока до 2 мл/мин наблюдается незначительное снижение степени извлечения германия до 96%.
При использовании 40 мл исходного раствора и объема сорбента Al2O3-ПГМГ-тайрон в колонке равном 0.21 мл, количественное извлечение германия (на уровне 99%) достигается из 190 колоночных объемов раствора.
Поскольку при увеличении кислотности растворов снижается степень извлечения германия(IV), то в качестве десорбирующих растворов использовали разбавленные растворы неорганических кислот. Результаты десорбции германия(IV) растворами HNO3 и HCl приведены в табл. 2. Видно, что количественная десорбция германия(IV) с поверхности Al2O3-ПГМГ-тайрон достигается при пропускании 10 мл 1 М HNO3. В процессе десорбции германия(IV) с поверхности сорбента Al2O3-ПГМГ-тайрон происходит и десорбция реагента. Однако ПГМГ остается закрепленным на поверхности кремнезема, и при повторной обработке водным раствором тайрона сорбционные свойства сорбента по отношению к германию(IV) восстанавливаются. Последующее модифицирование сорбента Al2O3-ПГМГ раствором тайрона после десорбции германия(IV) позволяет выдерживать, по крайней мере, 10 циклов сорбции–десорбции без снижения емкостных характеристик сорбента.
Селективность концентрирования Ge(IV) сорбентом Al2O3-ПГМГ-тайрон
Для определения селективности концентрирования германия на Al2O3-ПГМГ-тайрон создавали бинарные системы, содержащие 0.05 мкг/мл германия(IV) и 0.5 или 5 мкг/мл мышьяка(V), селена(IV), железа(III), меди(II). Сорбцию проводили в динамическом режиме со скоростью потока 1.5 мл/мин из объема раствора 40 мл при рН 2.0. Полученные значения селективности приведены в табл. 3.
Таблица 3.
Селективность извлечения германия(IV) в бинарных системах
| Смесь | C, мкг/мл | R(Ge), % | |||
|---|---|---|---|---|---|
| 10 мл | 20 мл | 30 мл | 40 мл | ||
| Ge(IV) + As(V) | 0.05 + 0.5 | 96 | 44.4 | 18.7 | 33.3 |
| 0.05 + 5 | 96 | 36.3 | 1.3 | 0.2 | |
| Ge(IV) + Se(IV) | 0.05 + 0.5 | 91 | 76 | 60 | 46 |
| 0.05 + 5 | 98 | 91 | 98 | 97 | |
| Ge(IV) + Fe(III) | 0.05 + 0.5 | 96 | 93 | 94 | 92 |
| 0.05 + 5 | 98 | 83 | 93 | 91 | |
| Ge(IV) + Cu(II) | 0.05 + 0.5 | 94 | 93 | 96 | 95 |
| 0.05 + 5 | 81 | 75 | 92 | 95 | |
Возможность концентрирования германия сорбентом Al2O3-ПГМГ-тайрон из растворов после вскрытия лигнитов определяли на модельных растворах максимально приближенных к составу лигнита, содержащих 0.05 мкг/мл германия(IV) и сопутствующие элементы: 0.5 мг/л железа(III), алюминия(III), кальция(II), магния(II), натрия(I), калия(I), 0.05 мг/л цинка(II), хрома(III), никеля(II), марганца(II), кобальта(II), меди(II). Сорбцию проводили в динамическом режиме со скоростью потока 1.5 мл/мин из объема раствора 50 мл при рН 2.0. Концентрацию германия контролировали каждые 10 мл.
При сорбции германия(IV) из растворов с рН 2.0 из 10 мл раствора, пройденных через миниколонку, наблюдалось количественное извлечение германия, при увеличении объема раствора до 50 мл степень извлечения снижается до 98%. Количественная десорбция германия достигается при пропускании 10 мл 1 М HNO3, с получением концентрированного по германию раствора.
Таким образом, сорбент Al2O3-ПГМГ-тайрон может быть использован для концентрирования германия(IV) из сложных систем, подобных лигниту, с последующей десорбцией 1 M раствором HNO3.
ЗАКЛЮЧЕНИЕ
Получены сорбционные материалы на основе оксидов кремния и алюминия, характеризующиеся простым синтезом, для концентрирования и отделения Ge(IV) от сопутствующих ионов цветных, щелочноземельных и щелочных металлов. Германий(IV) извлекается сорбентом на основе Al2O3 как за счет взаимодействия с тайроном, так и за счет взаимодействия с поверхностью оксида алюминия, а SiO2-ПГМГ-тайрон только за счет комплексообразования. Сорбционная емкость SiO2-ПГМГ-тайрон и Al2O3-ПГМГ-тайрон по отношению к Ge(IV) составляет 30 и 13 мкмоль/г, при этом на поверхности образуются комплексные соединения стехиометрии Ge : тайрон = 1 : 3. Концентрированию германия(IV) (0.05 мкг/мл) полученными сорбентами не мешают в кратных количествах: Na(I), K(I), (1000), Ca(II), Mg(II) (500), As(V), Se(IV), Fe(III), Cu(II) (100).
Сорбенты на основе оксида кремния и алюминия, послойно модифицированные полигексаметиленгуанидином и тайроном, могут быть использованы для концентрирования Ge(IV) из сложных систем.
Список литературы
Etschmann B., Liu W., Li K. et al. // Chem. Geol. 2017. V. 463. P. 29. https://doi.org/10.1016/j.chemgeo.2017.05.006
Zhou Ch., Du J., Zhang Yu. et al. // Fuel. 2021. V. 305. P. 121532. https://doi.org/10.1016/j.chemgeo.2017.05.006
Rafiee P., Ghassa S., Moosakazemi F. et al. // Clean. Prod. 2021. V. 315. P. 128223. https://doi.org/10.1016/j.jclepro.2021.128223
Zhang L., Xu Zh. // J. Hazard. Mater. 2016. V. 312. P. 28. https://doi.org/10.1016/j.jhazmat.2016.03.025
Torralvo F.A., Fernández-Pereira C., Villard E.G. et al. // Miner. Eng. 2018. V. 128. P. 106. https://doi.org/10.1016/j.mineng.2018.07.022
Chimenos J.M., Fernández A.I., del Valle-Zermeño R. et al. // Fuel. 2013. V. 112. P. 450. https://doi.org/10.1016/j.fuel.2013.05.059
Cheng. W.-Sh., Chang Bi-Ch., Chiu K.-L. // J. Environ. Chem. Eng. 2017. V. 5. P. 215. https://doi.org/10.1016/j.jece.2017.09.048
Arbuzov S.I., Spears D.A., Ilenok S.S. et al. // Ore Geol. Rev. 2021. V. 132. P. 103986. https://doi.org/10.1016/j.oregeorev.2021.103986
Dai Sh., Chekryzhov I.Yu., Seredin V.V. et al. // Gondwana Res. 2016. V. 29. P. 60. https://doi.org/10.1016/j.gr.2015.07.001
Qi H.-W., Rouxel O., Hu R.-Zh. et al. // Chem. Geol. 2011. V. 286. P. 252. https://doi.org/10.1016/j.chemgeo.2011.05.011
Haghighi H.K., Irannajad M., Fortuny A., Sastre A.M. // Hydrometallurgy. 2018. V. 175. P. 164. https://doi.org/10.1016/j.hydromet.2017.11.006
Tao Zh., Tao J., Zhihong L. // Miner. Eng. 2021. V. 160. 106682. https://doi.org/10.1016/j.mineng.2020.106682
Tao J., Tao Zh., Zhihong L. // J. Clean. Prod. 2021. V. 294. P. 126217. https://doi.org/10.1016/j.jclepro.2021.126217
Patel M., Karamalidis A.K. // Sep. Purif. Technol. 2021. V. 275. P. 118981. https://doi.org/10.1016/j.seppur.2021.118981
Bodnar' N.M., Buslaeva T.M., Erlikh G.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 4. P. 586. [Боднарь Н.М., Буслаева Т.М., Эрлих Г.В. и др. // Журн. неорган. химии. 2021. Т. 66. № 4. С. 549.]https://doi.org/10.1134/S0036023621040045
Alifkhanova L.M.k., Petrova Y.S., Bosenko S.N. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 4. P. 578. [Алифханова Л.М.к., Петрова Ю.С., Босенко С.Н. и др. // Журн. неорган. химии. 2021. Т. 66. № 4. С. 540.]https://doi.org/10.1134/S0036023621040033
Buyko O.V., Metelitsa S.I., Losev V.N. et al. // Anal. Method. 2020. V. 12. P. 3813. https://doi.org/10.1039/d0ay00624
Keshtkar Z., Tamjidi S., Vaferi B. // Environ. Technol. Innov. 2021. V. 22. P. 101439. https://doi.org/10.1016/j.eti.2021.101439
Wu H., Kudo T., Kim S.-Yu. et al. // Nucl. Eng. Technol. 2022. V. 54. P. 1597. https://doi.org/10.1016/j.net.2021.10.026
Losev V., Buyko O., Metelitsa S. et al. // Sep. Sci. Technol. 2020. V. 56. P. 1510. https://doi.org/10.1080/01496395.2020.1785500
Nastova I., Skapin T., Pejov L. // Surf. Sci. 2011. V. 605. P. 1525. https://doi.org/10.1016/j.susc.2011.05.023
Zamani M., Delfani A.M., Jabbari M. // Spectrochim. Acta. A. 2018. V. 201. P. 288. https://doi.org/10.1016/j.saa.2018.05.004
Hernández-Expósito A., Chimenos J.M., Fernández A.I. et al. // Chem. Eng. J. 2006. V. 118. P. 69. https://doi.org/10.1016/j.cej.2006.01.012
Cruz C.A., Marie S., Arrachart G., Pellet-Rostaing S. // Sep. Purif. Technol. 2018. V. 193. P. 214. https://doi.org/10.1016/j.seppur.2017.11.013
Takemura H., Morisada S., Ohto K. et al. // J. Chem. Technol. Biotechnol. 2013. V. 88. P. 1468. https://doi.org/10.1002/jctb.3985
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


