Журнал неорганической химии, 2022, T. 67, № 9, стр. 1219-1224
Рентгеноконтрастная стеклокерамика с микрокристаллами танталата кальция для лечения злокачественных новообразований
О. С. Плотникова a, b, *, Д. Н. Грищенко c, М. А. Медков c, В. И. Апанасевич a, И. В. Панкратов b, В. И. Невожай a, А. А. Полежаев a, Е. П. Костив a
a Тихоокеанский государственный медицинский университет
690002 Владивосток, пр-т Острякова, 2, Россия
b Приморский краевой онкологический диспансер
690105 Владивосток, ул. Русская, 59, Россия
c Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: radiolog2906@gmail.com
Поступила в редакцию 09.02.2022
После доработки 23.03.2022
Принята к публикации 30.03.2022
- EDN: XDDLRA
- DOI: 10.31857/S0044457X22090094
Аннотация
С целью расширения списка материалов, пригодных для лечения злокачественных новообразований, получена композиционная стеклокерамика, состоящая из микрокристаллов танталата кальция, заключенных в матрицу стекла. Материал исследован in vivo. Композит является радиомодификатором, улучшает визуализацию зоны облучения, не представляет угрозы радиоактивного заражения организма, снижает вероятность возникновения лучевых осложнений в здоровых тканях. Установлено, что благодаря двухфазному составу стеклокерамики микрокристаллы CaTa2O6 способны задерживаться в тканях в месте введения и обеспечивать более результативную лучевую терапию. Радиосенсибилизационные свойства материала повышают эффективность однократной дозы облучения. Созданная стеклокерамика является перспективным материалом для лечения больных, нуждающихся в применении радиотерапии.
ВВЕДЕНИЕ
Биологически активное стекло создано группой американских ученых в 1969 г. Стекло с соотношением компонентов (мас. %): SiO2 – 45; Na2O – 24.5; CaO – 24.5; P2O5 – 6 названо Bioglass 45S5. Оно считается остеокондуктивным, остеоиндуктивным и биодеградируемым. Влияние биостекла на рост и биоминерализацию клеток обеспечивается способностью осаждать на своей поверхности слой гидроксилированного карбоната апатита, идентичного минеральной фазе костной ткани [1–3]. Известна способность биостекол связываться с мягкими тканями [4]. В частности, было продемонстрировано, что биоактивные стекла и стеклокерамика могут быть использованы для регенерации широкого спектра мягких тканей [5–7].
Проводимые в настоящее время разработки новых продуктов для клинического применения способствуют расширению списка материалов, используемых в медицине, и созданию более перспективных их видов. Например, допирование биостекол различными металлами открывает новые возможности для их использования. В частности, допирование тяжелыми металлами, такими как висмут, вольфрам и тантал [8–10], делает их рентгеноконтрастными, что позволяет визуализировать процессы восстановления тканей.
В последнее время появились сообщения об использовании биостекол и стеклокерамики для лечения онкологических заболеваний методами гипертермии и брахитерапии. В первом случае допирование оксидами железа придает стеклам магнитные свойства, что позволяет использовать их для гипертермии [11–13], в результате которой с помощью внешнего магнитного поля локально в области злокачественного новообразования повышается температура. Этот внутренний источник тепла вызывает апоптоз в клетках опухоли, не повреждая здоровые окружающие ткани. Для брахитерапии онкологических заболеваний предложено использовать радиоизотопы, например, 135Sm, 90Sr и 90Y, включенные в матрицу биорезорбируемых стекол [12]. Так, метод радионуклидной эмболизации стеклянными микросферами с радиоизотопом иттрия-90 предложен для лечения злокачественных опухолей печени и желчевыводящих путей [14]. Микросферы состоят из стекла диаметром 20–30 мкм, в котором в матрицу встроен изотоп 89Y. Перед процедурой эмболизации иттрий-89 в ядерном реакторе активируется нейтронами до иттрия-90. Микросферы с 90Y вводят точно в артерии, питающие новообразование, и по капиллярам они попадают в ложе опухоли. Радиоизотоп создает внутри опухоли высокую дозу облучения (120–200 Гр) при относительно небольшом облучении (20–30 Гр) здоровой ткани печени, окружающей опухоль.
Наиболее перспективным направлением в области разработки радиомодификаторов является создание препарата на основе микро- и наночастиц тяжелых металлов, так как чем больше атомный номер ядра атома, тем выше вероятность взаимодействия фотонов тормозного и гамма-излучения с веществом путем фотоэффекта [15]. Создание препаратов, основанных на использовании наноразмерных частиц тяжелых элементов, например Ta2O5, представляет особый интерес, так как тантал обладает низкой токсичностью и практически биоинертен, что позволяет широко использовать его в медицине [16].
В данной статье представлен способ получения танталсодержащего композиционного материала на основе Bioglass 45S5 и исследована in vivo его способность к преодолению радиорезистентности опухоли за счет локальной радиомодификации злокачественных новообразований.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы композиционного материала, состоящего из Bioglass 45S5 и Ta2O5, получены одним из трех способов, разработанных в работе [17]. Состав образцов, мас. %: Ta2O5 – 20, SiO2 – 36, Na2O – 19.6, CaO – 19.6, P2O5 – 4.8 и Ta2O5 – 40, SiO2 – 27, Na2O – 14.7, CaO – 14.7, P2O5 – 3.6.
Выбран следующий способ. В органический раствор, содержащий олеат натрия, тетраэтоксисилан, олеат кальция и трибутилфосфат в стехиометрических количествах для получения биостекла 45S5, добавляли кристаллический оксид тантала. В качестве растворителя выступала смесь скипидара (сульфатного очищенного для органического синтеза) с толуолом в соотношении 40 : 60 соответственно. Все компоненты тщательно перемешивали при нагревании и производили отгонку растворителя при температуре 200°С. Образовавшийся прекурсор подвергали пиролизу в муфельной печи Nabertherm L5/13/B180 при средней скорости нагрева 7 град/мин до 1300°С и выдержке при этой температуре 30 мин. Для стеклования компонентов материал переносили в камеру отжига с температурой 550°С и выдерживали в течение 2 ч. Затем образец охлаждали при комнатной температуре и измельчали на вибрационной микромельнице Fritsch Pulverisette-0.
Получены порошки стеклокерамики следующего качества: 100% частиц имели размер <100 мкм, из них 85% частиц – размер <50 мкм. Измерение проведено с помощью ситового анализа ручным сухим способом ситами 01 и 005. Состав материала подтвержден рентгенофазовым анализом с помощью дифрактометра D8 Advance (Bruker AXS, Германия) в CuKα-излучении с графитовым монохроматором, программы поиска EVA и базы порошковых данных ICDD PDF-2. Для исследования состава, а также морфологии образцов использовали метод растровой электронной микроскопии (РЭМ). РЭМ-изображения и энергодисперсионные спектры получали на электронном сканирующем микроскопе S5500 (Hitachi, Япония). Генерацию первичного высокоэнергетического излучения проводили на линейном ускорителе TrueBeam (Varian Medical Systems, США). Уровень вторичного излучения регистрировали с помощью полупроводникового диодного детектора PDI-2.0 tm (Sun Nuclear Corp., США).
Экспериментальную суспензию для лечения злокачественных новообразований готовили непосредственно перед применением следующим образом. Сухой порошок стеклокерамики (150 мг) помещали в 15 мл физиологического раствора, встряхивали и отбирали необходимое количество суспензии шприцем калибра G16 для введения животным.
Эксперимент in vivo проводили на 28 мышах – самках весом 20–22 г. Всем мышам под кожу задней правой лапы перевивали опухоль аденокарциномы Эрлиха (500 000 клеток/мышь) в физиологическом растворе. Животных делили на две группы (по 14 в каждой), различающиеся способом лечения опухоли. Группа 1 – через 10 дней проводили облучение области опухоли. Группа 2 – через 10 дней в область опухоли вводили 0.3 мл экспериментальной суспензии с последующим облучением.
Сеанс лучевой терапии проводили на аппарате True Beam фирмы Varian с применением болюса с энергией фотонов до 6 МэВ одной фракцией, СОД 20 Гр ионизирующего излучения. В процессе эксперимента (на 1, 3, 7, 14 день) из каждой группы изымали по одной особи для взятия материала на гистологическое исследование с целью оценки морфологических изменений в тканях. Поэтому при расчете выживаемости они не учитывались.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Введение в опухоль радиосенсибилизаторов с последующим облучением приводит к появлению дополнительного вторичного излучения внутри опухоли, что усиливает воздействие лучевой терапии. В [18] исследована in vivo возможность применения наночастиц оксида тантала для лечения злокачественных новообразований. Получены результаты, подтверждающие эффективность использования материалов на основе Ta2O5. Отрицательным фактором является слишком высокая скорость выведения оксида тантала из тканей (одни сутки), что нежелательно в условиях длительного лечения заболевания. В целях эффективного проведения лучевой терапии проблему быстрого выведения частиц было решено преодолеть с помощью местного введения в опухоль препарата, состоящего из конгломерата танталсодержащих кристаллов, заключенных в матрицу биостекла.
Установлено, что в результате взаимодействия компонентов стекла Bioglass 45S5 с оксидом тантала при температуре 1300°С образуется танталсодержащая стеклокерамика (рис. 1). Фазовый состав прекурсоров, отожженных при различных температурах, а также при различном содержании Ta2O5 в Bioglass 45S5, был подробно исследован в [17]. Созданный двухфазный композиционный материал состоит из микрокристаллов кубической формы с длиной ребра ~1 мкм, равномерно распределенных в матрице стекла.
Энергодисперсионный спектр образца (рис. 2) подтверждает наличие Na, Ca, P, Si, Ta в составе материала. Согласно данным рентгенофазового анализа (рис. 3), в матрицу стекла заключены микрокристаллы состава CaTa2O6. Кристаллическая фаза соответствует № 01-077-1228 (С) из базы порошковых данных International Centre for Diffraction Data (ICDD), Powder Diffraction File (PDF), Kabekkody, 2007.
Рис. 2.
Микрофотография фрагмента стеклокерамики (а) и ее энергодисперсионный спектр в области сканирования 1 (б).
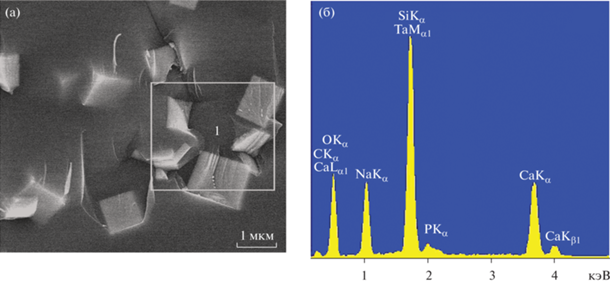
Стекло, в матрице которого находятся микрокристаллы танталата кальция, в живом организме подвергается деградации. Процесс сопровождается постепенным высвобождением кристаллов CaTa2O6. Следовательно, они способны задерживаться в тканях в месте введения на срок, достаточно длительный для эффективной лучевой терапии. Таким образом решается проблема высокой скорости выведения оксида тантала из тканей. При этом у образовавшегося в стекле CaTa2O6 сохраняются такие известные свойства Ta2O5, как рентгеноконтрастность [19] и возможность генерации вторичного излучения [20].
Методом Монте-Карло проведено моделирование генерации вторичного ионизирующего излучения в условиях генерации первичного высокоэнергетического излучения с энергией фотонов 6 МэВ. На рис. 4 представлены показатели генерации вторичного ионизирующего излучения в зависимости от расстояния до поверхности исследуемого образца. Все значения нормированы по отношению к значениям на расстоянии 2 см от поверхности облучаемого объекта, принятого за 100%, соответствующего фоновому значению. Генерация вторичного излучения на стекле, содержащем 20 и 40 мас. % оксида тантала, дает существенную прибавку к генерации вторичного излучения, которая составляет от 69 до 100% на поверхности исследуемого объекта и ~34% на расстоянии 5 мм от поверхности образцов по сравнению с дистиллированной водой. Таким образом, для достижения максимального эффекта необходим непосредственный контакт стеклокерамики, содержащей микрокристаллы CaTa2O6, со злокачественным новообразованием.
Рис. 4.
Показатели генерации вторичного ионизирующего излучения на различных образцах: дистиллированная вода (1), биостекло, содержащее 40 мас. % Ta2O5 (2), биостекло, содержащее 20 мас. % Ta2O5 (3), биостекло (4).

Для экспериментального подтверждения торможения роста перевиваемой животным опухоли выполнены исследования in vivo. Исходя из полученных данных, максимальное значение вторичного излучения получено у поверхности образца стеклокерамики, содержащей 40 мас. % оксида тантала. Тактика эксперимента очевидна: для эффективной лучевой терапии суспензия из композита с максимальным количеством тантала вводится непосредственно в место опухоли.
Результативность введения в опухоль исследуемого препарата оценивали по продолжительности жизни животных в группах с расчетом статистической значимости различий при критическом значении t-критерия Стьюдента 2.101 и уровне значимости α = 0.05. На рис. 5 представлена зависимость продолжительности жизни животных от способа лечения опухоли. Установлено, что в группе 1 средняя продолжительность жизни животных составила 14.9 ± 3.3 дня, медиана выживаемости – 11 дней (рис. 5). В группе 2 средняя продолжительность жизни животных составила 38.6 ± 3.3 дней, медиана выживаемости – 39 дней. Различие между группами статистически значимо (t = 4.22 при p = 0.000573). Таким образом, включение в программу лучевой терапии локального введения препарата на основе двухфазной стеклокерамики дало прибавку к выживаемости в 28 дней.
Идея использования стекла как инертной оболочки в онкологии, как уже было отмечено, не нова. В качестве наполнителя стеклянных микросфер использовали иттрий-90 или химиопрепарат доксорубицин. Так, при лечении рака печени микросферами с итрием-90 методом радиоэмболизации у 64 пациентов (создание искусственного радиоактивного тромба в зоне опухоли) позволило статистически значимо увеличить продолжительность жизни до 16.4 месяцев, а у части пациентов (12) – провести хирургическое лечение [14] и продлить среднюю продолжительность жизни до 51.9 месяцев. Использование стеклянных микросфер в качестве средства доставки иттрия-90 было применено у 531 пациента с метастазами колоректального рака в печень. Аналогично использовался метод радиоэмболизации. Применение этого метода позволило увеличить продолжительность жизни пациентов при стандартной терапии с 4.8 до 10.6 мес. [21]. Указанные методы лечения отвечают требованиям локальной лучевой терапии: их вводили местно с использованием ангиографии, формировали высокую концентрацию микросфер в зоне опухоли, однако сами сферы являлись источником ионизирующего излучения, что приводило к естественным ограничениям для их использования. Данных по введению нерадиоактивного препарата непосредственно к опухоли и генерации вторичного излучения при воздействии ионизирующего высокоэнергетического излучения (6 МэВ) на микрочастицах стекла, содержащего тяжелые элементы, в доступной нам литературе не найдено.
На основании современных представлений о тактике лучевой терапии злокачественных новообразований сформулированы требования, которым должен удовлетворять материал для локальной радиомодификации. Это должен быть препарат с размером частиц не более 150 мкм, способный образовывать устойчивую суспензию, пригодную для введения через инъекционную иглу, обладать рентгеноконтрастностью в диапазоне чувствительности компьютерного томографа, содержать достаточно большое (>10% веса) количество тяжелых элементов, генерировать вторичное излучение в области низкоэнергетического рентгеновского спектра (20–100 кэВ), обладать минимальной местной и системной токсичностью и оставаться на месте введения на протяжении длительного (2–6 месяцев) срока лучевой терапии. Экспериментальная суспензия потенциально отвечает указанным требованиям и представляет интерес для дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Установлено, что применение стеклокерамики, содержащей микрочастицы CaTa2O6, позволяет эффективно проводить лечение злокачественных новообразований. За счет двухфазного состава достигается пролонгированное присутствие препарата в зоне инъекции, что позволяет решить проблему быстрого выведения тантала из организма. Препарат повышает эффективность однократной дозы облучения. Включение в программу лучевой терапии стеклокерамики, содержащей микрокристаллы CaTa2O6, статистически значимо улучшает выживаемость пациентов. Комбинация биостекла и оксида тантала является перспективной платформой для создания препарата для локальной радиомодификации больных злокачественными новообразованиями, которые нуждаются в лучевой терапии. Препарат не представляет угрозы радиоактивного заражения организма и снижает вероятность возникновения лучевых осложнений в здоровых тканях.
Список литературы
Бучилин Н.В., Строганова Е.Е. // Стекло и керамика. 2008. № 8. С. 8.
Chen Q.Z., Thompson I.D., Boccacini A.R. // Biomaterials. 2006. V. 27. P. 2414.
Hench L., Jones J. Biomaterials Artificial Organs and Tissue Engineering. Woodhead Publishing, 2005. eBook ISBN: 9781845690861
Wilson J., Pigott G.H. // J. Biomed. Mater. Res. 1981. V. 15. P. 805.
Owens D.E., Peppas N.A. // Int. J. Pharm. 2006. V. 307. P. 93.
Miguez-Pacheco V., Greenspan D., Hench L.L. et al. // Am. Ceram. Soc. Bull. 2015. V. 94. № 6. P. 27.
Miguez-Pacheco V., Hench L.L., Boccaccini A.R. // Acta Biomater. 2015. V. 13. P. 1. https://doi.org/10.1016/j.actbio.2014.11.004
Grischenko D.N., Papynov E.K., Medkov M.A. // Theor. Found. Chem. Eng. 2021. V. 55. № 5. P. 1002. https://doi.org/10.1134/S0040579521320014
Medkov M.A., Grishchenko D.N., Kuryavyi V.G. et al. // Glass and Ceramics. 2018. V. 75. № 7–8. P. 322. [Медков М.А., Грищенко Д.Н., Курявый В.Г. и др. // Стекло и керамика. 2018. № 8. С. 40.]https://doi.org/10.1007/s10717-018-0079-5
Grishchenko D.N., Golub A.V., Kuryavyi V.G. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 10. P. 1592. [Грищенко Д.Н., Голуб А.В., Курявый В.Г. и др. // Журн. неорган. химии. 2021. Т. 66. № 10. С. 1497.]https://doi.org/10.1134/S0036023621100065
Zhang J., Wang D., Huang W. // J. Chinese Ceram. Soc. 2011. V. 39. № 6. P. 923.
Aspasio R.D., Borges R., Marchi J. // Biocompatible Glasses. 2016. V. 53. P. 249. https://doi.org/10.1007/978-3-319-44249-5_10
Velasco M.V., Souza M.T., Crovace M.C. et al. // Biomed. Glasses. 2019. V. 5. № 1. P. 148. https://doi.org/10.1515/bglass-2019-0013
Bourien H., Palard X., Rolland Y. et al. // Eur. J. Nucl. Med. Mol. Imaging. 2019. V. 46. P. 669. https://doi.org/10.1007/s00259-018-4199-5
Клиническая дозиметрия. Физико-технические основы / Под ред. Наркевич Б.Я. М.: Российский онкологический научный центр им. Н.Н. Блохина, 2019.
Wieser M.E., Holden N., Coplen T.B. et al. // Pure Appl. Chem. 2013. V. 85. № 5. P. 1047. https://doi.org/10.1351/PAC-REP-13-03-02
Grishchenko D.N., Slobodyuk A.B., Kuryavyi V.G. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. Р. 1606. [Грищенко Д.Н., Слободюк А.Б., Курявый В.Г. и др. // Журн. неорган. химии. 2020. Т. 65. № 10. С. 1408.]https://doi.org/10.1134/S0036023620100083
Лукьяненко К.С., Апанасевич В.И., Лагурева А.В. и др. // Тихоокеанский медицинский журн. 2016. Т. 61. № 4. С. 38. https://doi.org/10.17238/PmJ1609-1175.2016.4.38-40
Medkov M.A., Grishchenko D.N., Dmitrieva E.E. et al. // Theor. Found. Chem. Eng. 2020. V. 54. P. 1005. [Медков М.А., Грищенко Д.Н., Дмитриева Е.Э. и др. // Химическая технология. 2019. Т. 20. № 7. С. 299.]https://doi.org/10.1134/S0040579520050188
Плотникова О.С., Апанасевич В.И., Медков М.А. и др. // Тихоокеанский медицинский журн. 2020. Т. 4. С. 85. https://doi.org/10.34215/1609-1175-2020-4-85-87
Hickey R., Lewandowski R.J., Prudhomme T. et al. // J. Nucl. Med. 2016. V. 57. № 5. P. 665. https://doi.org/10.2967/jnumed.115.166082
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии





