Журнал неорганической химии, 2022, T. 67, № 9, стр. 1225-1231
Европийсодержащий конъюгат для фотодинамической терапии злокачественных новообразований
О. В. Шевченко a, b, c, d, *, Н. Г. Плехова b, М. А. Медков c, К. А. Паричук b, В. И. Апанасевич b, И. Г. Тананаев d, А. А. Юдаков c, П. А. Лукьянов a
a Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН
690022 Владивосток, пр-т 100 лет Владивостоку, 159, Россия
b Тихоокеанский государственный медицинский университет Минздрава России
690002 Владивосток, пр-т Острякова, 2, Россия
c Институт химии ДВО РАН
690022 Владивосток, пр-т 100 лет Владивостоку, 159, Россия
d Дальневосточный федеральный университет
690922 Владивосток, о. Русский, п. Аякс, 10, Россия
* E-mail: tarakovaolga@gmail.com
Поступила в редакцию 09.02.2022
После доработки 22.03.2022
Принята к публикации 30.03.2022
- EDN: ZRYPDU
- DOI: 10.31857/S0044457X22090112
Аннотация
Стремительный рост числа онкологических заболеваний обосновывает необходимость создания новых терапевтических средств и методов. Из-за невозможности проникновения лазерного света в ткани глубже 3 мм фотодинамическая терапия применяется для лечения поверхностных заболеваний. Цель исследования: охарактеризовать физико-химические свойства нового молекулярного конъюгата PEI/E6/DTPA/FA/Eu на основе фотосенсибилизатора Хлорина Е6, модифицированного европием, и оценить его фототоксическое действие на клетки асцитной опухоли Эрлиха. Установлено, что при 5-минутном облучении длиной волны 645 нм и энергией 6 Дж/см2 синтезированный молекулярный конъюгат PEI/E6/DTPA/FA/Eu генерирует активные формы кислорода в 5.1 раза интенсивнее, чем свободный Хлорин Е6. На 4-е сут после фотодинамического воздействия с PEI/E6/DTPA/FA/Eu показатель гибели клеток составил 75%, в то время как с Хлорином Е6 – только 24%.
ВВЕДЕНИЕ
Выдающиеся успехи в области терапии злокачественных новообразований в последние десятилетия обусловлены разработкой новых препаратов и методов лечения, а также модификацией широко используемых методов для повышения их эффективности. Фотодинамическая терапия (ФДТ) зарекомендовала себя как действенный способ лечения новообразований различной природы. Одной из ключевых проблем метода является ограниченная область его применения. Светочувствительные вещества (фотосенсибилизаторы, ФС), являющиеся неотъемлемым компонентом терапии, имеют максимумы поглощения в области до 700 нм. Следовательно, возбуждающий их красный свет лазера не способен проникать в ткани глубже, чем на 3 мм. Это обусловливает применение ФДТ, в основном, для поверхностно локализованных заболеваний [1–5].
Синтезирован молекулярный конъюгат, имеющий в составе широко применяемый ФС хлоринового ряда Хлорин Е6 и ионы европия [6, 7]. Предполагалось, что при воздействии излучения за счет передачи энергии от европия к Хлорину Е6 будет повышаться эффективность терапии из-за более интенсивной генерации супероксидного аниона (${\text{O}}_{2}^{ - }$), разрушающего опухолевые клетки [8], рис. 1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез молекулярного конъюгата полиэтиленимин/Хлорин Е6/ диэтилентриаминпентауксусная кислота/фолиевая кислота/европий (PEI/E6/DTPA/FA/Eu) осуществляли по ранее разработанной методике [6, 7].
Исследование функциональности препаратов. Одним из способов регистрации активных форм кислорода (АФК) является применение флуоресцентных зондов. Хлорин Е6 и PEI/E6/DTPA/FA/Eu вносили в 96-луночный планшет по 100 мкл, добавляли по 4 мкл/ячейку 2',7'-дихлородигидрофлуоресцеина и облучали в течение 15 мин красным светом 645 нм. Регистрацию параметров флуоресценции проводили при облучении 485 нм и флуоресценции при 530 нм.
Исследование фотоцитотоксичности. Клетки асцитной аденокарциномы Эрлиха в концентрации 1 × 106 кл/мл инкубировали в среде Игла, модифицированной по Дульбекко (Lonza, Verviers, Бельгия), содержащей 10% фетальной бычьей сыворотки (Life Technologics Inc., США) и 0.05% гентамицина (Sigma Aldrich, США), со свободным Хлорином Е6 и PEI/E6/DTPA/FA/Eu в различных концентрациях (1.56, 3.125, 6.25, 12.5 мкг/мл) в течение суток в термостате при 37°C, 5% CO2. Непоглощенные соединения удаляли путем отмывания монослоя средой и облучали красным светом длиной волны 645 нм (полупроводниковый лазер) в течение 15 мин по аналогии с реальной процедурой ФДТ. Через сутки после облучения в каждую лунку вносили по 20 мкл Resazurin, инкубировали 3 ч и определяли оптическую плотность образцов при 570 нм. Жизнеспособность клеток определяли на 2, 3 и 4 сут.
Статистическую обработку данных проводили с использованием пакета программ Microsoft Office (Excel) и Prism 7 (GraphPad Software Inc. v.7, Сан-Диего, США).
Характеристика методов исследования. Для синтеза молекулярного конъюгата использовали ФС Хлорин Е6 (ООО “Вета-Гранд”, Россия); полиэтиленимин (PEI, 25 000 Da, Sigma Aldrich, США), диэтилентриаминпентауксусную кислоту (DTPA, Acros, США); фолиевую кислоту (FA, BioChemica, Испания); 1-Ethyl-3-(3-диметиламинопропил)карбодиимид (EDC)/водорастворимый карбодиимид (WSC, Sigma-Aldrich, США); N-гидроксисукцинимид и 4-диметиламинопиридин (DMAP, Sigma-Aldrich, США). На финальном этапе синтеза конъюгаты насыщали раствором хлорида европия (EuCl3, Sigma-Aldrich, США). Низкомолекулярные соединения удаляли из конъюгатов с использованием мелкопористых мембран (6–8 кДа, SpectraPor, США) против дистиллированной воды.
Спектры поглощения и флуоресценции записывали на спектрофлуориметре Synergy H1 (BioTek, США). Для исследования качественного и количественного элементного состава использовали метод растровой электронной микроскопии. В качестве флуоресцентного зонда применяли 2',7'-дихлородигидрофлуоресцеин (Sigma-Aldrich, USA).
Энергодисперсионные спектры получали на электронном сканирующем микроскопе S5500 Hitachi (Япония).
Исследование фототоксичности синтезированного препарата осуществляли на клеточной линии асцитной аденокарциномы Эрлиха (Ehrlich ascitic tumor, EAT) при облучении препаратов красным светом длиной волны 645 нм от полупроводникового лазера (ОАО “Cвет и жизнь”, Россия), дозой облучения 6 Дж/см2. Жизнеспособность клеток определяли с помощью Resazurin (Abcam, США) согласно протоколу производителя [9]. Апоптотические клетки определяли после окрашивания Аннексин V/иодидом пропидия (BioLegend, США) с помощью флуоресцентного микроскопа Zeiss Axio Observer (Carl Zeiss, Германия) [10, 11].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характерные для Хлорина Е6 полосы поглощения с максимумами при 405, 503 и 662 нм, присутствующие в спектрах рис. 2, позволяют сделать заключение о его наличии в составе синтезированных структур [12]. В процессе синтеза в структуру молекулярного конъюгата была введена фолиевая кислота. Известно, что онкотрансформированные клетки гиперэкспрессируют рецептор фолиевой кислоты в большом количестве [13]. В связи с этим, фолиевая кислота широко используется в качестве диагностического и терапевтического агента для визуализации и обеспечения адресной доставки в опухоли [14, 15]. В спектрах синтезированного синтона PEI/E6/DTPA/FA и финального конъюгата PEI/E6/DTPA/FA/Eu присутствуют полосы поглощения с максимумами в области 250 и 280 нм, характерными для фолиевой кислоты [16].
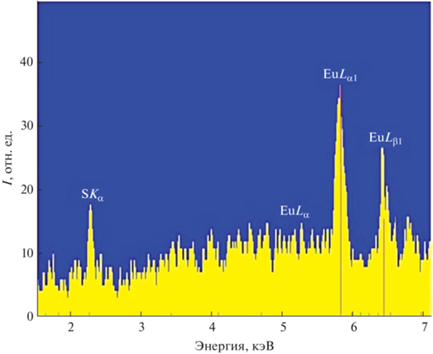
Методом растровой электронной микроскопии подтверждено наличие европия в финальном коньюгате, рис. 3а. Содержание европия в PEI/E6/DTPA/FA/Eu составило 12.1%.
Морфология поверхности
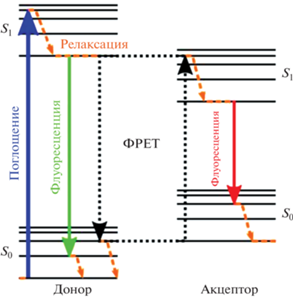
Физико-химические процессы, происходящие при фотодинамической терапии, можно описать согласно диаграмме Яблонского, рис. 4 [17, 18]. В обычных условиях на молекулярной орбитали ФС располагаются 2 электрона с противоположными спинами и низкой энергией. В процессе облучения ФС происходит процесс поглощения фотонов, в результате один из электронов переходит на уровень с более высокой энергией при сохранении своего спина (первое возбужденное синглетное состояние S0). В таком состоянии электрон находится наносекунды и теряет энергию, испуская свет (флуоресценция) или преобразуя его в тепло. Возбужденное синглетное состояние (S1) ФС характеризуется тем, что спин активированного электрона инвертируется в триплетное состояние на относительно долгий период (от микро- до миллисекунд), при котором оба электронных спина параллельны. Возбужденный триплет ФС может взаимодействовать с молекулами, согласно Яблонскому, по двум типам реакций. В результате реакции II типа образуется супероксидный анион, который индуцирует последующую продукцию АФК, разрушающих клетки опухоли [7, 8].
При активации свободного Хлорина Е6 и PEI/E6/DTPA/FA/Eu красным светом отмечалось дозозависимое возрастание флуоресценции при увеличении содержания Хлорина Е6 (рис. 5). Интенсивность генерации АФК молекулярным конъюгатом PEI/E6/DTPA/FA/Eu при облучении красным светом 645 нм в присутствии 2′,7′-дихлордигидрофлуоресцеина (специфический сенсор активных форм кислорода) в 5.1 раза превышала продукцию этой молекулы свободным Хлорином Е6 при облучении 5 мин и в 4.0 раза после облучения 30 мин, рис. 6.
Рис. 5.
Дозозависимое увеличение флуоресценции в препаратах при облучении красным светом в течение 5 мин.

Рис. 6.
Интенсивность генерации АФК свободным Хлорином Е6 и молекулярным конъюгатом PEI/E6/DTPA/FA/Eu (10 мкг Е6/мл).

Таким образом, генерация супероксидного аниона молекулярным комплексом в 4–5 раз интенсивнее, чем свободным Хлорином Е6, рис. 7.
Рис. 7.
Интенсивность генерации АФК свободным Хлорином Е6 и конъюгатом PEI/E6/DTPA/FA/Eu (31.3 мкг Е6/мл) при облучении красным светом.

Исследование фотоцитотоксичности проводили с помощью теста с Resazurin. Живые клетки метаболически активны и способны восстанавливать при участии митохондриальной редуктазы нефлуоресцентный краситель Resazurin до флуоресцерующего соединения Resorufin [9]. Установлено, что уже по истечении суток после облучения наблюдается более активная гибель клеток в присутствии молекулярного конъюгата по сравнению с действием свободного Хлорина Е6, рис. 8.
Рис. 8.
Жизнеспособность клеток аденокарциномы Эрлиха в присутствии PEI/E6/DTPA/FA/Eu и свободного Хлорина Е6.

Окрашивание клеток анексином V и припидиум иодидом (PI) широко используется для изучения апоптоза клеток. PI не способен проникать в живые или ранние апоптозные клетки из-за наличия неповрежденной цитоплазматической мембраны [10]. В поздних апоптозных и некротических клетках целостность плазматических и ядерных мембран снижается, что позволяет PI проходить через мембраны и флуоресцировать в красном диапазоне [10]. С помощью флуоресцентного микроскопа определяли показатели жизнеспособности и апоптоза клеток, рис. 9.
Рис. 9.
Клетки опухоли Эрлиха после воздействия Хлорина Е6 (а) и PEI/E6/DTPA/FA/Eu (б) в дозе 6.25 мкг/мл без (в) и после облучения (г), 4-е сут инкубации. Окраска Annexin V/PI, ув. Х1000.

На 4-е сутки после воздействия Хлорина Е6 (12.5 мкг/мл) показатель клеток в начальной степени некроза составил 76% и в конечной стадии 24%. Тогда как при указанной дозе эффект конъюгата PEI/E6/DTPA/FA/Eu на гибель клеток оказался более выраженным и соответственные показатели были 25 и 75%. Для клеток без воздействия препаратов и облучения показатель некроза был равен 10%, причем 86% составили живые клетки.
ЗАКЛЮЧЕНИЕ
Проведена серия экспериментов по исследованию функциональности впервые синтезированного конъюгата Хлорина Е6 и европия. Показана бóльшая способность соединения интенсивно генерировать АФК при облучении красным светом 645 нм, чем у свободного Хлорина Е6. Обнаруженные фотохимические и цитототоксические свойства позволяют рассматривать соединение PEI/E6/DTPA/FA/Eu в качестве перспективного и эффективного препарата для ФДТ при онкологии.
Список литературы
Grosjean P., Wagnieres G., Fontolliet C. et al. // Br. J. Cancer. 1998. № 11. P. 1989.
Lambert A., Nees L., Nuyts S. et al. // Frontiers in Oncology. 2021. № 11. P. 518. https://doi.org/10.3389/fonc.2021.626394
Yanovsky R.L., Bartenstein D.W., Rogers G.S. et al. // Photodermatology, Photoimmunology Photomedicine. 2019. № 35. P. 295. https://doi.org/10.1111/phpp.12489er.2010.07.007
Collier N.J., Rhodes L.E. // Molecules. 2020. №. 22. P. 5398. https://doi.org/10.3390/molecules25225398
Коршунова О.В., Плехова Н.Г. // Тихоокеанский медицинский журн. 2020. № 4(82). P. 15. https://doi.org/10.34215/1609-1175-2020-4-15-19
Шевченко О.В., Апанасевич В.И., Лукьянов П.А. // Известия CПБГТИ. 2020. № 52. С. 23. https://doi.org/10.36807/1998-9849-2020-52-78-23-27
Стеблевская Н.И., Медков М.А., Белобелецкая М.В. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 327. https://doi.org/10.31857/S0044457X2003017416
Yang H., Villani R.M., Wang H. et al. // J. Experimental Clinical Cancer Res. 2018. T. 37. № 1. P. 1. https://doi.org/10.1186/s13046-018-0909-x
Kamiloglu S., Sari G., Ozdal T. et al. // Food Frontiers. 2020. № 3. P. 332. https://doi.org/10.1002/fft2.44
Rieger A.M., Nelson K.L., Konowalchuk J.D. // JoVE. 2011. № 50. P. e2597 https://doi.org/10.3791/2597
Özdemir Ö. // Allergologia et immunopathologia. 2011. № 5. P. 259. https://doi.org/10.1016/j.aller.2010.07.007
Kuluncsics Z., Perdi D., Brulay E. et al. // J. Photochem. Photobiol. B: Biol. 1999. № 1. P. 71. https://doi.org/10.1016/S1011-1344(99)00130-X
Fernández M., Javaid F., Chudasama V. // Chem. Sci. 2018. № 4. P. 790. https://doi.org/10.1039/C7SC04004K
Ledermann J.A., Canevari S., Thigpen T. // Annals Oncology. 2015. № 10. P. 2034. https://doi.org/10.1093/annonc/mdv250
Prasad R., Agawane S.B., Chauhan D.S. et al. // Bioconjugate Chem. 2018. № 12. P. 4012. https://doi.org/10.1021/acs.bioconjchem.8b00522
Modupe O., Maurras J.B., Diosady L.L. // J. Agriculture Food Res. 2020. № 2. P. 100060. https://doi.org/10.1016/j.jafr.2020.100060
Allison R.R., Moghissi K. // Clinical Endoscopy. 2013. № 1. P. 24. https://doi.org/10.5946/ce.2013.46.1.24
Benov L. Photodynamic therapy: current status and future directions // Medical Principles and Practice. 2015. T. 24. Suppl. 1. P. 14. https://doi.org/10.1159/000362416
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии