Журнал неорганической химии, 2022, T. 67, № 9, стр. 1310-1318
Плазменно-электролитический синтез и исследование пленочных TiO2–WO3–ZnWO4 гетероструктур
М. С. Васильева a, b, *, И. В. Лукиянчук b, Т. П. Яровая b, А. А. Рыбалка a
a Дальневосточный федеральный университет,
690922 Владивосток, о. Русский, п. Аякс, 10, Россия
b Институт химии ДВО РАН
690922 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: vasileva.ms@dvfu.ru
Поступила в редакцию 27.02.2022
После доработки 21.03.2022
Принята к публикации 30.03.2022
- EDN: JBXDYA
- DOI: 10.31857/S0044457X22090173
Аннотация
Zn-, W-содержащие оксидные гетероструктуры сформированы методом плазменно-электролитического оксидирования титана в водных растворах, содержащих 0.1 М Na2WO4, 0.05 M Zn(CH3COO)2 с добавлением органических (0.05 M H2C2O4 или 0.1 M CH3COOH) и неорганической (0.05 M H2SO4) кислот. ПЭО-покрытия изучены методами рентгенофазового и энергодисперсионного анализа, сканирующей электронной микроскопии. В зависимости от используемой кислоты покрытия содержат WO3 и/или NaxWO3, Zn0.3WO3. Отжиг на воздухе при 500–700°С приводит к кристаллизации WO3 и ZnWO4 в их составе. Многогранники WO3 образуются на поверхности ПЭО-покрытий, сформированных в электролитах с щавелевой и серной кислотами. Вытянутые кристаллы ZnWO4 покрывают поверхность покрытий, полученных в электролите с уксусной кислотой. Все сформированные покрытия проявляют фотоактивность в деградации индигокармина (10 мг/л, рН 5.9) при УФ-облучении. Степень деградации составляет 10, 38 и 35% для образцов с ПЭО-покрытиями, сформированными в электролитах с добавлением CH3COOH, H2C2O4 и H2SO4 соответственно. Регулируя форму, размеры и состав микрокристаллов, растущих на поверхности ПЭО-покрытий при отжиге, можно влиять на фотокаталитическую активность образцов.
ВВЕДЕНИЕ
В последние годы загрязнение водных объектов различными органическими соединениями и красителями происходит нарастающими темпами, представляя серьезную экологическую проблему. Для очистки сточных вод от органических загрязнителей большой интерес представляют различные безреагентные методы, в том числе гетерогенный фотокатализ [1, 2]. Среди различных полупроводниковых материалов, используемых в фотокатализе, большое внимание привлекают вольфраматы переходных металлов с общей формулой MWO4, способные работать под действием как ультрафиолетового, так и видимого света [3–8]. Одним из наиболее широко исследуемых вольфраматов данной структуры является вольфрамат цинка ZnWO4 – уникальный полифункциональный полупроводниковый материал, обладающий комплексом важных физико-химических свойств [4–8].
Как правило, вольфрамат цинка получают в виде порошков, что затрудняет широкое практическое использование этого класса материалов из‑за ряда проблем, связанных, в частности, с необходимостью отделения порошкового катализатора в конце технологического цикла. Решить эту проблему можно, нанеся фотоактивный материал на твердую подложку. Ранее показано, что вольфраматы переходных металлов можно наносить на поверхность титановых субстратов одностадийным методом плазменно-электролитического оксидирования (ПЭО) [9–11], суть которого заключается в электрохимическом формировании оксидных слоев на поверхности вентильных металлов в условиях электрических разрядов [12]. Для получения на титане ПЭО-слоев с вольфраматами переходных металлов были использованы водные электролиты, содержащие вольфрамат натрия, ацетат цинка и уксусную кислоту, которую добавляли для подкисления раствора. Согласно [13], подкисление водного раствора Na2WO4 путем добавления к нему H3BO3 приводит к стабилизации pH и улучшению воспроизводимости результатов. Однако систематических исследований по влиянию природы кислоты на состав и свойства формируемых методом ПЭО покрытий до сих пор не было проведено.
Для исследования влияния природы кислоты на свойства формируемых покрытий были использованы уксусная CH3COOH, щавелевая Н2С2О4 и серная H2SO4 кислоты, которые отличаются не только по своей силе, но и по кислотному остатку. Следует отметить, что использование других сильных кислот, таких как соляная или азотная, при оксидировании титана невозможно вследствие сильного травящего действия хлорид- и нитрат-ионов соответственно.
Отметим, что Н2С2О4 – это не только более сильная (по сравнению с уксусной) органическая кислота, но и сильный восстановитель ($E_{{2{\text{C}}{{{\text{O}}}_{2}},{{2{{{\text{H}}}^{ + }}} \mathord{\left/ {\vphantom {{2{{{\text{H}}}^{ + }}} {{{{\text{C}}}_{2}}{\text{O}}_{4}^{{2 - }}}}} \right. \kern-0em} {{{{\text{C}}}_{2}}{\text{O}}_{4}^{{2 - }}}}}}^{0} = - 0.49\,\,{\text{В}}$) [14]. Кроме того, оксалат-ионы могут образовывать прочные комплексные соединения с различными металлами, включая цинк и вольфрам [14–16]. Согласно [16], в результате химического осаждения с использованием щавелевой кислоты образуется осадок, содержащий смесь WO3·2H2O и оксалата вольфрама, который после термообработки при 500°С разлагается с образованием наноразмерного WO3. Серная кислота является сильной кислотой, вследствие чего ее добавление способно значительно снизить рН, что будет способствовать полимеризации вольфрамат-ионов и уменьшит степень гидролиза катионов цинка в растворе. Сульфат-ионы, как и ацетат-ионы, не образуют малорастворимых соединений или прочных комплексных ионов с катионами цинка, что может оказать влияние на его встраивание в покрытия.
В настоящей работе исследовано влияние природы кислоты на состав, морфологию и свойства покрытий, формируемых в подкисленных растворах, содержащих вольфрамат натрия и ацетат цинка.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для плазменно-электролитического оксидирования использовали титановые пластинки из листового титана марки ВТ1-0 размером 2.0 × × 2.0 × 0.05 см. Образцы подвергали механическому шлифованию, при котором удаляли дефекты, образовавшиеся при резке металла. Затем образцы химически полировали в смеси кислот HF : HNO3 = 1 : 3 при 60–80°С в течение 2−3 с, промывали проточной, ополаскивали дистиллированной водой и сушили на воздухе.
ПЭО-обработку осуществляли в течение 10 мин в гальваностатических условиях (i = = 0.2 А/см2) в водных электролитах, содержащих 0.1 М Na2WO4, 0.05 М Zn(CH3COO)2 с добавлением 0.1 М CH3COOH (электролит I, рН 6–7), 0.05 М H2C2O4 (электролит II, рН 5–6), или 0.05 М H2SO4 (электролит III, рН 2). В зависимости от состава электролита сформированные композиты обозначали Ti/W-Zn (I), Ti/W-Zn (II) и Ti/W-Zn (III) соответственно. Некоторые из образцов дополнительно прокаливали на воздухе при температурах 500 и 700°C.
Толщину ПЭО-покрытий определяли с помощью вихретокового толщиномера ВТ201 (Россия) как среднее значение по результатам 10 измерений на обеих сторонах образца. Рентгенограммы образцов с ПЭО-покрытиями получали на рентгеновском дифрактометре Bruker D8 ADVANCE (Германия) в СuKα-излучении. При выполнении рентгенофазового анализа (РФА) использовали программу поиска “EVA” с банком данных “PDF-2”. Морфологию поверхности покрытий изучали с помощью сканирующего электронного микроскопа (СЭМ) высокого разрешения Hitachi S5500 (Япония), оснащенного приставкой для проведения энергодисперсионного рентгеноспектрального анализа Thermo Scientific (США). Глубина проникновения зондирующего луча ~1 мкм.
Исследование фотокаталитических свойств сформированных покрытий проводили на примере реакции разложения водного раствора индигокармина (10 мг/л, рН 5.9) в условиях облучения видимым и УФ-светом. Концентрацию индигокармина определяли с помощью спектрофотометра Юнико-1200/1201 (США), основываясь на уравнении Бугера–Ламберта–Бера:
где A – оптическая плотность раствора, ε – молярный коэффициент поглощения при данной длине волны, l – толщина поглощающего слоя и C − концентрация раствора. Поскольку ε и l – константы, то C прямо пропорциональна оптической плотности; следовательно, о концентрации можно судить на основании измерения параметра А.Для проведения фотокаталитических исследований образец с ПЭО-покрытием помещали в кварцевую ячейку с 30 мл раствора индигокармина. В качестве источников излучения использовали УФ-лампу (SB-100P) с максимумом излучения при длине волны λ = 365 нм и ксеноновую лампу (35 Вт) с излучением в диапазоне 510–680 нм. В каждом эксперименте до начала облучения раствор с образцом оставляли в темноте на 30 мин для установления адсорбционно-десорбционного равновесия, после чего измеряли оптическую плотность раствора, величину которой использовали как точку отсчета А0. Затем находящийся в растворе образец облучали в течение 3 ч. Измерение оптической плотности растворов индигокармина проводили при λ = 610 нм. Степень деградации индигокармина χ вычисляли по формуле
где A0 и А − это оптическая плотность раствора до и после облучения соответственно.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сразу после приготовления все используемые электролиты, независимо от природы используемой кислоты, представляли собой дисперсные системы с осадком белого цвета, выпадение которого, очевидно, обусловлено гидролизом катионов цинка с образованием малорастворимого гидроксида цинка (ks = 7.1 × 10–18). Во всех случаях после проработки электролитов в течение 10–20 мин наблюдалось посинение раствора и полное или частичное растворение осадка, что свидетельствует об изменении ионного состава растворов, происходящего под действием электрических разрядов и высоких температур в приэлектродной области. Интенсивность окраски раствора зависит от природы добавленной кислоты. Наиболее сильное посинение происходило в случае электролита III, чуть менее сильное – в электролите I, при этом в обоих случаях наблюдалось полное растворение осадка (табл. 1) Электролит II приобрел голубую окраску, при этом наблюдали заметное уменьшение количества осадка.
Таблица 1.
Конечное напряжения формирования Uк, состояние электролитов, содержащих 0.1 М Na2WO4 + 0.05 М Zn(CH3COO)2 с добавлением различных кислот, толщина h и цвет полученных ПЭО-покрытий
| Образец | Кислота | Состояние электролита | Uк, В | h, мкм | Цвет образца | |
|---|---|---|---|---|---|---|
| до ПЭО | после ПЭО | |||||
| Ti/W-Zn (I) | 0.1 М CH3COOH | Дисперсный | Истинный, синий | 194 ± 17 | 14 ± 3 | Серо-зеленый |
| Ti/W-Zn (II) | 0.05 М H2C2O4 | Дисперсный | Дисперсный, голубой | 185 ± 12 | 8 ± 2 | Серый |
| Ti/W-Zn (III) | 0.05 М H2SO4 | Дисперсный | Истинный, синий | 318 ± 15 | 38 ± 3 | Светло-зеленый |
Наблюдаемые изменения электролитов, очевидно, связаны с образованием в подкисленных растворах гекса- и паравольфрамат-ионов [H2W6O22]2– и [H2W12O42]10–, а также вольфрамоцинкатных гетерополианионов [ZnW12O40]6–, [ZnW11Zn(H2O)O39]8– [17–19]. Частичное восстановление вольфрама в составе этих изополи- и гетерополианионов (ИПА и ГПА) приводит к образованию вольфрамовых синей. Восстановителем может служить водород, выделяющийся как на катоде при электролизе молекул кислоты или воды, так и на аноде за счет термолиза воды. Учитывая более слабую интенсивность окраски электролита II, можно предположить, что концентрация ИПА и ГПА в нем меньше, чем в двух других электролитах, несмотря на промежуточное значение рН и восстановительные свойства щавелевой кислоты. Препятствовать формированию вольфрамоцинкатных ГПА в такой среде может образование устойчивых оксалатных комплексов цинка и вольфрама.
В табл. 1 представлены данные по конечному напряжению формирования, толщине и внешнему виду образцов, сформированных в различных электролитах. В электролите III (с H2SO4) формирование оксидных покрытий происходит при наибольшем напряжении. При этом формируются гладкие, светло-зеленые покрытия толщиной ∼40 мкм. Наиболее тонкие серые покрытия образуются в электролите II (c H2C2O4). Таким образом, прослеживается некоторая корреляция между рН электролитов, конечным напряжением формирования и толщиной покрытий.
Меньшие значения конечного напряжения и толщины ПЭО-покрытий свидетельствуют о повышенной растворяющей способности электролита II по отношению к титану и его оксиду за счет комплексообразования между оксалат-ионами и ионами титана, эжектируемых в электролит под действием электрических разрядов. На основании данных [20, 21] можно говорить о большей стабильности поверхностных комплексов диоксида титана с щавелевой кислотой, чем с уксусной кислотой. Образованию устойчивых комплексов может способствовать восстановление титана до более низких степеней окисления.
Согласно результатам энергодисперсионного анализа (табл. 2), все сформированные ПЭО-слои содержат как компоненты электролитов – вольфрам, цинк и углерод, так и материал основы – титан. Отметим, что сера не обнаружена в составе ПЭО слоев, сформированных в электролите с серной кислотой, в то время углерод обнаружен во всех покрытиях. Значительным отличием элементного состава Ti/W-Zn (II) образца является очень низкое содержание цинка – не более 0.4 ат. %, тогда как содержание вольфрама и титана сопоставимо с другими образцами.
Таблица 2.
Элементный состав полученных ПЭО-покрытий
| Образец | Элементный состав, ат. % | |||||
|---|---|---|---|---|---|---|
| С | O | Ti | W | Zn | Na | |
| Ti/W-Zn (I) | 26.3 | 59.2 | 3.3 | 8.5 | 2.6 | – |
| Ti/W-Zn (II) | 25.7 | 57.8 | 5.4 | 10.6 | 0.4 | 0.6 |
| Ti/W-Zn (III) | 24.8 | 59.3 | 4.3 | 9.1 | 2.4 | – |
Объяснить различие в концентрациях цинка в составе ПЭО-покрытий (2.4–2.6 ат. % в образцах Ti/W-Zn (I) и Ti/W-Zn (III) и только 0.4 ат. % в образце Ti/W-Zn (II)) можно, если предположить, что встраивание цинка в состав ПЭО-покрытий происходит в результате термолиза ГПА [ZnW12O40]6– или их лакунарных форм в условиях электрических разрядов на поверхности анода. Учитывая, что большая часть ионов цинка в электролите II находится в составе устойчивых оксалатных комплексов, концентрация ГПА в нем будет ниже, чем в электролитах I и III, о чем свидетельствует наименьшая интенсивность окраски при образовании гетерополисиней. Больший отрицательный заряд ГПА будет способствовать их миграции к поверхности анода, и, следовательно, их повышенной концентрации в приэлектродном слое. За счет больших размеров, сконцентрированные в приэлектродном слое ГПА будут экранировать поверхность анода, препятствуя адсорбции других анионов, в том числе оксалатных комплексов цинка. На участие ГПА может указывать тот факт, что при ПЭО-обработке титана в электролите, аналогичном по составу электролиту I, но содержащем меньше Zn(CH3COO)2 (0.04 моль/л) [9], встраивание цинка и вольфрама в состав ПЭО-покрытий происходит в том же соотношении W : Zn = 3.3.
Высокое содержание вольфрама (8–10 ат. %) во всех ПЭО-покрытиях предполагает наличие кислородных соединений вольфрама в их составе, что подтверждается результатами РФА (рис. 1–3). Из анализа приведенных рентгенограмм видно, что фазовый состав покрытий зависит от природы добавленной кислоты. В результате одностадийного ПЭО титана в электролитах I и III образуются ПЭО-слои, содержащие диоксид титана в модификациях рутил или анатаз, соответственно, и натрий-вольфрамовые бронзы (рис. 1, 3). ПЭО-слои, сформированные в электролите II, включают в состав оксид вольфрама WO3 и цинк-вольфрамовую бронзу Zn0.3WO3 (рис. 2). Отсутствие кристаллического диоксида титана в составе ПЭО-покрытий в этом случае, по-видимому, связано с недостаточной мощностью электрических разрядов, развивающихся на поверхности более тонких покрытий, образующихся в электролите со щавелевой кислотой, обладающей повышенным растворяющим действием по отношению к титану и его оксиду. Можно предположить, что диоксид титана в составе ПЭО-покрытий находится в аморфном состоянии, что подтверждается наличием гало в области 2θ 20°–30° на рентгенограмме образца Ti/W-Zn (II) (рис. 2).
Принимая во внимание тот факт, что в покрытиях, полученных в электролитах I и III, обнаружено ∼2 ат. % Zn, можно предположить, что Zn-содержащие соединения в их составе находятся в аморфном состоянии. Отжиг образцов должен способствовать их кристаллизации. Действительно, после отжига на воздухе в составе образцов с ПЭО-покрытиями обнаружен кристаллический вольфрамат цинка (рис. 1–3). В составе образцов Ti/W-Zn (I) и Ti/W-Zn (III) вольфрамат цинка ZnWO4 кристаллизуется в результате отжига уже при 500°С, тогда как в случае образца Ti/W-Zn (II) – только после отжига при 700°С. Следует отметить, что вольфрамат цинка и цинквольфрамовые бронзы образуются также в результате термолиза вольфрамоцинкатных ГПА [22, 23].
Таблица 3.
Поверхностная пористость (%) исходных и отожженных образцов
| Образец | Без отжига | Температура, °С | |
|---|---|---|---|
| 500 | 700 | ||
| Ti/W-Zn (I) | 6.0 | 7.7 | 6.8 |
| Ti/W-Zn (II) | 10.0 | 9.2 | 9.0 |
| Ti/W-Zn (III) | 7.3 | 8.4 | 8.3 |
Согласно СЭМ-изображениям ПЭО-покрытий, приведенным на рис. 4, морфология поверхности образцов также в значительной степени зависит от состава электролита. Наиболее неоднородная поверхность, на которой видны как крупные, так и мелкие поры, характерна для образца Ti/W‑Zn (III) (рис. 4в). В электролите с добавлением щавелевой кислоты формируются однородные покрытия с большим количеством пор размером <10 мкм (рис. 4б). По сравнению с Ti/W-Zn (II), на поверхности образца Ti/W-Zn (I) (рис. 4а) число пор меньше, а их размеры заметно больше. Обработка изображений с помощью программы ImageJ позволила определить поверхностную пористость покрытий (табл. 3), которая согласуется с визуальными наблюдениями.
Рис. 4.
СЭМ-изображения поверхности исходных (а–в), отожженных при 500°С (г–е) и 700°С (ж–и) ПЭО-покрытий. (а, г, ж) – Ti/W-Zn (I); (б, д, з) – Ti/W-Zn (II); (в, е, и) – Ti/W-Zn (III).

На поверхности всех ПЭО-покрытий, отожженных при 500°С (рис. 4г–4е), наблюдается образование кристаллов вблизи пор. При этом в случае образца Ti/W-Zn (II) заметный рост кристаллов происходит также внутри пор, что приводит к незначительному уменьшению поверхностной пористости покрытий (табл. 3). Рост пористости в результате отжига образцов Ti/W-Zn (I) и Ti/W-Zn (III), очевидно, связан с образованием трещин на поверхности покрытий (рис. 4г, 4е).
Еще более значительные изменения морфологии образцов Ti/W-Zn (I) и Ti/W-Zn (II) наблюдаются после их отжига при 700°С (рис. 4ж, 4з). На поверхности обоих образцов образуются кристаллы разной формы и размера, детальный анализ которых приведен на рис. 5. Поверхность образца Ti/W‑Zn (I) плотно покрывается вытянутыми кристаллами толщиной ~200 нм и длиной не более 400 нм. Согласно данным энергодисперсионного анализа, атомное отношение вольфрама и цинка в кристаллах соответствует вольфрамату цинка. На поверхности Ti/W-Zn (II) наблюдаются преимущественно крупные кристаллы (диаметром 2–3 мкм), состав которых соответствует триоксиду вольфрама (рис. 5б). В меньшей степени рост кристаллов при 500–700°С выражен для ПЭО-покрытия, полученного в электролите с серной кислотой (рис. 4е, 4и). Образующиеся на поверхности образцов Ti/W-Zn (III) отдельные кристаллы по форме и составу аналогичны кристаллам на поверхности Ti/W‑Zn (II), однако значительно меньше по размерам – их диаметр не превышает 1 мкм (рис. 5б, 5в). Пористость покрытий, отожженных при 700°С, мало отличается от их пористости после отжига при 500°С. Можно отметить определенную корреляцию между толщиной ПЭО-покрытий (табл. 1) и их термическим поведением – чем меньше толщина, тем более сильное изменение поверхности покрытий происходит после высокотемпературного отжига.
Рис. 5.
СЭМ-изображения и элементный состав кристаллов, образовавшихся на поверхности ПЭО-покрытий, отожженных при 700°С: (а) – Ti/W-Zn (I); (б) – Ti/W-Zn (II); (в) – Ti/W-Zn (III).

Результаты исследования фотокаталитических свойств композитов в реакции деградации анионного красителя индигокармина в условиях облучения видимым и УФ-светом приведены в табл. 4 и на рис. 6. Во всех случаях при облучении видимым светом степень деградации индигокармина не превышает 5%, что сопоставимо с результатами холостого опыта (1%). Следовательно, в условиях эксперимента (рН 5.9, видимый свет) все полученные покрытия проявляют очень слабую фотокаталитическую активность.
Таблица 4.
Степень деградации (%) индигокармина в условиях облучения видимым светом в отсутствие и в присутствии образцов до и после их отжига
| Образец | Без отжига | Температура,°С | |
|---|---|---|---|
| 500 | 500 | ||
| Холостой эксперимент | 1 | – | – |
| Ti/W-Zn (I) | 3.5 | 3.5 | 3.0 |
| Ti/W-Zn (II) | 3.5 | 4.0 | 5.0 |
| Ti/W-Zn (III) | 2.0 | 4.5 | 5.0 |
Рис. 6.
Степень деградации индигокармина (10 мг/л) в условиях УФ-облучения в отсутствие и в присутствии образцов до и после их отжига.
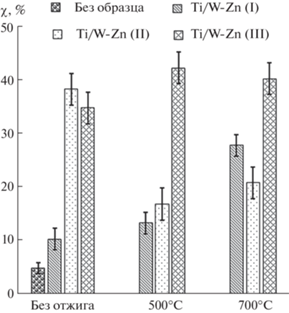
В условиях УФ-облучения (рис. 6) все сформированные ПЭО-покрытия проявляют фотокаталитическую активность, которая зависит как от условий их получения, так и последующего отжига. Среди серии исходных образцов наибольшую активность проявили ПЭО-покрытия, полученные в электролитах II и III, т.е. с добавлением щавелевой и серной кислот соответственно. Степень деградации индигокармина в присутствии образцов Ti/W-Zn (I), Ti/W-Zn (II) и Ti/W-Zn (III) достигает ~10, 38 и 35% соответственно, тогда как при УФ-облучении раствора индигокармина без каких-либо образцов она не превышает 5%. Наиболее активные образцы Ti/W-Zn (II) и Ti/W-Zn (III) имеют более развитую поверхность с пористостью 10.0 и 7.3% (табл. 3). Поскольку по фазовому и элементному составу эти покрытия имеют определенные отличия, в том числе по содержанию цинка, можно предположить, что именно развитая морфология поверхности является фактором, определяющим более высокую активность этих образцов. В этом случае может быть достигнута более высокая степень контакта молекул индигокармина с поверхностью фотокатализатора.
Высокотемпературный отжиг по-разному влияет на активность образцов. Фотокаталитическая активность образцов Ti/W-Zn (II) зависит от температуры отжига: степень деградации индигокармина существенно снижается после отжига при 500°С и несколько повышается после отжига при 700°С. Фотокаталитическая активность образцов Ti/W-Zn (III) практически не меняется после отжига, а активность образцов Ti/W-Zn (I) возрастает в три раза после отжига при 700°С.
Во всех случаях прослеживается корреляция между влиянием отжига на изменение морфологии поверхности образцов и на их фотокаталитическую активность. ПЭО-покрытия, полученные в электролите с серной кислотой, характеризуются наибольший толщиной. После высокотемпературного отжига морфология их поверхности меняется в меньшей степени – наблюдается рост отдельных кристаллов, равномерно распределенных по поверхности, и образование трещин. Незначительное изменение морфологии поверхности данных образцов Ti/W-Zn (III) соответствуют стабильности их фотокаталитических свойств. Поверхность Ti/W-Zn (I) образца после отжига покрывается кристаллами вольфрамата цинка, что приводит к увеличению их активности в деградации индигокармина. Напротив, образование крупных кристаллов триоксида вольфрама на поверхности Ti/W-Zn (II) образца заметно снижает его фотоактивность.
ЗАКЛЮЧЕНИЕ
Исследовано влияние природы кислоты, добавляемой в водный электролит с Na2WO4 и Zn(CH3COO)2, а также высокотемпературной обработки на состав, морфологию поверхности и фотокаталитические свойства оксидных гетероструктур, формируемых на поверхности титана одностадийным методом ПЭО.
Согласно результатам энергодисперсионного анализа, ПЭО-слои, сформированные в электролитах с серной и уксусной кислотами, содержат 2.4–2.6 ат. % Zn и 8.5–9.1 ат. % W. Одновременное встраивание цинка и вольфрама может быть связано с участием вольфрамовоцинкатных гетерополианионов в образовании ПЭО-покрытий. В электролите с щавелевой кислотой образуются устойчивые оксалатные комплексы цинка, вследствие чего концентрация ГПА меньше, в результате формируются ПЭО-слои, содержащие до 0.4 ат. % Zn.
По данным РФА, в электролитах с уксусной и серной кислотами образуются ПЭО-слои, содержащие диоксид титана в модификациях рутил или анатаз соответственно, и натрий-вольфрамовые бронзы. В составе ПЭО-слоев, сформированных в электролите с щавелевой кислотой, обнаружены триоксид вольфрама и цинк-вольфрамовая бронза. Во всех случаях вольфрамат цинка ZnWO4 кристаллизуется в составе ПЭО-слоев после отжига на воздухе при температурах 500 и/или 700°С.
Показано, что все сформированные покрытия проявляют фотокаталитическую активность в реакции разложения индигокармина в условиях УФ-облучения. Полученные пленочные гетероструктуры перспективны в качестве фотокатализаторов очистки сточных вод от органических загрязнителей, в том числе в проточных системах.
Список литературы
Herrmann J.-M. // Top. Catal. 2005. V. 34. № 1–4. P. 49. https://doi.org/10.1007/s11244-005-3788-2
Zhu D., Zhou Q. // Environ. Environ. Nanotechnol. Monit. Manag. 2019. V. 12. P. 100255. https://doi.org/10.1016/j.enmm.2019.100255
Montini T., Gombac V., Hameed A. et al. // Chem. Phys. Lett. 2010. V. 498. № 1–3. P. 113. https://doi.org/10.1016/j.cplett.2010.08.026
Huang G., Zhu Y. // J. Mater. Sci. Eng. 2007. V. 139. P. 201. https://doi.org/10.1016/j.mseb.2007.02.009
Dodd A., McKinely A., Tsuzuki T. et al. // J. Europ. Ceram. Soc. 2009. V. 29. P. 139. https://doi.org/10.1016/j.jeurceramsoc.2008.05.027
Wu Q., Liu X., Hou S. et al. // Colloids Surf. A. 2021. V. 629. P. 127459. https://doi.org/10.1016/j.colsurfa.2021.127459
Kumar G.M., Lee D.J., Jeon H.C. et al. // Ceram. Int. 2022. V. 48. P. 4332. https://doi.org/10.1016/j.ceramint.2021.10.228
Geetha G.V., Keerthana S.P., Madhuri K. et al. // Inorg. Chem. Commun. 2021. V. 132. P. 108810. https://doi.org/10.1016/j.inoche.2021.108810
Bryzhin A.A., Tarkhanova I.G., Gantman M.G. et al. // Surf. Coat. Technol. 2020. V. 393. P. 125746. https://doi.org/10.1016/j.surfcoat.2020.125746
Брыжин А.А., Руднев В.С., Лукиянчук И.В. et al. // Кинетика и катализ. 2020. Т. 61. № 2. С. 262. [Bryzhin A.A., Rudnev V.S., Lukiyanchuk I.V. et al. // Kinet. Catal. 2020. V. 61. № 2. P. 283.] https://doi.org/10.1134/S0023158420020020
Руднев В.С., Васильева М.С., Лукиянчук И.В. // Неорган. материалы. 2019. Т. 55. № 7. С. 727. [Rudnev V.S., Vasilyeva M.S., Lukiyanchuk I.V. // Inorg. Mater. 2019. V. 55. № 7. Р. 681.] https://doi.org/10.1134/S0020168519070148
Суминов И.В., Белкин П.Н., Эпельфельд А.В. и др. Плазменно-электролитическое модифицирование поверхности металлов и сплавов. М.: Техносфера, 2011. 512 с.
Lukiyanchuk I.V., Rudnev V.S., Kuryavyi V.G. et al. // Thin Solid Films. 2004. V. 446. № 1. P. 54. https://doi.org/10.1016/S0040-6090(03)01318-X
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.
Dengel A.C., Griffith W.P., Powell R.D. et al. // Dalton Trans. 1987. № 1. P. 17. https://doi.org/10.1039/DT9870000991
Горобцов Ф.Ю., Симоненко Т.Л., Симоненко Н.П. и др. // Журн. неорган. химии. 2021. Т. 66. № 12. С. 1693. [Gorobtsov P.Y., Simonenko T.L., Simonenko N.P. et al. // Rus. J. Inorg. Chem. 2021. V. 66. № 12. P. 1811.] https://doi.org/10.1134/S0036023621120032
Мохосоев М.В., Швецова Н.А. Состояние ионов молибдена и вольфрама в водных растворах. Улан-Удэ: Бурятское книжное изд-во, 1977. 168 с.
Nakajima K., Eda K., Himeno S. Effect of the central oxoanion size on the voltametric properties of Keggin-type [XW12O40]n− (n = 2−6) complexes // Inorg. Chem. 2010. V. 49. № 11. P. 5212. https://doi.org/10.1021/ic1003353
Мороз Я.А. // Вестник ДонНУ. Сер. А: Естественные науки. 2017. № 1. С. 92. http://donnu.ru/public/journals/files/VestnikDonNU_A_2017_N1_compr.pdf
Weisz A.D., Regazzoni A.E., Blesa M.A. // Croat. Chem. Acta. 2007. V. 80. № 3-4. P. 325.
Roncaroli F., Blesa M.A. // J. Coord. Chem. 2010. V. 63. № 14–16. P. 2488. https://doi.org/10.1080/00958972.2010.487561
Чередниченко Л.А., Мороз Я.А. // Кинетика и катализ. 2018. Т. 59. № 5. С. 560. [Cherednichenko L.A., Moroz Y.A. // Kinet. Catal. 2018. Т. 59. № 5. С. 572. https://doi.org/10.1134/S0023158418050038]
Мороз Я.А., Лозинский Н.С., Лопанов А. и др. // Журн. общ. химии. 2022. Т. 92. № 1. С. 147. https://doi.org/10.31857/S0044460X22010164
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии





