Журнал неорганической химии, 2023, T. 68, № 2, стр. 203-208
Термодинамика монокристаллов на основе молибдата цезия: стандартная энтальпия образования, энтальпия решетки, теплоемкость
Н. И. Мацкевич a, *, А. Н. Семерикова a, В. А. Трифонов a, Д. А. Самошкин a, b, А. А. Чернов b, С. В. Станкус b, С. А. Лукьянова a, В. Н. Шлегель a, В. П. Зайцев a, c, В. А. Кузнецов a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Институт теплофизики им. С.С. Кутателадзе СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 1, Россия
c Сибирский государственный университет водного транспорта
630099 Новосибирск, ул. Щетинкина, 33, Россия
* E-mail: nata.matskevich@yandex.ru
Поступила в редакцию 19.08.2022
После доработки 12.09.2022
Принята к публикации 16.09.2022
- EDN: LPHEOT
- DOI: 10.31857/S0044457X22601456
Аннотация
Кристаллы Cs2MoO4, Li1.9Cs0.1MoO4 были выращены низкоградиентным методом Чохральского из расплавов. Методом калориметрии растворения измерена стандартная энтальпия образования молибдата цезия (Cs2MoO4). Методом дифференциальной сканирующей калориметрии в интервале температур 320–710 K измерена теплоемкость Li1.9Cs0.1MoO4. С использованием цикла Борна–Габера рассчитана энтальпия решетки Cs2MoO4. Показано, что молибдат цезия является термодинамически устойчивым по отношению к распаду на простые оксиды (Cs2O, MoO3), что делает его перспективным для использования. Установлено, что соединение Li1.9Cs0.1MoO4 не имеет фазовых переходов в интервале температур 320–710 K.
ВВЕДЕНИЕ
Монокристаллы на основе молибдатов и вольфраматов металлов первой группы, в частности на основе лития и цезия, находят широкое применение в различных областях [1–12]. Так, они используются в микроэлектронике, оптоэлектронике, оптической коммуникации, физике высоких энергий и др. Одним из преимуществ этих монокристаллов являются относительно низкие температуры плавления (до 1300 K), в связи с чем уменьшаются энергозатраты на производство.
Монокристаллы молибдатов и вольфраматов щелочных и щелочноземельных элементов также хорошо зарекомендовали себя при исследовании редких событий, таких как двойной безнейтринный β-распад и упругое когерентное рассеяние нейтрино на ядрах. Ввиду того, что зависимость сечения упругого когерентного рассеяния нейтрино на ядрах пропорциональна квадрату количества нейтронов в ядре, привлекательным является применение мишеней с большим числом нейтронов, таковыми являются ядра молибдена и вольфрама.
Для оптимизации условий процесса роста монокристаллов, для понимания процессов устойчивости и деградации, для выбора наиболее оптимальных областей применения необходимы всесторонние физико-химические, в частности термодинамические исследования монокристаллов.
В настоящей работе низкоградиентным методом Чохральского выращены кристаллы Cs2MoO4 и Li1.9Cs0.1MoO4. Целью работы является определение стандартной энтальпии образования, энтальпии решетки и энергии стабилизации монокристалла Cs2MoO4, а также определение теплоемкости кристалла Li1.9Cs0.1MoO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Монокристалл Cs2MoO4 был выращен из собственного расплава методом Чохральского в условиях низких градиентов температуры [13, 14]. В качестве прекурсоров использовали глубоко очищенный MoO3 (ИНХ СО РАН) и Cs2CO3 (ос. ч., ООО “Ланхит”). Реактивы смешивали в мольном соотношении Cs2CO3 : MoO3 = 1 : 1 согласно уравнению реакции: Cs2CO3 + MoO3 = Cs2MoO4 + + CO2↑.
Твердотельный синтез проводили в тех же платиновых тиглях размером 130 (L) × 70 (D) мм3, из которых были выращены кристаллы. Реактивы перемешивали, засыпали в тигель. Закрытый платиновой крышкой, снабженной патрубком, тигель помещали в трехзонную печь сопротивления с верхней и нижней теплоизоляцией с низкой теплопроводностью и нагревали до 1000 K со скоростью 30 град/ч и выдерживали при этой температуре в течение 5 ч. Полноту твердотельных синтезов контролировали, наблюдая изменения веса, вызванные выходом CO2, и сравнивая их с расчетными изменениями веса. После этого температуру поднимали на 5 K выше точки плавления со скоростью 70 град/ч и выдерживали при этой температуре более 5 ч для гомогенизации расплава.
Кристалл Cs2MoO4 (рис. 1) выращивали на воздухе на неориентированные затравки. Процесс роста кристаллов осуществлялся в автоматическом режиме.
Синтез кристалла Li1.9Cs0.1MoO4 проводили непосредственно в ростовой установке из исходных компонентов: Li2CO3 “ос. ч.” 20-2 (ТУ 6-09-4757-84, Новосибирский завод редких металлов), MoO3 (ИНХ СО РАН), Cs2MoO4 “ч.” (ТУ 6-09-04-80-82). В платиновый тигель с размерами 130 (L) × × 70 (D) мм3 помещали стехиометрическую смесь соответствующих компонентов. Тигель помещали в трех зонную печь с омическим нагревателем. Смесь нагревали до температуры, на 10–15 K превышающей температуру плавления выращиваемого соединения, и выдерживали в течение 10 ч для гомогенизации расплава. Затем температуру расплава снижали до температуры равновесия между расплавом и затравкой.
Кристалл Li1.9Cs0.1MoO4 (рис. 2) был выращен на поликристаллическую затравку, намороженную на платиновый держатель. Скорость вращения затравки составляла 6 об/мин, продолжительность процесса выращивания – 4 сут при скорости кристаллизации 0.5 мм/ч.
Рентгенофазовый анализ кристаллов Cs2MoO4, Li1.9Cs0.1MoO4 проводили на дифрактометре Shimadzu XRD-7000 (CuKα-излучение).
Для определения стандартной энтальпии образования монокристалла Cs2MoO4 был выбран метод калориметрии растворения. Метод калориметрии растворения широко используется для получения термохимических характеристик неорганических и органических соединений [15–18]. Растворный автоматизированный калориметр с изотермической оболочкой, в котором проводилось определение стандартной энтальпии образования Cs2MoO4, подробно описан в наших работах [19–21]. Перед проведением измерений энтальпии растворения молибдата цезия калориметр был проверен на правильность работы путем растворения хлорида калия. Полученная на данном калориметре энтальпия растворения KCl хорошо совпала с величиной, рекомендованной в литературе [22, 23].
Теплоемкость кристалла Li1.9Cs0.1MoO4 определяли в температурном интервале 320–710 K. Целью данного исследования было выяснение наличия фазовых переходов в этом интервале. Теплоемкость измеряли методом дифференциальной сканирующей калориметрии. В настоящее время современные методы по определению теплоемкости методом ДСК являются одними из востребованных методов [24–28]. Для измерений теплоемкости кристалла Li1.9Cs0.1MoO4 использовали калориметр фирмы NETZSCH, прибор марки DSC 404 F1. Измерения проводили в платиновых тиглях с корундовыми вкладышами и платиновыми крышками. Эксперименты осуществляли в потоке аргона (20 мл/мин). Скорость нагрева была подобрана таким образом, чтобы обеспечить прецизионность измерений, и составляла 6 град/мин. Методика и процесс проведения измерений описаны в работах [29–31].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученые соединения Cs2MoO4 и Li1.9Cs0.1MoO4 были охарактеризованы методом рентгенофазового анализа. Согласно результатам анализа, монокристалл Cs2MoO4 имеет орторомбическую структуру (пр. гр. Pmcn). Параметры решетки: a = 6.575, b = 11.598, c = 8.513 Å. Параметры хорошо совпадают с результатами, приведенными в литературе [32]. Кристалл Li1.9Cs0.1MoO4 имеет структуру фенакита (пр. гр. R3). Параметры решетки: a = b = 14.194, c = 9.482 Å.
Для определения стандартной энтальпии образования монокристалла Cs2MoO4 в качестве растворителя был выбран водный раствор гидроксида калия (KOH) c концентрацией 0.40162 моль кг–1 KOH, молярная масса KOH 56.10564 г моль–1.
Термохимический цикл для определения стандартной энтальпии образования монокристалла Cs2MoO4 был построен таким образом, что энтальпия растворения оксида молибдена в KOH сравнивалась с энтальпией растворения Cs2MoO4. Схема термохимического цикла представлена ниже.
(1)
$\begin{gathered} {\text{Mo}}{{{\text{O}}}_{3}}({\text{s}}) + 2{\text{KOH}}({\text{sol}}) = 2{{{\text{K}}}^{ + }}({\text{sol}}) + {\text{MoO}}_{4}^{{2 - }}({\text{sol}}) + \\ + \,\,{{{\text{H}}}_{{\text{2}}}}{\text{O}}\,({\text{l}}) + {\text{KOH}}({\text{sol}}) + {{\Delta }_{{{\text{sol}}}}}H_{1}^{0}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{C}}{{{\text{s}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{4}}\left( {\text{s}} \right) + {\text{KOH}}\left( {{\text{sol}}} \right) = 2{\text{C}}{{{\text{s}}}^{ + }}\left( {{\text{sol}}} \right) + \\ + \,\,{\text{MoO}}_{4}^{{2 - }}\left( {{\text{sol}}} \right) + {\text{KOH}}\left( {{\text{sol}}} \right) + {{\Delta }_{{{\text{sol}}}}}H_{2}^{0}. \\ \end{gathered} $Энтальпии растворения MoO3 и Cs2MoO4 измерены экспериментально. С использованием закона Гесса можно получить:
(3)
$\begin{gathered} {\text{Mo}}{{{\text{O}}}_{3}}\left( {\text{s}} \right) + 2{\text{KOH}}\left( {{\text{sol}}} \right) + 2{\text{C}}{{{\text{s}}}^{ + }}\left( {{\text{sol}}} \right) = \\ = {\text{C}}{{{\text{s}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{4}}\left( {\text{s}} \right) + 2{{{\text{K}}}^{ + }}\left( {{\text{sol}}} \right) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\left( {\text{l}} \right) + {{\Delta }_{r}}{{H}^{0}}. \\ \end{gathered} $Измеренные нами энтальпии растворения для оксида молибдена, молибдата цезия при температуре 298.15 K составляют:
Погрешности приведены для 95%-го доверительного интервала с использованием коэффициента Стьюдента.
Из схемы реакций (1)–(3), согласно закону Гесса, можно рассчитать энтальпию реакции (3):
Далее из уравнения (3) можно выразить стандартную энтальпию образования исследуемого соединения:
Величины для стандартных энтальпий образования соединений и ионов, необходимых для расчета, представлены ниже [33]: ${{\Delta }_{f}}H_{{298}}^{0}$ $\left( {{\text{K}}_{{{\text{sol}}}}^{ + }} \right)$ = –252.253 ± ± 0.125 кДж моль–1; ${{\Delta }_{f}}H_{{298}}^{0}$ (H2O) = –285.829 ± ± 0.040 кДж моль–1; ${{\Delta }_{f}}H_{{298}}^{0}$ (KOHsol) = –482.289 ± ± 0.150 кДж моль–1; ${{\Delta }_{f}}H_{{298}}^{0}$ (MoO3s) = –745.170 ± ± 0.460 кДж моль–1; ${{\Delta }_{f}}H_{{298}}^{0}$ $\left( {{\text{Cs}}_{{{\text{sol}}}}^{{\text{ + }}}} \right)$ = –258.069 ± ± 0.125 кДж моль–1.
С использованием измеренной нами энтальпии реакции (3) и вышеприведенных стандартных энтальпий образования мы рассчитали стандартную энтальпию образования молибдата цезия:
Ранее в работе [34] была измерена стандартная энтальпия образования молибдата цезия путем растворения в водном растворе гидроксида цезия. Молибдат цезия был получен в работе [34] путем очистки коммерческого реактива фирмы Cerac Pure. Полученная в работе [34] величина стандартной энтальпии образования молибдата цезия равна: ${{\Delta }_{f}}H_{{298}}^{0}$ (Cs2MoO4) = –1514.61 ± 0.46 кДж моль–1. Как можно видеть, в пределах погрешности измерений величины стандартных энтальпий образования монокристалла Cs2MoO4, выращенного в настоящей работе, и молибдата цезия, полученного в работе [34], согласуются между собой. Это говорит о надежности полученных величин.
Далее из измеренной стандартной энтальпии образования монокристаллического Cs2MoO4 мы рассчитаем энергию стабилизации. Энергия стабилизации – это энтальпия образования из простых оксидов, в данном случае из Cs2O и MoO3. Для Cs2MoO4 энергия стабилизации рассчитывается по следующем уравнению: ${{\Delta }_{{{\text{ox}}}}}H_{{298}}^{0}$ (Cs2MoO4, s) = ${{\Delta }_{f}}H_{{298}}^{0}$ (Cs2MoO4, s) – ${{\Delta }_{f}}H_{{298}}^{0}$ (Cs2O, s) – ${{\Delta }_{f}}H_{{298}}^{0}$ (MoO3, s). Энергия стабилизации была рассчитана на основании измеренной нами стандартной энтальпии образования Cs2MoO4 и стандартных энтальпий образования простых оксидов, взятых из справочника [33]: ${{\Delta }_{f}}H_{{298}}^{0}$ (Cs2O, s) = –345.974 ± 1.171 кДж моль–1; ${{\Delta }_{f}}H_{{298}}^{0}$ (MoO3, s) = –745.170 ± 0.460 кДж моль–1.
Рассчитанная энергия стабилизации равна:
Поскольку энергия стабилизации Cs2MoO4 является отрицательной величиной, можно заключить, что монокристалл Cs2MoO4 является термодинамически стабильным по отношению к распаду на простые оксиды, что делает его перспективным для использования.
Далее, используя значение стандартной энтальпии образования, мы рассчитали энтальпию решетки (ΔlatH0) для монокристалла Cs2MoO4. Для расчета использовали цикл Борна–Габера:
(1a)
$\begin{gathered} 2{\text{Cs}}\left( {\text{s}} \right) + {\text{Mo}}\left( {\text{s}} \right) + 2{{{\text{O}}}_{2}}\left( {\text{g}} \right) = \\ = \,\,{\text{C}}{{{\text{s}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{4}}\left( {\text{s}} \right) + {{\Delta }_{f}}H_{{1{\text{a}}}}^{0}, \\ \end{gathered} $(2a)
$2{\text{C}}{{{\text{s}}}^{ + }}\left( {\text{g}} \right) = 2{\text{Cs}}\left( {\text{s}} \right) + 2{{\Delta }_{r}}H_{{{\text{2a}}}}^{0},$(3a)
${\text{M}}{{{\text{o}}}^{{6 + }}}\left( {\text{g}} \right) = {\text{Mo}}\left( {\text{s}} \right) + {{\Delta }_{r}}H_{{3{\text{a}}}}^{0},$(4a)
$4{{{\text{O}}}^{{2 - }}}\left( {\text{g}} \right) = 2{{{\text{O}}}_{2}}\left( {\text{g}} \right) + 4{{\Delta }_{r}}H_{{4{\text{a}}}}^{0},$———————————————————-
(5a)
$\begin{gathered} 2{\text{C}}{{{\text{s}}}^{ + }}\left( {\text{g}} \right) + {\text{M}}{{{\text{o}}}^{{6 + }}}\left( {\text{g}} \right) + 2{{{\text{O}}}^{{2 - }}}\left( {\text{g}} \right) = \\ = \,\,{\text{C}}{{{\text{s}}}_{{\text{2}}}}{\text{Mo}}{{{\text{O}}}_{{\text{4}}}}\left( {\text{s}} \right) + {{\Delta }_{{{\text{lat}}}}}H_{{5{\text{a}}}}^{0}. \\ \end{gathered} $Энтальпии образования ионов Cs+(g), Mo6+(g), O2–(g) были взяты из справочника [33]: ${{\Delta }_{r}}H_{{{\text{2a}}}}^{0}$ = = –452.6 кДж моль–1; ${{\Delta }_{r}}H_{{{\text{3a}}}}^{0}$ = –22463.9 кДж моль–1; ${{\Delta }_{r}}H_{{{\text{4a}}}}^{0}$ = –905.8 кДж моль–1.
С использованием цикла (1a)–(4a) мы рассчитали энтальпию решетки для Cs2MoO4: ${{\Delta }_{{{\text{lat}}}}}H_{{{\text{5a}}}}^{{\text{0}}}$ = –28510 кДж моль–1.
В следующей части статьи перейдем к измерению теплоемкости соединения Li1.9Cs0.1MoO4. Теплоемкость определяли методом ДСК в интервале температур 320−710 K. Масса образца Li1.9Cs0.1MoO4 для измерения высокотемпературной теплоемкости составляла 73.32 мг. В качестве калибровочного образца использовали сапфир массой 85.28 мг.
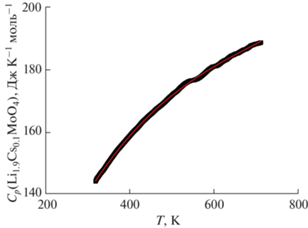
Проводили три термических цикла измерений в интервале температур 320–710 K. Данные второго и третьего нагрева хорошо согласуются между собой. Данные первого нагрева отличаются, это связано с отжигом образца и удалением абсорбированных примесей с поверхности образца. Данные третьего нагрева теплоемкости представлены на рис. 3.
Из рис. 3 видно, что кривая теплоемкости для соединения Li1.9Cs0.1MoO4 изменяется монотонно. Следовательно, в исследуемом интервале температур отсутствуют фазовые переходы, что очень важно для использования.
Для сглаживания теплоемкости мы использовали программное обеспечение Origin.
Теплоемкость соединения Li1.9Cs0.1MoO4 была описана нами полиномом третьей степени:
Отклонение экспериментально измеренной теплоемкости от сглаженного значения не превышало 0.3%.
Согласно представленной выше зависимости, теплоемкость соединения Li1.9Cs0.1MoO4 при стандартной температуре составляет: Cp (Li1.9Cs0.1MoO4, 298.15 K) = 140.1 Дж K–1 моль–1.
Мы также оценили теплоемкость Li1.9Cs0.1MoO4 как аддитивную величину из теплоемкости Li2MoO4 и Cs2MoO4, измеренной методом низкотемпературной калориметрии [35, 36]. Оцененная величина составляет: Cp (Li1.9Cs0.1MoO4, 298.15 K) = 133.2 Дж K–1 моль–1. Данная величина в пределах 5% согласуется с величиной, полученной путем расчета по кубическому полиному. Разница между экспериментальной теплоемкостью Li1.9Cs0.1MoO4 при стандартных условиях и теплоемкостью, оцененной аддитивным методом из теплоемкости Li2MoO4 и Cs2MoO4, может быть связана как с ошибкой эксперимента ДСК, так и с неизоструктурностью молибдатов лития и цезия.
Таким образом, в настоящей работе были выращены кристаллы Cs2MoO4 и Li1.9Cs0.1MoO4 низкоградиентным методом Чохральского с весовым контролем. Методом калориметрии растворения определена стандартная энтальпия образования Cs2MoO4, рассчитана энтальпия стабилизации и энтальпия решетки. Показано, что данное соединение является термодинамически устойчивым по отношению к распаду на простые оксиды, что делает его перспективным для применения. Теплоемкость кристалла Li1.9Cs0.1MoO4 измерена методом дифференциальной сканирующей калориметрии в интервале температур 320–710 K. Показано, что в данном интервале отсутствуют фазовые переходы.
ЗАКЛЮЧЕНИЕ
Низкоградиентным методом Чохральского выращены кристаллы Cs2MoO4, Li1.9Cs0.1MoO4. Стандартная энтальпия образования молибдата цезия определена методом калориметрии растворения; рассчитана энтальпия решетки и энергия стабилизации. Методом дифференциальной сканирующей калориметрии измерена теплоемкость соединения Li1.9Cs0.1MoO4 в интервале температур 320–710 K. Показано, что зависимость теплоемкости соединения Li1.9Cs0.1MoO4 от температуры является плавной, т.е. в интервале температур 320–710 K отсутствуют фазовые переходы.
Список литературы
Simonenko T.L., Bocharova V.A., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1779. https://doi.org/10.1134/S0036023621120160
Bekker T.B., Coron N., Danevich F.A. et al. // Astroparticle Phys. 2016. V. 72. P. 38. https://doi.org/10.1016/j.astropartphys.2015.06.002
Barinova O., Sadovskiy A., Ermochenkov I. // J. Cryst. Growth. 2017. V. 468. P. 365. https://doi.org/10.1016/j.jcrysgro.2016.10.009
Fattakhova Z.A., Vovkotrub E.G., Zhknarova G.S. // Russ. J. Inorg. Chem. 2021. V. 66. P. 35. https://doi.org/10.1134/S0036023621010022
Teng T., Xiao L., Shen L. et al. // Appl. Surf. Sci. 2022. V. 601. P. 154101. https://doi.org/10.1016/j.apsusc.2022.154101
Isaenko L.I., Korzhneva K.E., Khyzhin O.Y. et al. // J. Solid State Chem. 2019. V. 277. P. 786. https://doi.org/10.1016/j.jssc.2019.07.047
Steblevskaya N.I., Belobeletskaya M.V., Yarovaya T.P. et al. // Russ. J. Inorg. Chem. 2022. V. 67. P. 245. https://doi.org/10.1134/S0036023622020164
Kim H., Pandey I.R., Khan A. et al. // Cryst. Res. Technol. 2019. V. 54. P. 1900079. https://doi.org/10.1002/crat.201900079
Son J.K., Pandey I.R., Kim H.J. et al. // IEEE Trans. Nucl. Sci. 2018. V. 65. P. 2120. https://doi.org/10.1109/TNS.2018.2818330
Papynov E.K., Shichalin O.O., Belov A.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1434. https://doi.org/10.1134/S0036023621090114
Smith A.L., Kauric G., van Eijck L. et al. // J. Solid State Chem. 2017. V. 253. P. 89. https://doi.org/10.1016/j.jssc.2017.05.032
Matskevich N.I., Semerikova A.N., Shlegel V.N. et al. // J. Alloys Compd. 2021. V. 850. P. 156683. https://doi.org/10.1016/j.jallcom.2020.156683
Kasimkin P.V., Moskovskih V.A., Vasiliev Y.V. // J. Cryst. Growth. 2014. V. 390. P. 67. https://doi.org/10.1016/j.jcrysgro.2013.12.027
Volokitina A., Loiko P., Pavlyuk A. et al. // Opt. Mater. Express. 2020. V. 10. P. 2356. https://doi.org/10.1364/OME.400894
Matiutin A.S., Kovalenko N.A., Uspenskaya I.A. // J. Chem. Eng. Data. 2022. V. 67. P. 984. https://doi.org/10.1021/acs.jced.1c00849
Druzhinina A.I., Tiflova L.A., Monayenkova A.S. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. P. 2101. https://doi.org/10.1134/S0036024419110098
Matskevich N.I., Kellerman D.G., Gelfond N.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 720. https://doi.org/10.1134/S0036023620050150
Tsvetkov D.S., Sereda V.V., Malyshkin D.A. et al. // Chim. Techno Acta. 2021. V. 7. P. 42. https://doi.org/10.15826/CHIMTECH.2020.7.2.01
Matskevich N.I., Wolf Th., Vyazovkin I.V. et al. // J. Alloys Compd. 2015. V. 628. P. 126. https://doi.org/10.1016/j.jallcom.2014.11.220
Matskevich N.I., Chuprova M.V., Punn R. et al. // Thermochim. Acta. 2007. V. 459. P. 125. https://doi.org/10.1016/j.tca.2007.03.015
Matskevich N.I., Krabbes G., Berasteguie P. // Thermochim. Acta. 2003. V. 397. P. 97. https://doi.org/10.1016/S0040-6031(02)00330-1
Kilday M.V. // J. Res. Nat. Bur. Stand. 1980. V. 85. P. 467.
Gunther C., Pfestorf R., Rother M. et al. // J. Therm. Anal. Calorim. 1988. V. 33. P. 359. https://doi.org/10.1007/BF01914624
Guskov A.V., Gagarin P.G., Guskov V.N. et al. // Russ. J. Phys. Chem. A. 2022. V. 96. P. 1195. https://doi.org/10.1134/S0036024422060103
Zvereva I.A., Shelyapina M.G., Chislov M. et al. // J. Therm. Anal. Calorim. 2022. V. 147. P. 6147. https://doi.org/10.1007/s10973-021-10947-4
Kosova D.A., Provotorov D.I., Kuzovchikov S.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 752. https://doi.org/10.1134/S0036023620050125
Samoshkin D.A., Agazhanov A.Sh., Stankus S.V. // J. Phys.: Conf. Ser. 2021. V. 2119. P. 012135. https://doi.org/10.1088/1742-6596/2119/1/012135
Smirnova N.N., Markin A.V., Abarbanel N.V. et al. // Russ. J. Phys. Chem. A. 2021. V. 95. P. 2387. https://doi.org/10.1134/S0036024421120219
Matskevich N.I., Wolf Th., Le Tacon M. et al. // J. Therm. Anal. Calorim. 2017. V. 130. P. 1125. https://doi.org/10.1007/s10973-017-6493-z
Drebushchak V.A., Isaenko L.I., Lobanov S.I. et al. // J. Therm. Anal. Calorim. 2017. V. 129. P. 103. https://doi.org/10.1007/s10973-017-6176-9
Tkachev E.N., Matskevich N.I., Samoshkin D.A. et al. // Phys. B: Cond. Matter. 2021. V. 612. P. 412880. https://doi.org/10.1016/j.physb.2021.412880
Khan A., Khan S., Kim H.J. et al // Optik. 2021. V. 242. P. 167035. https://doi.org/10.1016/j.ijleo.2021.167035
Glushko V.P. Termicheskie Konstanty Veshchestv (Thermal Constants of Substances), Moscow: VINITI, 1965–1982. № 1–10.
O’Hare P.A.G., Hoekstra H.R. // J. Chem. Thermodyn. 1973. V. 5. P. 851. https://doi.org/10.1016/S0021-9614(73)80047-3
Musikhin A.E., Naumov V.N., Bespyatov M.A. et al. // J. Alloys Compd. 2015. V. 639. P. 145. https://doi.org/10.1016/j.jallcom.2015.03.159
Orborne D.W., Flotov H.E., Hoekstra H.R. // J. Chem. Thermodyn. 1974. V. 6. P. 179. https://doi.org/10.1016/0021-9614(74)90260-2
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии