Журнал неорганической химии, 2023, T. 68, № 2, стр. 174-180
Термодинамическое исследование процессов сорбции газообразного ферроцена на металлоорганическом каркасе [Zn4(ndc)4(ur)2(dmf)]
Л. Н. Зеленина a, *, Т. П. Чусова a, С. А. Сапченко a, Н. В. Гельфонд a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: zelenina@niic.nsc.ru
Поступила в редакцию 02.08.2022
После доработки 19.09.2022
Принята к публикации 27.09.2022
- EDN: LOTENW
- DOI: 10.31857/S0044457X22601274
Аннотация
Давление ферроцена в системе хозяин (металлоорганический каркас [Zn4(dmf)(ur)2(ndc)4])–гость (ферроцен) измерено методом статической тензиметрии с мембранными нуль-манометрами в диапазоне температур от 324 до 462 K. В результате исследования получены температурные зависимости давления для процесса перехода гостя из каркаса хозяина в газовую фазу, определены энтальпия и энтропия этого процесса, рассчитано изменение энергии Гиббса в процессе связывания ферроцена каркасом. На основе этой информации сделаны выводы о характере взаимодействий между молекулами-хозяевами и молекулами-гостями и проведено сравнение полученных результатов с исследованным ранее процессом сорбции бензола на [Zn4(dmf)(ur)2(ndc)4].
ВВЕДЕНИЕ
Металлоорганические координационные полимеры (МОКП) представляют собой координационные соединения, в которых атомы металлов объединены в одно-, двух- или трехмерную структуру благодаря координации к мостиковым лигандам. МОКП с трехмерной каркасной структурой представляют наибольший интерес благодаря их перманентной пористости и, как следствие, способности к образованию соединений включения с широким спектром субстратов от небольших молекул углекислого газа, диоксидов азота и серы [1] до макромолекул полимеров и ферментов [2].
Основным способом исследования систем гость–хозяин на основе МОКП остается кристаллография. Например, структурное изучение соединений включения газов в МОКП позволяет не только определить точное положение гостевых молекул внутри координационного полимера, но и выявить сорбционные центры на поверхности координационного полимера, с которыми гостевые молекулы взаимодействуют сильнее всего. Так, нейтронографическое исследование in situ соединений включения углекислого газа в координационные полимеры MFM-126 и MFM-127 позволило установить взаимодействие гостевых молекул СО2 как между собой, так и с амидными группами каркаса [3].
Хотя структурная информация о локализации ван-дер-ваальсовых взаимодействий между центрами каркаса и гостевыми молекулами очень важна, она не дает представления об энергетике этих взаимодействий. Однако энергетика имеет не менее важное значение для понимания процессов сорбции, разделения субстратов и катализа. Исследование систем гость–хозяин с использованием термодинамических методов (калориметрия, тензиметрия) позволяет количественно описать энергетику процессов сорбции и таким образом существенно дополнить структурную информацию.
Между тем работы, посвященные термодинамике соединений включения на основе металлоорганических координационных полимеров, по-прежнему редки в литературе. Из недавних успешных попыток применения термодинамических экспериментов для изучения МОКП следует упомянуть ряд экспериментальных исследований, где количественные термодинамические характеристики (Ka, ∆H) процесса адсорбции различных органических молекул на МОКП в водных растворах были получены методом изотермической калориметрии титрования [4–7]. Калориметрические эксперименты по насыщению координационных полимеров HKUST-1 и UiO-66 различными органическими жидкими С6-субстратами (н-гексан, 2-метилпентан, 2,2-диметилбутан) показали высокое сродство этих соединений к разветвленным углеводородам, а не к н-гексану, что является ценной информацией для разработки методов разделения смесей этих углеводородов [8]. Сочетание тензиметрических и дифракционных экспериментов позволило лучше понять сложный процесс десорбции бензола из аддукта C6H6 и координационного полимера [Zn2(bdc)2(dabco)] (bdc2– = = терефталат, dabco = диазабициклооктан), а также выявить три стадии этого процесса, связанные с эффектом дыхания (изменение структуры каркаса при включении или удалении гостевых молекул) [9].
Таким образом, существующие на данный момент литературные данные по термодинамике супрамолекулярных систем на основе МОКП в основном сфокусированы на соединениях включения ароматических органических молекул, тогда как соединения включения летучих металлоорганических комплексов, таких как ферроцен, практически не изучены. Однако в последнее время соединения включения ферроцена привлекают большое внимание материаловедов ввиду электрохимической активности этого комплекса, а также с точки зрения использования полученных соединений включения как прекурсоров углеродных материалов [10]. Так, адсорбция [Fe(C5H5)2] пленками координационного полимера HKUST-1 сопровождается уменьшением электрического сопротивления аддукта [11]. В то же время разложение соединения включения [Fe(Cp)2]@ZIF-8 позволяет получить углеродный материал, допированный атомами железа и азота, являющийся одним из лучших катализаторов для электрохимического восстановления кислорода [12].
В настоящей работе впервые получены термодинамические характеристики (∆H, ∆S, ∆G) процессов сорбции ферроцена металлоорганическим координационным полимером [Zn4(dmf)(ndc)4(ur)2] (dmf = диметилформамид, ndc2– = 2,6-нафталиндикарбоксилат, ur = уротропин). Этот полимер обладает каркасной структурой, довольно высокой удельной площадью поверхности (820 м2 г–1), а также вследствие наличия каналов диаметром 9 Å легко поглощает как газы (CO, CO2, ацетилен) [13], так и бензол, ферроцен и S4N4, при этом благодаря высокой кристалличности этого материала у всех полученных соединений включения были определены структуры [14, 15]. Ранее нами были получены термодинамические характеристики процессов сорбции бензола и воды данным координационным полимером в уникальном эксперименте по адсборции этих субстратов из газовой фазы [16]. Таким образом, настоящая работа является продолжением детальных исследований термодинамических аспектов формирования систем гость–хозяин координационным полимером [Zn4(dmf)(ndc)4(ur)2].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов. Ферроцен марки “ч. д. а.”, который перед синтезом очищали вакуумной сублимацией, и координационный полимер состава [Zn4(dmf)(ndc)4(ur)2] (I), где dmf – диметилформамид, ndc2– – анион нафталиндикарбоновой кислоты, ur – уротропин, служили исходными соединениями для синтеза комплексов I · nFe(C5H5)2. Синтез полимера описан в нашей предыдущей работе [14], его структура охарактеризована методом РСА, состав и чистота подтверждены с помощью порошковой рентгеновской дифракции (РФА), ИК-, TГ- и элементного (C, H, N) анализов. Согласно результатам анализов, соединение было однофазным и соответствовало химической формуле Zn4C63H55N9O17 ([Zn4(dmf)(ndc)4(ur)2]). По данным [14], максимальное содержание ферроцена в полимере I соответствует химической формуле I · 4Fe(C5H5)2. Образцы I · nFe(C5H5)2 синтезировали как в избытке, так и в недостатке ферроцена (относительно n = 4) непосредственно в рабочем объеме мембранного нуль-манометра. В эксперименте 1 синтез проводили в избытке ферроцена, в манометр загружали навески полимера (0.0503 г) и ферроцена (0.0291 г) в соотношении 1 : 4.58. Навеску ферроцена засыпали в стеклянную ампулу с разбиваемым кончиком, которую вакуумировали (1.33 Па), перепаивали газовой горелкой и загружали в рабочий объем нуль-манометра. Прибор, заполненный исходными соединениями, откачивали до давления 1.33 Па при температуре 368 K в течение 1 ч, чтобы удалить со стенок манометра и из пористого полимера адсорбированные газы и воду. Затем нуль-манометр охладили, отпаяли от вакуумной системы с помощью газовой горелки, встряхиванием разбили ампулу с навеской ферроцена и, установив прибор в печь тензиметрической установки, начали нагрев и измерение давления в системе. Температурный режим нагрева печи и измеренное давление насыщенного и ненасыщенного пара ферроцена показаны на рис. 1.
Как видно из рис. 1б, экспериментальные данные хорошо согласуются с работой [17], где приведены рекомендованные значения давления насыщенного пара ферроцена, что говорит об отсутствии примесей в использованном образце. Выход в ненасыщенный пар позволил рассчитать по уравнению идеального газа количество свободного ферроцена, которое осталось в системе. Оно составило 13.28% от массы ферроцена, загруженного в манометр. Таким образом, 86.72% ферроцена вошло в каркас, что соответствует составу I · 3.97Fe(C5H5)2. По окончании синтеза нуль-манометр охлаждали до комнатной температуры, прибор подключали к вакуумной системе и при температуре 363–368 K откачивали ферроцен, не вошедший в каркас. Его количество взвесили (0.0033 г), оно хорошо согласуется с рассчитанным значением (0.0039 г). Затем нуль-манометр отсоединяли от вакуумной системы и помещали в тензиметрическую установку для проведения эксперимента. Количество свободного (не связанного с каркасом) ферроцена, оставшегося в нуль-манометре, уточняли в ходе эксперимента по выходу в ненасыщенный пар от линии моновариантного равновесия Fe(C5H5)2(тв) = = Fe(C5H5)2(газ) (см. раздел “Анализ полученных данных”). Остальные образцы готовили в недостатке ферроцена и состав образца рассчитывали по количеству ферроцена, удаленного после синтеза из камеры манометра, и по выходу в ненасыщенный пар в ходе тензиметрических экспериментов. Описанным способом было приготовлено четыре образца, их состав приведен в табл. 1.
Рис. 1.
Температурный режим печи в процессе синтеза I · nFe(C5H5)2 (а) и зависимость давления пара ферроцена от температуры в координатах lgp–1000/T (б): квадраты – экспериментальные значения, прямая – данные [17].
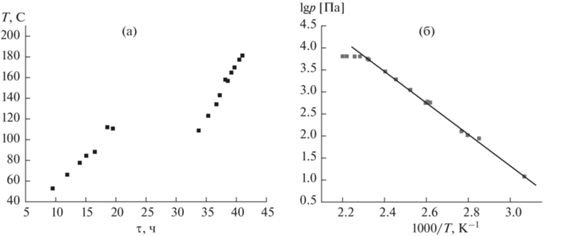
Таблица 1.
Условия проведения экспериментов
| № эксперимента | n в I · nFe(C5H5)2 | ΔТ, K | Δp, Па | Исходная концентрация Fe(C5H5)2, г/л | m, г Fe(C5H5)2 (гостя) |
Объем камеры нуль-манометра, V, мл |
|---|---|---|---|---|---|---|
| 1 2 3 4 |
3.97 1.75 0.80 0.65 |
324–457 328–446 345–459 348–462 |
13–3400 16–720 50–1050 51–960 |
2.1958 0.0242 0.0184 0.0459 |
0.02523 0.00070 0.00120 0.00104 |
11.49 28.89 65.28 22.64 |
Статический метод с мембранными нуль-манометрами. Температурную зависимость давления пара измеряли статическим методом с использованием мембранных нуль-манометров системы Новикова–Суворова [18], изготовленных из пирексового стекла. Чувствительность использованных нуль-манометров варьировалась от 13 до 20 Па. Схема установки приведена в работе [19], в работах [20–22] подробно описаны основные характеристики установки, предельная ошибка измерения давлений с учетом ошибки компенсации, ошибки измерения катетометром и неточностей, связанных с необратимым температурным дрейфом нулевого положения, не превышала 70 Па. Величина предельной ошибки измерения температуры, оцененная из калибровок Pt–Pt/Rh-термопары по реперным веществам (In, Pb, Cd) и из калибровок установки по ртути, нафталину и аргону, не превышала 0.3 K. Точность термостатирования составляла ±0.1 K, радиальный и продольный градиенты температуры в рабочей камере не превышали 0.5 K, что было установлено специальными измерениями контрольной Pt–Pt/Rh-термопарой. Объем мембранного нуль-манометра определяли с точностью 0.05 см3 как разность между массой пустого манометра и манометра, заполненного дистиллированной водой. Точность определения массы образца составляла 0.0001 г. Методика заполнения мембранных нуль-манометров, подробно описанная в предыдущем разделе, позволила избавиться от балластного давления, вызываемого остатками влаги и воздуха, адсорбированными на стенках камеры манометра. Измерения проводили как при нагревании (прямой ход), так и при охлаждении (обратный ход) манометра. Совпадение измеренных давлений на прямом и обратном ходе являлось критерием того, что эти давления относятся к равновесной системе. Время установления равновесия при нагревании составляет ~40 мин, при охлаждении – 1.5 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Давление насыщенного и ненасыщенного пара ферроцена над I · nFe(C5H5)2, где 0.65 ≤ n ≤ 3.97, измерено в четырех экспериментах с различными массами исследуемого соединения и объемами манометра. Эксперименты осуществляли в широком интервале температур (324 ≤ Т, K ≤ 462), давлений (13 ≤ p, Па ≤ 3400) и концентраций (0.0184 ≤ m/V, г/л ≤ 2.1958). Максимальная температура нагрева составляла 462 K, поскольку выше начинается разложение I [16]. Условия проведения экспериментов представлены в табл. 1, экспериментальные данные – на рис. 2.
Рис. 2.
Данные экспериментов 1–4 (значки) и литературные данные по давлению насыщенного пара (линия) [17] в координатах lgp–1000/T.

Как видно из рис. 2, в каждом образце содержится свободный ферроцен, поскольку при низких температурах экспериментальные точки лежат на линии моновариантного равновесия сублимации ферроцена [17]. С повышением температуры свободный ферроцен полностью переходит в газовую фазу (экспериментальные точки отходят от линии моновариантного равновесия) и становится ненасыщенным паром. Одновременно с этим процессом происходит переход ферроцена-гостя в газовую фазу, но его давление намного меньше давления свободного ферроцена, поэтому его вклад в измеренное давление становится ощутимым только на стадии появления ненасыщенного пара. В этой дивариантной области давление pi, измеренное при температуре Ti, состоит из двух слагаемых: давления пара ферроцена-гостя и давления ненасыщенного пара свободного ферроцена, которое подчиняется закону идеального газа:
Концентрацию свободного ферроцена (Cj) в ненасыщенном паре в каждом опыте (j) определяли по координатам точки (рj, Tj), с которой начинается отход от линии моновариантного равновесия (рис. 2).
(2)
${{C}_{{j{\text{ }}}}} = {{p}_{j}}_{{{\text{fer}}}}{\text{/}}{{T}_{j}} \to {{p}_{j}}_{{{\text{fer}}}} = {{C}_{j}}{{T}_{j}}.$Для эксперимента 1 количество свободного ферроцена, рассчитанного по уравнению идеального газа в точке отхода от линии моновариантного равновесия, составляет 0.0006 г, что как раз покрывает разницу между рассчитанным значением (0.0039 г), полученным из данных по насыщению полимера ферроценом, и избыточным ферроценом (0.0033 г), откачанным из манометра после синтеза (см. раздел “Синтез образцов”).
Давление пара ферроцена-гостя (pi g), рассчитанное по уравнению (1), представлено на рис. 3 в координатах lgpg = f(1/T) (а) и lgpgn = f(1/T) (б), где n – число грамм-молей ферроцена-гостя в исходном образце (табл. 1), pgn = pg/n. Как видно из рисунка, давление, нормированное к 1 молю ферроцена, одинаково для всех изученных составов. Такой результат возможен только при условии, что все молекулы ферроцена, принимающие участие в парообразовании, энергетически равноценны.
Рис. 3.
Температурная зависимость давления пара ферроцена над I · nFe(C5H5)2 в координатах lgpg–1000/T (а) и lgpgn–1000/T (б), где pgn = pg/n.

Полученная информация позволила рассчитать термодинамические характеристики процесса выхода в газовую фазу ферроцена-гостя из металло-органического каркаса I:
(3)
${\text{I}}\,\,{{\cdot}}\,\,{\text{Fe}}{{\left( {{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{5}}} \right)}_{2}}({\text{тв}}) = {\text{I}}({\text{тв}}) + {\text{Fe}}{{\left( {{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{5}}} \right)}_{2}}{\kern 1pt} ({\text{г}}).$Данные по насыщенному пару (4 эксперимента, 51 точка) были обработаны методом наименьших квадратов с использованием целевой функции, основанной на принципе максимального правдоподобия [23]:
(4)
$\begin{gathered} \psi = \sum\limits_{i = 1}^N {\sum\limits_{j = 1}^{ni} {{{{{{\left[ {p_{{\text{э}}}^{{(ij)}} - p_{p}^{{(ij)}}} \right]}}^{2}}} \mathord{\left/ {\vphantom {{{{{\left[ {p_{{\text{э}}}^{{(ij)}} - p_{p}^{{(ij)}}} \right]}}^{2}}} {{{W}_{{ij}}}}}} \right. \kern-0em} {{{W}_{{ij}}}}}} } , \\ {{W}_{{ij}}} = ~\,\,\Delta p_{{ij}}^{2} + \left( {\frac{{dp}}{{dT}}} \right)_{{ij}}^{2}\Delta T_{{ij}}^{2}, \\ \end{gathered} $(5)
$\begin{gathered} {{\Delta }_{{{\text{пр}}3}}}H_{{{{T}_{{{\text{ср}}}}}}}^{0} = 61.9 \pm 1.5{\text{ кДж/моль}}; \\ {{\Delta }_{{{\text{пр}}3}}}S_{{{{T}_{{{\text{ср}}}}}}}^{0} = 90.6 \pm 3.3{\text{ Дж/моль/K}}; \\ \ln (p{\text{/}}p^\circ ) = \\ = 10.8940--7441.68/Т(382{\kern 1pt} --{\kern 1pt} 462\,\,{\text{K}}), \\ p^\circ = {{10}^{5}}\,\,{\text{Па}}. \\ \end{gathered} $Отклонения нормированных экспериментальных данных от рассчитанных по уравнению (5) представлены на рис. 4. Видно, что разброс точек носит случайный характер, а отклонения не превышают предельно допустимых значений, рассчитанных из погрешностей измерений температуры и давления, что указывает на отсутствие систематических ошибок в экспериментах.
Проведено сравнение полученных данных по ферроцену с результатами нашей работы по бензолу [16] (рис. 5), приведены также данные по сублимации ферроцена [17] и испарению бензола [26].
Рис. 5.
Давление паров ферроцена над I · Fe(C5H5)2(тв) и бензола над I · C6H6(тв) по сравнению с чистыми соединениями.

Из рис. 5 видно, что давление бензола над комплексом I · C6H6(тв) выше, чем ферроцена над I · Fe(C5H5)2(тв), следовательно, связи ферроцена с каркасом I должны быть сильнее, чем в случае бензола.
Полагая, что энергия связи – это изменение энергии Гиббса в процессе связывания 1 моля ферроцена 1 молем каркаса (процесс, обратный изученному нами), получаем:
(6)
$\begin{gathered} {\text{I}}({\text{тв}}) + {\text{Fe}}{{\left( {{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{5}}}}} \right)}_{2}}({\text{г}}) = {\text{I}}\,\,\cdot{\text{ Fe}}{{\left( {{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{5}}} \right)}_{2}}({\text{тв}}), \\ {{\Delta }_{{{\text{пр}}6}}}G_{{422}}^{0} = - 23.6 \pm 1.5\,\,{\text{кДж/моль}}{\text{.\;}}~~~~~~~~~~ \\ \end{gathered} $Для подобного процесса в случае бензола $\Delta G_{{426}}^{0}$ = –14.39 кДж/моль [16].
ЗАКЛЮЧЕНИЕ
Методом статической тензиметрии с мембранными нуль-манометрами изучен процесс перехода ферроцена в газовую фазу из комплексов состава [Zn4(dmf)(ndc)4(ur)2]·nFe(C5H5)2(тв), 0.65 ≤ n ≤ 3.97. Полученные результаты доказывают энергетическую эквивалентность молекул ферроцена, принимающих участие в парообразовании. Из экспериментальных данных рассчитана летучесть ферроцена (ln(p/p°)) и термодинамические параметры изученного процесса (${{\Delta }_{{{\text{пр}}}}}H_{{{{Т}_{{{\text{ср}}}}}}}^{0}{\kern 1pt} ,$ ${{\Delta }_{{{\text{пр}}}}}S_{{{{Т}_{{{\text{ср}}}}}}}^{0},$ ${{\Delta }_{{{\text{пр}}}}}G_{{{{Т}_{{{\text{ср}}}}}}}^{0}$). Порядок величины энергии Гиббса указывает на физическую адсорбцию ферроцена на полимере. Количественная информация о процессах сорбции гостей на металлоорганических координационных полимерах может быть использована для синтеза функциональных материалов с заданными свойствами.
Список литературы
Emam H.E., Abdelhameed R.M., Ahmed H.B. // J. Environ. Chem. Eng. 2020. V. 8. № 5. P. 104386. https://doi.org/10.1016/j.jece.2020.104386
Hankari S., Bousmina M., Kadib A. // Prog. Mater. Sci. 2019. V. 106. P. 100579. https://doi.org/10.1016/j.pmatsci.2019.100579
Humby J.D., Benson O., Smith G.L. et al. // Chem. Sci. 2019. V. 10. P. 1098. https://doi.org/10.1039/C8SC03622E
Kato S., Drout R.J., Farha O.K. // Cell Rep. Phys. Sci. 2020. V. 1. P. 100006. https://doi.org/10.1016/j.xcrp.2019.100006
Wei Y.-B., Wang M.-J., Luo D. et al. // Mater. Chem. Front. 2021. V. 5. P. 2416. https://doi.org/10.1039/D0QM01097A
Drout R.J., Kato S., Chen H. et al. // J. Am. Chem. Soc. 2020. V. 142. № 28. P. 12357. https://doi.org/10.1021/jacs.0c04668
Sha F., Tai T.-Y., Gaidimas M.A. et al. // Langmuir. 2022. V. 38. № 22. P. 6771. https://doi.org/10.1021/acs.langmuir.2c00812
Cuadrado-Collados C., Rojas-Mayorga C.K., Saavedra B. et al. // J. Phys. Chem. C. 2019. V. 123. № 18. P. 11699. https://doi.org/10.1021/acs.jpcc.9b01381
Ukraintseva E.A., Manakov A.Yu., Samsonenko D.G. et al. // J. Inclusion Phenom. Macrocyclic Chem. 2013. V. 77. P. 205. https://doi.org/10.1007/s10847-012-0234-5
Huang Zh., Yu H., Wang L. et al. // Coord. Chem. Rev. 2021. V. 430. P. 213737. https://doi.org/10.1016/j.ccr.2020.213737
Liu J., Wächter T., Irmler A. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7. № 18. P. 9824. https://doi.org/10.1021/acsami.5b01792
Wang J., Han G., Wang L. et al. // Small. 2018. V. 14. № 15. P. 1704282. https://doi.org/10.1002/smll.201704282
Sapchenko S.A., Dybtsev D.N., Samsonenko D.G. et al. // Chem. Commun. 2015. V. 51. P. 13918. https://doi.org/10.1039/C5CC05779E
Sapchenko S.A., Samsonenko D.G., Dybtsev D.N. et al. // Dalton Trans. 2011. V. 40. P. 2196. https://doi.org/10.1039/C0DT00999G
Sapchenko S.A., Samsonenko D.G., Dybtsev D.N. et al. // Inorg. Chem. 2013. V. 52. № 17. P. 9702. https://doi.org/10.1021/ic400940w
Zelenina L.N., Chusova T.P., Sapchenko S.A. et al. // JCT. 2013. V. 57. P. 128. https://doi.org/10.1016/j.jct.2013.07.021
Fulem M., Růžička K., Červinka C. et al. // JCT. 2013. V. 57 P. 530. https://doi.org/10.1016/j.jct.2012.07.023
Суворов А.В. Термодинамическая химия парообразного состояния. Л.: Химия, 1970. С. 46.
Zelenina L.N., Chusova T.P., Vasilyeva I.G. // JCT. 2013. V. 57. P. 101. https://doi.org/10.1016/j.jct.2012.08.005
Zelenina L.N., Titov V.A., Chusova T.P. et al. // JCT. 2003. V. 35. P. 1601. https://doi.org/10.1016/S0021-9614(03)00123-X
Zelenina L.N., Chusova T.P., Isakov A.V. et al. // JCT. 2020. V. 141. P. 105958. https://doi.org/10.1016/j.jct.2019.105958
Zelenina L.N., Chusova T.P., Isakov A.V. et al. // JCT. 2021. V. 158. P. 106424. https://doi.org/10.1016/j.jct.2021.106424
Титов В.А., Коковин Г.А. // Математические методы в химической термодинамике. Новосибирск: Наука, 1980. С. 98.
Фундаментальные основы процессов химического осаждения пленок и структур для наноэлектроники / Под ред. Смирновой Т.П. Новосибирск: Изд-во СО РАН, 2013. 175 с.
Zelenina L.N., Chusova T.P. // Russ. J. Gen. Chem. 2021. V. 91. P. 1984. https://doi.org/10.31857/S0044460X21100097
Гурвич Л.В. // Вестн. АН СССР. 1983. № 3. С. 54.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



