Журнал неорганической химии, 2023, T. 68, № 2, стр. 181-190
Влияние положения заместителей на давление насыщенного пара тетрафторзамещенных фталоцианинов цинка
Д. В. Бонегардт a, С. В. Трубин a, А. С. Сухих a, Д. Д. Клямер a, Т. В. Басова a, *
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: basova@niic.nsc.ru
Поступила в редакцию 30.08.2022
После доработки 07.09.2022
Принята к публикации 16.09.2022
- EDN: LQZYWW
- DOI: 10.31857/S0044457X22601614
Аннотация
Настоящая работа посвящена исследованию влияния положения фтор-заместителей в молекулах тетрафторзамещенных фталоцианинов цинка на давление их насыщенного пара. Для этого температурная зависимость давления насыщенного пара фталоцианинов цинка с фтор-заместителями в периферийном (ZnPcF4-p) и непериферийном (ZnPcF4-np) положении фталоцианинового кольца была изучена методом Кнудсена с масс-спектрометрической регистрацией состава газовой фазы и рассчитаны термодинамические параметры парообразования. Проведено сравнение полученных данных для ZnPcF4-p и ZnPcF4-np с незамещенным и гексадекафторзамещенным фталоцианинами цинка с точки зрения анализа межмолекулярных взаимодействий в кристаллах данных соединений. Показано, что тетрафторзамещенные фталоцианины обладают более высоким давлением пара по сравнению с их незамещенным (ZnPc) и гексадекафторзамещенным (ZnPcF16) производными. При этом энтальпия сублимации увеличивается в ряду ZnPcF4-p < ZnPcF4-np < ZnPc < ZnPcF16.
ВВЕДЕНИЕ
Благодаря своим физико-химическим свойствам фталоцианины металлов являются предметом большого числа теоретических и экспериментальных исследований [1–4]. Фталоцианины металлов находят широкое применение в различных областях электроники, например, в качестве активных слоев полевых транзисторов [5, 6], диодов [7, 8], солнечных элементов [2, 9] и химических сенсоров [10, 11].
Для использования фталоцианинов в ряде электронных устройств их необходимо получать в виде тонких пленок. Одним из важных методов получения тонких пленок является физическое осаждение из газовой фазы. Благодаря летучести (способности вещества переходить в газовую фазу без разложения) незамещенных и некоторых галогензамещенных фталоцианинов данный метод используется для получения их тонких пленок [12].
Количественной характеристикой летучести является давление насыщенного пара соединения при определенной температуре. Полученные данные позволяют определять возможность разделения летучих фталоцианинов методом сублимации. По диаграммам зависимости давления пара от температуры (P–T) могут быть установлены качественные закономерности, которые используются при выборе оптимальных условий напыления пленок фталоцианинов. На основе данных по температурной зависимости давления насыщенного пара могут быть рассчитаны термодинамические параметры парообразования, которые являются справочными данными, используемыми в термохимических расчетах и для количественной оценки межмолекулярного взаимодействия во фталоцианинах.
В литературе имеется ряд работ, опубликованных еще в 1970–1995 г. [13–17], а также более поздние работы нашей научной группы [18], в которых проводились измерения температурной зависимости давления пара некоторых незамещенных фталоцианинов металлов. Так, температурная зависимость давления пара фталоцианина меди изучена для ряда незамещенных фталоцианинов металлов, а именно: в Cu(II)Pc [13, 14], Ni(II)Pc, Pb(II)Pc, TiOPc [15], H2Pc, VOPc, NiPc [16]. Авторы работы [16] использовали торсионный метод для измерения давления пара VOPc, H2Pc, GeCl2Pc и NiPc. Результаты измерений этим методом хорошо согласуются с данными работы [17], в которой давление насыщенного пара GeCl2Pc и SiCl2Pc было изучено методом Кнудсена.
Позже в работах нашей научной группы были проведены исследования давления насыщенного пара тетра-трет-бутилзамещенных фталоцианинов цинка и ванадила [19], а также гексадеказамещенных фталоцианинов MPcF16 [20–24] и тетрафторзамещенных фталоцианинов меди, кобальта и ванадила [25]. Было показано, что для фталоцианинов кобальта и меди давление пара уменьшается в ряду MPcF4 > MPc > MPcF16.
В случае тетрафторзамещенных фталоцианинов металлов заместители могут быть введены как в периферийные (MPcF4-p), так и в непериферийные (MPcF4-np) положения бензольных колец (рис. 1). Ранее были исследованы только MPcF4-p (M = Co, Cu, VO), а фталоцианины цинка и MPcF4-np с непериферийным положением фтор-заместителей исследованы не были.
Рис. 1.
Тетрафторзамещенные фталоцианины цинка с F-заместителями в непериферийных (ZnPcF4-np) и периферийных (ZnPcF4-p) положениях фталоцианинового кольца.

Настоящая работа посвящена исследованию влияния положения фтор-заместителей в молекулах тетрафторзамещенных фталоцианинов цинка на давление насыщенного пара. Для этого температурная зависимость давления насыщенного пара фталоцианинов цинка с фтор-заместителями в периферийном (ZnPcF4-p) и непериферийном (ZnPcF4-np) положении фталоцианинового кольца была изучена методом Кнудсена с масс-спектрометрической регистрацией состава газовой фазы и рассчитаны термодинамические параметры парообразования. Проведено сравнение полученных данных с точки зрения анализа межмолекулярных взаимодействий в кристаллах данных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетрафторзамещенные фталоцианины ZnPcF4-p и ZnPcF4-np синтезировали по стандартным методикам, разработанным ранее для незамещенных фталоцианинов металлов [26]. Очистку фталоцианинов проводили методом двухкратной вакуумной сублимации (5 × 10–5 Торр) с использованием установки, позволяющей регулировать градиент температуры. Порошки ZnPcF4-p и ZnPcF4-np представляли собой смесь четырех региоизомеров из-за различных возможных положений атома фтора, которые не разделялись из-за близости параметров сублимации.
ИК-спектры исследуемых фталоцианинов регистрировали на ИК-Фурье-спектрометре ФТ-801 в диапазоне 400–4000 см–1. ИК-спектр ZnPcF4-p: 433, 746, 822, 872, 947, 1049, 1090, 1113, 1165, 1227, 1263, 1331, 1402, 1481, 1508, 1616 см–1. ИК-спектр ZnPcF4-np: 563, 714, 743, 762, 802, 880, 928, 999, 1043, 1085, 1130, 1252, 1334, 1398, 1454, 1489, 1589, 1618 см–1.
Элементный анализ на содержание C, H, N осуществляли на приборе Thermo Finnigan Flash, аппаратная погрешность составляла <1%, результатом анализа являлось среднее арифметическое содержание элементов по 2–3 измерениям.
| C | H | N | |
| Найдено, %: | 59.4; | 1.9; | 17.3. |
| Для ZnPcF4-p | |||
| вычислено, %: | 59.1; | 1.9; | 17.2. |
| C | H | N | |
| Найдено, %: | 59.2; | 1.9; | 17.1. |
| Для ZnPcF4-np | |||
| вычислено, %: | 59.1; | 1.9; | 17.2. |
Температурные зависимости давления насыщенных паров полученных соединений были измерены методом Кнудсена на масс-спектрометре МИ-1201 с использованием техники, описанной в работе [27], в области температур до 60°С. Энергия ионизирующего пучка составляла 35 эВ. Температуру испарителя задавали ступенчато с шагом 0–30°С. При каждой установившейся температуре регистрировали полный масс-спектр до 2000 мас. ч. Использовали камеры Кнудсена из молибдена, внутренняя полость которых имела диаметр 0.7 см и длину 0.7 см, диаметр эффузионного отверстия – 0.2 мм, длина канала – 0.2 мм. Отношение площади испарения к площади эффузионного отверстия составляло ∼1000. Температуру эффузионной камеры задавали ступенчато (шаг 5–10°С) с помощью прецизионного терморегулятора и измеряли Pt/PtRh(10%)-термопарой. Время выхода температуры эффузионной камеры на стационарный режим составляло не более 1 мин. Измерения интенсивности ионного тока в стационарном режиме проводили в течение 25–40 мин. В эффузионную камеру загружали ~2 мг вещества. Экспериментальные результаты обрабатывали по специальной программе [27, 28].
В расчет закладывали измеренные значения давления Р и температуры Т, а также предельные ошибки измерения ΔР и температуры ΔТ. Погрешность измерения давления составляет 10%. Для ΔТ предельная ошибка составляет ±2°С и складывается из погрешностей калибровки и собственной ошибки термопары.
Измерения давления пара проводили по пикам молекулярных ионов. Давление пара в камере Кнудсена (Р) связано с измеренной интенсивностью ионного тока известным соотношением:
где I – измеренная интенсивность ионного тока соответствующего иона, Т – температура испарения, В – константа, зависящая от чувствительности масс-спектрометра к данному сорту ионов [15].Для определения константы В для каждого соединения использовали многотемпературный вариант метода полного испарения известного количества вещества [27]. Давление в объеме камеры Кнудсена при температуре Т определяется потерей массы вещества w (г) за время t (с) уравнением Герца–Кнудсена:
(2)
$P = \frac{w}{{KAt}}{{\left( {\frac{{2\pi RT}}{M}} \right)}^{{1/2}}} = 0.02255\frac{w}{{KAt}}{{\left( {\frac{T}{M}} \right)}^{{1/2}}},$(3)
${{w}_{i}} = \frac{{{{S}_{{ef}}}{{M}^{{1/2}}}B\int\limits_0^t {T_{i}^{{1/2}}{{I}_{i}}dt} }}{{0.02255}},$Подставляя уравнение (4) в формулу (1), получаем уравнение, связывающее давление в эффузионной камере с измеряемыми в эксперименте величинами:
(5)
$P = \frac{{0.02255wIT}}{{{{S}_{{ef}}}{{M}^{{1/2}}}\int\limits_0^t {T_{i}^{{1/2}}{{I}_{i}}dt} }},$Расчет и анализ поверхностей Хиршфельда (ПХ) проводили в программе CrystalExplorer 21.5 [29]. Оценку энергии решетки также проводили в программе CrystalExplorer с использованием базиса B3LYP/6-31G(d, p) и “кластерного” подхода, при котором вокруг выбранной молекулы генерировался кластер молекул в радиусе 10 Å, т.е. для центральной молекулы и любой другой молекулы в кластере существует пара атомов, расстояние между которыми <10 Å. Энергию решетки рассчитывали как полусумму энергий взаимодействия между центральной молекулой и каждой молекулой в кластере. Более подробно этот подход описан в работе [30].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для измерения давления насыщенного пара использовали эффузионный метод Кнудсена, основанный на измерении скорости истечения пара через малое отверстие из объема, содержащего насыщенный пар [18]. Наиболее эффективной модификацией метода Кнудсена является его комбинация с масс-спектрометром. Данный вариант позволяет контролировать состав паровой фазы непосредственно в процессе измерения. Было показано, что, как и большинство фталоцианинов металлов, ZnPcF4-p и ZnPcF4-np сублимируются в виде мономеров и не разлагаются вплоть до температуры 500°С. Это свидетельствует о мономолекулярном процессе сублимации в исследуемом интервале температур и преимущественно молекулярном строении кристаллов или о слабом ассоциативном взаимодействии в твердой фазе.
Экспериментальные результаты по исследованию температурной зависимости давления насыщенного пара ZnPcF4-p и ZnPcF4-np в сравнении с другими фталоцианинами цинка [21] представлены на рис. 2. Коэффициенты А и В в уравнении зависимости давления насыщенного пара от температуры lg P = –A/T + B и термодинамические параметры парообразования этих фталоцианинов представлены в табл. 1. Значения энтальпии и энтропии сублимации приведены для середины значения исследуемого интервала температур.
Рис. 2.
Температурные зависимости давления насыщенного пара ZnPc, ZnPcF16 [20], ZnPcF4-p и ZnPcF4-np.

Таблица 1.
Коэффициенты А и В в уравнении температурной зависимости давления пара lg P [атм.] = –A/T + B и термодинамические параметры сублимации фталоцианинов цинка
| Фталоцианин | A | B | ΔHТ, ккал/моль | $\Delta S_{T}^{^\circ },$ кал/(моль K) | T, oC | Источник |
|---|---|---|---|---|---|---|
| ZnPcF4-p | 8731 | 10.5 | 40.0 ± 0.6 | 35.1 ± 1.0 | 355–435 | Наст. работа |
| ZnPcF4-np | 8980 | 10.7 | 41.1 ± 1.1 | 35.7 ± 1.5 | 400–453 | Наст. работа |
| β-ZnPc | 10 530 | 9.5 | 48.1 ± 1.9 | 43.6 ± 2.7 | 390–438 | [21] |
| ZnPcF16 | 12 350 | 10.7 | 56.5 ± 0.4 | 48.9 ± 0.6 | 385–440 | [21] |
Тетрафторзамещенные фталоцианины обладают более высоким давлением пара по сравнению с их незамещенным (ZnPc) и гексадекафторзамещенным (ZnPcF16) производными [21]. При этом энтальпия сублимации увеличивается в ряду ZnPcF4-p < ZnPcF4-np < ZnPc < ZnPcF16. Если сравнивать фторзамещенные фталоцианины цинка с различным положением заместителей в макрокольце, то ZnPcF4-p обладает большей летучестью, чем ZnPcF4-np, при этом энтальпия его сублимации ниже на ~1 ккал/моль. Необходимо отметить, что давление пара описывается не только энтальпией, но и энтропией фазового перехода, которая довольно близка для ZnPcF4-p и ZnPcF4-np (табл. 1).
Различное давление пара соединений определяется особенностями их кристаллического строения и межмолекулярного взаимодействия в кристалле. Основной вклад в энергию решетки кристалла вносят ван-дер-ваальсовы и электростатические контакты периферийных атомов соседних молекул, а также специфические взаимодействия, число и тип которых определяются способом упаковки молекул в кристалле. Поскольку все исследуемые в данной работе фталоцианины имеют схожий мотив упаковки (молекулярные стопки), различия в межмолекулярных контактах внутри стопки молекул и между молекулярными стопками могут быть плохо различимы при простом визуальном анализе кристаллических структур. Использование поверхностей Хиршфельда позволяет визуализировать даже относительно слабые межмолекулярные контакты и провести более подробный и информативный сравнительный анализ межмолекулярных взаимодействий.
На рис. 3 представлены молекулярные упаковки β-ZnPc [31], ZnPcF4-np [32], ZnPcF4-p [33] и ZnPcF16 [34]. Молекулы β-ZnPc упакованы в стопки под углом 46.55° (угол между направлением упаковки и плоскостью молекулы) с расстоянием между соседними молекулами 3.338 Å, причем индивидуальные стопки ориентированы друг относительно друга таким образом, что молекулы в соседних стопках образуют узор, напоминающий “елочку”. Следовательно, каждая молекула ZnPc контактирует как с двумя параллельно расположенными соседними молекулами в стопке, так и с двумя молекулами, которые расположены практически перпендикулярно (угол между нормалями к плоскостям молекул в соседних стопках равен 93.10°). ZnPcF4-np имеет характер упаковки молекул, аналогичный β-ZnPc (угол упаковки 47.22°, расстояние между молекулами в стопке 3.263 Å, угол между молекулами в соседних стопках 94.43°). Молекулы ZnPcF4-p также упаковываются в стопки, однако имеют другой характер ориентации стопок, идентичный α-полиморфным модификациям незамещенных фталоцианинов, таких как α-CuPc [35] и α-CoPc [36]. Расстояние между молекулами ZnPcF4-p в стопке равно 3.337 Å, угол упаковки – 25.07°. В кристаллической структуре ZnPcF16 содержатся две независимые молекулы, которые упаковываются в два типа стопок. Расстояние между молекулами и угол упаковки составляют 3.181 Å и 48.77° для стопок первого типа и 3.218 Å и 48.18° для стопок второго типа. Молекулы в стопках одного типа параллельны друг другу, угол между плоскостями молекул в стопках разного типа равен 30.22°.
На рис. 4 приведены поверхности Хиршфельда, раскрашенные в соответствии со значением параметра dnorm (нормализованное контактное расстояние). CrystalExplorer автоматически подбирает диапазон dnorm для каждой молекулы (–0.0664–1.3120 для β-ZnPc, –0.2466–1.3280 для ZnPcF4-np, –0.1559–1.1946 для ZnPcF4-p, –0.1746–1.3287 и –0.1742–1.4177 для ZnPcF16), поэтому для более простого визуального сравнения для всех поверхностей был использован единый диапазон –0.2–1.4 значений dnorm. Во всех четырех исследуемых соединениях молекулы центросимметричные, поэтому на рис. 4 все ПХ показаны только с одной стороны, поскольку обратная сторона выглядит полностью идентично. Для ZnPcF16 приведены две ПХ, так как его кристаллическая структура содержит две независимые молекулы.
Рис. 4.
Поверхности Хиршфельда, раскрашенные в соответствии со значением параметра dnorm в диапазоне –0.2–1.4.
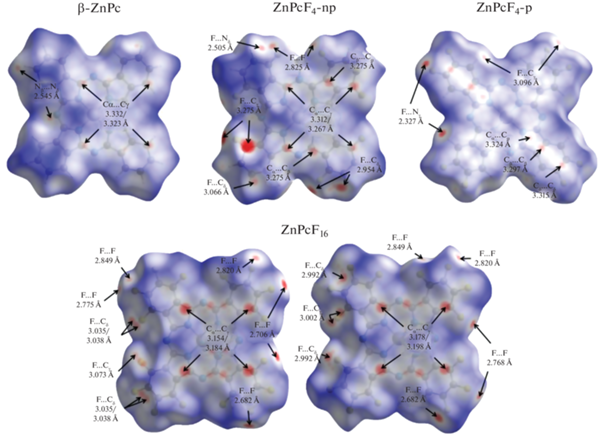
ПХ β-ZnPc показывает, что взаимодействие между соседними в стопке молекулами выражено в двух симметричных парах близких контактов Cα…Cγ с расстоянием между атомами 3.323/3.332 Å. Взаимодействие между молекулами в соседних стопках выражено симметричной парой контактов Nβ…Hδ 2.545 Å. Отсутствие на ПХ β-ZnPc ярко выраженных красных пятен указывает на то, что все близкие контакты являются относительно слабыми, т.е. расстояния между парами атомов, участвующих в близком контакте, не сильно отличаются от суммы их ван-дер-ваальсовых радиусов.
Взаимодействия между соседними молекулами ZnPcF4-np в стопке, как и в случае β-ZnPc, выражаются в виде двух пар 3.312/3.267 Å близких контактов Cα…Cγ, к которым также добавилась пара контактов Cα…Cβ (3.275 Å). По сравнению с β-ZnPc эти близкие контакты более выражены, что объясняется меньшим расстоянием (на 0.075 Å) между молекулами ZnPcF4-np. Вместе с этим внешний вид ПХ ZnPcF4-np показывает, что дополнительные атомы фтора вносят существенный вклад в межмолекулярные взаимодействия между молекулами в соседних стопках. Два наиболее ярких красных пятна соответствуют паре близких контактов F…Cγ (2.793 Å), образованных с двумя молекулами в соседней стопке. Кроме того, по периметру ПХ расположено множество менее выраженных красных пятен, которые соответствуют близким контактам F…F (2.825 Å), F…Hδ (2.505 Å) и F…Cδ (2.954/3.066 Å).
Для ZnPcF4-p взаимодействия между соседними в стопке молекулами выражены в виде трех симметрично расположенных пар близких контактов: Cα…Cα (3.324 Å), Cβ…Cβ (3.297 Å) и Cδ…Cδ (3.315 Å). Близкие контакты между соседними в стопке молекулами более выражены и представлены парой сильных контактов F…Hγ (2.327 Å) и парой контактов F…Сγ (3.096 Å).
Аналогично β-ZnPc и ZnPcF4-np на ПХ обеих молекул ZnPcF16 наблюдаются четыре выраженных красных пятна, соответствующих двум парам близких контактов Cα…Cγ (3.154/3.184 Å для первой молекулы и 3.178/3.198 Å для второй молекулы). Поскольку в ZnPcF16 все 16 атомов водорода замещены атомами фтора, большинство близких контактов между молекулами в соседних стопках являются контактами фтор–фтор, кратчайший из которых равен 2.692 Å. Между молекулами ZnPcF16 есть также близкие контакты F…Сγ (3.073Å для первой молекулы и 3.002 Å для второй молекулы) и F…Сδ (контакты с расстояниями 3.035/3.038 и 2.992 Å для первой и второй молекул соответственно). Следует отметить, что контакты фтор–углерод есть только между стопками молекул одного типа, в то время как контакты между стопками разного типа ограничены только контактами фтор–фтор.
Кроме параметра dnorm для ПХ существует другой полезный тип раскраски, так называемый shape index S, который рассчитывается по формуле:
Раскрашивание ПХ с использованием параметра shape index позволяет выявить слабые π–π-взаимодействия, которые проявляются на ПХ в виде пары из синего и красного треугольников, расположенных в форме “песочных часов” [37]. Поскольку молекула фталоцианина представляет собой ароматический макроцикл, такой тип раскраски является особенно полезным при анализе межмолекулярных взаимодействий. На рис. 5 показаны ПХ, раскрашенные в соответствии с параметром shape index, при этом поверх каждой ПХ нарисована следующая в стопке молекула.
Для β-ZnPc и ZnPcF4-np межмолекулярные π–π-взаимодействия ограничиваются парой слабых контактов между пиррольными фрагментами молекул. Угол между плоскостями пиррольных фрагментов равен 3.59° для β-ZnPc и 2.41° для ZnPcF4-np, расстояние – 3.286 и 3.232 Å, сдвиг – 0.945 и 1.066 Å соответственно. В структуре ZnPcF16 наблюдается несколько большее перекрытие между плоскостями соседствующих друг с другом в стопке молекул. Из-за этого вместо пар пиррол–пиррол в ZnPcF16 π–π-взаимодействия происходят между пиррольными фрагментами и фрагментами центрального макроцикла. Значения угол/расстояние/сдвиг для первой молекулы ZnPcF16 равны 1.14°/3.187 Å/ 1.402 Å и 0.44°/3.203 Å/1.403 Å, для второй – 0.39°/3.211 Å/1.414 Å и 1.60°/3.188 Å/1.384 Å. Наконец, в ZnPcF4-p благодаря вдвое меньшему углу упаковки по сравнению с рассмотренными выше соединениями происходит полное перекрытие плоскостей соседних молекул в стопках. Из-за этого π–π-взаимодействие происходит на уровне молекула–молекула, где каждый фрагмент одной молекулы вступает в π–π-контакт с соответствующими фрагментами двух соседних молекул в стопке. Угол между плоскостями для всех индивидуальных фрагментов молекулы ZnPcF4-p равен 0°, значения расстояние/сдвиг равны 3.293/ 1.652 Å и 3.426/1.355 Å для бензольных фрагментов, 3.403/1.413 Å и 3.278/1.682 Å для пиррольных фрагментов, 3.257/1.723 Å и 3.254/1.728 Å для фрагментов центрального макроцикла. Усредненные значения для всей молекулы – 3.328/ 1.581 Å.
Таким образом, анализ поверхностей Хиршвельда показал, что ZnPc, ZnPcF4-np и ZnPcF16 обладают схожим характером взаимодействия между соседними молекулами в стопке. Вместе с этим в структурах ZnPcF4-p и ZnPcF4-np присутствуют выраженные близкие контакты между молекулами в соседних стопках, вызванные наличием разупорядоченных атомов фтора, поскольку ZnPcF4 представляет собой смесь четырех региоизомеров из-за различного возможного положения фтор-заместителей. Наличие таких близких контактов понижает общую энергию кристаллической решетки, что может способствовать более высокой летучести данных соединений по сравнению с ZnPc и ZnPcF16.
Помимо анализа межмолекулярных взаимодействий CrystalExplorer также позволяет оценить значение энергии кристаллической решетки, которое тесно связано с энтальпией сублимации. В табл. 2 приведены полученные значения энергии кристаллической решетки. В отличие от ПХ, которая может быть сгенерирована для молекулы с разупорядоченными фрагментами и будет в данном случае показывать потенциальные межмолекулярные контакты, расчет энергии решетки для такой молекулы не будет иметь физического смысла. Поэтому для соединений ZnPcF4-p и ZnPcF4-np, кристаллическая структура которых содержит разупорядоченные атомы фтора, мы вручную разрешили разупорядочение и в результате получили четыре варианта расположения атомов фтора в кристаллической структуре каждого из них. Затем для каждого их этих вариантов был проведен расчет энергии решетки. Хотя такой подход не отражает реального хаотического распределения F-заместителей у молекул в кристалле, он позволяет оценить минимальное и максимальное значения энергии решетки, при этом разница между этими значениями косвенно указывает на то, насколько сильное влияние оказывает взаимное расположение атомов фтора на межмолекулярные взаимодействия в кристалле. Несмотря на то, что расчетные значения энергии решетки несколько выше, чем значения энтальпии сублимации, полученные из экспериментальных измерений, тем не менее они увеличиваются в том же ряду, что и энтальпия сублимации: ZnPcF4-p < ZnPcF4-np < < ZnPc < ZnPcF16.
ЗАКЛЮЧЕНИЕ
Температурная зависимость давления насыщенного пара фталоцианинов цинка с фтор-заместителями в периферийном (ZnPcF4-p) и непериферийном (ZnPcF4-np) положении фталоцианинового кольца была изучена методом Кнудсена с масс-спектрометрической регистрацией состава газовой фазы и рассчитаны термодинамические параметры парообразования. Было показано, что ZnPcF4-p и ZnPcF4-np обладают более высоким давлением пара по сравнению с ZnPc и ZnPcF16. При этом энтальпия сублимации увеличивается в ряду ZnPcF4-p < ZnPcF4-np < ZnPc < < ZnPcF16. Если сравнивать фторзамещенные фталоцианины цинка с различным положением заместителей в макрокольце, то ZnPcF4-p обладает большей летучестью, чем ZnPcF4-np, а его энтальпия сублимации на 1 ккал/моль ниже.
Проведено сравнение полученных данных с точки зрения анализа межмолекулярных взаимодействий в кристаллах данных соединений. Анализ поверхностей Хиршфельда показал, что ZnPc, ZnPcF4-np и ZnPcF16 обладают схожим характером взаимодействия между соседними молекулами в стопке. Вместе с этим в структурах ZnPcF4-p и ZnPcF4-np присутствуют выраженные близкие контакты между молекулами в соседних стопках, вызванные наличием разупорядоченных атомов фтора. Наличие таких близких контактов понижает общую энергию кристаллической решетки, что положительно сказывается на летучести данных соединений. Рассчитанные значения энергии кристаллической решетки для фталоцианинов цинка увеличиваются в том же ряду, что и энтальпия их сублимации.
Список литературы
Wang H., Wu Q., Cheng L. et al. // Energy Storage Mater. 2022. V. 52. P. 495.https://doi.org/10.1016/J.ENSM.2022.08.022
Kumar A., Kumar Vashistha V., Kumar Das D. // Coord. Chem. Rev. 2021. V. 431. P. 213678. https://doi.org/10.1016/J.CCR.2020.213678
Nyokong T. // Coord. Chem. Rev. 2007. V. 251. № 13–14 Spec. Iss. P. 1707. https://doi.org/10.1016/j.ccr.2006.11.011
Gorbunova Y.G., Martynov A.G., Birin K.P. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 202. https://doi.org/10.1134/S0036023621020091
Jiang H., Hu P., Ye J. et al. // Adv. Mater. 2017. V. 29. № 10. P. 1605053. https://doi.org/10.1002/adma.201605053
Brinkmann H., Kelting C., Makarov S. et al. // Phys. Status Solidi: Appl. Mater. Sci. 2008. V. 205. № 3. P. 409. https://doi.org/10.1002/pssa.200723391
Gupta H., Mahajan A., Bedi R.K. // Indian J. Pure Appl. Phys. 2008. V. 46. № 6. P. 435.
Raveendra Kiran M., Ulla H., Satyanarayan M.N. et al. // Opt. Mater. (Amst). 2019. V. 96. P. 109348. https://doi.org/10.1016/j.optmat.2019.109348
Ilgün C., Sevim A.M., Çakar S. et al. // Sol. Energy. 2021. V. 218. P. 169. https://doi.org/10.1016/J.SOLENER.2021.02.042
Acikbas Y., Erdogan M., Capan R. et al. // Optik (Stuttg). 2021. V. 245. P. 167661. https://doi.org/10.1016/j.ijleo.2021.167661
Bengasi G., Meunier-Prest R., Baba K. et al. // Adv. Electron. Mater. 2020. V. 6. № 12. P. 1. https://doi.org/10.1002/aelm.202000812
Klyamer D., Bonegardt D., Krasnov P. et al. // Thin Solid Films. 2022. V. 754. P. 139301. https://doi.org/10.1016/J.TSF.2022.139301
Curry J., W. Shaw Jr. R. // J. Phys. Chem. 1965. V. 69. № 1. P. 344. https://doi.org/10.1021/j100885a505
Bonderman P.D., Cater D.E., Bennett E.W. // J. Chem. Eng. Data. 2002. V. 15. № 3. P. 396. https://doi.org/10.1021/je60046a004
Yase K., Takahashi Y., NorihikoArakato et al. // Jpn. J. Appl. Phys. 1995. V. 34. P. 636. https://doi.org/10.1143/JJAP.34.636
Шаулов Ю.Х., Лопаткина И.Л., Кирюхин И.А. et al. // Журн. физ. химии. 1975. Т. 49. № 1. С. 252.
Шаулов Ю.Х., Приселков Ю.А., Лопаткина И.Л., Маркова И.Я. // Журн. физ. химии. 1972. Т. 46. № 4. С. 857.
Semyannikov P.P., Basova T.V., Grankin V.M. et al. // J. Porphyr. Phthalocyanines. 2000. V. 4. № 3. P. 271. https://doi.org/10.1002/(SICI)1099-1409(200004/0-5)4:3<271::AID-JPP205>3.3.CO;2-W
Plyashkevich V., Basova T., Semyannikov P. et al. // Thermochim. Acta. 2010. V. 501. № 1–2. P. 108. https://doi.org/10.1016/J.TCA.2010.01.019
Kol’tsov E., Basova T., Semyannikov P. et al. // Mater. Chem. Phys. 2004. V. 86. № 1. P. 222. https://doi.org/10.1016/j.matchemphys.2004.03.007
Semyannikov P., Basova T., Trubin S. et al. // J. Porphyr. Phthalocyanines. 2006. V. 10. № 8. P. 1034. https://doi.org/10.1142/S1088424606000387
Basova T., Semyannikov P., Plyashkevich V. et al. // Crit. Rev. Solid State Mater. Sci. 2009. V. 34. № 3–4. P. 180. https://doi.org/10.1080/10408430903245377
Семянников П.П., Басова Т.В., Трубин С.В. и др. // Журн. физ. химии. 2008. Т. 82. № 2. С. 221.
Басова Т.В., Семянников П.П., Игуменов И.К. // Давление насыщенного пара фталоцианинов. СПб., 2007. С. 136.
Klyamer D.D., Sukhikh A.S., Trubin S.V. et al. // Cryst. Growth & Des. 2020. V. 20. № 2. P. 1016. https://doi.org/10.1021/acs.cgd.9b01350
Erdoǧmus A., Nyokong T. // J. Mol. Struct. 2010. V. 977. № 1–3. P. 26. https://doi.org/10.1016/J.MOLSTRUC.2010.04.048
Гранкин В.М., Семянников П.П. // Приборы и техника эксперимента 1991. Т. 4. С. 129.
Lopatin S.I., Shugurov S.M., Tyurnina Z.G. et al. // Glas. Phys. Chem. 2021. V. 47. № 1. P. 38. https://doi.org/10.1134/S1087659621010077
Spackman P.R., Turner M.J., McKinnon J.J. et al. // J. Appl. Crystallogr. 2021. V. 54. P. 1006. https://doi.org/10.1107/S1600576721002910
Mackenzie C.F., Spackman P.R., Jayatilaka D. et al. // IUCrJ. 2017. V. 4. P. 575. https://doi.org/10.1107/S205225251700848X
Scheidt W.R., Dow W. // J. Am. Chem. Soc. 1977. V. 99. № 4. P. 1101. https://doi.org/10.1021/ja00446a021
Bonegardt D., Klyamer D., Sukhikh A. et al. // 2021. V. 9. № 6. P. 137. https://doi.org/10.3390/chemosensors9060137
Klyamer D.D., Sukhikh A.S., Gromilov S.A. et al. // Macroheterocycles. 2018. V. 11. № 3. P. 304. https://doi.org/10.6060/mhc180794b
Jiang H., Ye J., Hu P. et al. // Sci. Rep. 2014. V. 4. P. 1. https://doi.org/10.1038/srep07573
Erk P. // CCDC 112723: Experimental Crystal Structure Determination. 2004. https://doi.org/10.5517/cc3s97d
Ballirano P., Caminiti R., Ercolani C. et al. // J. Am. Chem. Soc. 1998. V. 120. № 49. P. 12798. https://doi.org/10.1021/ja973815p
Pugachev A.D., Tkachev V.V., Aldoshin S.M. et al. // Russ. J. Gen. Chem. 2021. V. 91. № 7. P. 1297. https://doi.org/10.1134/S1070363221070069
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии




