Журнал неорганической химии, 2023, T. 68, № 2, стр. 167-173
Термодинамическое исследование летучего комплекса бензоилтрифторацетоната магния с N,N,N',N'-тетраметилэтилендиамином
Е. С. Викулова a, *, С. В. Сысоев a, А. В. Сартакова a, b, Э. А. Рихтер a, b, В. А. Рогов b, c, А. А. Назарова a, Л. Н. Зеленина a, Н. Б. Морозова a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Лаврентьева, 3, Россия
b Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 1, Россия
c Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, пр-т Лаврентьева, 5, Россия
* E-mail: lazorevka@mail.ru
Поступила в редакцию 26.08.2022
После доработки 13.09.2022
Принята к публикации 16.09.2022
- EDN: LQQWNY
- DOI: 10.31857/S0044457X22601560
Аннотация
Для расширения библиотеки летучих прекурсоров магния, аттестованных для эффективного применения в химических газофазных процессах осаждения соответствующих оксидных или фторидных слоев, проведено термодинамическое исследование разнолигандного комплекса Mg(tmeda)(btfac)2 (tmeda = N,N,N',N'-тетраметилэтилендиамин, btfac = бензоилтрифторацетонат). Процесс плавления изучен с помощью ДСК (Тпл = 459.4 ± 0.3 K, ${{\Delta }_{{{\text{пл}}}}}H_{{459.4}}^{^\circ }$ = 42.9 ± 0.4 кДж/моль), процесс сублимации – с помощью метода потока (переноса) в интервале температур 407–447 K (${{\Delta }_{{{\text{субл}}}}}H_{{427}}^{^\circ }$ = 163 ± ± 6 кДж/моль, ΔсублS427 = 293 ± 14 Дж/(моль K)). Вещество переходит в газовую фазу с частичным разложением. Проведено термодинамическое моделирование состава конденсированных фаз, образующихся из Mg(tmeda)(btfac)2 с добавлением H2 или O2, в зависимости от температуры (700–1300 K), общего давления (133–13332 Па) и отношения газа-реагента к прекурсору (0–300). Полученные данные могут быть использованы для определения экспериментальных параметров процессов получения функциональных слоев. Сравнение результатов с аналогичным трифторацетилацетонатным комплексом позволило количественно выявить эффект замены метильной группы в анионном лиганде на фенильную.
ВВЕДЕНИЕ
Летучие комплексы металлов востребованы в качестве прекурсоров для получения функциональных неорганических материалов методами химического газофазного (MOCVD) и атомно-слоевого (ALD) осаждения. Поэтому детальное термодинамическое исследование таких соединений важно не только в аспекте накопления фундаментальных данных, но и для эффективного практического использования в процессах MOCVD и ALD.
В частности, данные по температурным зависимостям давления насыщенного пара (тензиметрия) при организации квазиравновесных условий массопереноса позволяют определять количество прекурсора, поступающего в реакционную зону [1]. Это особенно важно для реакторов, конструкции которых не предусматривают возможности гравиметрического контроля испаренного вещества. Результаты дифференциальной сканирующей калориметрии (ДСК) необходимы для определения интервала возможных температур испарителя, поскольку четко показывают начало разложения соединения в конденсированной фазе. Установленные методом ДСК температуры плавления и твердофазных переходов определяют границы областей измерений для тензиметрических экспериментов. Термодинамические характеристики плавления позволяют оценить параметры сублимации/испарения, если только один из этих процессов исследован экспериментально [1]. Это относится и к процессам сублимации разных полиморфных модификаций соединения.
Термодинамические параметры обсуждаемых фазовых превращений собраны в работе [2] для широкого ряда соединений, включая летучие комплексы металлов. Для магния термодинамические исследования фокусировались на прекурсорах, не содержащих фтор. Определены параметры сублимации и/или испарения для двух металлоорганических соединений магния (динеопентила [2] и бис-циклопентадиенила [2–4]), двух хинолинатных [2, 5, 6] и трех β-иминокетонатных [7] комплексов, бис-(дипивалоилметаната) магния [2, 8] и четырех разнолигандных комплексов на его основе с N-донорными хелатирующими молекулами [2, 8–10]. Среди фторированных летучих соединений магния, включающих гомо- и гетеролептические β-дикетонатные комплексы с диаминными [9, 11, 12] и аминоалкоголятными [13] лигандами соответственно, количественные данные получены только для Mg(tmeda)(tfac)2, где tmeda = N,N,N',N'-тетраметилэтилендиамин, tfac = трифторацетонат (рис. 1) [14].
Рис. 1.
Разнолигандные β-дикетонатные комплексы магния (Ph – фенильная группа (C6H5), Me – метильная группа (CH3), tBu – трет-бутильная группа (C(CH3)3)).

Вместе с тем фторированные прекурсоры магния представляют особый интерес для получения пленок MgF2. Их можно использовать без дополнительного сореагента (концепция single-source MOCVD [15, 16]) или для перехода к более удобным реагентам в традиционных процессах ALD (например, кислород или пары воды по сравнению с HF [17–20]).
В настоящей работе проведено термодинамическое исследование недавно синтезированного летучего фторированного комплекса Mg(tmeda)(btfac)2, где btfac = бензоилтрифторацетонат (рис. 1) [12]. Методами ДСК и потока изучены процессы плавления и сублимации соответственно. Экспериментальные данные дополнены термодинамическим моделированием равновесного состава конденсированных фаз, образующихся при различных температурах, давлениях и стехиометрии реакционной смеси (прекурсор/газ-реагент). Хотя обсуждаемые газофазные процессы осаждения не являются равновесными, выявляемые таким образом тренды полезны для определения условий формирования целевой фазы в реакторах MOCVD [21–23] или ALD [24], в данном случае MgF2 или MgO.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез Mg(tmeda)(btfac)2 осуществляли по методике [12] взаимодействием соответствующего диаква-β-дикетоната магния с диамином. Продукт очищали двукратной вакуумной сублимацией (423 K/1.33 Па). Результаты элементного анализа и ЯМР-спектроскопии подтверждают чистоту полученного образца (≥99.5%).
Элементный анализ (Химический исследовательский ЦКП СО РАН) проводили согласно [24], стандартные погрешности составляют ≤0.5 мас. %:
ЯМР 1H: 500.129 МГц, ЯМР 13C: 125.757 МГц. ЯМР 1H (CDCl3, 7.26 ppm): 7.88 (d, JH,H = 7.3 Гц, 4H, o-HPh, btfac), 7.46 (t, JH,H = 7.3 Гц, 2H, p-HPh, btfac), 7.39 (t, JH,H = 7.3 Гц, 4H, m-HPh, btfac), 6.35 (s, 2H, CH, btfac), 2.62 (s, 4H, CH2, tmeda), 2.36 (s, 12H, CH3, tmeda). ЯМР 13C (CDCl3, 77.16 ppm): 181.81 (s, C=O, btfac), 172.79 (q, JC,F = 31.2 Гц, C=O, btfac), 119.35 (q, JC,F = 285.7, CF3, btfac), 139.20 (s, Ci(Ph), btfac), 131.84 (s, Cp(Ph), btfac), 128.43, 127.69 (s + s, Co/m(Ph), btfac), 90.96 (s, CH, btfac), 56.51 (s, CH2, tmeda), 46.57 (s, CH3, tmeda).
Рентгенофазовый анализ (дифрактометр Shimadzu XRD-7000, CuKα-излучение, Ni-фильтр, линейный детектор One Sight, диапазон 2θ = 5°–40°, 0.0143 град/с) подтверждает фазовую чистоту образца. Экспериментальная порошкограмма (рис. 2) соответствует рассчитанной по монокристальным данным [12].
Дифференциальную сканирующую калориметрию проводили на калориметре Setaram Sensys DSC TG при скорости нагрева 1.0 K/мин. Стандартные погрешности измерения температуры плавления и теплового эффекта составили <0.5 K и 1.0% соответственно (калибровка по металлическому In). Исследуемые образцы (14.8–17.0 мг) были помещены в вакуумированные стеклянные ампулы.
Температурную зависимость давления насыщенного пара над кристаллическим Mg(tmeda)(btfac)2 измеряли методом потока (переноса) на оригинальной установке [9, 14], в качестве газа-носителя использовали гелий. Квазиравновесные условия были доказаны неизменностью получаемых величин давления от скорости его потока (0.5–2.0 л/ч). Количество вещества, перешедшего в газовую фазу при определенной температуре (в испарителе, Tэксп) и сконденсированного в зоне охлаждения (в приемнике, Tкомн), было определено гравиметрически (Δm). Расчет величин парциального давления пара Mg(tmeda)(btfac)2 проводили с использованием общего давления в реакторе (pобщ):
где NHe – количество газа-носителя He (моль), n – количество сублимированного/сконденсированного Mg(tmeda)(btfac)2 (моль). Последнее определяли в предположении мономерного состава паровой фазы (n = Δm/M, M = 570.81 г/моль). Следует отметить, что для родственных комплексов, обсуждаемых в работе (рис. 1), мономерность паров подтверждена масс-спектрометрически [14, 26]. При точности измерения температуры, расхода гелия и массы вещества, равной 0.5 K, 2% и 5 × × 10–4 г соответственно стандартная погрешность определения давления не превышала 5%. Первичные экспериментальные данные (конденсат) приведены в табл. 1. При статистической обработке использованы такие же целевые функции, как и в работах, посвященных изучению родственных комплексов [9, 14].Таблица 1.
Экспериментальные и расчетные данные, полученные для Mg(tmeda)(btfac)2 методом потока
| Т, K | Масса конденсата, мг | Скорость потока He, л/ч | Время эксперимента, ч | pэксп* | pрасч** |
|---|---|---|---|---|---|
| Па | |||||
| 407.65 | 8.4 | 2.015 | 72.0 | 0.22 | 0.25 |
| 413.15 | 14.5 | 2.015 | 72.0 | 0.39 | 0.47 |
| 423.15 | 1.7 | 2.015 | 2.0 | 1.63 | 1.43 |
| 423.15 | 17.9 | 2.015 | 20.0 | 1.72 | 1.43 |
| 433.15 | 5.2 | 2.015 | 2.0 | 4.99 | 4.17 |
| 433.15 | 17.0 | 0.923 | 18.0 | 3.96 | 4.17 |
| 440.15 | 14.7 | 2.015 | 3.0 | 9.40 | 8.58 |
| 445.15 | 14.2 | 2.015 | 2.1 | 13.0 | 14.2 |
| 447.15 | 6.9 | 0.923 | 2.0 | 14.4 | 17.2 |
Термодинамическое моделирование проводили согласно подходам, разработанным в Институте неорганической химии СО РАН [27], когда задача расчета равновесия сводилась к минимизации ΔG системы при определенных соотношениях потоков элементов, заданных составом вещества и реакционной атмосферы, с условием постоянства состава конденсированных фаз и соответствия газовых смесей закону Дальтона. В расчетах учитывали кристаллические фазы Mg, C, MgF2, MgO, Mg(OH)2, MgCO3, Mg3N2 и 92 молекулярные формы газовой фазы. Использовали стандартные термодинамические характеристики индивидуальных веществ (ΔобрH°(298 K), S°(298 K), $C_{p}^{0} = f(T)$ [28]), базу данных и прикладную программу расчета равновесий банка данных по свойствам материалов электронной техники [29, 30]. Доступ к базе данных и расчетной программе возможен через авторов настоящей работы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Mg(tmeda)(btfac)2 формируется как однофазный продукт (рис. 2) независимо от условий очистки (сублимация/перекристаллизация), хотя для родственного трифторацетилацетонатного комплекса (рис. 1) характерно образование полиморфных модификаций [31]. Вероятно, это связано с детерминированностью мотива кристаллической упаковки вследствие наличия ароматических фенильных групп [12]. В связи с этим никаких твердофазных превращений не наблюдалось на кривых ДСК до температуры плавления.
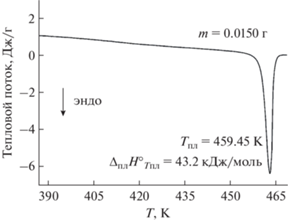
Типичный пик плавления Mg(tmeda)(btfac)2 приведен на рис. 3. Данные по температуре и тепловому эффекту повторного нагрева навески m = = 0.0150 г после недельной выдержки совпадают в пределах указанной точности метода. В результате статистической обработки получены следующие параметры: Тпл = 459.4 ± 0.3 K, ${{\Delta }_{{{\text{пл}}}}}H_{{{{Т}_{{{\text{пл}}}}}}}^{^\circ }$ = 42.9 ± ± 0.4 кДж/моль, ${{\Delta }_{{{\text{пл}}}}}{{S}_{{{{Т}_{{{\text{пл}}}}}}}}$ = 93.4 ± 0.5 кДж/моль. Таким образом, в разнолигандных комплексах Mg(tmeda)(L)2 замена метильной группы (L = tfac [9]) на фенильную (L = btfac) приводит к существенному увеличению температуры плавления (~94 K) и соответствующих термодинамических величин. Это согласуется с высокой энергией кристаллической решетки, ранее рассчитанной для изучаемого комплекса [12]. Вместе с тем фторированный комплекс Mg(tmeda)(btfac)2 является более низкоплавким (разница ~30 K) по сравнению с родственным дипивалоилметанатным комплексом, не содержащим фтор (рис. 1).
Тензиметрическое исследование процесса сублимации проведено в интервале температур 407–447 K. Во всем диапазоне парообразование Mg(tmeda)(btfac)2 сопровождается частичным разложением, на что указывает превышение потери массы источника по сравнению с привесом приемника (разница ~30%, рис. 3). Данные элементного и рентгенофазового анализа образцов из приемника подтверждают чистоту получаемого конденсата. Таким образом, обработка данных по конденсированному веществу представляет наиболее корректные уравнение температурной зависимости и величины соответствующих термодинамических функций: ln(p/p°) ± t σ = 35.2 – – 19 620/T (давление в атмосферах, σ2 = 545 000/T2 – – 2540/T + 2.96), ${{\Delta }_{{{\text{субл}}}}}H_{{427}}^{^\circ }$ = 163 ± 6 кДж/моль, ΔсублS427 = 293 ± 14 Дж/(моль K). Получаемые из этого уравнения величины давления пара в пределах указанной точности метода совпадают с рассчитанными из первичных экспериментальных данных (табл. 1).
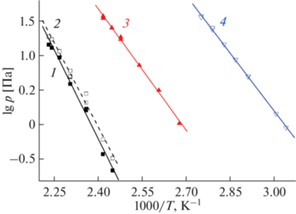
Сравнение величин давления пара для исследуемого соединения и родственных комплексов Mg(tmeda)(L)2 представлено на рис. 4. Можно оценить, что замена метильной группы (L = tfac [14]) на фенильную (L = btfac) приводит к понижению давления пара примерно на три порядка. Более того, введение ароматического заместителя в β-дикетонатный лиганд делает фторированный комплекс магния менее летучим по сравнению с нефторированным аналогом (L = thd [9], разница в величинах давления пара примерно два порядка). Таким образом, новый прекурсор Mg(tmeda)(btfac)2 расширяет “диапазон летучести” соединений магния, что особенно востребовано при подборе комбинаций прекурсоров разных металлов для процессов соосаждения многокомпонентных систем.
Рис. 4.
Температурные зависимости давления насыщенного пара над кристаллическими комплексами магния: Mg(tmeda)(btfac)2 (1 – давление рассчитано из массы вещества, осажденного в приемнике (конденсат), 2 – давление рассчитано из массы вещества, сублимированного в источнике), Mg(tmeda)(thd)2 (3) [9] и Mg(tmeda)(tfac)2 (4) [14].
Спецификой фторированных летучих прекурсоров ряда металлов, включая щелочноземельные, является возможность получения соответствующих оксидных, фторидных или смешанных фаз в зависимости от условий осаждения [14, 32–35]. Применение инструментов термодинамического моделирования позволяет перейти от полномерного эмпирического поиска параметров формирования целевой фазы к адаптации выявленных трендов в изменении фазового состава образующихся материалов от температуры, давления, реакционной атмосферы и соотношения входных газовых потоков. Такой подход использован нами в работе [14] для определения условий осаждения MgO из фторированных прекурсоров обсуждаемого класса. Было показано, что введение паров воды приводит к увеличению области температур формирования оксидной фазы [14], и рассчитанные температуры согласуются с использованными в экспериментах MOCVD по получению пленок MgO [11]. В настоящей работе мы сфокусировались на условиях получения MgF2, поэтому в качестве газов-реагентов рассматривали кислород и водород. Общее давление задавали в интервале 133–1333 Па, характерном для реакторов MOCVD и ALD, а температуру процесса и соотношение молей газа-реагента к прекурсору варьировали в широком интервале.
Согласно расчетам, при термическом разложении Mg(tmeda)(btfac)2 без добавления газа-реагента и в присутствии водорода практически во всем интервале температур прогнозируется образование MgF2 c примесью графита, кроме низкотемпературной области, где возможно осаждение чистого MgF2 (рис. 5а). При этом увеличение количества водорода приводит к росту области образования чистой фазы. Так, в интервале n(H2)/n(Mg(tmeda)(btfac)2) = 50–300 температурная граница MgF2/(MgF2 + C) возрастает от 505 до 702 K (p = 1333 Па). Уменьшение общего давления в системе приводит к заметному понижению температурных границ образования смешанной фазы. Например, понижение давления до 133 Па сопровождается снижением температурной границы MgF2/(MgF2 + C) на 70 K при n(H2)/n(Mg(tmeda)(btfac)2) = 70 и на 100 K при n(H2)/n(Mg(tmeda)(btfac)2) = 300. В то время как повышение общего давления значительно расширяет зону образования чистого MgF2. Так, увеличение давления на порядок (от 1333 до 13 332 Па) приводит к повышению температурной границы появления углерода на 70–120 K без изменения ее профиля.
Рис. 5.
Равновесные CVD-диаграммы систем Mg(tmeda)(btfac)2 + H2 (а) и Mg(tmeda)(btfac)2 + O2 (б), показывающие температуры фазовых границ MgF2 + C/MgF2, MgF2/MgO + MgF2 и MgO + MgF2/MgO при общем давлении 133 Па (пунктирные кривые), 1333 Па (сплошные кривые), и 13332 Па (штрихпунктирная кривая) в зависимости от стехиометрии реакционной смеси.
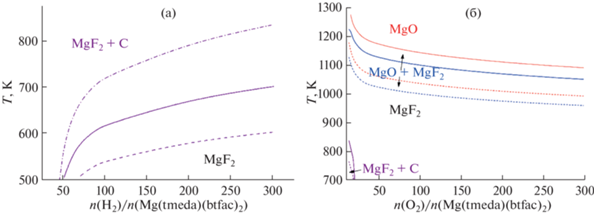
В присутствии кислорода (рис. 5б) при том же (p = 1333 Па) давлении температурные границы образования примеси графита выше, а требуемое отношение газа реагента и прекурсора меньше: фазы MgF2 и C сосуществуют при n(O2)/n(Mg(tmeda)(btfac)2) ≤20 и температурах <850 K. При увеличении температуры процесса и количества кислорода прогнозируется формирование чистой фазы MgF2. Вместе с тем при высоких температурах ожидается появление оксидной фазы: вначале наблюдается узкая область одновременного образования MgF2 + MgO, а затем чистого MgO (рис. 5б). Температурные границы этих областей понижаются при увеличении количества кислорода. Наиболее выраженное изменение наблюдается в диапазоне n(O2)/n(Mg(tmeda)(btfac)2) ≤ 50, фазовые границы MgF2/MgO + MgF2 и MgO + MgF2/MgO понижаются до 1130 и 1182 K соответственно, т.е. разница составляет ~100 K. В интервале соотношений реагентов от 50 до 300 изменение уже не превышает 80 K. В этом диапазоне ширина зоны сосуществования фаз MgO + MgF2 меняется незначительно – температурный интервал между фазовыми границами MgF2/MgO + MgF2 и MgO + MgF2/MgO уменьшается от 47 до 40 K.
Уменьшение общего давления в системе (рис. 5) приводит к заметному понижению температурных границ образования оксидной фазы и уменьшению зоны MgO + MgF2. Например, десятикратное снижение давления (до 133 Па) отражается в снижении фазовых границ MgF2/MgO + + MgF2 и MgO + MgF2/MgO примерно на 100 K и уменьшении интервала между ними на 7 K (15–20% от ширины зоны при 1333 Па). Температурная граница углеродсодержащей зоны (MgF2 + C) также опускается с уменьшением давления.
Сравнивая результаты моделирования систем Mg(tmeda)(L)2 + O2 для родственных фторированных прекурсоров (L = tfac [14], btfac), необходимо отметить, что общий вид кривых температуры фазовых границ в зависимости от стехиометрии реакционной смеси (CVD-диаграмма, рис. 5б) сохраняется. Однако большее содержание углерода в лиганде btfac ожидаемо увеличивает область формирования графита (фазы MgF2 + C): температура <850 K, соотношение реагентов <20 для Mg(tmeda)(btfac)2 и температура <805 K, соотношение реагентов <15 для Mg(tmeda)(tfac)2 [14]. При соотношениях n(O2)/n(Mg(tmeda)(L)2) < 25 температурные границы образования оксидной фазы выше для L = tfac. При большем количестве кислорода картина инвертируется (L = btfac > tfac), но разница между границами невелика (~10 K).
ЗАКЛЮЧЕНИЕ
Методами ДСК и тензиметрии (потока) проведено термодинамическое исследование летучего комплекса Mg(tmeda)(btfac)2 как возможного прекурсора для химического газофазного и атомно-слоевого осаждения. Определено уравнение p(T) зависимости давления насыщенного пара (407–447 K) и термодинамические параметры процессов плавления и сублимации. Установлено, что для фторированных комплексов Mg(tmeda)(L)2 замена метильной группы в β-дикетонатном лиганде L = CF3COCHCOR на фенильную приводит к повышению температуры плавления (~94 K) и понижению давления пара (~3 порядка).
Анализ результатов термодинамического моделирования позволяет рекомендовать для получения наиболее чистых слоев MgF2 из Mg(tmeda)(btfac)2 в присутствии H2 использование больших концентраций газа-реагента (соотношение водород/прекурсор >50). Сравнительно высокое общее давление в системе позволяет использовать более низкие температуры осаждения: например, при 13332 Па фаза графита появляется при 835 K, при 1333 Па – при 700 K. В присутствии O2 целесообразно проводить процесс при соотношении газ-реагент/прекурсор >20. Увеличение общего давления в реакторе расширяет диапазон формирования чистой фазы MgF2. С другой стороны, введение кислорода дает возможность получения MgO, для чего благоприятны наиболее низкие давления и высокие температуры (например, T >1100 K при 133 Па). В определенных условиях можно получать смешанные оксидно-фторидные системы.
Список литературы
Zherikova K.V., Verevkin S.P. // RSC Adv. 2020. V. 10. № 63. P. 38158.
Acree Jr.W., Chickos J.S. // J. Phys. Chem. Ref. Data. 2017. V. 46. № 1. P. 013104. https://doi.org/10.1063/1.4970519
Hull H.S., Reid A.F., Turnbull A.G. // Aust. J. Chem. 1965. V. 18. № 2. P. 249. https://doi.org/10.1071/CH9650249
Hayashi D., Teraoka A., Sakaguchi Y. et al. // J. Cryst. Growth. 2016. V. 453. P. 54. https://doi.org/10.1016/j.jcrysgro.2016.08.002
Ribeiro da Silva M.A.V., Matos M.A.R., Goncalves J.M. et al. // Thermochim. Acta. 1994. V. 247. P. 245. https://doi.org/10.1016/0040-6031(94)80125-8
Ribeiro da Silva M.A.V., Matos M.A.R., Goncalves J.M. et al. // J. Chem. Thermodyn. 1998. V. 30. P. 299. https://doi.org/10.1006/jcht.1997.0299
Pousaneh E., Rüffer T., Assim K. et al. // RSC Adv. 2018. V. 8. № 35. P. 19668. https://doi.org/10.1039/c8ra01851k
Maria M., Selvakumar J., Raghunathan V.S. et al. // Surf. Coat. Technol. 2009. V. 204. № 1–2. P. 222. https://doi.org/10.1016/j.surfcoat.2009.07.022
Vikulova E.S., Zherikova K.V., Korolkov I.V. et al. // J. Therm. Anal. Calorim. 2014. V. 118. № 2. P. 849. https://doi.org/10.1007/s10973-014-3997-7
Zherikova K.V., Vikulova E.S., Makarenko A.M. et al. // Thermochim. Acta. 2020. V. 689. P. 178643. https://doi.org/10.1016/j.tca.2020.178643
Wang L., Yang Y., Ni J. et al. // Chem. Mater. 2005. V. 17. № 23. P. 5697. https://doi.org/10.1021/cm0512528
Викулова Е.С., Сухих А.С., Михайлова М.А. и др. // Журн. структур. химии. 2022. Т. 63. № 8. С. 97037. https://doi.org/0.26902/JSC_id97037
Kim H.S., George S.M., Park B.K. et al. // Dalton Trans. 2015. V. 44. № 5. P. 2103. https://doi.org/10.1039/c4dt03497j
Vikulova E.S., Zherikova K.V., Sysoev S.V. et al. // J. Therm. Anal. Calorim. 2019. V. 137. P. 923. https://doi.org/10.1007/s10973-018-07991-y
Fragala M.E., Toro R.G., Rossi P. et al. // Chem. Mater. 2009. V. 21. № 10. P. 2062. https://doi.org/10.1021/cm802923w
Fragala M.E., Toro R.G., Privitera S. et al. // Chem. Vapor Deposit. 2011. V. 17. № 4–6. P. 80. https://doi.org/10.1002/cvde.201106849
Hennessy J., Jewell A.D., Greer F. et al. // J. Vac. Sci. Technol. A. 2015. V. 33. № 1. P. 01A125. https://doi.org/10.1116/1.4901808
Lee Y., Sun H., Young M.J. et al. // Chem. Mater. 2016. V. 28. № 7. P. 2022. https://doi.org/10.1021/acs.chemmater.5b04360
Mäntymäki M., Ritala M., Leskelä M. // Coatings. 2018. V. 8. № 8. P. 277. https://doi.org/10.3390/coatings8080277
Lee S.H., Park H., Kim H. et al. // Comput. Mater. Sci. 2021. V. 191. P. 110327. https://doi.org/10.1016/j.commatsci.2021.110327
Merenkov I.S., Gostevskii B.A., Krasnov P.O. et al. // New J. Chem. 2017. V. 41. № 20. P. 11926. https://doi.org/10.1039/C7NJ01651D
Shestakov V.A., Kosyakov V.I., Kosinova M.L. // Russ. Chem. Bull. 2019. V. 68. P. 1983. https://doi.org/10.1007/s11172-019-2656-3
Shestakov V.A., Kosinova M.L. // Russ. Chem. Bull. 2021. V. 70. № 8. P. 1446. https://doi.org/10.1007/s11172-021-3238-8
Drozdov E.O., Dubrovenskii S.D., Malygin A.A. // Russ. J. Gen. Chem. 2020. V. 90. № 5. P. 880. https://doi.org/10.1134/S1070363220050217
Mikhailovskaya T.F., Makarov A.G., Selikhova N.Y. et al. // J. Fluor. Chem. 2016. V. 183. P. 44. https://doi.org/10.1016/j.jfluchem.2016.01.009
Hatanpää T., Kansikas J., Mutikainen I. et al. // Inorg. Chem. 2001. V. 40. № 4. P. 788. https://doi.org/10.1021/ic000310i
Golubenko A.N., Kosinova M.L., Titov V.A. et al. // Thin Solid Films. 1997. V. 293. P. 11. https://doi.org/10.1016/S0040-6090(96)09071-2
Гурвич Л.В., Вейц И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Справочное издание в 4-х т. / M.: Наука, 1978–1982. Т. 1–4.
Кузнецов Ф.А., Воронков М.Г., Борисов В.О. и др. Фундаментальные основы процессов химического осаждения пленок и структур для наноэлектроники. Серия “Интеграционные проекты СО РАН”. Вып. 37 Н.: Изд. СО РАН, 2013. 176 с.
Киселева Н.Н. Компьютерное конструирование неорганических соединений: использование баз данных и методов искусственного интеллекта. М.: Наука, 2005. С. 13.
Vikulova E.S., Zherikova K.V., Piryazev D.A. et al. // J. Struct. Chem. 2017. V. 58. P. 1681. https://doi.org/10.1134/S0022476617080297
Tsymbarenko D.M., Makarevich A.M., Shchukin A.E. et al. // Polyhedron. 2017. V. 134. P. 246. https://doi.org/10.1016/j.poly.2017.05.062
Mishra S., Daniele S. // Chem. Rev. 2015. V. 115. № 16. P. 8379. https://doi.org/10.1021/cr400637c
Pellegrino A.L., Lucchini G., Speghini A. et al. // J. Mater. Res. 2020. V. 35. № 21. P. 2950. https://doi.org/10.1557/jmr.2020.253
Pochekutova T.S., Khamylov V.K., Fukin G.K. et al. // Polyhedron. 2020. V. 177. P. 114263. https://doi.org/10.1016/j.poly.2019.114263
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии