Журнал неорганической химии, 2023, T. 68, № 3, стр. 300-309
Влияние условий образования на физико-химические свойства СsxV2O5 · nH2O
Н. В. Подвальная a, *, Г. С. Захарова a
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: podnat@inbox.ru
Поступила в редакцию 15.08.2022
После доработки 14.10.2022
Принята к публикации 17.10.2022
- EDN: JCUAQO
- DOI: 10.31857/S0044457X22601389
Аннотация
Гидротермальным, гидролитическим и золь-гель методами синтезированы цезийсодержащие соединения на основе гидратированного оксида ванадия(V) общей формулы СsxV2O5· nH2O, где 0.1 ≤ x ≤ 0.6, 0.8 ≤ n ≤ 1.2. Установлено, что область гомогенности по катиону внедрения Cs+, а также содержание четырехвалентного ванадия определяются условиями получения образцов. Основные физико-химические характеристики полученных соединений изучены с помощью ИК-спектроскопии, рентгенофазового и термогравиметрического анализа, сканирующей электронной микроскопии и низкотемпературной адсорбции азота. Наибольшей удельной поверхностью, равной 34.0 и 16.5 м2/г, обладают соединения СsxV2O5· nH2O стержневой морфологии, полученные гидролитическим и гидротермальным методами синтеза соответственно. Температурные зависимости электропроводности СsxV2O5· nH2O позволили оценить энергию активации проводимости соединений, различающихся содержанием четырехвалентного ванадия. Показано, что только в высокотемпературной области энергия активации проводимости зависит от содержания V4+ в образцах, наименьшее значение которой имеет Сs0.6V2O5 · H2O, синтезированный гидротермальным методом.
ВВЕДЕНИЕ
Гидратированный оксид ванадия(V) V2O5 ⋅ ⋅ nH2O привлекает внимание исследователей благодаря уникальной слоистой структуре, позволяющей легко проводить процессы интеркаляции/деинтеркаляции катионов различных металлов, а также молекул органических соединений [1]. Это свойство способствует использованию данных соединений в качестве катодных материалов химических источников тока [2], тонкопленочных материалов термоэлектрических приборов [3], газовых сенсоров для определения триэтиламина С6Н15N и монооксида углерода CO [4]. Высокая интеркаляционная емкость гидратированного оксида ванадия объясняется его химической природой. Он представляет собой поливанадиевую кислоту H2V12O31 ⋅ nH2O, содержащую обменно-активные протоны [5].
На основе V2O5 ⋅ nH2O могут быть получены твердые растворы внедрения общей формулы МxV2O5 ⋅ nH2O с широкой областью гомогенности по внедряемому катиону [6]. Известно, что для соединений МxV2O5 ⋅ nH2O (М = Li, Na, K, Rb, Cs) величина межслоевого расстояния пропорциональна размеру гидратированного катиона и увеличивается в ряду от Cs+ к Li+, оказывая влияние на физико-химические свойства соединения. В литературе имеется большое количество публикаций, посвященных МxV2O5 ⋅ nH2O (М = Li, Na, K) [2, 3, 6–8], при этом сведения по CsxV2O5 ⋅ nH2O весьма малочисленны. Соединения на основе гидратированного оксида ванадия(V), содержащие цезий, могут быть синтезированы методом ионного обмена [9, 10]. Наличие ионообменных протонов в структуре гидратированного оксида ванадия позволяет получить Cs0.28V2O5 · 0.8H2O c межслоевым расстоянием ~11 Å [10]. Высокая селективность V2O5 ⋅ nH2O к катионам Cs+ способствует синтезу СsxV2O5 · nH2O даже из высококонцентрированных растворов щелочных и щелочноземельных металлов. Такая высокая избирательность может быть использована при извлечении ионов цезия из растворов [11]. Проведение синтеза методом ионного обмена в атмосфере азота с использованием в качестве растворителя ацетона приводит к повышению содержания цезия в образцах с образованием соединений состава Сs0.41V2O5⋅ nH2O [12]. Традиционным способом синтеза СsxV2O5 · nH2O является золь-гель метод, при котором для получения ксерогеля (H3O)0.15Сs0.18V2O5.1 ⋅ 0.65H2O используется раствор пероксованадата цезия [13]. Следует отметить, что в литературе практически отсутствуют сведения о простых и надежных гидрохимических методах синтеза СsxV2O5 ⋅ nH2O, позволяющих регулировать его морфологию, размер частиц, а также содержание четырехвалентного ванадия в конечном продукте.
Цель настоящей работы – изучение условий образования цезийсодержащих соединений на основе гидратированного оксида ванадия(V) состава СsxV2O5 ⋅ nH2O гидролитическим (Hyd), гидротермальным (AC) и золь-гель (SG) методами синтеза. Дополнительно проведен сравнительный анализ структуры, морфологии, текстурных характеристик и электропроводности СsxV2O5 ⋅ ⋅ nH2O, синтезированных в Hyd-, AC- и SG-условиях. Впервые для получения СsxV2O5 ⋅ nH2O применен гидротермальный метод синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали метаванадат цезия СsVO3 марки “ос. ч.”, сульфат ванадила гидрат VOSO4 ⋅ 3H2O “ч. д. а.”, оксид ванадия(V) V2O5 “ос. ч.”, 30%-ный раствор пероксида водорода Н2О2 марки “ос. ч.”. Сульфат ванадила гидрат применяли для регулирования кислотности реакционных растворов. Соединения CsxV2O5 · nH2O синтезировали тремя способами. При гидролитическом методе 50 мл реакционного раствора с молярным соотношением исходных компонентов 0.1 ≤ СsVO3/VOSO4 · 3H2O ≤ 2 и 1.9 ≤ ≤ рН ≤ 3.6 нагревали до 80°С и выдерживали в течение 2 ч. В результате были получены темно-зеленые осадки, маркированные как CsxV2O5 · ⋅ nH2O-Hyd, которые затем отфильтровывали, промывали водой и сушили на воздухе при комнатной температуре. При гидротермальном методе синтеза 30 мл реакционного раствора с 2.5 ≤ рН ≤ 2.8, содержащего исходные соединения в молярном соотношении 0.03 ≤ CsVO3/VOSO4 · 3H2O ≤ 0.1, загружали в автоклав объемом 50 мл, нагревали до 180°С со скоростью 5 град/мин и выдерживали в течение 24 ч. Образовавшиеся темно-зеленые осадки отфильтровывали, промывали водой и сушили на воздухе при комнатной температуре. Полученные соединения обозначены как CsxV2O5· nH2O-АС. Пероксидные растворы, содержащие исходные компоненты в соотношении 0 < СsVO3/V2O5 ≤ 0.3, были использованы для получения образцов золь-гель методом [13]. Реакционную массу медленно нагревали до 60°С и выдерживали при перемешивании в течение 1 ч. При этом происходило интенсивное разложение пероксидных соединений ванадия с образованием геля, который затем сушили при 60°С на воздухе с получением темно-бурого продукта. Синтезированные по золь-гель технологии ванадаты цезия обозначены как CsxV2O5 · nH2O-SG.
Содержание ионов цезия определяли методом атомно-aбсорбционной спектроскопии в пламени ацетилен–воздух на приборе Atomic Absorption Spectrophotometer 503 (Perkin-Elmer). Определение суммарного содержания ванадия проводили титрованием солью Мора в присутствии фенилантраниловой кислоты, концентрации ванадия(IV) – титрованием перманганатом калия. Рентгенофазовый анализ (РФА) выполняли на дифрактометре Shimadzu XRD 7000. Исследования образцов методом ИК-Фурье-спектроскопии проводили на спектрометре Spectrum Оne (Perkin-Elmer). Текстурные характеристики (удельную поверхность, пористость) определяли методом низкотемпературной адсорбции азота на анализаторе Gemini VII (Micromeritics). Исследование морфологии образцов осуществляли на сканирующем электронном микроскопе (СЭМ) JEOL JSM 6390 LA, интегрированном с энергодисперсионным рентгеновским анализатором EX-23010BU. Термический анализ проводили в атмосфере воздуха на анализаторе STA 449 F3 Jupiter (Netzsch), совмещенном с масс-спектрометром QMC 403 (ТГ–ДСК–МС). Электросопротивление образцов измеряли двухконтактным методом цифровым прибором Е7-14 на переменном токе с частотой 1 МГц в режимах нагревания (скорость нагрева 2 град/мин) и естественного охлаждения. Образцы готовили в виде таблеток прессованием порошков синтезированных соединений под давлением 108 Па с последующим нанесением на их поверхность слоя графита.
PЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате использования гидротермального, гидролитического и золь-гель методов синтеза получено три типа цезийсодержащих соединений. Соединения имеют общую формулу СsxV2O5 · nH2O и являются твердыми растворами внедрения на основе V2O5 · nH2O. Фазовый состав синтезированных осадков установлен с помощью ИК-спектроскопии как наиболее информативного метода для гидратированных ванадатов. В гидротермальных условиях образование ${\text{С}}{{{\text{s}}}_{{{\text{0}}{\text{.6}}}}}{\text{V}}_{{{\text{0}}{\text{.6}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.4}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O - AC}}$ происходит в очень узком интервале молярного соотношения исходных компонентов 0.04 ≤ СsVO3/VOSO4 · ⋅ 3H2O ≤ 0.05 при рН 2.8. ИК-спектр синтезированного соединения в области колебаний связей V–O подобен спектру V2O5 ⋅ 0.6H2O (рис. 1а, кривая 1) [14]. Интенсивная узкая полоса при 1012 см–1 обусловлена валентными колебаниями кратных связей V=O, полоса при 766 см–1 характеризует асимметричные валентные колебания мостиковых связей V–O–V, а полоса при 540 см–1 – валентные колебания связей V–О кристаллической решетки Сs0.6V2O5 · nH2O-АС. Отличительной особенностью ИК-спектра Сs0.6V2O5 · nH2O-АС является отсутствие характерной полосы поглощения при ~924 см–1, ответственной за валентные колебания связей V…OН [15]. Это свидетельствует о переходе части ионов ванадия(IV) из ванадий-кислородных слоев (анионная подрешетка) в межслоевое пространство в виде ванадил-ионов VO2+ (катионная подрешетка) [16]. Очевидно, что введение в реакционную массу сульфата ванадила гидрата в виде ионов VO2+ позволяет целенаправленно изменять концентрацию четырехвалентного ванадия в конечном продукте. По-видимому, катионы VO2+ стимулируют полимеризацию анионов ${{{\text{H}}}_{{\text{2}}}}{{{\text{V}}}_{{{\text{10}}}}}{\text{O}}_{{28}}^{{4 - }},$ создавая благоприятные условия для образования СsxV2O5 ⋅ nH2O, а проведение синтеза в условиях автоклавной обработки, вероятно, способствует восстановлению пятивалентного ванадия до четырехвалентного и его частичному переходу в катионную подрешетку. Деформационные колебания молекул воды в Сs0.6V2O5· ⋅ nH2O-АС соответствуют полосам в области ~1615–1616 см–1, а полосы, отвечающие валентным колебаниям Н–O–H, проявляются в интервале 3544–3582 см–1. При молярном соотношении СsVO3/VOSO4 · 3H2O < 0.04 осадок не образуется. С ростом молярного соотношения CsVO3/VOSO4 · 3H2O > 0.05 в продуктах реакции помимо основной фазы CsxV2O5 · nH2O дополнительно фиксируется в качестве примеси триванадат цезия CsV3O8 [17]. При этом в ИК-спектрах наряду с полосами основной фазы Cs0.6V2O5 · nH2O-АС наблюдается слабое плечо при ~952–967 см–1, свидетельствующее о присутствии в качестве примеси CsV3O8 (рис. 1а, кривая 2).
Рис. 1.
ИК-спектры соединений, полученных гидротермальным методом (а) при молярном соотношении исходных компонентов 0.04 ≤ СsVO3/VOSO4 · 3H2O ≤ ≤ 0.05 (1) и CsVO3/VOSO4 · 3H2O > 0.05 (2), гидролитическим методом (б) при 0.5 ≤ CsVO3/VOSO4 · 3H2O ≤ ≤ 1.5 (1) и CsVO3/VOSO4 · 3H2O > 1.5 (2), золь-гель методом (в) при молярном соотношении при CsVO3/V2O5 = 0 (1), 0 < CsVO3/V2O5 ≤ 0.2 (2) и CsVO3/V2O5 > 0.2 (3). Полосы вазелинового масла обозначены звездочкой.

Гидролитическим методом синтеза в интервале молярных соотношений 0.5 ≤ СsVO3/VOSO4 · ⋅ 3H2O ≤ 1.5 получены цезийсодержащие соединения на основе гидратированного оксида ванадия(V) общей формулы СsxV2O5 · nH2O-Hyd (0.2 ≤ x ≤ 0.3). Соединение состава ${\text{С}}{{{\text{s}}}_{{{\text{0}}{\text{.3}}}}}{\text{V}}_{{{\text{0}}{\text{.3}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.7}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O - Нyd,}}$ характеризующееся максимальным содержанием четырехвалентного ванадия, получено при молярном соотношении 0.5 ≤ СsVO3/VOSO4 · 3H2O ≤ 1.0 и 2.8 ≤ рН ≤ 3.0. Соединение Cs0.2V2O5 · nH2O-Hyd, отличающееся минимальным содержанием четырехвалентного ванадия, формируется при молярном соотношении 1.0 < СsVO3/VOSO4 · 3H2O ≤ 1.5. Дальнейшее увеличение концентрации цезия в исходном растворе (CsVO3/VOSO4 · 3H2O > 1.5) приводит к образованию смеси CsxV2O5 · nH2O как основной фазы и CsV3O8 в качестве примеси. При СsVO3/VOSO4 · 3H2O < 0.5 осадок практически не образуется. На рис. 1б (кривая 1) приведен ИК-спектр Cs0.3V2O5 · nH2O-Нyd, полученного при молярном отношении СsVO3/VOSO4 · 3H2O = 1.0. При CsVO3/VOSO4 · 3H2O > 1.5 наряду с полосами основной фазы CsxV2O5 · nH2O-Hyd наблюдается полоса при 680 см–1, характеризующая асимметричные валентные колебания мостиковых связей V–O–V, и слабое плечо при ~960–968 см–1, относящееся к валентным колебаниям связей V–O и свидетельствующее о присутствии в качестве примеси CsV3O8 (рис. 1б, кривая 2) [14].
Золь-гель методом при молярном соотношении компонентов реакционной смеси 0 < < CsVO3/V2O5 ≤ 0.2 синтезировано соединение CsxV2O5 · nH2O-SG, где 0.1 ≤ x ≤ 0.18. С ростом отношения CsVO3/V2O5 > 0.2 в осадках фиксируется примесь CsV3O8. При СsVO3/V2O5 = 0 образуется V2O5 · nH2O (рис. 1в, кривая 1). На рис. 1в (кривая 2) представлен ИК-спектр CsxV2O5 · nH2O-SG, синтезированного при соотношении 0 < CsVO3/V2O5 ≤ ≤ 0.2. Содержание цезия в образце хорошо согласуется с результатами, приведенными в работе [13]. При молярном отношении CsVO3/V2O5 > 0.2 помимо основной фазы CsxV2O5 · nH2O-SG обнаружена примесь CsV3O8, что подтверждается наличием в ИК-спектрах полосы при 675 см–1, отвечающей асимметричным валентным колебаниям мостиковых связей V–O–V (рис. 1в, кривая 3).
В соответствии с полученными результатами, а также с данными по ионному состоянию ванадия(V) в растворах в слабокислой области рН [18], создаваемой VOSO4 ⋅ 3H2O, процесс образования цезийсодержащего соединения на основе гидратированного оксида ванадия(V) при гидротермальном и гидролитическом методах синтеза может быть представлен реакцией:
(1)
$\begin{gathered} 1{\text{/}}3{\text{С}}{{{\text{s}}}^{ + }} + 1{\text{/}}6{{{\text{H}}}_{{\text{2}}}}{{{\text{V}}}_{{{\text{10}}}}}{\text{O}}~ + 1{\text{/}}3{\text{V}}{{{\text{O}}}^{{2 + }}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{C}}{{{\text{s}}}_{{{\text{0}}{\text{.33}}}}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{О}} + 1{\text{/}}3{{{\text{Н}}}^{ + }}. \\ \end{gathered} $Формирование СsxV2O5 ⋅ nH2O в условиях золь-гель метода описывается приведенными ниже химическими реакциями. На первой стадии при растворении оксида ванадия(V) в пероксиде водорода образуется красно-коричневая монопероксованадиевая кислота [19]:
(2)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}} + {\text{ }}2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to 2{\text{HV}}{{{\text{O}}}_{{\text{2}}}}\left( {{{{\text{O}}}_{{\text{2}}}}} \right) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Согласно диаграмме ионного состояния ванадия(V) в кислой среде в рабочем диапазоне концентраций ванадия последний существует в виде иона ${\text{VO}}_{2}^{ + }$ [18], образование которого может быть представлено реакцией:
(3)
${\text{HV}}{{{\text{O}}}_{{\text{2}}}}{\text{(}}{{{\text{O}}}_{{\text{2}}}}) + {{{\text{H}}}^{ + }} \to ~\,\,{\text{VO}}_{2}^{ + } + {\text{ }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 1{\text{/}}2{{{\text{O}}}_{2}}.$При введении CsVO3 происходит формирование СsxV2O5 ⋅ nH2O-SG:
(4)
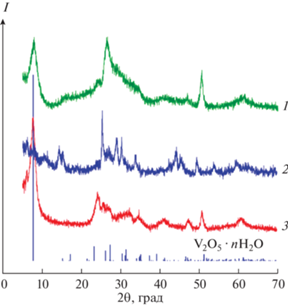
$\begin{gathered} {\text{2VO}}_{2}^{ + } + х{\text{C}}{{{\text{s}}}^{ + }} + \left( {1 + n + 0.5x} \right){{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to {\text{С}}{{{\text{s}}}_{{\text{x}}}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{5}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \left( {2{\text{ }} + x} \right){{{\text{H}}}^{ + }} + 0.25x{{{\text{O}}}_{2}}. \\ \end{gathered} $Соединения CsxV2O5 · nH2O, синтезированные различными методами и характеризующиеся повышенным содержанием четырехвалентного ванадия, были подробно изучены с помощью РФА (рис. 2). Соединения кристаллизуются в моноклинной сингонии (пр. гр. С12/m1). На дифрактограммах всех синтезированных СsxV2O5 · nH2O аналогично V2O5 ⋅ nH2O фиксируются рефлексы от плоскостей (00l), подтверждающие их слоистое строение. Наличие рефлексов hkl в образцах свидетельствует о частичной потере слоистой ориентации слоев V–O при внедрении Сs+ в межслоевое пространство. Подобное разупорядочение слоистой структуры отмечено при интеркаляции V2O5⋅ nH2O катионами ${\text{NH}}_{4}^{ + }$ [20], Na+, тетраметиламмония (CH3)4N+ [21] и K+ [22]. Межслоевое расстояние в Сs0.6V2O5 · nH2O-АС (d00l = 11.15 Å) меньше аналогичного значения для Cs0.3V2O5 · · nH2O-Нyd (d00l = 11.58 Å) и Cs0.18V2O5 · nH2O-SG (d00l = 11.54 Å). Вероятно, это связано с увеличением электростатического взаимодействия катионов цезия и ионов ванадила VO2+, расположенных в межслоевом пространстве, c отрицательно заряженными слоями V–O Сs0.6V2O5 · nH2O-АС [20]. Межслоевое расстояние в Сs0.6V2O5 · nH2O-АС также меньше, чем в V2O5 ⋅ 1.6H2O, где оно составляет 11.57 Å [23]. Очевидно, что значение межслоевого расстояния зависит не только от электростатического взаимодействия между Cs+, VO2+, находящимися в межслоевом пространстве, и отрицательно заряженными слоями V–O, сжимающего межслоевое расстояние, но и от степени гидратации соединений, приводящей к расширению межслоевого расстояния. Значение межслоевого расстояния для ванадатов, синтезированных гидролитическим и золь-гель методами, близко к величине межслоевого расстояния для V2O5 ⋅ 1.6H2O. Оценка среднего размера кристаллитов CsxV2O5 · nH2O, полученных различными методами синтеза, была проведена с использованием уравнения Шеррера [24]. Средний размер кристаллитов равен ~16.4, 6.0 и 7.4 нм для Сs0.6V2O5 · nH2O-АС, Cs0.3V2O5 · nH2O-Нyd и Cs0.18V2O5 · nH2O-SG соответственно. Увеличение размера частиц при формировании Сs0.6V2O5 · · nH2O-АС, вероятно, обусловлено процессами агрегации частиц под действием более высоких температур, используемых при проведении синтеза в гидротермальных условиях.
Рис. 2.
Дифрактограммы порошков Cs0.3V2O5 · nH2O-Нyd (1), Сs0.6V2O5 · nH2O-АС (2), Cs0.18V2O5 · nH2O-SG (3) и позиции брегговских пиков V2O5 · 1.6H2O по данным ICSD № 74-3093.
Электронно-микроскопические исследования показали, что метод синтеза определяет морфологию конечного продукта. Соединение Cs0.3V2O5 · ⋅ nH2O-Нyd образовано частицами стержневой морфологии диаметром 30–45 нм и длиной 0.3–0.5 мкм, агломерированными в ансамбли, подобные цветам диаметром 1–3 мкм (рис. 3). Сs0.6V2O5 · ⋅ nH2O-АС также имеет морфологию стержней диаметром 70–170 нм и длиной 5–10 мкм (рис. 4). Цезийсодержащее соединение на основе гидратированного оксида ванадия(V), синтезированное золь-гель методом, состоит из частиц размером до 120 мкм, образованных сросшимися пластинами неправильной формы (рис. 5). Чистота синтезированных продуктов и отсутствие посторонних примесей подтверждены энергодисперсионным рентгеновским микроанализом (рис. 3в–5в). Как показывают экспериментальные данные, в формировании морфологии частиц CsxV2O5 · nH2O сульфат ванадила гидрат выполняет роль покрывающего агента (capping agent). Вероятно, ионы ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ селективно адсорбируясь на гранях продуктов синтеза, могут координироваться ионами VO2+ или способствовать их селективной адсорбции на гранях кристалла, приводя к формированию CsxV2O5 · nH2O стержневой морфологии. Следует отметить, что явление “capping agent” в последние десятилетия получает все большую популярность для синтеза веществ с преимущественной ориентацией или заданной морфологией [25, 26].
Рис. 3.
СЭМ-изображения и спектр рентгеновского энергодисперсионного микроанализа Cs0.3V2O5 · · nH2O-Нyd. Дополнительный пик от углерода обусловлен подложкой, применяемой для фиксации образца.

Рис. 4.
СЭМ-изображения и спектр рентгеновского энергодисперсионного микроанализа Сs0.6V2O5 · · nH2O-АС. Дополнительный пик от углерода обусловлен подложкой, применяемой для фиксации образца.

Рис. 5.
СЭМ-изображения и спектр рентгеновского энергодисперсионного микроанализа Cs0.18V2O5 · · nH2O-SG. Дополнительный пик от углерода обусловлен подложкой, применяемой для фиксации образца.

На рис. 6 представлены результаты исследования удельной поверхности и пористости синтезированных цезийсодержащих соединений на основе гидратированного оксида ванадия(V). Согласно классификации ИЮПАК [27], изотермы сорбции гидратов СsxV2O5 · nH2O относятся к IV типу с петлей гистерезиса Н3. Такое поведение ассоциируется с наличием в соединениях пор щелевидной формы. Установлено, что удельная поверхность образцов Cs0.3V2O5· nH2O-Нyd, Сs0.6V2O5 · nH2O-АС и Cs0.18V2O5 · nH2O-SG равна 34.0, 16.5 и 1.78 м2/г соответственно. В этой же последовательности, по данным СЭМ, увеличивается размер частиц CsxV2O5 · nH2O (рис. 3–5). Дополнительно изменяется и морфология частиц CsxV2O5 · nH2O. Низкая величина удельной поверхности соединения CsxV2O5 · nH2O-SG обусловлена формой частиц, состоящих из сильно агломерированных хаотичных пластин. Для образцов Cs0.3V2O5 · nH2O-Нyd и Сs0.6V2O5 · nH2O-АС наблюдается широкое распределение пор по размерам с преимущественным размером пор 270 и 330 нм соответственно, свидетельствующее о наличии макропор в структуре соединений (рис. 6а, 6б). Распределение пор по размерам для Cs0.18V2O5 · ⋅ nH2O-SG описывается тремя характеристическими максимумами (рис. 6в). Преимущественный размер пор, вычисленный для первого и второго экстремумов на кривой распределения, составляет 22 и 43 нм соответственно и подтверждает наличие мезопор в структуре Cs0.18V2O5 · nH2O-SG. Третий экстремум на кривой распределения указывает на присутствие макропор в образцах, преимущественный размер которых равен 85 нм. Очевидно, что, используя различные методы синтеза, можно регулировать текстурные свойства CsxV2O5 · nH2O.
Рис. 6.
Изотермы сорбции, кривые распределения пор по размерам (вставка) образцов Cs0.3V2O5 · nH2O-Нyd (а), Сs0.6V2O5 · nH2O-АС (б) и Cs0.18V2O5· nH2O-SG (в): 1 – адсорбция, 2 – десорбция.

Термическая стабильность образцов CsxV2O5 · · nH2O изучена методом ТГ–ДСК–МС (рис. 7). Согласно ТГ-кривой, дегидратация Cs0.3V2O5 · · nH2O-Нyd и Cs0.18V2O5 · nH2O-SG происходит в одну стадию (рис. 7а, 7б). Основная потеря массы наблюдается в интервале температур 50‒300°С и соответствует удалению кристаллогидратной воды. Процесс сопровождается ярко выраженным эндоэффектом при 104 и 113°С для Cs0.3V2O5 · · nH2O-Нyd и Cs0.18V2O5 · nH2O-SG соответственно. Одновременно на МС-кривых регистрируются широкие и размытые пики, характерные для молекулярного иона H2O+, c m/z = 18 a.e.м. Наличие кристаллогидратной воды также подтверждено данными ИК-спектроскопии. При дальнейшем повышении температуры происходит термическое разложение образцов, сопровождаемое экзотермическими эффектами с максимумами при 322°С для Cs0.3V2O5 · nH2O-Нyd и 336, 367°С для Cs0.18V2O5 · nH2O-SG. Отнесение всех последующих термических эффектов, зафиксированных на ДСК-кривых, проведено на основании диаграммы состояния системы Cs2O‒V2O5 [28]. Повышение температуры отжига до ~490 ± 2°С приводит к инконгруэнтному плавлению ванадата цезия состава Cs2V8O20.8 с образованием V2O5 и Cs2V6O16. Плавлению Cs2V6O16 соответствует эндоэффект при 537 ± 3°С. Термолиз Cs0.3V2O5 · ⋅ nH2O-Нyd заканчивается эндоэффектом при 576°С, соответствующим образованию эвтектики СsVO3 с Сs4V2O7, и сопровождается прибылью массы на ТГ-кривой. Конгруэнтным плавлением СsVO3 при 636°C завершается термолиз Cs0.18V2O5 · · nH2O-SG. Различие в температурных эффектах на ДСК-кривых для Cs0.3V2O5 · nH2O-Нyd и Cs0.18V2O5 · nH2O-SG обусловлено, по-видимому, содержанием цезия в синтезированных образцах.
Рис. 7.
Кривые ТГ, ДСК и MC образцов Cs0.3V2O5 · · 0.8H2O-Нyd (а), Cs0.18V2O5 · 1.2H2O-SG (б) и Сs0.6V2O5 · H2O-АС (в).

Дегидратация Сs0.6V2O5 · H2O-АС, в отличие от Cs0.3V2O5 · nH2O-Нyd и Cs0.18V2O5 · nH2O-SG, протекает в три стадии (рис. 7в). Основная убыль массы, относящаяся к потере кристаллогидратной воды, происходит в интервале 50‒300°С и сопровождается ярко выраженным эндоэффектом с максимумом при 78°С. Последующую убыль массы следует отнести к удалению двух типов химически связанной воды: координированной ванадил-ионами VO2+, находящимися в катионной подрешетке соединения, и ионами четырехвалентного ванадия V4+ анионной подрешетки [29]. Процесс сопровождается экзоэффектами при 310, 360 и 500°С и заканчивается полным окислением четырехвалентного ванадия с образованием гексаванадата Cs2V6O16 и метаванадата цезия СsVO3. Последующие эндоэффекты на кривой ДСК при 533 и 646°C, соответствующие плавлению Cs2V6O16 и СsVO3, подтверждают предложенную последовательность превращений. Рассчитано содержание воды в образцах, а именно: Cs0.3V2O5 · 0.8H2O-Нyd, Сs0.6V2O5 · H2O-АС и Cs0.18V2O5 · 1.2H2O-SG.
Представляло интерес изучить электропроводность синтезированных СsxV2O5 · nH2O, различающихся содержанием четырехвалентного ванадия. Известно, что соединения MxV2O5 · nH2O относятся к смешанным полупроводникам. Электронная составляющая проводимости зависит от концентрации четырехвалентного ванадия в образцах и осуществляется за счет поляронов малого радиуса в режиме перескоков между разнозарядными ионами ванадия [30]. Катионная составляющая проводимости определяется диффузией соответствующих ионов и зависит от относительной влажности воздуха [31]. На рис. 8 представлены температурные зависимости электропроводности СsxV2O5 · nH2O в координатах Аррениуса. На экспериментальных кривых CsxV2O5 · · nH2O в режиме нагревания можно выделить два прямолинейных участка. Для всех синтезированных соединений участок низкотемпературной области находится в интервале от комнатной температуры до 358 K. Энергия активации проводимости в указанном интервале температур, вычисленная по формуле σ = σ0exp(-E/RT), равна 0.16, 0.15 и 0.17 эВ для Сs0.6V2O5 · H2O-АС, Cs0.3V2O5 · · 0.8H2O-Нyd и Cs0.18V2O5 · 1.2H2O-SG соответственно. Ее значение определяется подвижностью носителей заряда, которая в низкотемпературной области пропорциональна содержанию воды в образцах [31]. При дальнейшем увеличении температуры до 423 K для Сs0.6V2O5 · H2O-АС, Cs0.3V2O5 · 0.8H2O-Нyd и Cs0.18V2O5 · 1.2H2O-SG на высокотемпературном участке проводимости наблюдается излом на зависимости lg σ = f(1/T), энергия активации проводимости при этом возрастает и равна 0.3, 0.38 и 0.45 эВ соответственно. Наименьшим значением энергии активации проводимости в высокотемпературной области обладает Сs0.6V2O5 · H2O-АС (Еа = 0.3 эВ), отличающийся повышенным содержанием четырехвалентного ванадия. Аналогичный вид зависимости lgσ = f(1/T) с изломом в интервале температур 373–380 K получен при изучении электропроводности NaxV2O5 · nH2O и KxV2O5· nH2O [30, 32]. Вероятно, температурные изменения электропроводности данного класса соединений обусловлены ступенчатой дегидратацией образцов, сопровождаемой уменьшением межслоевого расстояния, что приводит к увеличению энергии активации проводимости.
ЗАКЛЮЧЕНИЕ
Проведен сравнительный анализ морфологических особенностей и текстурных характеристик СsxV2O5 · nH2O, полученного с применением различных методов синтеза. Впервые гидротермальным методом синтезирован Сs0.6V2O5 · H2O, частицы которого имеют стержневую морфологию диаметром 70−170 нм и длиной 5−10 мкм. Гидролитический метод позволяет формировать соединения CsxV2O5 · nH2O-Нyd с наиболее развитой удельной поверхностью. Установлено, что использование сульфата ванадила гидрата при гидролитическом и гидротермальном методах синтеза приводит к образованию частиц стержневой морфологии и обусловлено, по-видимому, “capping agent” эффектом. Дополнительно применение сульфата ванадила гидрата позволяет целенаправленно регулировать содержание четырехвалентного ванадия в образцах. Предложенные методы получения СsxV2O5 · nH2O являются простыми, низкозатратными и обеспечивают получение конечного продукта с различными текстурными характеристиками. Изучение температурной зависимости электропроводности СsxV2O5 · nH2O показало, что в низкотемпературной области энергия активации проводимости соединений практически одинакова и не зависит от содержания V4+. В высокотемпературной области (318−423 K) наименьшей энергией активации (0.3 эВ) обладает Сs0.6V2O5 · nH2O-АС, синтезированный гидротермальным методом и характеризующийся повышенным содержанием четырехвалентного ванадия.
Список литературы
Livage J. // Solid State Ionics. 1996. V. 86–88. № 2. P. 935. https://doi.org/10.1016/0167-2738(96)00336-0
Clites M., Hart J.L., Taheri M.L. et al. // ACS Energy Lett. 2018. V. 3. № 3. P. 562. https://doi.org/10.1021/acsenergylett.7b01278
El-Desoky M.M., Al-Assiri M.S., Bahgat A.A. // J. Phys. Chem. Solids. 2014. V. 75. P. 992. https://doi.org/10.1016/j.jpcs.2014.04.003
Grigorieva A., Badalyan S., Goodilin E. et al. // Eur. J. Inorg. Chem. 2010. V. 210. № 33. P. 5247. https://doi.org/10.1002/ejic. 201000372
Захарова Г.С., Денисова Т.А., Волков В.Л. и др. // Журн. неорган. химии. 1988. Т. 33. № 6. С. 1444.
Волков В.Л., Захарова Г.С., Бондаренка В.М. Ксерогели простых и сложных поливанадатов. Екатеринбург: Изд-во УрО РАН, 2001.
Feng J., Xiong Z., Zhao L. et al. // J. Power Sources. 2018. V. 396. P. 230. https://doi.org/10.1016/j.jpowsour.2018.06.021
Подвальная Н.В., Захарова Г.С. // Неорган. материалы. 2021. Т. 57. № 8. С. 838. https://doi.org/10.31857/S0002337X2108026116
Yao T., Oka Y. // Solid State Ionics. 1997. V. 96. P. 127. https://doi.org/10.1016/S0167-2738(96)00623-6
Yao T., Oka Y., Yamamoto N. // J. Mater. Chem. 1992. V. 2. № 3. P. 331. https://doi.org/10.1039/JM9920200331
Shivastava O.P., Komarneni S.K., Malla P. // Mater. Res. Bull. 1991. V. 26. P. 357.
Liu Y.-J., Cowen J.A., Kaplan T.A. et al. // Chem. Mater. 1995. V. 7. P. 1616. https://doi.org/10.1021/cm00057a007
Волков В.Л., Захарова Г.С., Ивакин А.А. и др. // Журн. неорган. химии. 1987. Т. 32. № 10. С. 2427.
Tian B., Tang W., Su C. et al. // Appl. Mater. Interfaces. 2018. V. 10. № 1. P. 642. https://doi.org/10.1021/acsami.7b15407
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Moscow: Mir, 1991.
Волков В.Л., Захарова Г.С. // Журн. неорган. химии. 1988. Т. 33. № 6. С. 1580.
Кристаллов Л.В., Корякова О.В., Переляева Л.А. и др. // Журн. неорган. химии. 1987. Т. 32. № 8. С. 1811.
Livage J. // Coord. Chem. Rev. 1998. V. 178–180. № 2. P. 999. https://doi.org/10.1016/S0010-8545(98)00105-2
Butler A., Clague M.J., Meister G.E. // Chem. Rev. 1994. V. 94. № 3. P. 625.
Najdoski M., Koleva V., Samet A. // J. Phys. Chem. C. 2014. V. 118. P. 9636. https://doi 10.21./jp4127122
Durupthy O., Steunou N., Coradin T. et al. // J. Mater. Chem. 2005. V. 15. P. 1090. https://doi.org/10/1039/b414893b
Подвальная Н.В., Захарова Г.С. // Журн. неорган. химии. 2020. Т. 65. № 7. С. 880. https://doi.org/10.31857/S0044457X20070156
Petkov V., Trikalitis P.N., Bozin E.S. et al. // J. Am. Chem. Soc. 2002. V. 124. № 34. P. 10157. https://doi.org/10.1021/ja026143y
Patterson A.L. // Phys. Rev. 1939. V. 56. № 10. P. 978. https://doi.org/10.1103/PhysRev.56.978
Chandrasekaran P., Viruthagiri G., Srinivasan N. // J. Alloys Compd. 2012. V. 540. P. 89. https://doi.org/10.1016/j.jallcom.2012.06.032
Suwanboon S., Amornpitoksuk P., Randorn C. // Ceram. Int. 2019. V. 45. P. 2111. https://doi.org/10.1016/j.ceramint.2018.10.116
Sing K.S.W., Everett D.H., Haul R.A.W. et al. // Pure Appl. Chem. 1985. V. 57. № 4. P. 603. https://doi.org/10.1351/pac198557040603
Диаграммы состояния систем тугоплавких оксидов: Справочник. Вып. 5. Двойные системы. Л.: Наука, 1986. Ч. 2.
Charbi N., Sanchez C., Livage J. et al. // Inorg. Chem. 1982. V. 21. № 10. P. 2758. https://doi.org/10.1021/ic00137a043
Bahgat H.A., Mady A.S., Abdel Moghny A.S. et al. // J. Mater. Sci. 2011. V. 27. № 10. P. 865. https://doi.org/10.1016/S1005-0302(11)60157-6
Bahgat A.A., Ibrahim E.A., El-Desoky M.M. // Thin Solid Films. 2005. V. 489. P. 68. https://doi.org/10.1016/j.tsf.2005.05.001
El-Desoky M.M., Al-Assiri M.S., Bahgat A.A. // J. Alloys Compd. 2014. V. 590. P. 572. https://doi.org/10.1016/j.jallcom.2013.12.168
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



