Журнал неорганической химии, 2023, T. 68, № 6, стр. 737-745
Исследование кристаллических структур аниона [B10Cl10]2– с имидазолиевыми катионами
А. В. Голубев a, *, А. С. Кубасов a, А. Ю. Быков a, Е. Ю. Матвеев b, Н. А. Саркисов b, И. В. Новиков b, П. С. Стародубец c, Н. А. Романов c, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
c Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва,
Миусская пл., 9, Россия
* E-mail: golalekseival@mail.ru
Поступила в редакцию 21.12.2022
После доработки 28.12.2022
Принята к публикации 09.01.2023
- EDN: UFNNUM
- DOI: 10.31857/S0044457X22602322
Аннотация
Предложен новый способ получения имидазолиевых солей перхлорированного клозо-декаборатного аниона (RMIM)2[B10Cl10] (R = H, n-Et, n-Bu, n-C8H17). Синтез этих соединений может быть осуществлен простыми реакциями обмена между калиевой солью декахлор-клозо-декаборатного аниона K2[B10Cl10] и хлоридами производных имидазолия. С помощью рентгеноструктурного анализа и анализа поверхности Хиршфельда исследованы кристаллические упаковки и межмолекулярные взаимодействия для соединений (EMIM)2[B10Cl10] и (BMIM)2[B10Cl10]. Анионы [B10Cl10]2– в кристаллической решетке этих соединений связаны сеткой слабых взаимодействий Cl…Cl с расстоянием между атомами хлора 2.246–3.623 Å.
ВВЕДЕНИЕ
Слабокоординирующие анионы играют важную роль в современной фундаментальной и прикладной химии [1]. Они находят применение в качестве стабилизирующих ионов для реакционноспособных катионов, таких как Et3Si+, Et2Al+ и др. [2–4], или как компоненты ионных жидкостей [5–8]. Одними из таких анионов являются высшие клозо-боратные анионы и их производные [9–15]. Данные анионы обладают рядом уникальных свойств, что позволяет найти им различное применение [16–18]. В настоящее время известно достаточно большое количество соединений на их основе, которые можно считать ионными жидкостями [19, 20].
Известно, что главным отличием ионных жидкостей от кристаллических соединений является слабое кулоновское взаимодействие между ионами [21–23], приводящее к слабой координации между ними. Исследование этих возможных взаимодействий с помощью современных методов анализа, как экспериментальных, так и теоретических, позволит лучше узнать и в дальнейшем предсказать наиболее подходящие катион/анионные составы.
Одними из катионов для исследований клозо-боратных анионов в качестве компонентов ионных жидкостей являются имидазолиевые катионы. Первыми объектами исследований подобных составов были клозо-декаборатный [B10H10]2– и клозо-додекаборатный [B12H12]2– анионы [24] и их пергалогенированные аналоги [BnHaln]2– (n = 10, 12) [25–28]. Однако наличие двойного отрицательного заряда не позволило раскрыть их перспективность. Другими объектами исследований являлись карбораны и их производные [RCB11H11]– [29]. Один из способов модификации кластерных анионов бора – введение экзополиэдрического заместителя, что позволяет не только изменить общий заряд системы до –1, но и добиться необходимых физико-химических свойств [30–34]. В связи с этим данные анионы также были исследованы как перспективные компоненты ионных жидкостей [35].
В настоящей работе представлен новый способ получения солей перхлорированного клозо-декаборатного аниона [B10Cl10]2– с рядом имидазолиевых катионов: MIM (метилимидазолий), EMIM (1-этил-3-метилимидазолий), BMIM (1-бутил-3-метилимидазолий), MOIM (1-метил-3-октилимидазолий). Кроме того, методами рентгеноструктурного анализа и анализа поверхности Хиршфельда исследованы кристаллические упаковки и межмолекулярные взаимодействия соединений (EMIM)2[B10Cl10] и (BMIM)2[B10Cl10], что позволит расширить понимание слабых межмолекулярных взаимодействий в соединениях подобного типа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. K2[B10Cl10] был получен по известной методике [36]. (MIM)Cl (95%, Aldrich), (EMIM)Cl (98%, Aldrich), (BMIM)Cl (98%, Aldrich), (MOIM)Cl (97%, Aldrich) и ацетонитрил являлись коммерческими препаратами и не требовали дополнительной очистки.
Элементный анализ на углерод, водород и азот проводили на автоматическом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba).
ИК-спектры соединений записывали на ИК-Фурье-спектрофотометре Инфралюм ФТ-08 (НПФ ФП “Люмекс”) в области 4000–400 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии исследуемого вещества в тетрахлорметане CCl4.
Спектры 11В, 1Н, 13С ЯМР растворов исследуемых веществ в CD3CN записывали на импульсном Фурье-спектрометре Bruker MSL-300 (ФРГ) на частотах 96.32, 300.3, 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан и эфират трехфтористого бора.
Рентгеноструктурные исследования. Кристаллы солей (EMIM)2[B10Cl10] и (BMIM)2[B10Cl10], пригодные для рентгеноструктурных исследований, получали медленным парофазным насыщением ацетонитрильного раствора диэтиловым эфиром при температуре +4°С. Набор дифракционных отражений получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker D8 Venture (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Данные проиндексированы и интегрированы с помощью программы SAINT [37]. Применялась поправка на поглощение, основанная на измерениях эквивалентных отражений (SADABS) [38]. Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода CH- и BH-групп уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп).
Все расчеты выполнены с использованием программы SHELXTL [39]. Структура расшифрована и уточнена с помощью программного комплекса OLEX2 [40].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структур приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные для структур 2 и 3
| Соединение | 2 (EMIM)2[B10Cl10] | 3 (BMIM)2[B10Cl10] |
|---|---|---|
| Брутто-формула | C26H47B20Cl20N9 | C16H30B10Cl10N4 |
| M | 1410.92 | 741.04 |
| T, K | 150 | 100.00 |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | P21/c | P |
| a, Å | 18.116(4) | 10.360(3) |
| b, Å | 10.013(2) | 19.804(7) |
| c, Å | 35.185(7) | 33.572(19) |
| α, град | 90 | 74.67(2) |
| β, град | 100.838(9) | 88.83(2) |
| γ, град | 90 | 85.973(12) |
| V, Å3 | 6269(2) | 6627(5) |
| Z | 4 | 8 |
| ρрасч, г/см3 | 1.495 | 1.486 |
| μ, мм–1 | 0.906 | 0.860 |
| F(000) | 2824.0 | 2992.0 |
| Излучение, нм | MoKα (λ = 0.71073) | MoKα (λ = 0.71073) |
| Интервал углов 2θ, град | 4.234–60.06 | 3.774–53.842 |
| Отражений собрано | 40478 | 54156 |
| Число независимых отражений | 16893 [Rint = 0.0313, Rsigma = 0.0430] | 28216 [Rint = 0.0374, Rsigma = 0.0602] |
| GООF | 1.099 | 1.048 |
| R1, wR2 по N0 | R1 = 0.0520, wR2 = 0.1097 | R1 = 0.0683, wR2 = 0.1497 |
| R1, wR2 по N | R1 = 0.0653, wR2 = 0.1165 | R1 = 0.0867, wR2 = 0.1598 |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2226235, 2226236).
Анализ поверхности Хиршфельда был выполнен с использованием программного обеспечения Crystal Explorer 17.5 [41]. Донорно-акцепторные пары визуализировали с использованием стандартного (высокого) разрешения поверхности и dnorm: поверхности отображаются в фиксированной цветовой шкале от –0.640 (красный) до 0.986 (голубой) а. е.
Синтез (MIM)2[B10Cl10] (1). К раствору соли MIMCl (87.7 мг, 0.74 ммоль) в ацетонитриле медленно приливали раствор соли K2B10Cl10 (200 мг, 0.37 ммоль) в ацетонитриле, после чего образовавшийся мелкодисперсный осадок отфильтровывали, а раствор упаривали на роторном испарителе. К полученному остатку приливали 10 мл этилацетата и обрабатывали на ультразвуковой ванне в течение 10 мин. Образовавшийся осадок отфильтровывали и промывали (2 × 10 мл) диэтиловым эфиром. Получено 204.2 мг (0.32 ммоль) (MIM)2[B10Cl10]. Выход 88%. Ниже приведены результаты элементного анализа для C8H14B10Cl10N4. Найдено, %: С 15.13; Н 2.18; N 8.79. Вычислено, %: С 15.28; Н 2.24; N 8.91. 11В ЯМР-спектр (CD3CN, δ, м. д.): –4.2 (s, 2B, B1, B10), –11.3 (s, 8B, B2–B9). 1Н ЯМР-спектр (CD3CN, δ, м. д.): 10.1 (s, 2H, NH), 8.96 (s, 2H, NCHN), 7.26 (s, 2H, CH), 7.24 (s, 2H, CH), 3.82 (s, 6H, NCH3). 13С ЯМР-спектр (CD3CN, δ, м. д.): 136.5 (NCHN), 123.4 (CH), 121.5 (CH), 36.2 (NCH3). ИК-спектр (CCl4, ν, см–1): 3349, 3154, 3118, 1562, 1471, 1161, 1002, 832, 743, 620, 522.
Синтез (EMIM)2[B10Cl10] (2). Реакцию проводили аналогично вышеописанной методике для соединения 1. Из EMIMCl (108.4 мг, 0.74 ммоль) и K2B10Cl10 (200 мг, 0.37 ммоль) было получено 230.4 мг (0.34 ммоль) (EMIM)2[B10Cl10]. Выход составил 91%. Ниже приведены данные элементного анализа для C12H22B10Cl10N4. Найдено, %: С 20.91; Н 3.15; N 8.11. Вычислено, %: С 21.04; Н 3.24; N 8.18. 11В ЯМР-спектр (CD3CN, δ, м. д.): –4.2 (s, 2B, B1, B10), –11.3 (s, 8B, B2–B9). 1Н ЯМР-спектр (CD3CN, δ, м. д.): 8.96 (s, 2H, NCHN), 7.26 (s, 2H, CH), 7.24 (s, 2H, CH), 4.30 (m, 4H, NCH2), 3.98 (s, 6H, NCH3), 1.56 (t, 6H, NCH2CH3). 13С ЯМР-спектр (CD3CN, δ, м. д.): 136.5 (NCHN), 123.4 (CH), 121.5 (CH), 45.5 (NCH2), 36.7 (NCH3), 13.8 (NCH2CH3). ИК-спектр (CCl4, ν, см–1): 3149, 3115, 2961, 2932, 2876, 2861, 1564, 1468, 1160, 1003, 835, 742, 619, 520.
Синтез (BMIM)2[B10Cl10] (3). Реакцию проводили аналогично вышеописанной методике для соединения 1. Из BMIMCl (129.1 мг, 0.74 ммоль) и K2B10Cl10 (200 мг, 0.37 ммоль) было получено 246.6 мг (0.33 ммоль) (BMIM)2[B10Cl10]. Выход составил 90%. Ниже приведены данные элементного анализа для C16H30B10Cl10N4. Найдено, %: С 25.81; Н 3.99; N 7.43. Вычислено, %: С 25.93; Н 4.08; N 7.56. 11В ЯМР-спектр (CD3CN, δ, м. д.): –4.2 (s, 2B, B1, B10), –11.3 (s, 8B, B2–B9). 1Н ЯМР-спектр (CD3CN, δ, м. д.): 8.98 (s, 2H, NCHN), 7.23 (s, 2H, CH), 7.22 (s, 2H, CH), 4.25 (m, 4H, NCH2), 3.98 (s, 6H, NCH3), 1.88 (m, 4H, NCH2CH2), 1.26 (m, 4H, N–CH2CH3), 0.98 (t, 6H, N–CH3). 13С ЯМР-спектр (CD3CN, δ, м. д.): 136.8 (NCHN), 123.4 (CH), 121.8 (CH), 50.1 (NCH2), 36.8 (NCH3), 32.1 (NCH2CH2), 19.5 (N–CH2CH3), 13.3 (N–CH2CH3). ИК-спектр (CCl4, ν, см–1): 3166, 3150, 3118, 2965, 2879, 1596, 1566, 1465, 1429, 1164, 1108, 1003, 949, 831, 742, 659, 646, 621, 522.
Синтез (MOIM)2[B10Cl10] (4). Реакцию проводили аналогично вышеописанной методике для соединения 1. Из MOIMCl (170.6 мг, 0.74 ммоль) и K2B10Cl10 (200 мг, 0.37 ммоль) было получено 307.7 мг (0.32 ммоль) (MOIM)2[B10Cl10]. Выход 88%. Ниже приведены данные элементного анализа для C24H46B12Cl12N4. Найдено, %: С 30.32; Н 4.79; N 5.77. Вычислено, %: С 30.48; Н 4.90; N 5.92. 11В ЯМР-спектр (CD3CN, δ, м. д.): –4.2 (s, 2B, B1, B10), –11.3 (s, 8B, B2–B9). 1Н ЯМР-спектр (CD3CN, δ, м. д.): 8.97 (s, 2H, NCHN), 7.24 (s, 2H, CH), 7.22 (s, 2H, CH), 4.25 (m, 4H, NCH2), 3.97 (s, 6H, NCH3), 1.88 (m, 4H, NCH2CH2), 1.26 (m, 16H, N–(CH2)4CH3), 0.97 (t, 6H, N–CH3). 13С ЯМР-спектр (CD3CN, δ, м. д.): 136.8 (NCHN), 123.4 (CH), 121.8 (CH), 50.1 (NCH2), 36.8 (NCH3), 32.1 (NCH2CH2), 31.0–24.0 (N–(CH2)4–CH2CH3, 19.5 (N–CH2CH3), 13.3 (N–CH2CH3). ИК-спектр (CCl4, ν, см–1): 3148, 3116, 2967, 2933, 2878, 2861, 1566, 1467, 1166, 1003, 832, 743, 618, 519.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
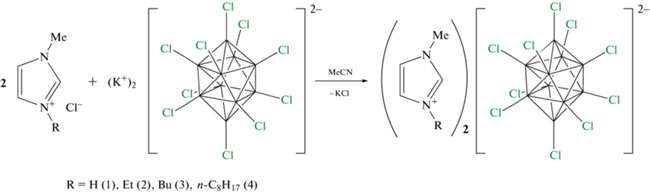
Синтез. Для проведения стандартных реакций обмена катионов использовали растворимые в ацетонитриле калиевые соли перхлорированного клозо-декаборатного аниона K2[B10Cl10] с соответствующими хлоридами производных имидазолия (RMIM)Cl (R = H, n-Et, n-Bu, n-C8H17). Общая схема синтеза приведена ниже:
Схема 1 . Схема синтеза имидазолиевых солей перхлорированного клозо-декаборатного аниона.
Образовавшийся твердый хлорид калия KCl отфильтровывали, а фильтрат упаривали на роторном испарителе и обрабатывали этилацетатом на ультразвуковой ванне. Полученный осадок отфильтровывали и полностью высушивали в вакууме масляного насоса. Чистоту конечных соединений подтверждали данными CHN-элементного анализа.
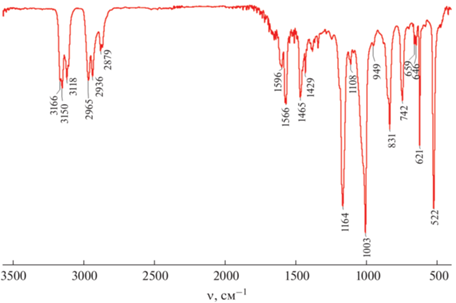
В ИК-спектре конечного соединения, например (BMIM)2[B10Cl10] (рис. 1), наблюдаются две группы полос, которые можно отнести к катионной и анионной частям. Полосы в области 3170–2870 см–1 являются характеристичными для валентных колебаний С–H, полоса при 831 см–1 отвечает валентным колебаниям C–N, а полосы в области 1600–600 см–1 относятся к структурным колебаниям в катионе (BMIM)+ [42]. Для аниона [B10Cl10]2– наблюдаются три интенсивные полосы при 1164, 1003 и 522 см–1, характеристичные для колебаний B–Cl [15].
Таким образом, данный метод синтеза позволяет получать интересуемые нас соединения с перхлорированным клозо-декаборатным анионом [B10Cl10]2– с высоким выходом и использовать катионы имидазолия с заместителями различного строения.
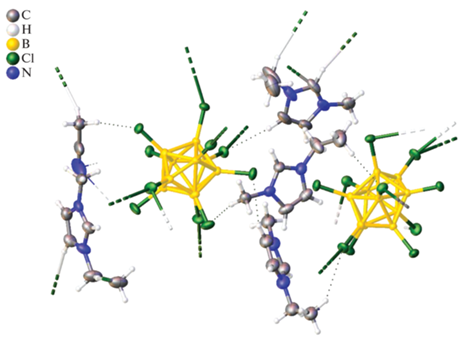
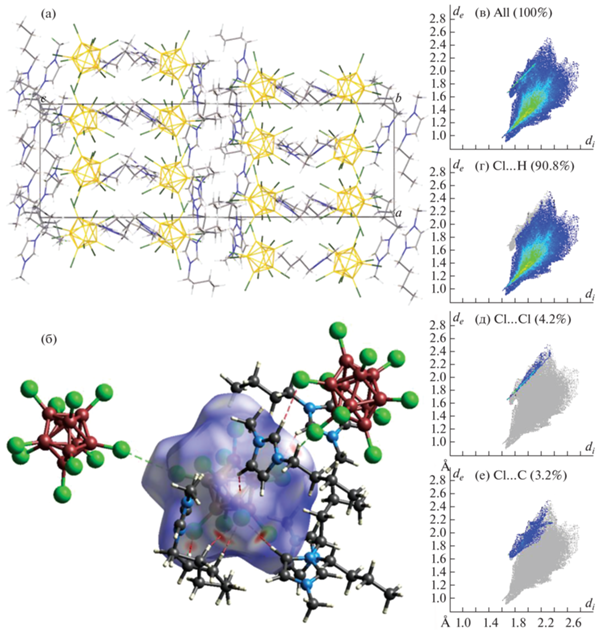
Рентгеноструктурный анализ и анализ поверхности Хиршфельда. Моноклинная элементарная ячейка (P21/c) соли 2 содержит четыре катиона (EMIM)+, два аниона [B10Cl10]2– и молекулу ацетонитрила (рис. 2). Один из катионов разупорядочен по двум позициям с заселенностями 0.5 : 0.5. Этильная группа второго катиона разупорядочена с заселенностями 0.512 : 0.488. Додекахлор-клозо-додекаборатный анион образует слабые контакты Cl…Cl с соседними анионами (расстояния Cl–Cl лежат в диапазоне 3.246–3.420 Å) и контакты H…Cl с катионами имидазолия.
В кристалле соли 2 образуются катионно-анионные слои, параллельные плоскости ab. Анионы в слое связаны слабыми взаимодействиями Cl…Cl, которые показаны на поверхности Хиршфельда аниона в виде красных пятен и пунктирных зеленых линий на рис. 2а. На 2D-развертке поверхности Хиршфельда аниона контакты Cl…Cl представлены в виде острого зубца с наименьшими значениями de и di, равными 1.6 Å. На данный тип взаимодействий приходится 6% поверхности Хиршфельда аниона, в то время как наибольший процент взаимодействий (85.2%) приходится на контакты Cl…H, на контакты Cl…C приходится 5.4% взаимодействий, а на контакты Cl…N – 3.3% (рис. 3).
Рис. 3.
Фрагмент кристаллической упаковки (а), dnorm поверхность Хиршфельда комплекса аниона [B10Cl10]2– в соли 2 (б), 2D-развертка поверхности Хиршфельда аниона (в) и границы контактов Cl…H (г), Cl…Cl (д) и Cl…C (е).
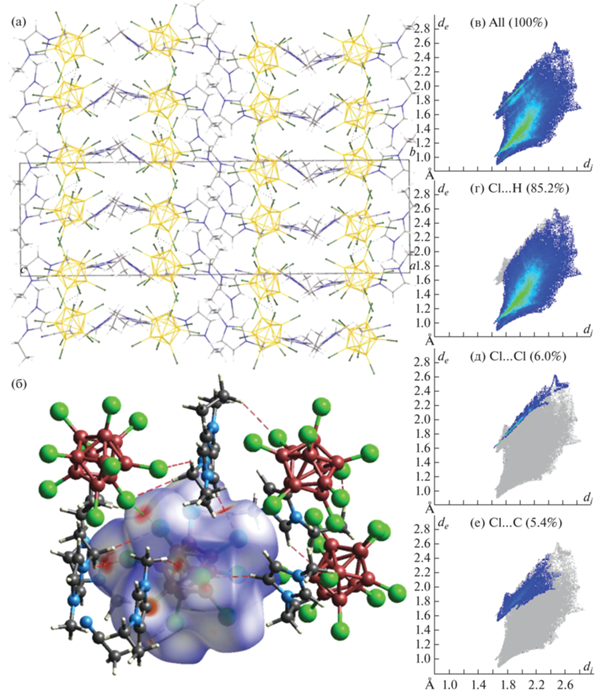
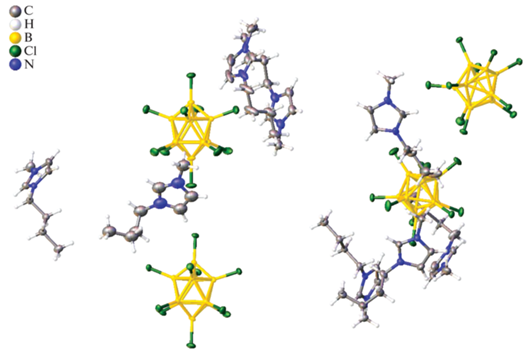
Кристаллографически независимая часть триклинной элементарной ячейки (P-1) соли 3 содержит четыре независимых аниона [B10Cl10]2– и восемь катионов (BMIM)+, один из которых разупорядочен по двум позициям с заселенностями 0.5 : 0.5, а бутильная группа второго разупорядочена по двум позициям (рис. 4). Как и в описанном выше соединении, в соли 3 анионы связаны слабыми взаимодействиями Cl…Cl, расстояния Cl…Cl лежат в диапазоне 3.306–3.623 Å.
Аналогично соли 2 при упаковке в соли 3 образуются катионно-анионные слои, параллельные плоскости ab (рис. 4а). Анионы образуют цепочки, связанные контактами Cl…Cl, вдоль оси a, которые представлены на поверхности Хиршфельда аниона в виде красных пятен и показаны пунктирными зелеными линиями. Среднее значение de и di немного больше, чем в соли 2, и составляет 1.65 Å, на контакты Cl…Cl также приходится меньший процент поверхности аниона (4.2%), в то время как на контакты Cl…H – 90.8%, что на 5.6% больше, чем в соли 2. На контакты Cl…C приходится 3.2% поверхности Хиршфельда аниона (рис. 5).
ЗАКЛЮЧЕНИЕ
Предложен новый простой способ получения имидазолиевых солей декахлор-клозо-декаборатного аниона (RMIM)2[B10Cl10] (R = H, n-Et, n-Bu, n-C8H17). Исследование некоторых полученных целевых соединений с помощью рентгеноструктурного анализа для соединений 2 и 3 показало, что в элементарной ячейке наблюдается наличие нескольких анионов и катионов, обусловленное стерической затрудненностью ионов в структуре, что в результате приводит к снижению способности этих соединений к кристаллизации. Это, в свою очередь, говорит об уменьшении межмолекулярных взаимодействий и приводит к снижению температуры плавления данных соединений. Изучение полученных кристаллических упаковок с помощью анализа поверхности Хиршфельда для аниона [B10Cl10]2– показало, что наблюдается наличие слабых межмолекулярных взаимодействий между анионами и катионами, которые образованы контактами Cl…Сl, Cl…H, Cl…С, Cl…N.
Список литературы
Krossing I., Raabe I. // Angew. Chem. Int. Ed. 2004. V. 43. № 16. P. 2066. https://doi.org/10.1002/anie.200300620
Kessler M., Knapp C., Sagawe V. et al. // Inorg. Chem. 2010. V. 49. № 11. P. 5223. https://doi.org/10.1021/ic100337k
Kim K.C., Reed C.A., Long G.S. et al. // J. Am. Chem. Soc. 2002. V. 124. № 26. P. 7662. https://doi.org/10.1021/ja0259990
Knapp C. // Compr. Inorg. Chem. II. 2013. V. 1. P. 651. https://doi.org/10.1016/B978-0-08-097774-4.00125-X
Zhu Y., Hosmane N.S. // Eur. J. Inorg. Chem. 2017. V. 2017. № 38. P. 4369. https://doi.org/10.1002/ejic.201700553
Martínez-Palou R. // Mol. Divers. 2010. V. 14. № 1. P. 3. https://doi.org/10.1007/s11030-009-9159-3
El Abedin S.Z., Pölleth M., Meiss S.A. et al. // Green Chem. 2007. V. 9. № 6. P. 549. https://doi.org/10.1039/b614520e
Zhao D., Liao Y., Zhang Z.D. // Clean – Soil, Air, Water. 2007. V. 35. № 1. P. 42. https://doi.org/10.1002/clen.200600015
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystal. 2016. V. 6. № 5. P. 60. https://doi.org/10.3390/cryst6050060
Golubev A.V., Kubasov A.S., Turyshev E.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1333. https://doi.org/10.1134/S0036023620090041
Zhizhin K.Y., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Ivanov S.V., Davis J.A., Miller S.M. et al. // Inorg. Chem. 2003. V. 42. № 15. P. 4489. https://doi.org/10.1021/ic0344160
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Avdeeva V.V., Malinina E.A., Zhizhin K.Y. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 8. P. 519. https://doi.org/10.1134/S1070328421080017
Stogniy M.Y., Bogdanova E.V., Anufriev S.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 10. P. 1537. https://doi.org/10.1134/S0036023622600848
Avdeeva V.V., Garaev T.M., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 1. P. 28. https://doi.org/10.1134/S0036023622010028
Avdeeva V.V., Kubasov A.S., Korolenko S.E. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 5. P. 628. https://doi.org/10.1134/S0036023622050023
Sivaev I.B. // Chem. Heterocycl. Compd. 2017. V. 53. № 6–7. P. 638. https://doi.org/10.1007/s10593-017-2106-9
Green M.D., Long T.E. // Polym. Rev. 2009. V. 49. № 4. P. 291. https://doi.org/10.1080/15583720903288914
Markiewicz R., Klimaszyk A., Jarek M. et al. // Int. J. Mol. Sci. 2021. V. 22. № 11. P. 5935. https://doi.org/10.3390/ijms22115935
Pádua A.A.H., Costa Gomes M.F., Canongia Lopes J.N.A. // Acc. Chem. Res. 2007. V. 40. № 11. P. 1087. https://doi.org/10.1021/ar700050q
Kravchenko E.A., Gippius A.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 546. https://doi.org/10.1134/S0036023620040105
Jiao N., Zhang Y., Liu L. et al. // J. Mater. Chem. A. 2017. V. 5. № 26. P. 13341. https://doi.org/10.1039/c7ta04038e
Nieuwenhuyzen M., Seddon K.R., Teixidor F. et al. // Inorg. Chem. 2009. V. 48. № 3. P. 889. https://doi.org/10.1021/ic801448w
Belletire J.L., Schneider S., Shackelford S.A. et al. // J. Fluor. Chem. 2011. V. 132. № 11. P. 925. https://doi.org/10.1016/j.jfluchem.2011.07.009
Zhou N., Zhao G., Dong K. et al. // RSC Adv. 2012. V. 2. № 26. P. 9830. https://doi.org/10.1039/c2ra21700g
Golub I.E., Filippov O.A., Belkova N.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 11. P. 1639. https://doi.org/10.1134/S0036023621110073
Larsen A.S., Holbrey J.D., Tham F.S. et al. // J. Am. Chem. Soc. 2000. V. 122. № 30. P. 7264. https://doi.org/10.1021/ja0007511
Kravchenko E.A., Gippius A.A., Zhurenko S.V. et al. // Polyhedron. 2021. V. 210. P. 115514. https://doi.org/10.1016/j.poly.2021.115514
Golubev A.V., Kubasov A.S., Bykov A.Y. et al. // Inorg. Chem. 2021. V. 60. № 12. P. 8592. https://doi.org/10.1021/acs.inorgchem.1c00516
Matveev E.Y., Kubasov A.S., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 7. P. 776. https://doi.org/10.1134/S0036023615070104
Matveev E.Y., Levitskaya V.Y., Novikov S.S. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 12. P. 1928. https://doi.org/10.1134/S0036023622601532
Burdenkova A.V., Zhdanov A.P., Klyukin I.N. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 11. P. 1616. https://doi.org/10.1134/S0036023621110036
Justus E., Rischka K., Wishart J.F. et al. // Chem. – A Eur. J. 2008. V. 14. № 6. P. 1918. https://doi.org/10.1002/chem.200701427
Kravchenko E.A., Gippius A.A., Vologzhanina A.V. et al. // Polyhedron. 2016. V. 117. P. 561. https://doi.org/10.1016/j.poly.2016.06.016
SAINT, Bruker AXS Inc.: Madison (WI), USA 2018
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Crystallogr. 2015. V. 48. № 1. P. 3. https://doi.org/10.1107/S1600576714022985
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. № Md. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339. https://doi.org/10.1107/S0021889808042726
Spackman P.R., Turner M.J., McKinnon J.J. et al. // J. Appl. Crystallogr. 2021. V. 54. P. 1006. https://doi.org/10.1107/S1600576721002910
Dharaskar S.A., Varma M.N., Shende D.Z. et al. // Sci. World J. 2013. V. 2013. № 395274. P. 1. https://doi.org/10.1155/2013/395274
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии