Журнал неорганической химии, 2023, T. 68, № 7, стр. 988-996
Термические превращения пористого анодного оксида алюминия, сформированного в электролитах на основе смесей серной и щавелевой кислот
И. В. Росляков a, b, *, И. В. Колесник b, М. А. Белокозенко b, А. Д. Япрынцев a, К. С. Напольский b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: ilya.roslyakov@gmail.com
Поступила в редакцию 01.12.2022
После доработки 06.02.2023
Принята к публикации 15.02.2023
- EDN: RHMFAB
- DOI: 10.31857/S0044457X22602061
Аннотация
Анодирование алюминия в электролитах на основе смесей нескольких кислот открывает возможность формирования пористых пленок анодного оксида алюминия (АОА) с контролируемым в широком интервале периодом структуры. Отдельной задачей является исследование термических превращений пленок АОА, полученных в смешанных электролитах, так как сложный химический состав материала может приводить к особенностям при последующем отжиге. Установлено, что в составе АОА, сформированного анодированием алюминия в электролитах на основе смесей серной и щавелевой кислот, присутствуют примесные оксалат- и сульфат-анионы. При этом массовая доля сульфатов оказывается примерно на порядок больше, чем оксалатов, и увеличивается с ростом соотношения концентраций серной и щавелевой кислот в используемом электролите. Аналогично с ростом соотношения концентраций серной и щавелевой кислот увеличивается температура кристаллизации аморфного АОА в смесь низкотемпературных полиморфных модификаций Al2O3. Таким образом, соотношение компонентов в используемом смешанном электролите оказывает влияние на состав и термические превращения АОА.
ВВЕДЕНИЕ
Анодное окисление алюминия в электролитах на основе растворов кислот приводит к формированию на поверхности металла пористых пленок анодного оксида алюминия (АОА). Структуру АОА можно представить в виде набора непересекающихся цилиндрических каналов, которые расположены перпендикулярно поверхности пленки. В зависимости от выбранных условий анодирования (состав и концентрация электролита, приложенное напряжение, температура и продолжительность процесса) параметры пористой структуры можно контролируемо изменять в широких пределах [1]. Уникальная структура в сочетании с простотой получения материала предопределили широкое использование АОА в различных областях науки и техники. Кроме декоративного и антикоррозионного применения АОА используют для создания мембран [2–4], матриц для синтеза анизотропных наноструктур [5–7], планарных устройств [8–10], оптических фильтров [11–13].
Уникальной особенностью АОА является возможность формирования пространственно упорядоченных структур с гексагональной упаковкой пор в плоскости пленки. Отметим, что для выбранного состава электролита подобная морфология наблюдается лишь в узком интервале напряжений анодирования [14, 15]. Данный факт значительно сужает диапазон доступных периодов структуры и диаметров пор в случае высоких требований к пространственному упорядочению системы каналов и, соответственно, ограничивает практическое применение АОА. Необходимо отметить, что в ряде случаев качество упаковки пор оказывает решающее влияние на функциональные характеристики материала [16, 17]. Таким образом, поиск условий анодирования, приводящих к формированию пространственно упорядоченной пористой структуры с ранее недоступным периодом (диаметром пор), является актуальной задачей.
Как правило, анодирование алюминия проводят в электролитах на основе растворов индивидуальных кислот. Среди наиболее распространенных следует отметить серную [18], щавелевую [19], селеновую [20], фосфористую [21] и ортофосфорную [22] кислоты, для каждой из которых эмпирически найдены узкие диапазоны напряжений, приводящие к формированию АОА с упорядоченной пористой структурой. В то же время электролиты на основе смесей нескольких кислот открывают перспективы формирования АОА с гексагональной упаковкой пор в широком интервале напряжений анодирования и, как следствие, возможность тонко настраивать период структуры (диаметр пор) при сохранении высокой степени упорядочения пор [23–25]. Отдельной задачей является исследование термических превращений АОА, полученного в смешанных электролитах. В данном случае материал имеет сложный химический состав из-за одновременного присутствия примесей анионов нескольких кислот. Это может приводить к особенностям при последующей термической обработке, широко используемой для повышения химической стабильности и увеличения удельной площади поверхности АОА [26, 27]. Отметим, что предварительная термическая обработка является необходимой стадией для создания на основе АОА газовых сенсоров [9], твердооксидных топливных элементов [28] и носителей катализаторов [29].
В настоящей работе изучены пористые пленки АОА, сформированные анодированием алюминия в электролитах на основе смесей серной и щавелевой кислот. Поведения АОА исследовано в широком диапазоне температур с использованием различных инструментальных методов: растровой электронной микроскопии, рентгеноспектрального, термогравиметрического, дифференциального термического и рентгенофазового анализа, инфракрасной (ИК) спектроскопии. Установлены состав и кристаллическая структура материала на различных этапах термической обработки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного материала использовали алюминиевую фольгу высокой чистоты (99.99%) толщиной 100 мкм. На предварительном этапе выполняли электрохимическую полировку алюминия для очистки и уменьшения шероховатости его поверхности [30].
Анодное окисление алюминия проводили в двухэлектродной электрохимической ячейке, в которой подвергаемая анодированию область алюминиевой фольги была ограничена резиновым кольцом с диаметром 3.2 см. Катодом выступало алюминиевое кольцо сопоставимого размера, расположенное на расстоянии 8 см от анода. В качестве электролита использовали водные растворы смесей серной (H2SO4) и щавелевой (H2C2O4) кислот с различной концентрацией компонентов: 0.3 M H2SO4 + 0.1 M H2C2O4; 0.3 M H2SO4 + 0.3 M H2C2O4; 0.1 M H2SO4 + 0.3 M H2C2O4 (ниже обозначены как 3S1O, 3S3O и 1S3O соответственно). В процессе анодирования электролит термостатировали при 1°C и интенсивно перемешивали. Продолжительность процесса контролировали кулонометрически: анодирование прекращали, когда плотность заряда достигала 100 Кл/см2 (соответствует толщине АОА ⁓50 мкм).
Для получения АОА в свободном состоянии оставшийся алюминий селективно растворяли в смеси брома и метанола, взятых в соотношении 1 : 10 по объему.
Термическую обработку АОА проводили в печи Nabertherm L5/12 на воздухе со скоростью нагрева 5 град/мин до температуры 1000°C с последующей закалкой. Пористые пленки располагали между двумя корундовыми пластинами для предотвращения механических деформаций.
Для исследования кинетики анодирования в каждом из используемых электролитов применяли метод линейной вольтамперометрии (ЛВА). Напряжение линейно увеличивали с помощью источника постоянного тока Agilent N5751А со скоростью 100 мВ/с с шагом 50 мВ. Протекающий ток регистрировали при помощи мультиметра Tektronix DMM4020.
Растровую электронную микроскопию (РЭМ) и рентгеноспектральный микроанализ (РСМА) проводили на микроскопе Carl Zeiss NVision 40, оснащенном детектором Oxford Instruments X-Max 80. Предварительно на поверхность АОА наносили слой хрома толщиной 5 нм с помощью установки магнетронного напыления Quorum Technologies Q150T ES. Обработку РЭМ-изображений для вычисления геометрических параметров пористой структуры производили в программах ImageJ [31] и Statistics2D [32]. Долю пор в гексагональном окружении определяли по алгоритму Вороного с использованием программы Statistics2D [32].
Термогравиметрический (ТГ) и дифференциальный термический анализ (ДТА) с масс-спектрометрией отходящих газов проводили при скоростях нагрева 5, 20 и 50 град/мин на термоанализаторе Netzsch STA 409 PC Luxx, совмещенном с квадрупольным масс-спектрометром Netzch QMS 403C Aëolos. Измерения осуществляли в динамической воздушной атмосфере при скорости потока 50 мл/мин. Масса навески составляла ⁓10 мг.
Рентгенофазовый анализ (РФА) проводили на дифрактометре Bruker D8 Advance, используя CuKᾱ-излучение с длиной волны 1.5418 Å, в диапазоне углов 2θ от 30° до 50° c шагом сканирования 0.02°. Фазы идентифицировали с использованием базы данных ICDD PDF2.
Регистрацию ИК-спектров проводили на ИК-Фурье-спектрометре Perkin Elmer Spectrum Three в геометрии нарушенного полного внешнего отражения c использованием приставки Universal ATR Accessory (кристалл алмаз/KRS-5). Термический анализ, РФА и ИК-спектроскопию выполняли для пористых пленок АОА, перетертых в порошок в агатовой ступке.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Зависимости плотности тока от напряжения анодирования демонстрируют экспоненциальный рост в исследуемом диапазоне напряжений (рис. 1а). Подобное поведение согласуется с численной моделью транспорта ионов в барьерном диэлектрическом слое при приложении сильного электрического поля [33]. Согласно литературным данным [18], оптимальное напряжение для формирования гексагональной упаковки каналов при анодировании алюминия в 0.3 М серной кислоте составляет 25 В. Данное значение было использовано для получения АОА в электролитах 3S1O и 3S3O. В случае электролита 1S3O напряжение формирования АОА было увеличено до 30 В для сохранения плотности тока ⁓1.37 мА/см2, соответствующей напряжению 25 В в электролитах 3S1O и 3S3O по данным ЛВА (рис. 1а, табл. 1).
Рис. 1.
Электрохимические отклики, зарегистрированные в процессе анодирования алюминия в электролитах на основе смесей серной и щавелевой кислот. Линейная вольтамперометрия со скоростью развертки напряжения 100 мВ/с (а). Хроноамперограммы анодирования алюминия, зарегистрированные при постоянном напряжении (б) (показана только начальная стадия эксперимента).
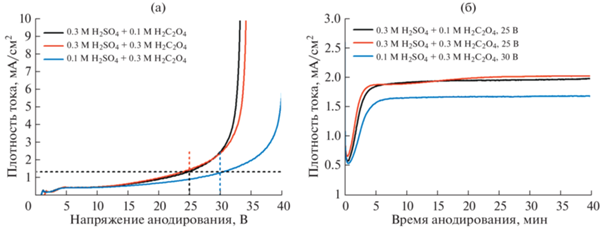
Таблица 1.
Условия анодирования алюминия в электролитах на основе смесей серной и щавелевой кислот и параметры структуры полученного АОА
| Параметр | 3S1O 0.3 M H2SO4 + 0.1 M H2C2O4 | 3S3O 0.3 M H2SO4 + 0.3 M H2C2O4 | 1S3O 0.1 M H2SO4 + 0.3 M H2C2O4 |
|---|---|---|---|
| U, В | 25 | 25 | 30 |
| jЛВА, мА/см | 1.37 | 1.47 | 1.28 |
| jсредн, мА/см | 2.02 ± 0.07 | 2.04 ± 0.06 | 1.69 ± 0.06 |
| Dint, нм | 64 ± 7 | 64 ± 9 | 77 ± 10 |
| Dp, нм | 20 ± 2 | 19 ± 3 | 24 ± 4 |
| Ψ, % | 44 | 46 | 39 |
Примечание. U – напряжение анодирования; jЛВА – плотность тока при напряжении анодирования по данным линейной вольтамперометрии; jсредн – средняя плотность тока за все время анодирования при постоянном напряжении; Dint – расстояние между соседними порами, Dp – диаметр пор, Ψ – доля пор в гексагональном окружении.
Хроноамперограммы анодирования алюминия в различных электролитах при постоянном напряжении представлены на рис. 1б. Резкое уменьшение плотности тока на начальной стадии вызвано увеличением толщины барьерного слоя АОА. В момент наблюдения минимума тока происходит зарождение пор, затем ток возрастает до стационарного значения, что соответствует установившемуся режиму роста пористой структуры. Подобное поведение характерно для формирования АОА при постоянном напряжении в порообразующих электролитах [34, 35]. Постоянство плотности тока через 5 мин после начала анодирования подтверждает кинетический контроль процесса при выбранных условиях, так как скорость электрохимической реакции оказывается независимой от толщины АОА [14, 15]. Иными словами, массоперенос в порах АОА от их основания к верхней поверхности оксидной пленки достаточно быстрый и не ограничивает скорость электрохимического окисления.
Морфология полученного АОА была изучена с помощью РЭМ (рис. 2) с последующей статистической обработкой изображений, позволившей рассчитать параметры пористой структуры (табл. 1). В качестве количественной характеристики степени упорядочения была рассчитана доля пор в гексагональном окружении. В полученных образцах она не превышает 46%. Для достижения большей степени порядка требуется последующая дополнительная оптимизация выбранного напряжения анодирования для каждого из используемых электролитов. Отметим, что расстояние между соседними порами пропорционально приложенному напряжению с коэффициентом ⁓2.55 нм/В, что хорошо согласуется с литературными данными для индивидуальных кислот [33]. Напротив, диаметр пор в нижней части пористого АОА (со стороны барьерного слоя) мало зависит от условий анодирования и составляет ⁓21 нм.
Рис. 2.
Изображения растровой электронной микроскопии для нижней стороны пористой пленки анодного оксида алюминия, полученной анодированием металла в различных условиях: 0.3 M H2SO4 + 0.1 M H2C2O4 при 25 В (а); 0.3 M H2SO4 + 0.3 M H2C2O4 при 25 В (б); 0.1 M H2SO4 + 0.3 M H2C2O4 при 30 В (в). Масштабная метка одинакова для всех изображений.

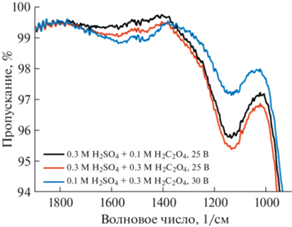
ИК-спектры АОА, полученного анодированием алюминия в различных электролитах, представлены на рис. 3. Уменьшение пропускания в низкоэнергетической области спектра ниже 1000 1/см соответствует колебаниям связей Al–O. Примесные анионы серной кислоты в составе АОА проявляются в виде широкой полосы при ~1150 1/см [36], интенсивность которой больше при анодировании алюминия в электролитах с большей концентрацией H2SO4 (S3O1 и S3O3). Двойной минимум пропускания в районе 1500 1/см соответствует симметричным и асимметричным колебаниям С2О$_{4}^{{2 - }}$ [37]. По аналогии с анионами серной кислоты, интенсивность данной полосы оказывается больше при использовании электролитов с большей концентрацией щавелевой кислоты (S3O3 и S1O3).
Рис. 3.
Данные ИК-спектроскопии для анодного оксида алюминия, полученного анодированием алюминия в электролитах на основе смесей серной и щавелевой кислот.
Термическая обработка АОА сопровождается несколькими стадиями потери массы (рис. 4а). На первой стадии (Δm1) в диапазоне температур ниже 800°С происходит удаление воды. Величина Δm1 практически не зависит от используемого электролита и составляет ⁓3.8 мас. % (табл. 2). Удаление воды происходит в несколько этапов. В диапазоне температур до ~300°С наблюдается удаление молекул H2O, сорбированных стенками пор АОА. Менее выраженное уменьшение массы при больших температурах вплоть до 800°С соответствует разложению гидроксидов и оксогидроксидов алюминия. Дополнительным подтверждением двойственной химической природы воды в структуре АОА являются два широких максимума на масс-спектрах (рис. 4б), соответствующие массовому числу 18 (H2O+).
Рис. 4.
Термические превращения анодного оксида алюминия, полученного анодированием алюминия в электролитах на основе смесей серной и щавелевой кислот: термогравиметрические кривые (скорость нагрева 5 град/мин) (а); масс-спектры продуктов разложения для АОА, полученного в электролите состава 0.3 M H2SO4 + 0.3 M H2C2O4 при 25 В (скорость нагрева 50 град/мин) (б); данные дифференциального термического анализа (скорость нагрева 5 град/мин) (в).
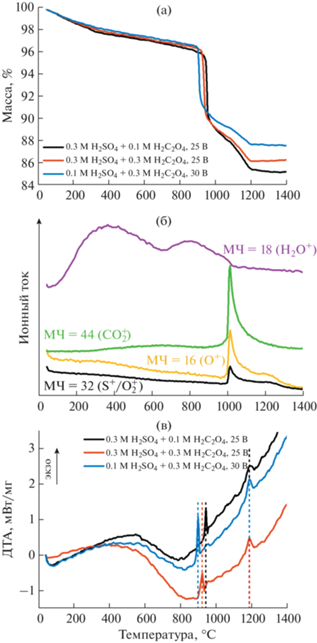
Таблица 2.
Результаты термогравиметрического и дифференциального термического анализа анодного оксида алюминия, полученного анодированием алюминия в электролитах на основе смесей серной и щавелевой кислот
| Параметр | 3S1O | 3S3O | 1S3O |
|---|---|---|---|
| Δm1, мас. % | 4.2 | 3.8 | 3.5 |
| Δm2, мас. % | 7.7 | 7.9 | 7.2 |
| Δm3, мас. % | 2.9 | 2.1 | 1.7 |
| Δmобщ, мас. % | 14.8 | 13.8 | 12.4 |
| Tγ, °C | 940 | 920 | 895 |
| Tα, °C | 1185 | 1185 | 1185 |
| ${{T}_{{\Delta {{m}_{2}}}}},$ °C | 945 | 930 | 900 |
Примечание. Δm1–3 – потеря массы на различных стадиях термического разложения (см. обозначения в тексте); Δmобщ – общая потеря массы при отжиге до 1400°C; Tγ – температура кристаллизации в смесь низкотемпературных полиморфных модификаций Al2O3; Tα – температура кристаллизации в фазу корунда (α-Al2O3); TΔm2 – температура основной стадии потери массы при 900°C (Δm2).
Резкая потеря массы при температуре ⁓900°C (Δm2) сопровождается максимумом ионного тока на масс-спектрах для массовых чисел 16 (O+), 32 (S+/О$_{2}^{ + }$) и 44 (CO$_{2}^{ + }$) (рис. 4б). Этот набор соответствует характерным продуктам термического разложения анионов щавелевой и серной кислот, которые внедряются в структуру АОА в процессе анодирования. Потеря массы на данной стадии мало зависит от используемого электролита и составляет ⁓7.6 мас. % (табл. 2). В указанном диапазоне температур также виден резкий экзотермический максимум на кривых ДТА (рис. 4в), который, согласно литературным данным для индивидуальных электролитов, соответствует кристаллизации исходного аморфного материала в смесь низкотемпературных полиморфных модификаций Al2O3 (в основном γ-Al2O3) [38–40].
Потеря массы на третьей стадии удаления примесей (Δm3) в диапазоне от 900 до 1200°С, напротив, в значительной степени определяется соотношением кислот в используемом электролите. В частности, относительное уменьшение Δm3 составляет более 50% при переходе от 3S1O к 1S3O. Это может свидетельствовать о том, что на данной стадии преимущественно разлагаются примесные анионы серной кислоты, тогда как анионы щавелевой кислоты менее устойчивы при нагреве и их удаление из структуры АОА в основном соответствует Δm2. Аналогичные выводы можно сделать на основе сопоставления литературных данных по термическому поведению АОА, полученного в индивидуальных электролитах. Расчеты показывают, что отношение Δm2/(Δm2 + Δm3) составляет ⁓90% для щавелевокислого АОА [39] и стремится к 60% для сернокислого материала [40].
После второго фазового перехода при температуре ⁓1200°С, который, согласно литературным данным для индивидуальных электролитов, соответствует кристаллизации в фазу корунда [38–40], дальнейшей потери массы не наблюдается. Это свидетельствует о формировании при данной температуре стехиометрического оксида алюминия, не содержащего в составе примесей электролита.
Рассмотрим зависимости характерных температур термических превращений АОА, полученного в различных электролитах (табл. 2). Отчетливо видно, что температура первого фазового перехода (Tγ) уменьшается с увеличением концентрации щавелевой кислоты в электролите. Аналогичную зависимость демонстрирует положение основной стадии потери массы на шкале температур (${{T}_{{\Delta {{m}_{2}}}}}$). Это позволяет предположить, что рост массовой доли сульфатов как анионов, более устойчивых при высоких температурах по сравнению с оксалатами, увеличивает термическую стабильность АОА. Напротив, к моменту достижения температуры второго фазового перехода (Tα) примеси в составе АОА практически отсутствуют. Это приводит к тому, что Tα почти не зависит от состава используемого электролита. Указанные характерные температуры термических превращений (Tγ и ${{T}_{{\Delta {{m}_{2}}}}}$) для АОА, полученного в индивидуальных электролитах, также оказываются выше в случае применения сернокислого электролита, чем при использовании раствора щавелевой кислоты [38–40].
Для количественного определения соотношения сульфат- и оксалат-анионов в составе АОА данные ТГ дополнены результатами РСМА. Это позволило с помощью независимого метода установить соотношение серы и алюминия в исследованном материале. Массовую долю оксалат-анионов принимали равной разнице между потерей массы (по данным ТГ) в диапазоне температур от 800 до 1400°С (Δm2 + Δm3) и массовой долей сульфат-анионов, рассчитанной из РСМА. Полученные массовые доли примесей различного состава представлены в табл. 3.
Таблица 3.
Химический состав анодного оксида алюминия, полученного анодированием алюминия в электролитах на основе смесей серной и щавелевой кислот, для исходного материала и после отжига при 1000°C с закалкой (скорость нагрева 5 град/мин). Расчеты проведены на основе данных ТГ и РСМА
| Параметр | 3S1O | 3S3O | 1S3O |
|---|---|---|---|
| Исходный материал | |||
| H2O + OH−, мас. % | 4.2 | 3.8 | 3.5 |
| C2O$_{4}^{{2 - }},$ мас. % | 0.6 | 1.2 | 1.4 |
| SO$_{4}^{{2 - }},$ мас. % | 10.0 | 8.8 | 7.5 |
| Al2O3, мас. % | 85.2 | 86.2 | 87.6 |
| После отжига при 1000°C | |||
| H2O + OH−, мас. % | 1.9 | 1.7 | 2.0 |
| C2O$_{4}^{{2 - }},$ мас. % | 0.0 | 0.0 | 0.0 |
| SO$_{4}^{{2 - }},$ мас. % | 3.0 | 2.4 | 1.8 |
| Al2O3, мас. % | 95.1 | 95.9 | 96.2 |
В среднем по трем используемым электролитам массовая доля анионов серной кислоты (~9 мас. %) практически на порядок превышает содержание оксалат-анионов (~1 мас. %). Это может быть следствием большей равновесной концентрации анионов серной кислоты по сравнению с анионами щавелевой кислоты для всех используемых электролитов из-за значительно большей степени диссоциации серной кислоты по сравнению с щавелевой (для серной кислоты pKa1 < 0, pKa2 = 1.99; для щавелевой кислоты pKa1 = 1.25, pKa2 = 3.81 [41]). При этом массовая доля сульфатов в составе АОА увеличивается с увеличением соотношения концентраций серной/щавелевой кислот в электролите. Аналогичное утверждение справедливо и для оксалат-анионов, массовая доля которых увеличивается с ростом соотношения концентраций щавелевой/серной кислот в электролите.
Для уточнения химического состава АОА после основной стадии потери массы при 900°С (Δm2) был проведен отжиг материала при 1000°C со скоростью нагрева 5 град/мин с последующей закалкой. Полученные пористые пленки исследованы с помощью ТГ, РСМА, РФА и ИК-Фурье-спектроскопии. Данные ТГ демонстрируют две стадии потери массы (рис. 5а). Вплоть до 500°C наблюдается удаление примесей, адсорбированных высокоразвитой поверхностью материала в процессе хранения на воздухе. Отметим, что для АОА характерно значительное увеличение площади поверхности вследствие кристаллизации материала в смесь низкотемпературных полиморфных модификаций Al2O3 (в основном γ-Al2O3) при температуре ~900°C (рис. 5б) [39, 42].
Рис. 5.
Термическое поведение, структура и состав АОА после отжига при 1000°C с закалкой (скорость нагрева 5 град/мин): термогравиметрия (скорость нагрева 20 град/мин) (а), рентгенофазовый анализ (б) и ИК-Фурье-спектроскопия (в).
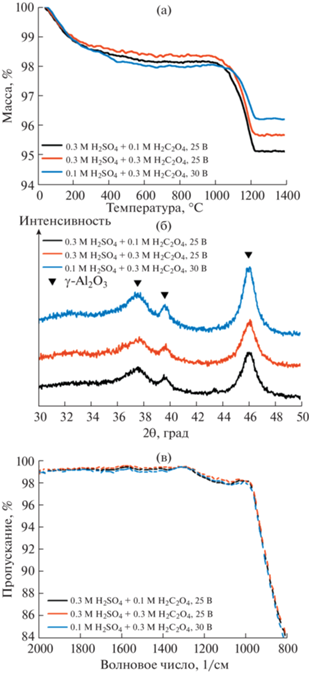
В диапазоне температур от 1000 до 1200°C наблюдается плавная потеря массы, которая в количественном выражении хорошо согласуется с потерей массы на стадии Δm3 для исходного материала (табл. 2). Отметим, что потеря массы на данной стадии согласуется в пределах погрешности с массовой долей сульфат-анионов, рассчитанной из соотношения серы и алюминия по данным РСМА. Таким образом, в составе АОА после отжига при 1000°C отсутствуют оксалат-анионы (табл. 3). Это подтверждает, что примеси щавелевой кислоты полностью удаляются на стадии Δm2 при 900°C. На ИК-спектрах АОА после отжига при 1000°C заметны слабые минимумы пропускания при ~1150 1/см, которые соответствуют остаточному содержанию сульфат-анионов (рис. 5в).
ЗАКЛЮЧЕНИЕ
Анодирование алюминия в электролитах на основе смесей серной и щавелевой кислот приводит к формированию пористых оксидных пленок. По данным РЭМ, расстояние между соседними порами пропорционально приложенному напряжению с коэффициентом 2.56 нм/В, тогда как диаметр пор в нижней части АОА мало зависит от условий анодирования и составляет ⁓21 нм.
В составе пористых пленок, полученных в смешанных электролитах, присутствует сорбированная и химически связанная вода, массовая доля которой (⁓3.8 мас. %) практически не зависит от используемого электролита. Массовые доли примесных анионов серной и щавелевой кислот в составе АОА экспериментально определены с помощью термогравиметрии и рентгеноспектрального микроанализа и составляют в среднем 8.8 и 1.2%, соответственно. Увеличение концентрации серной кислоты в электролите приводит к увеличению массовой доли сульфатов в материале, которые за счет большей устойчивости при высоких температурах по сравнению с оксалатами увеличивают термическую стабильность АОА (в частности, температуру кристаллизации исходно аморфного АОА в смесь низкотемпературных полиморфных модификаций Al2O3). Отметим, что сульфаты присутствуют в составе АОА вплоть до кристаллизации материала в фазу корунда при ~1200°C, тогда как оксалаты менее термически устойчивы и полностью разлагаются при температуре ⁓1000°C.
Список литературы
Domagalski J.T., Xifre-Perez E., Marsal L.F. // Nanomaterials. 2021. V. 11. P. 430. https://doi.org/10.3390/nano11020430
Petukhov D.I., Chernova E.A., Kapitanova O.O. et al. // J. Membr. Sci. 2019. V. 577. P. 184. https://doi.org/10.1016/j.memsci.2019.01.041
Roslyakov I.V., Petukhov D.I., Napolskii K.S. // Nanotechnology. 2021. V. 32. P. 33LT01. https://doi.org/10.1088/1361-6528/abfeea
Petukhov D.I., Kan A.S., Chumakov A.P. et al. // J. Membr. Sci. 2021. V. 621. P. 118994. https://doi.org/10.1016/j.memsci.2020.118994
Valeev R., Romanov E., Beltukov A. et al. // Phys. Status Solidi C. 2012. V. 9. P. 1462. https://doi.org/10.1002/pssc.201100677
Gordeeva E.O., Roslyakov I.V., Leontiev A.P. et al. // Beilstein J. Nanotechnology. 2021. V. 12. P. 957. https://doi.org/doi:10.3762/bjnano.12.72
Ryzhkov I.I., Kharchenko I.A., Mikhlina E.V. et al. // Int. J. Heat Mass Transfer. 2021. V. 176. P. 121414. https://doi.org/10.1016/j.ijheatmasstransfer.2021.121414
Lee Y.H., Chang I., Cho G.Y. et al. // Int. J. Precision Engineering Manufacturing-Green Technology. 2018. V. 5. P. 441. https://doi.org/10.1007/s40684-018-0047-0
Roslyakov I.V., Kolesnik I.V., Evdokimov P.V. et al. // Sens. Actuators, B. 2021. V. 330. P. 129307. https://doi.org/10.1016/j.snb.2020.129307
Kalinin I.A., Roslyakov I.V., Tsymbarenko D.M. et al. // Sens. Actuators, A. 2021. V. 317. P. 112457. https://doi.org/10.1016/j.sna.2020.112457
Santos A. // J. Mater. Chem. C 2017. V. 5. P. 5581. https://doi.org/10.1039/C6TC05555A
Szwachta G., Bialek E., Wlodarski M. et al. // Nanotechnology. 2022. V. 33. P. 455707. https://doi.org/10.1088/1361-6528/ac83ca
Sadykov A.I., Kushnir S.E., Roslyakov I.V. et al. // Electrochem. Commun. 2019. V. 100. P. 104. https://doi.org/10.1016/j.elecom.2019.01.027
Roslyakov I.V., Gordeeva E.O., Napolskii K.S. // Electrochim. Acta. 2017. V. 241. P. 362. https://doi.org/10.1016/j.electacta.2017.04.140
Gordeeva E.O., Roslyakov I.V., Napolskii K.S. // Electrochim. Acta. 2019. V. 307. P. 13. https://doi.org/10.1016/j.electacta.2019.03.098
Petukhov D.I., Napolskii K.S., Berekchiyan M.V. et al. // ACS Appl. Mater. Interfaces. 2013. V. 5. P. 7819. https://doi.org/10.1021/am401585q
Noyan A.A., Leontiev A.P., Yakovlev M.V. et al. // Electrochim. Acta. 2017. V. 226. P. 60. https://doi.org/10.1016/j.electacta.2016.12.142
Masuda H., Hasegwa F., Ono S. // J. Electrochem. Soc. 1997. V. 144. P. L127. https://doi.org/10.1149/1.1837634
Masuda H., Fukuda K. // Science. 1995. V. 268. P. 1466. https://doi.org/10.1126/science.268.5216.1466
Nishinaga O., Kikuchi T., Natsui S. et al. // Sci. Rep. 2013. V. 3. P. 2748. https://doi.org/10.1038/srep02748
Akiya S., Kikuchi T., Natsui S. et al. // Electrochim. Acta. 2016. V. 190. P. 471. https://doi.org/10.1016/j.electacta.2015.12.162
Masuda H., Yada K., Osaka A. // Jpn. J. Appl. Phys. Lett. 1998. V. 37. P. L1340. https://doi.org/10.1143/JJAP.37.L1340
Almasi Kashi M., Ramazani A., Noormohammadi M. et al. // J. Phys. D: Appl. Phys. 2007. V. 40. P. 7032. https://doi.org/10.1088/0022-3727/40/22/025
Almasi Kashi M., Ramazani A., Mayamai Y. et al. // Jpn. J. Appl. Phys. 2010. V. 49. P. 015202–1. https://doi.org/10.1143/JJAP.49.015202
Xu Y.F., Liu H., Li X.J. et al. // Mater. Lett. 2015. V. 151. P. 79. https://doi.org/10.1016/j.matlet.2015.03.049
Mardilovich P.P., Govyadinoy A.N., Mazurenko N.I. et al. // J. Membr. Sci. 1995. V. 98. P. 143. https://doi.org/10.1016/0376-7388(94)00185-2
Ширин Н.А., Росляков И.В., Берекчиян М.В. и др. // Журн. неорган. химии. 2013. Т. 67. № 6. С. 868.
Lee Y.H., Ren H., Wu E.A. et al. // Nano Lett. 2020. V. 20. P. 2943. https://doi.org/10.1021/acs.nanolett.9b02344
Kousar R., Kim S.H., Byun J.Y. // J. King Saud University - Engineer. Sci. 2021.https://doi.org/10.1016/j.jksues.2021.09.003
Гордеева Е.О., Росляков И.В., Садыков А.И. и др. // Электрохимия. 2018. Т. 54. № 11. С. 999.
Schneider C.A., Rasband W.S., Eliceiri K.W. // Nat. Methods. 2012. V. 9. P. 671. https://doi.org/10.1038/nmeth.2089
Программы для анализа упорядочения пор в анодном оксиде алюминия. http://www.eng.fnm.msu.ru/software/
Lee W., Park S.J. // Chem. Rev. 2014. V. 114. P. 7487. https://doi.org/10.1021/cr500002z
Parkhutik V.P. // J. Phys. D: Appl. Phys. 1992. V. 25. P. 1258. https://doi.org/10.1088/0022-3727/25/8/017
Kim M., Kim H., Bae C. et al. // J. Phys. Chem. C. 2014. V. 118. P. 26789. https://doi.org/10.1021/jp507576c
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений / Пер. с англ. под ред. Пентина Ю.А. М.: Мир, 1991.
Vrublevsky I., Chernyakova K., Ispas A. et al. // J. Lumin. 2011. V. 131. P. 938. https://doi.org/10.1016/j.jlumin.2010.12.027
Mata-Zamora M.E., Saniger J.M. // Revista Mexicana de Fisica. 2005. V. 51. P. 502.
Roslyakov I.V., Kolesnik I.V., Levin E.E. et al. // Surf. Coat. Technol. 2020. V. 381. P. 125159. https://doi.org/10.1016/j.surfcoat.2019.125159
Roslyakov I.V., Shirin N.A., Berekchiian M.V. et al. // Microporous Mesoporous Mater. 2020. V. 294. P. 109840. https://doi.org/10.1016/j.micromeso.2019.109840
Lide D.R. CRC Handbook of Chemistry and Physics, 84th ed. CRC Press (2003).
Mardilovich P.P., Govyadinov A.N., Mukhurov N.I. et al. // J. Membr. Sci. 1995. V. 98. P. 131. https://doi.org/10.1016/0376-7388(94)00184-Z
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


