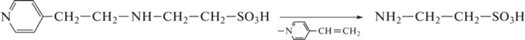Журнал неорганической химии, 2023, T. 68, № 8, стр. 1059-1065
Протолитические и комплексообразующие свойства изомерных N‑(пиридилэтил)тауринов
Г. П. Жарков a, *, О. В. Филимонова a, Ю. С. Петрова a, Е. О. Землякова b, А. В. Пестов a, b, Л. К. Неудачина a
a Уральский федеральный университет им. первого Президента России
Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
b Институт органического синтеза им. И.Я. Постовского УрО РАН
620990 Екатеринбург,
ул. Академическая, 20, Россия
* E-mail: gennady.zharkov@mail.ru
Поступила в редакцию 15.12.2022
После доработки 03.04.2023
Принята к публикации 04.04.2023
- EDN: MKWMIP
- DOI: 10.31857/S0044457X22602218
Аннотация
Синтезированы новые N-производные таурина – N‑[2‑(2‑пиридил)этил]таурин (HL1) и N‑[2‑(4‑пиридил)этил]таурин (HL2). Методом алкалиметрического титрования водных растворов с pH‑потенциометрической индикацией при I = 0.1 моль/л (KCl/KNO3) и t = 25 ± 1°C определены показатели констант кислотной диссоциации функциональных групп в составе реагентов (HL1: pKа0 = 3.80 ± 0.03, pKа1 = 8.67 ± 0.02; HL2: pKа0 = 4.80 ± 0.05, pKа1 = 8.18 ± 0.04). Установлено, что реагент НL1 более устойчив к процессу деструкции. Исследовано комплексообразование НL1 с ионами переходных и щелочноземельных металлов. Показано, что введение в структуру таурина 2‑(2‑пиридил)этильного заместителя приводит к значительному возрастанию устойчивости (Δ lg β ≥ 1) комплексов НL1 с ионами меди(II), кобальта(II), никеля(II), цинка(II), кадмия(II) и серебра(I). Комплексы ионов кальция(II), магния(II), стронция(II) и бария(II) с НL1 характеризуются незначительным приростом устойчивости (Δ lg β < 1) по сравнению с таурином. По полученным данным высказаны предположения о структуре исследуемых комплексов.
ВВЕДЕНИЕ
Важным направлением современной координационной химии является функционально ориентированный дизайн новых органических соединений. Данное направление нацелено на получение соединений, обладающих набором заранее заданных свойств, на реализацию такого строения (или структуры) искомого соединения, чтобы получить максимально возможный эффект для выполнения требуемой функции [1]. Это может быть такое важное свойство, как селективность – избирательное связывание конкретных ионов металлов в комплекс. Для эффективного использования группы методов QSAR [2] с целью количественного предсказания и описания связи структуры новых лигандов с их комплексообразующими свойствами необходимы два типа данных: первый тип данных должен содержать информацию о структуре новых реагентов, второй тип – информацию об их комплексообразующих свойствах. В этой связи необходим направленный синтез и идентификация новых лигандов с закономерно изменяющимся строением (путем введения в состав известных лигандов новых функциональных групп) и исследование их кислотно-основных и комплексообразующих свойств.
Рядом уникальных свойств характеризуется таурин – 2‑аминоэтансульфоновая кислота и ее производные, которые обладают высокой биологической активностью и используются в качестве компонентов лекарственных средств, биологически активных добавок (БАД) [3, 4] и буферных растворов Гуда (Good’s buffers) [5]. Комплексные соединения с таурином также находят широкое применение. Так, тауринат магния нашел свое применение в повышении стрессоустойчивости в условиях пандемии COVID‑19 [6], тауринат кальция обладает гемостатической активностью [7], тауринат железа(II) может быть использован в качестве БАД в борьбе с железодефицитной анемией [8].
Ранее нами изучено строение комплексов N,N‑бис(2-гидроксиэтил)таурина [9] с ионами никеля(II) и кобальта(II), определены значения соответствующих констант устойчивости. Продолжением этих работ является исследование свойств новых производных таурина, содержащих 2‑пиридилэтильный заместитель. Известно, что пиридиновый фрагмент является основой ряда лекарственных средств, входит в состав биологически активных веществ и витаминов [10]. Введение пиридилалкильного заместителя в состав аминополимеров приводит к значительному возрастанию емкости сорбционных материалов на их основе [11–13]. Таким образом, исследование свойств пиридилсодержащих лигандов представляет интерес как с точки зрения интерпретации селективных свойств сорбентов, содержащих соответствующие функциональные группы, так и с точки зрения выявления закономерностей влияния состава новых органических реагентов на их комплексообразующие свойства.
Целью настоящей работы является исследование кислотно-основных и комплексообразующих свойств новых N-производных таурина – N‑[2‑(2‑пиридил)этил]таурина (HL1) и N‑[2‑(4‑пиридил)этил]таурина (HL2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез N-2-(2-пиридил)этил-2-аминоэтансульфокислоты (HL1). Смесь 5.28 мл (0.05 моль) 2-винилпиридина и 6.25 г (0.05 моль) 2‑аминоэтансульфокислоты в 30 мл воды выдерживали при 70°С в течение 24 ч. Воду упаривали на роторном испарителе, к остатку добавляли 50 мл этанола, доводили до кипения и охлаждали. Осадок отфильтровывали и сушили при 20°С до постоянной массы. Выход 9.43 г (82%). Найдено, %: С 47.39; H 6.53; N 11.97; S 13.01. Для С9Н14N2SO3 вычислено, %: С 46.96; H 6.09; N 12.17; S 13.91. ИК-спектр (ν, см–1): 3209 сл ν(N–H), 3010 ср ν(C–H) Ar, 2831 ср, 2802 ср ν(С–Н), 1630 сл γ(С=С), 1594 ср δ(N–H), 1478 ср δ(C–H), 1225 ср ν(С–N), 1158 с, 1141 с, 1033 с. ν(S=O). Спектр 1Н ЯМР (D2O, δ, м.д.): 3.23 (т, 2Н, J = 6.4, СН2СH2SО3); 3.27 (т, 2Н, J = 5.6, СН2СH2N); 3.29 (т, 2Н, J = 6.4, СН2SО3); 3.53 (т, 2Н, J = 5.6, СH2CH2N); 7.37 (д, 1Н, J = 4.0, α-НPy); 7.40 (т, 1Н, J = 6.0, β-НPy); 7.85 (д, 1Н, J = 6.0, β'-НPy); 8.50 (т.д, 1Н, J = 6.0, 1,2, γ-НPy).
Синтез N-2-(4-пиридил)этил-2-аминоэтансульфокислоты (HL2) осуществляли аналогично HL1, только вместо 2‑винилпиридина использовали такое же количество 4-винилпиридина. Выход 8.72 г (76%). Найдено, %: С 46.53; H 6.81; N 11.72; S 12.78. Для С9Н14N2SO3 вычислено, %: С 46.96; H 6.09; N 12.17; S 13.91. ИК-спектр (ν, см–1): 3142 ср ν(N–H), 3032 ср ν(C–H)Ar, 2945 ср, 2984 ср ν(С–Н), 1668 сл γ(С=С), 1612 ср δ(N–H), 1473 ср δ(C–H), 1205, 1179 с, 1040 с ν(S=O). Спектр 1Н ЯМР (D2O, δ, м.д.): 2.88 (м, 2Н, СН2СH2SО3); 2.90 (м, 2Н, СН2СH2N); 3.04 (м, 2Н, СН2SО3); 3.23 (м, 2Н, СH2CН2N); 7.34 (д, 2Н, J = 6.1, α-НPy); 8.43 (д, 2Н, J = 6.1, β-НPy).
Рабочие растворы солей металлов с концентрацией 0.1 моль/л готовили из соответствующих хлоридов квалификации “ч. д. а.” (нитрата квалификации “х. ч.” в случае серебра(I)). Стандартизацию рабочих растворов солей металлов проводили методом комплексонометрического титрования [14].
Алкалиметрическое титрование водных растворов проводили с pH‑потенциометрической индикацией при ионной силе I = 0.1 моль/л (KCl/KNO3) и t = 25 ± 1°C, используя иономер И‑160МИ, оснащенный стеклянным (ЭС‑10603) и хлорсеребряным (ЭСр-10103) электродами. Иономер калибровали по стандартным буферным растворам. Для титрования использовали автоматическую бюретку Dosimat 665.
Изучены растворы, содержащие 10 ммоль/л реагента в присутствии и в отсутствие 2 ммоль/л катионов меди(II), никеля(II) и кобальта(II). При исследовании комплексообразования реагентов с ионами цинка(II), кадмия(II), серебра(I), магния(II), кальция(II), стронция(II) и бария(II) титрование проводили в растворах с концентрацией катионов металлов 1 ммоль/л. При изучении систем, содержащих ионы металлов, образующих потенциально малоустойчивые комплексные соединения с исследуемыми реагентами (цинк(II), кадмий(II), магний(II), кальций(II), стронций(II), барий(II) и серебро(I)), их концентрация составляла 1 ммоль/л. Концентрация лиганда в этом случае составляла 25 ммоль/л, т.е. поддерживался 25-кратный избыток реагента. Для перевода реагента в полностью протонированную форму (H2L+) в титруемый раствор предварительно добавляли эквивалентное количество сильной кислоты (HCl/HNO3). В качестве титранта использовали приготовленный из фиксанала 0.2 моль/л раствор гидроксида натрия.
Для каждой системы снимали не менее трех кривых титрования. Данные по трем кривым титрования обрабатывали в рамках одного алгоритма с помощью программы ChemEqui [15, 16]. В табл. 1 представлена краткая сводка экспериментальных параметров для некоторых систем.
Таблица 1.
Сводка экспериментальных параметров для систем H–L1, H–Cu2+–L1 и H–Ni2+–L1 (I = 0.1 моль/л, t = 25 ± 1°C)
| Экспериментальный параметр | Обозначение | Величина |
| H–L1 | ||
| Состав раствора | CL | 0.01 моль/л |
| pH | 2.4–11.9 | |
| Число наборов данных, число точек в каждом наборе | 3 набора 61 точка |
|
| Метод расчета | ChemEqui [15, 16] | |
| Константы протонирования | lg β11 lg β21 |
8.67 ± 0.02 12.37 ± 0.03 |
| Статистический критерий | $R_{1}^{2}$ | 0.9972 |
| $R_{2}^{2}$ | 0.9979 | |
| $R_{3}^{2}$ | 0.9983 | |
| H–Cu2+–L1 | ||
| Состав раствора | CL | 0.01 моль/л |
| CM | 0.002 моль/л | |
| pH | 2.9–9.8 | |
| Число наборов данных, число точек в каждом наборе | 3 набора 45 точек |
|
| Метод расчета | ChemEqui [15, 16] | |
| Константы устойчивости | lg β011 lg β012 lg β–112 lg β–212 |
6.06 ± 0.10 10.00 ± 0.11 1.42 ± 0.16 –8.94 ± 0.24 |
| Статистический критерий | $R_{1}^{2}$ | 0.9977 |
| $R_{2}^{2}$ | 0.9983 | |
| $R_{3}^{2}$ | 0.9991 | |
| H–Ni2+–L1 | ||
| Состав раствора | CL | 0.01 моль/л |
| CM | 0.002 моль/л | |
| pH | 2.9–9.5 | |
| Число наборов данных, число точек в каждом наборе | 3 набора 41 точка |
|
| Метод расчета | ChemEqui [15, 16] | |
| Константы устойчивости | lg β011 lg β012 lg β–112 |
4.55 ± 0.06 7.81 ± 0.07 –2.07 ± 0.14 |
| Статистический критерий | $R_{1}^{2}$ | 0.9952 |
| $R_{2}^{2}$ | 0.9953 | |
| $R_{3}^{2}$ | 0.9961 | |
В программе реализуется метод наименьших квадратов для вычисления равновесных констант и связанных величин на основе экспериментальных результатов практически любого физико-химического метода. Равновесные константы рассчитывают путем поиска наилучшего соответствия экспериментальных данных и предполагаемой химической модели равновесной системы. В ChemEqui используют три алгоритма минимизации для решения нелинейных задач методом наименьших квадратов: Гаусса–Ньютона с аналитическим представлением производных, симплекс и Монте-Карло.
В данной работе моделирование осуществляли неградиентным методом Монте-Карло, поскольку метод удобен в поиске начальных приближений, когда бывает сложно даже предположить их величины. Кроме того, этот метод позволяет находить глобальный минимум и контролировать, правильно ли он найден. В основе метода лежит поиск минимума суммы квадратов разностей (pHрасч – pHэксп)2. Для определения pHрасч на каждом шаге по текущим оценкам равновесных констант проводится расчет равновесных концентраций. Для этого привлекается закон сохранения массы вещества в форме системы уравнений (1), где CH, CM и CL – аналитические (общие) концентрации базисных компонентов, а [H], [M] и [L] – их равновесные концентрации. При моделировании предполагали, что в системе устанавливаются равновесия общего вида (2), описываемые константами равновесий (3). Оценку точности величин lg βijk осуществляли с помощью подпрограммы анализа устойчивости решения.
(1)
$\left\{ {\begin{array}{*{20}{c}} {{{C}_{{\text{H}}}}{\text{\; = \;}}\left[ {\text{H}} \right]{\text{\; + \;}}\sum i{{{{\beta }}}_{{ijk}}}{{{\left[ {\text{H}} \right]}}^{i}}{{{\left[ {\text{M}} \right]}}^{j}}{{{\left[ {\text{L}} \right]}}^{k}}} \\ {{{C}_{{\text{M}}}}{\text{\; = \;}}\left[ {\text{M}} \right]{\text{\; + \;}}\sum j{{{{\beta }}}_{{ijk}}}{{{\left[ {\text{H}} \right]}}^{i}}{{{\left[ {\text{M}} \right]}}^{j}}{{{\left[ {\text{L}} \right]}}^{k}}} \\ {{{C}_{{\text{L}}}}{\text{\; = \;}}\left[ {\text{L}} \right]{\text{\; + \;}}\sum k{{{{\beta }}}_{{ijk}}}{{{\left[ {\text{H}} \right]}}^{i}}{{{\left[ {\text{M}} \right]}}^{j}}{{{\left[ {\text{L}} \right]}}^{k}}} \end{array}} \right.,$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
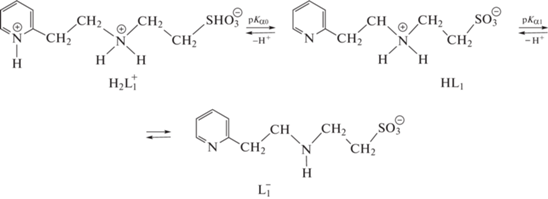
По данным pH-потенциометрического титрования с помощью программы ChemEqui были рассчитаны показатели констант ионизации функциональных групп реагентов (табл. 2). По кривым титрования реагента HL1 установлено, что кислотная диссоциация реагента протекает по схеме 1 :
Таблица 2.
Показатели констант ионизации функциональных групп в составе HL1, HL2 и некоторых других лигандов (I = 0.1 моль/л, t = 25 ± 1°C)
Схема 1 .
В табл. 1 в качестве количественной оценки адекватности модели представлены коэффициенты детерминации R2 для некоторых систем. Значения рассчитанных коэффициентов детерминации лежат в диапазоне 0.9–0.99, что свидетельствует о высокой адекватности модели.
По кривым титрования реагента HL2 установлено, что его кислотная диссоциация протекает по той же схеме. Однако нетипичное положение перегибов кривых алкалиметрического титрования позволяет сделать вывод, что в растворе находится смесь реагента НL2 и таурина. По-видимому, кислая среда в случае реагента НL2 способствует ретрореакции Михаэля (схема 2 ):
Схема 2 .
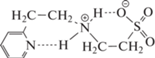
Реагент НL1 более устойчив к процессу деструкции, вероятно, из-за возможности образования внутримолекулярной водородной связи, которая стабилизирует аддукт Михаэля (схема 3 ):
Схема 3 .
В случае реагента НL2 такой стабилизирующий эффект не может реализоваться. Несмотря на протекание реакции частичного разложения, полученные данные позволили оценить константы ионизации функциональных групп кислоты НL2. Как следует из полученных данных (табл. 2), 2-пиридильный изомер (кислота HL1) является более слабым основанием Бренстеда по азоту пиридинового кольца, чем изомер в четвертом положении (кислота HL2), это обусловлено возможностью формирования внутримолекулярной водородной связи (схема 3 ), экранирующей донорность атома азота в случае кислоты HL1. Напротив, основность атома азота аминогруппы немного выше у 4-пиридильного изомера, что также определяется внутримолекулярным экранированием протона в сопряженной кислоте 2-пиридильного изомера HL1 (схемы 2 и 3 ).
По рассчитанным показателям констант кислотной диссоциации для производного таурина (HL1) установлено, что введение 2‑(2‑пиридил)этильного фрагмента приводит к некоторому понижению основности аминогруппы таурина. По сравнению с 2‑(2‑аминоэтил)пиридином исследуемый реагент характеризуется значительно меньшей основностью аминогруппы в результате отрицательного индуктивного эффекта со стороны сульфоэтильного фрагмента и образования внутримолекулярной водородной связи (схема 3 ).
Значения логарифмов констант устойчивости металлокомплексов HL1 в сравнении с соответствующими значениями для некоторых реагентов, приведенными в литературе, представлены в табл. 3.
Таблица 3.
Значения логарифмов констант устойчивости комплексов исследуемых производных и некоторых реагентов с ионами металлов (I = 0.1 моль/л, t = 25 ± 1°C)
| Пока-затель | Cu2+ | Ni2+ | Co2+ | Zn2+ | Cd2+ | Ag+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ |
|---|---|---|---|---|---|---|---|---|---|---|
| HL1 | ||||||||||
| lg β1 | 6.06 ± 0.10 | 4.54 ± 0.08 | 3.04 ± 0.11 | 3.68 ± 0.19 | 3.24 ± 0.20 | 3.71 ± 0.12 | 2.66 ± 0.32 | 3.00 ± 0.23 | 2.91 ± 0.25 | 3.18 ± 0.22 |
| lg β2 | 10.0 ± 0.11 | 7.85 ± 0.10 | 4.79 ± 0.68 | Нет данных | 6.20 ± 0.33 | 7.67 ± 0.17 | 5.74 ± 0.32 | 5.78 ± 0.30 | 5.87 ± 0.31 | 5.78 ± 0.38 |
| Таурин [20] | ||||||||||
| lg β1 | 3.56 ± 0.07 | 2.77 ± 0.05 | 2.09 ± 0.05 | Нет данных | 2.78 ± 0.03 | 3.05 ± 0.05 | 2.08 ± 0.26 | 2.78 ± 0.13 | 2.57 ± 0.17 | 2.46 ± 0.18 |
| lg β2 | 6.52 ± 0.20 | 5.52 ± 0.14 | 5.37 ± 0.11 | 5.00 ± 0.03 | 5.28 ± 0.11 | 6.41 ± 0.01 | 6.28 ± 0.02 | 6.25 ± 0.02 | 6.18 ± 0.01 | 6.17 ± 0.02 |
| 2‑(2‑Аминоэтил)пиридин [24] | ||||||||||
| lg β1 | 7.5 | 5.2 | ||||||||
| lg β2 | 13.1 | 8.43 | ||||||||
Установлено, что исследуемый реагент образует наиболее устойчивые комплексы с ионами меди(II). По устойчивости комплексов, образуемых с HL1 ионы меди(II), никеля(II), кобальта(II) и цинка(II) можно расположить в следующей последовательности: Zn2+ < Cu2+ > Ni2+ > Co2+, соответствующей ряду Ирвинга–Вильямса [17]. Ионы магния(II), кальция(II), стронция(II) и бария(II) характеризуются близкими значениями констант устойчивости комплексов c исследуемым лигандом. Относительно высокой устойчивостью характеризуются комплексы HL1 с ионами серебра(I).
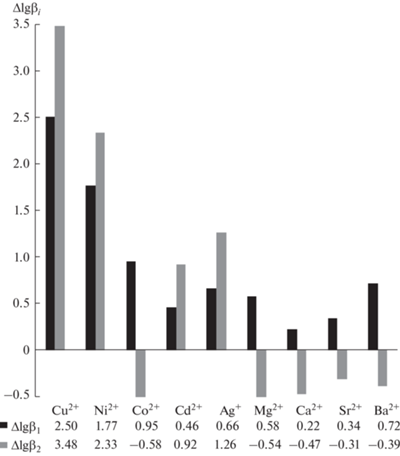
Для оценки влияния введения 2‑(2‑пиридил)этильного фрагмента в состав таурина на его комплексообразующие свойства рассчитана разность в значениях lg β для исследуемого лиганда HL1 и таурина. Полученные данные представлены на рис. 1.
Показано, что введение в структуру таурина 2‑(2‑пиридил)этильного заместителя приводит к значительному возрастанию устойчивости (Δ lg β ≥ 1) комплексов НL1 с ионами меди(II), кобальта(II), никеля(II), цинка(II) и кадмия(II). Это указывает на образование дополнительного шестичленного хелатного цикла с участием 2-(2-пиридил)этильного фрагмента. Значительный выигрыш в устойчивости комплекса (Δlgβ2 ≥ 1) реализуется также и для ионов серебра(I). Однако в данном случае вопрос о возможности одновременного образования хелатных циклов с участием серебра(I), 2‑(2‑пиридил)этильной и сульфоэтильной групп остается открытым, поскольку известно, что ион Ag+ при комплексообразовании требует линейного расположения донорных атомов [18]. Комплексные соединения ионов кальция(II), магния(II), стронция(II) и бария(II) с HL1 состава 1 : 1 характеризуются несколько большей устойчивостью по сравнению с таурином, а состава 1 : 2 – меньшей устойчивостью. В совокупности с информацией о том, что ионы кальция(II), магния(II), стронция(II) и бария(II) относятся к “жестким кислотам” (по классификации Пирсона [19]) и склонны к комплексообразованию с “жесткими основаниями” (прежде всего с лигандами, содержащими донорные атомы кислорода), полученные данные указывают на то, что в случае указанных ионов участие 2‑(2‑пиридил)этильного фрагмента в комплексообразовании маловероятно.
Интересно, что введение пиридилэтильного фрагмента в состав таурина позволяет значительно дифференцировать его свойства по отношению к меди(II) и серебру(I). Так, сам таурин образует комплексы с данными ионами, характеризующиеся близкими значениями констант устойчивости [20]. Значения же β2 комплексов HL1 с медью(II) и серебром(I) отличаются более чем на 2 порядка.
При сравнении комплексообразующих свойств HL1 с 2‑(2‑аминоэтил)пиридином (табл. 3) установлено, что введение сульфоэтильной группы в состав последнего приводит к уменьшению устойчивости комплексных соединений с медью(II) и никелем(II). Наблюдаемая закономерность объясняется понижением основности пиридинового азота, в особенности аминогруппы исследуемого реагента, по сравнению с 2‑(2‑аминоэтил)пиридином.
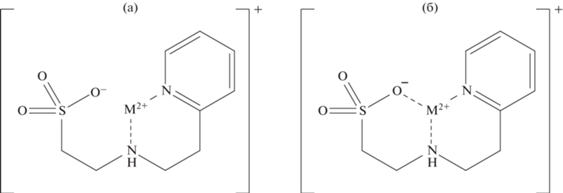
По данным из табл. 3 нельзя сделать однозначный вывод о структуре комплексных соединений HL1 с ионами металлов. Ввиду повышения устойчивости комплексов реагента с ионами меди(II), кобальта(II), никеля(II) и цинка(II) по сравнению с таурином можно заключить, что 2‑(2‑пиридил)этильный фрагмент принимает участие в координации, образуя шестичленный хелатный цикл. Так, в работе [21] при исследовании структуры комплексных соединений никеля(II) с таурином установлено образование шестичленного хелатного цикла с участием атомов кислорода сульфоновой группы и азота аминогруппы. Для реагента N‑(2‑пиридилметил)таурина в работах [22, 23] при исследовании структуры бис-комплексов меди(II) и никеля(II) установлено образование двух хелатных циклов: шестичленного с участием сульфоэтильного фрагмента и пятичленного с участием 2‑пиридилметильного фрагмента. В то же время при изучении комплексообразования гидроксиалкильных производных таурина с ионами никеля(II) [9] установлено, что кислород сульфогруппы не участвует в координации. Таким образом, можно предположить два варианта строения комплексных соединений HL1 с ионами металлов. На рис. 2а, 2б представлены возможные структуры монокомплексов в случае образования соответственно одного и двух хелатных циклов.
ЗАКЛЮЧЕНИЕ
Получены новые N-производные таурина – N‑[2‑(2‑пиридил)этил]таурин (HL1) и N‑[2‑(4‑пиридил)этил]таурин (HL2). Определены значения констант кислотной диссоциации функциональных групп в составе реагентов (HL1: pKa0 = 3.80 ± 0.03, pKa1 = 8.67 ± 0.02; HL2: pKa0 = 4.80 ± 0.05, pKa1 = = 8.18 ± 0.04). Показано, что аминогруппа в составе исследуемых лигандов характеризуется меньшей основностью по сравнению с таурином. Установлено, что НL2 в растворе частично деструктирует с образованием таурина по ретрореакции Михаэля, что не позволяет исследовать его комплексообразующие свойства. Реагент НL1 более устойчив к процессу деструкции, вероятно, из-за возможности образования внутримолекулярной водородной связи. Определены значения констант устойчивости комплексов, образуемых НL1 с рядом ионов переходных и щелочноземельных металлов. Показано, что наиболее устойчивые комплексные соединения НL1 образует с ионами меди(II) (lg β1 = 6.06 ± 0.10, lg β2 = 10.0 ± 0.11). Установлено, что введение в структуру таурина 2‑(2‑пиридил)этильного заместителя приводит к значительному росту устойчивости (Δ lg β ≥ 1) комплексов НL1 с ионами меди(II), кобальта(II), никеля(II), цинка(II), кадмия(II) и серебра(I).
Список литературы
Киселев Ю.М. Химия координационных соединений. М.: Юрайт, 2021.
Маджидов Т.И., Баскин И.И., Антипин И.С. и др. Введение в хемоинформатику: Компьютерное представление химических структур. Казань: Казан. ун-т, 2020.
Samadi M., Haghi-Aminjan H., Sattari M. et al. // Life Sci. 2021. V. 265. P. 118813. https://doi.org/10.1016/j.lfs.2020.118813
Sedaghat M., Choobineh S., Ravasi A.A. // Life Sci. 2020. V. 258. P. 118225. https://doi.org/10.1016/j.lfs.2020.118225
Good N.E., Winget G.D., Winter W. et al. // Biochemistry. 1966. V. 5. № 2. P. 467. https://doi.org/10.1021/bi00866a011
Sankova M.V., Kytko O.V., Meylanova R.D. et al. // Res. Results Pharmacol. 2020. V. 6. № 4. P. 65. https://doi.org/10.3897/rrpharmacology.6.59407
Gurevich K.G., Urakov A.L., Bashirova L.I. et al. // Asian J. Pharm. Clin. Res. 2018. V. 11. № 11. P. 452. https://doi.org/10.22159/ajpcr.2018.v11i11.29049
Liberal Â., Pinela J., Vívar-Quintana A.M. et al. // Foods. 2020. V. 9. № 12. P. 1871. https://doi.org/10.3390/foods9121871
Zemlyakova E.O., Pestov A.V., Slepukhin P.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 11. P. 667. https://doi.org/10.1134/S107032841811009X
Машковский М.Д. Лекарственные средства. М.: РИА “Новая волна”, 2008.
Lakiza N.V., Tissen O.I., Neudachina L.K. et al. // Russ. J. Appl. Chem. 2013. V. 86. № 9. P. 1383. https://doi.org/10.1134/S1070427213090114
Pestov A.V., Bratskaya S.Yu., Azarova Yu.A. et al. // Russ. J. Appl. Chem. 2011. V. 84. № 4. P. 713. https://doi.org/10.1134/S1070427211040276
Pestov A.V., Lakiza N.V., Tissen O.I. et al. // Russ. Chem. Bull. 2014. V. 63. № 3. P. 754. https://doi.org/10.1007/s11172-014-0503-0
ГOCT 10398-2016
Solov’ev V.P., Baulin V.E., Strakhova N.N. et al. // J. Chem. Soc. 1998. № 6. P. 1489. https://doi.org/10.1039/a708245b
Solov’ev V.P., Tsivadze A.Yu. // Prot. Met. Phys. Chem. Surf. 2015. V. 51. № 1. P. 1. https://doi.org/10.1134/S2070205115010153
Irving H., Williams R.J.P. // J. Chem. Soc. 1953. P. 3192. https://doi.org/10.1039/jr9530003192
Умланд Ф., Янсен А., Тириг Д. и др. Комплексные соединения в аналитической химии. М.: Мир, 1975.
Pearson R.G. // J. Am. Chem. Soc. 1963. V. 85. № 22. P. 3533. https://doi.org/10.1021/ja00905a001
Petrova Yu.S., Neudachina L.K. // Russ. J. Inorg. Chem. 2013. V. 58. № 5. P. 617. https://doi.org/10.1134/S0036023613050173
Jiang Y.-M., Cai J.-H., Liu Z.-M. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2005. V. 61. № 5. P. M878. https://doi.org/10.1107/S1600536805010846
Du Z.-X., Qin J.-H., Wang J.-G. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2008. V. 64. № 2. P. M341. https://doi.org/10.1107/S1600536808000779
Liao B.-L., Li J.-X., Jiang Y.-M. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2007. V. 63. № 7. P. M1974. https://doi.org/10.1107/S1600536807029911
NIST Critically Selected Stability Constants of Metal Complexes. 2004. Version 8.0.
Дополнительные материалы
- скачать ESM.zip
- Приложение 1. Spectral Data. Рис 1. - Рис 4.
Приложение 2. Titration Curves
Инструменты
Журнал неорганической химии