Журнал неорганической химии, 2023, T. 68, № 8, стр. 1066-1076
Комплекс цинка(II) с 2-окси-5-этилфенилфосфоновой кислотой: синтез, строение, токсичность и накопление в клетках HeLa
И. С. Иванова a, Г. С. Цебрикова b, *, А. Б. Илюхин a, В. П. Соловьев b, М. А. Лапшина c, Ю. И. Рогачева c, Е. Н. Пятова a, В. Е. Баулин c, А. Ю. Цивадзе b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва,
Ленинский пр-т, 31, корп. 4, Россия
c Институт физиологически активных веществ ФГБУН Федерального исследовательского центра проблем химической физики и медицинской химии РАН
142432 Московская обл., Черноголовка, Ленинский пр-т, 1, Россия
* E-mail: tsebrikova@yandex.ru
Поступила в редакцию 11.04.2023
После доработки 03.05.2023
Принята к публикации 05.05.2023
- EDN: MYBLVM
- DOI: 10.31857/S0044457X23600597
Аннотация
Синтезирован комплекс цинка(II) с 2-окси-5-этилфенилфосфоновой кислотой (Н3L) состава [Zn(H2L)2(Н2О)2][Zn(HL)(Н2О)] · H2O (I), структура которого установлена на основании совокупности данных рентгеноструктурного и элементного анализа, квантово-химических расчетов, ИК- и электронной спектроскопии. Потенциометрическим титрованием определены константы устойчивости комплексов кислоты Н3L с перхлоратом цинка(II) в воде. Впервые изучены цитотоксические свойства кислоты Н3L и комплекса I на клетках HeLa (аденокарцинома шейки матки человека). Методом лазерной конфокальной микроскопии получены результаты по накоплению комплекса I в клетках HeLa.
ВВЕДЕНИЕ
Синтез и исследование физико-химических и биологических свойств комплексов биоактивных органических лигандов с катионами различных металлов позволяют существенно расширить возможности структурного дизайна лекарственных средств [1–6].
В нормальном протекании процессов в живых организмах важную роль играют такие d-элементы, как железо, медь и цинк. Дисбаланс этих металлов запускает процессы старения, способствует развитию атеросклероза, мутагенеза, нейродегенерации, иммунологических нарушений и др. [7–12]. Механизм возникновения таких заболеваний связывают с генерацией активных форм кислорода, вызывающих окислительный стресс с участием ионов железа и меди [13, 14].
Производные 2-оксибензойной (салициловой) кислоты (H2Sal) широко применяются в клинической практике как жаропонижающие, анальгетические и противовоспалительные средства. Они могут оказывать терапевтическое влияние на опухоли, такие как рак молочной [15], поджелудочной [16], предстательной железы, яичников [17], рак легких [18]. Известно, что комплексы цинка(II) с производными салициловой кислоты также обладают противоопухолевой активностью [19].
2-Оксифенилфосфоновые кислоты являются малоизученными фосфорильными аналогами салициловой кислоты, в которых карбоксильная группа заменена фосфоновым фрагментом (рис. 1). Такая замена приводит к появлению других физико-химических и биологических свойств этих кислот по сравнению с салициловой кислотой, что обусловливает наш интерес к изучению как свободных 2-оксифенилфосфоновых кислот, так и их комплексов с биологически активными металлами [20–23].
В настоящей работе синтезирован комплекс цинка(II) с 2-окси-5-этилфенилфосфоновой кислотой (Н3L) состава [Zn(H2L)2(Н2О)2][Zn(HL)(Н2О)] · H2O (I), структура которого установлена на основании данных рентгеноструктурного и элементного анализа, квантово-химических расчетов и ИК-спектроскопии. Методом потенциометрического титрования определены константы устойчивости комплексов кислоты Н3L с перхлоратом цинка(II) в воде. Впервые изучены цитотоксические свойства кислоты Н3L и комплекса I на клетках HeLa (аденокарцинома шейки матки человека) с использованием МТТ-теста. Кроме того, оценка накопления комплекса I в клетках HeLa проведена методом лазерной конфокальной микроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H и 31Р записывали на спектрометре Bruker СХР-200; стандарты – ТМС (внутренний) и 85% Н3РО4 (внешний). Температуры плавления измеряли на приборе Boetius PHMK 05. Анализ содержания С и Н проводили на С,Н,N-анализаторе Carlo Erba (Strumentazione, Italy). Содержание фосфора и цинка определяли методом атомной эмиссии с индуктивно связанной плазмой на приборе iCAP-6500 Duo (Thermo Scientific, США). ИК-спектры регистрировали на спектрометре Bruker Vertex 70 в диапазоне 4000–400 см–1 (суспензия в вазелиновом масле) и методом НПВО на спектрометре Nexsus, Nicolete.
2-Оксифенил-5-этилфосфоновую кислоту синтезировали согласно [20]. Температура плавления и результаты элементного анализа и спектров ЯМР соответствовали литературным данным. Для изучения комплексообразования использовали гексагидрат перхлората цинка(II) марки “х. ч.”.
Комплекс [Zn(H2L)2(Н2О)2][Zn(HL)(Н2О)] · H2O (I) был получен в виде бесцветного кристаллического осадка при смешивании водных растворов Н3L (0.3 г, 1.5 ммоль) и Zn(ClO4)2 · 6H2O (0.3 г, 0.7 ммоль). Комплекс достаточно хорошо растворим в воде, поэтому для его полного осаждения реакционную смесь выдерживали не менее 12 ч при температуре +6°С, а затем фильтровали и промывали ледяной водой. Выход составил 0.5 г (88%).
| C | H | P | Zn | |
| Найдено, %: | 35.98, 36.15; | 4.04, 4.28; | 11.79, 11.62; | 16.34, 16.24. |
| Для C24H37O16P3Zn2 | ||||
| вычислено, %: | 35.76; | 4.59; | 11.57; | 16.17. |
Константы устойчивости комплексов 2-окси-5-этилфенилфосфоновой кислоты (H3L) с перхлоратом цинка(II) определяли методом потенциометрического титрования с использованием потенциометра OP-300 (Radelkis) по методике [24].
Растворы кислоты H3L и соли Zn(ClO4)2 · 6H2O с начальным объемом 160 мл титровали стандартным 0.1 М раствором NaOH при температуре 298 ± 0.1 K и ионной силе I = 0.1 M KCl. Выполнено четыре титрования в интервале pH от 2.6 до 11.3, которые включали от 51 до 61 точки. Исходные аналитические концентрации кислоты и соли варьировали в интервалах 0.29–1.05 и 0.60–2.26 мМ соответственно (табл. 1). При титровании отношение начальных концентраций реагентов $c_{{\text{L}}}^{{\text{0}}}{\text{/}}c_{{{\text{Zn}}}}^{{\text{0}}}$ варьировалось от 1.5 до 2.2. В четвертом титровании в интервале pH 6.5–9.5 наблюдали образование осадка. Поэтому данные этого титрования в указанной области в расчетах констант комплексообразования не использовали.
Таблица 1.
Условия изучения комплексообразования 2-окси-5-этилфенилфосфоновой кислоты с Zn(ClO4)2 · 6H2O в воде при 298 K: интервалы pH и начальных концентраций (ммоль/л) реагентов в растворе
| № | pH | $c_{{{\text{Zn}}}}^{0}$ | $c_{{\text{L}}}^{0}$ | n |
|---|---|---|---|---|
| 1 | 3.4–11.3 | 0.30–0.29 | 0.63–0.60 | 57 |
| 2 | 3.3–11.1 | 0.47–0.45 | 0.70–0.67 | 56 |
| 3 | 3.2–11.1 | 0.32–0.31 | 0.72–0.69 | 61 |
| 4 | 2.6–11.3 | 1.05–0.96 | 2.26–2.06 | 51 |
Константы устойчивости комплексов 2-окси-5-этилфенилфосфоновой кислоты (H3L) с перхлоратом цинка(II) рассчитывали с использованием программы CHEMEQUI [25, 26], предназначенной для моделирования равновесий в растворах. В нашем случае потенциометрического титрования неизвестные константы устойчивости комплексов ${{\beta }_{1}},~{{\beta }_{2}} \ldots $ были искомыми и оптимизируемыми параметрами для минимизации квадратов остатков программой CHEMEQUI:
(1)
$\Phi ({{\beta }_{1}},\beta {{~}_{2}} \ldots ) = \mathop \sum \limits_{i = 1}^n {{\left( {{\text{p}}{{{\text{H}}}_{{exp,i}}} - {\text{p}}{{{\text{H}}}_{i}}} \right)}^{2}},$(3)
${{C}_{j}} = {\text{exp}}\left( {\ln {\kern 1pt} {{{{\beta }}}_{j}} + ~\mathop \sum \limits_{k = 1}^m {{\nu }_{{jk}}}{\kern 1pt} \ln {\kern 1pt} {{C}_{k}}} \right),$(4)
$\mathop \sum \limits_{i = 1}^s {{\nu }_{{ki}}}{{C}_{i}} = ~\,\,C_{k}^{0},\,\,k = 1,2, \ldots ,~m,$Цинк(II) образует в воде устойчивые гидроксиды [28], поэтому оценка констант комплексообразования Zn2+ с кислотой H3L была выполнена как с учетом реакций гидролиза цинка(II), так и без их учета. В расчетах использовали известные константы lg βn для равновесий Zn2+ + nH2O = = Zn2+(OH–)n + nH+ (n = 1, 2), составляющие в воде при 298 K и ионной силе I = 0.1 M (NaNO3) соответственно –7.89 и –14.92 [28]. Для расчета констант комплексообразования Zn2+ c протонированными формами лиганда HnL(3–n)– (n = 0, 1, 2) ранее были определены константы протонирования кислоты из данных ее титрования раствором NaOH, которые составили 11.58, 17.94 и 21.14 соответственно для равновесий L3– + nH+ = HnL(3–n)– (n = 1, 2, 3) при 298 K и ионной силе I = 0.1 M (KCl) [21]. Независимое определение констант протонирования кислоты позволяет более надежно определить константы комплексообразования кислоты с катионом металла [29].
Нами было проанализировано девять моделей равновесий в растворе с образованием от одной до четырех химических форм: 1) ZnL; 2) ZnL, ZnOH, Zn(OH)2; 3) ZnL, ZnL(OH); 4) ZnL, ZnL(OH), ZnL(OH)2; 5) ZnL, ZnL(OH), ZnOH, Zn(OH)2; 6) ZnL, ZnL2; 7) ZnL, ZnL2, ZnL2(OH); 8) ZnL, ZnL2, ZnL(OH), ZnL2(OH); 9) ZnL, ZnL2, ZnHL, ZnL2(OH). Здесь для простоты заряды частиц, образованных ионами Zn2+, L3–, H+ и OH–, не указаны. В качестве критериев выбора модели равновесных реакций, вполне соответствующей эксперименту, использовали R-фактор Гамильтона ($HRF$) и коэффициент детерминации ($R_{{det}}^{2}$):
Экспериментальные данные РСА для соединения I получены на дифрактометре Bruker AXS D8 Venture Photon III C14 IuS 3.0 (λ(MoKα), графитовый монохроматор) [30] (табл. 2). Поглощение учтено полуэмпирическим методом по эквивалентам (программа SADABS) [31]. Структура определена комбинацией прямого метода и Фурье-синтезов. Атомы водорода рассчитаны из геометрических соображений. Структуры уточнены полноматричным анизотропно-изотропным МНК. Все расчеты выполнены по программам SHELXS и SHELXL [32]. “Монокристаллы” I растут в виде тонких сросшихся пластин (как в слюде), разделить которые невозможно. Было проверено более 20 кристаллов, все они оказались сростками, но часть рефлексов для всех образцов индицировали в одной и той же ячейке. Лучший из кристаллов, с которого были получены экспериментальные данные, все равно был образован не менее чем восемью доменами (программа CellNow [33]). Для интегрирования был выбран наибольший домен (~35% индицированных при соотношении сигнал/фон ≥ 8 рефлексов), в процессе интегрирования матрицу ориентации фиксировали. Уточнение проводили с учетом центросимметричного двойникования, 37% рассеивающей мощности “кристалла” разупорядочено. Низкое качество эксперимента позволило перевести в анизотропию лишь атомы Zn и упорядоченные атомы P, что привело к ошибке типа A в checkcif (39 неводородных атомов уточняли в изотропном приближении). Две ошибки типа B (высокий wR2 и низкая точность в связях C–C) обусловлены строением образца.
Таблица 2.
Основные структурные данные и результаты уточнения структуры I
| Параметр | Значение |
|---|---|
| Формула | C24H37O16P3Zn2 |
| М | 805.18 |
| T, K | 100(2) |
| Излучение, λ, Å | 0.71073 |
| Сингония | Моноклинная |
| Пр. гр. | Pc |
| a, Å | 20.103(4) |
| b, Å | 14.009(3) |
| c, Å | 7.6143(15) |
| β, град | 94.50(3) |
| V, Å3 | 2137.8(8) |
| Z | 2 |
| dх, г/см3 | 1.251 |
| μ, мм–1 | 1.288 |
| F(000) | 828 |
| Размер образца, мм | 0.22 × 0.20 × 0.02 |
| интервал θ, град | 2.5–25.3 |
| Пределы h, k, l | –23 ≤ h ≤ 24 –16 ≤ k ≤ 16 –9 ≤ l ≤ 7 |
| Число измеренных отражений | 11095 |
| Число независимых отражений, Rint | 6141, 0.0903 |
| Полнота до θ = 25.242°, % | 98.5 |
| Max, min пропускание | 0.73, 0.20 |
| Число параметров | 6141/38/197 |
| S | 1.387 |
| R1, wR2 [I > 2σ(I)] | 0.1481, 0.3480 |
| R1, wR2 (все данные) | 0.1805, 0.3710 |
| ∆ρmax/∆ρminе/Å3 | 1.569–0.926 |
| Абсолютная конфигурация | 0.52(8) |
Структурные данные и результаты уточнения для соединения I депонированы в Кембриджском банке структурных данных (CCDC № 2244640); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
Эксперименты по определению цитотоксичности кислоты H3L и комплекса I проводили на клетках HeLa (аденокарцинома шейки матки человека), полученных из коллекции клеточных культур позвоночных (Санкт-Петербург, Россия). Клетки HeLa были выращены в среде Игла МЕМ (ПанЭко, Россия), содержащей 10% эмбриональной сыворотки (HyClone, США), пенициллин (50 ед/мл), стрептомицин (50 мг/мл), в атмосфере 5% CO2 при температуре 37°С. Клетки рассевали в 96-луночные планшеты в концентрации 5 × 104 клеток/мл. Через 24 ч тестируемые соединения, предварительно растворенные в диметилсульфоксиде (ДМСО), вносили в культуральную среду. Клетки инкубировали при 37°С в увлажненной атмосфере воздуха и 5% CO2 в течение 48 ч. Затем в инкубационную среду вносили 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (MTT, Sigma-Aldrich) в концентрации 0.5 мг/мл. Окрашивание клеток проводили при 37°С в увлажненной атмосфере воздуха и 5% CO2 в течение 2 ч. Далее инкубационную среду отбирали и кристаллы образованного МТТ-формазана растворяли в 100%-ном ДМСО. Интенсивность окраски определяли при длине волны 536 нм с помощью планшетного ридера Cytation 3 (BioTek, США). За 100% принимали интенсивность окраски контрольных клеток, не обработанных тестируемым соединением. Статистический анализ, построение графиков и определение концентрации, вызывающей 50%-ное ингибирование роста популяции клеток (IC50), определяли на основе дозозависимых кривых с помощью программного обеспечения OriginPro 8.
Изучение клеточной аккумуляции комплекса I проводили на клетках HeLa. Клетки, выращенные на покровных стеклах размером 24 × 24 мм при плотности клеточной культуры 15 × 104/2 мл в шестилуночных планшетах, инкубировали в течение 24 ч с растворенным в ДМСО комплексом I, конечная концентрация которого в инкубационной среде составляла 100 мкM. В качестве контроля использовали клетки без обработки комплексом. Далее клетки отмывали от остатков среды раствором PBSx1 (фосфатно-солевой буфер) и фиксировали раствором 4%-ного параформальдегида в течение 30 мин при комнатной температуре. Затем проводили пермеабилизацию в 0.5%-ном растворе Triton X-100 в PBSx1 в течение 10 мин при комнатной температуре. Далее образцы после промывания в деионизованной воде сушили при комнатной температуре в темноте. Заклеивали стекла по периметру лаком. Изучение накопления комплекса I в клетках проводили с помощью лазерного сканирующего микроскопа Zeiss LSM 880 (Carl Zeiss, Германия). Изображения получали в инвертированном конфокальном режиме с использованием объектива C Plan-Apochromat 63X/1.4 Oil DIC M27. Для возбуждения флуоресценции комплекса I использовали лазерное облучение с длиной волны 405 нм, сигнал детектировали в диапазоне длин волн 415–536 нм. Все полученные треки были сохранены в формате czi-ном. Полученные изображения были обработаны с помощью программы для анализа изображений ImageJ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее нами был синтезирован комплекс [Cu(H2L)2(Н2О)2], состав и строение которого установлены на основании данных РСА, элементного анализа и ИК-спектроскопии [21]. В настоящей работе получен комплекс [Zn(H2L)2(Н2О)2][Zn(HL)(Н2О)] · H2O (I), который, в отличие от светло-голубых кристаллов комплекса меди, представляет собой прозрачные слоистые кристаллы.
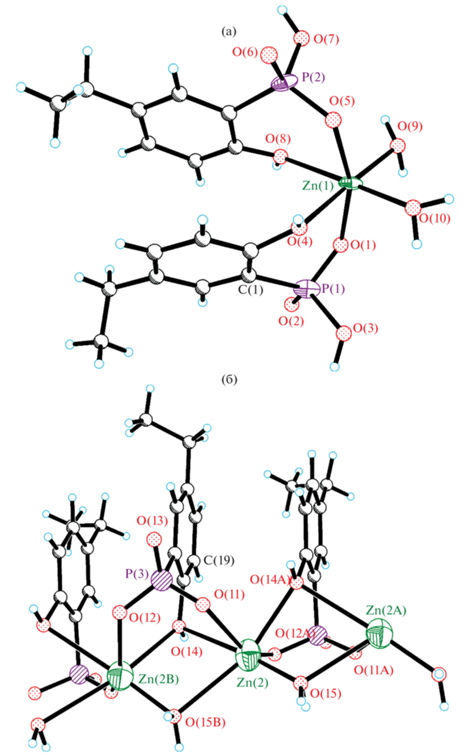
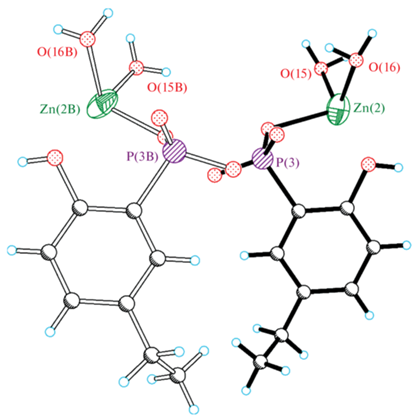
Структура I образована комплексами [Zn(H2L)2(Н2О)2] (рис. 2а, рис. S1 ), 1D-цепочками [Zn(HL)(Н2О)] (рис. 2б, рис. S1 ) и кристаллизационными молекулами H2O. В октаэдрическом комплексе [Zn(H2L)2(Н2О)2] атомы O молекул H2O находятся в цис-позиции друг к другу, аналогично расположены и атомы O оксифенильных фрагментов, в то время как фосфоновые атомы O – в транс-позиции друг к другу. В аналогичных комплексах меди(II) с H3L [21], 2-оксифенилфосфоновой [23] и 2-окси-5-метоксифенилфосфоновой кислотой [22] атомы O молекул H2O и атомы O оксифенильных фрагментов находятся в транс-позиции; комплексы центросимметричны. В 1D-цепочке [Zn(HL)(Н2О)] мостиковые атомы O оксифенильного фрагмента, молекулы H2O и фосфонового фрагмента объединяют соседние атомы Zn. Следует отметить, что цепочка разупорядочена по двум позициям (рис. 3) в соотношении 0.54 : 0.46, а координированные молекулы H2O в каждой цепочке разупорядочены по двум позициям с заселенностями O(15), O(16), O(15B) и O(16B) 0.27, 0.27, 0.26 и 0.20 соответственно. Низкое качество экспериментальных данных позволяет обсуждать лишь топологию структурных единиц.
Отнесение колебательных частот донорных групп в ИК-спектре лиганда Н3L, позволяющих судить о его координации, а также комплекса меди [Cu(H2L)2(H2O)2] приведено в работе [21]. При сохранении общего характера ИК-спектр комплекса I несколько отличается от ИК-спектров Н3L и [Cu(H2L)2(H2O)2]. Основные отличия в ИК-спектрах комплексов наблюдаются в интервале частот 1285–1070 см–1, где лежат полосы ν(Ph–O), τ(CH2), ν(P=O) и δPh. В спектре комплекса цинка в этом спектральном диапазоне присутствуют: полоса средней интенсивности около 1271 см–1, более интенсивная полоса около 1235 см–1, менее интенсивная полоса при 1215 см–1 и очень интенсивная широкая полоса с максимумами при 1139, 1103, 1074 см–1. В спектре [Cu(H2L)2(H2O)2] в этом спектральном диапазоне наблюдаются две хорошо разрешенные полосы: дублетная полоса средней интенсивности при 1249, 1225 см–1 и интенсивная дублетная полоса при 1115, 1086 см–1. В диапазоне 900–420 см–1 в основном меняется соотношение интенсивности полос.
Что касается фосфорильной группы, то к ν(P=O) в спектре комплекса I можно отнести узкую полосу выше средней интенсивности при 1235 см–1. Это несколько выше, чем положение полосы ν(P=O) в спектре свободной Н3L (1230 см–1), и свидетельствует о присутствии не участвующего в координации с катионом цинка фосфорильного атома кислорода. В спектре комплекса меди, в котором фосфорильный кислород молекулы Н3L также не участвует в координации с катионом меди, частота ν(P=O) незначительно (~6 см–1) понижается. Полоса при 1271 см–1 может быть связана с ν(Ph–O) фенольной группы. Интенсивные полосы при 1024 и 937 см–1 в спектре I обусловлены колебаниями δ(POH) и ν(PO) фосфонового фрагмента (1017 и 943 см–1 в ИК-спектре [Cu(H2L)2(H2O)2]).
В диапазоне частот 4000–2000 см–1 в ИК спектре I на фоне широкой интенсивной полосы с максимумом при ⁓3000 см–1 фиксируются полосы валентных колебаний молекул воды ν(H2O), входящих в состав комплекса, а также ν(С‒Н), ν(OH)Ph и ν(ОН)Р. Новую по сравнению со спектром Н3L полосу около 3381 см–1 в ИК-спектре комплекса цинка можно отнести к валентным колебаниям координированных молекул воды (3314 см–1 в спектре медного комплекса). Деформационным колебаниям δ(H2O) соответствует полоса ниже средней интенсивности при 1672 см–1 (широкая полоса при ~1695 см–1 в спектре комплекса меди). Полоса около 3148 см–1 может быть обусловлена ν(OH)Ph (3201 см–1 в комплексе меди). Валентные колебания OH-групп фосфонового фрагмента ν(OH)P имеют малую интенсивность (2570 и 2274 см–1 в спектре [Cu(H2L)2(H2O)2]).
Принимая во внимание общий характер спектров комплексов цинка и меди c Н3L, можно сказать, что при одинаковом способе координации Н3L эти комплексы изоструктурными не являются, что согласуется с данными РСА.
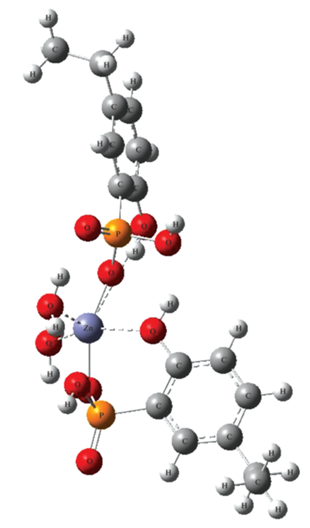
Геометрия комплекса цинка(II) с H3L также была определена по результатам DFT-расчетов с использованием программы Gaussian 06 (функционал B3LYP с базовым набором 6-31+G(d,p)). Согласно расчетам, координационное окружение атома цинка в изолированной части комплекса [Zn(H2L)2(Н2О)2] в целом идентично окружению, определенному методом РСА (рис. 4). Различия в геометрии связаны, по-видимому, с тем, что расчеты проводили в газовой фазе, а в РСА использовали кристаллический образец. В изолированной части комплекса [Zn(H2L)2(H2O)2] длины связей Zn–ОРРh составляют 1.922–1.925 Å, Zn–ОРh – 2.229–2.307 Å, а Zn–OН2 – 2.247–2.266 Å.
Рис. 4.
Пространственное строение изолированной части комплекса [Zn(H2L)2(H2O)2] по результатам квантово-химических расчетов.
Константы устойчивости комплексов цинка(II) с 2-окси-5-этилфенилфосфоновой кислотой H3L (рис. 5, табл. 3) в воде при 298 K и ионной силе 0.1 М KCl определены методом потенциометрического титрования с использованием четырех расчетных алгоритмов программы CHEMEQUI (см. Экспериментальную часть), предназначенной для определения констант устойчивости из экспериментальных данных различных физико-химических методов [25, 26]. В расчетах использовали известные константы протонирования lg βm кислоты H3L в воде при 298 K и ионной силе 0.1 М: 11.58, 17.94 и 21.14 соответственно для равновесий L3– + mH+ = HmL(3–m)– (m = 1, 2 и 3) [21].
Рис. 5.
Диаграмма распределения комплексов Zn2+ с 2-окси-5-этилфенилфосфоновой кислотой в зависимости от pH в воде при 298 K, ионной силе 0.1 М и начальных концентрациях реагентов Zn2+ и H3L соответственно 0.31 и 0.71 мМ. α – Процентная доля равновесных концентраций ионов относительно общей концентрации Zn2+.
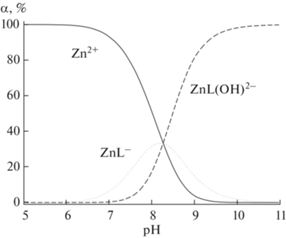
Таблица 3.
Константы устойчивости комплексов Zn2+ с 2-окси-5-этилфенилфосфоновой кислотой H3L в воде при 298 K и ионной силе 0.1 M KCl
| i | Равновесие | lg βi ± sdа |
|---|---|---|
| 1 | Zn2+ + L3– = ZnL– | 6.63(13)б |
| 2 | Zn2+ + L3– + OH– = Zn(OH)L2– | 12.68(36) |
| 3 | ZnL– + OH– = Zn(OH)L2– | 6.06(38) |
Ион Zn2+ с L3– образует в воде простой комплекс ZnL–, который в щелочной среде с ростом pH до 10 практически полностью превращается в комплекс ZnL(OH)2–. Максимум связывания 33% иона Zn2+ в комплекс ZnL– приходится на pH 8.2 при концентрации реагентов Zn2+ и H3L около 0.3 и 0.7 мМ соответственно (рис. 5). Кислота H3L значительно слабее связывает цинк(II) в комплекс ZnL– (lg KZnL = 6.63, табл. 3), чем медь(II) в комплекс CuL– (lg KCuL = 8.91 [21]). Тем не менее константа устойчивости комплекса ZnL– в случае 2-окси-5-этилфенилфосфоновой кислоты не является низкой: только для половины из 568 комплексов состава ZnLig самых различных органических лигандов характерны константы устойчивости >5.0 в воде в стандартных условиях при 298 K и ионной силе 0.1 М [34]. В работе [35] показано, что константы устойчивости ионов металлов Mi и Mj с органическим лигандом в воде в стандартных условиях связаны простой зависимостью: lg Kj = = (ri/rj) · lg Ki, где ri и rj – термодинамические радиусы ионов Mi и Mj. Поскольку rCu = 0.826 и rZn = 1.138 [35], исходя из значения lg KCuL = 8.91 для комплекса CuL– приведенное уравнение дает для комплекса ZnL– величину lg KZnL = 6.47, хорошо согласующуюся с экспериментальным значением 6.63 ± 0.13 (табл. 3). Ступенчатая константа присоединения иона OH– к комплексу ZnL– lg K(ZnL– + OH–) = 6.06 существенно выше, чем аналогичная константа lg K(CuL– + OH–) = 4.48 [21] для меди(II). Этот факт косвенно свидетельствует о том, что координационная сфера цинка(II) заполняется донорными центрами кислоты в значительно меньшей степени, чем в случае меди(II).
Наши недавние исследования in vivo показали, что 2-окси-5-этилфенилфосфоновая кислота (H3L) обладает высокой анальгетической активностью и представляет интерес в качестве нестероидного противовоспалительного препарата, являясь при этом малотоксичным соединением (LD50 = 2000 мг/кг) [20, 21]. Ее комплекс [Cu(H2L)2(Н2О)2] при такой же малой токсичности проявляет анальгетический эффект значительно выше эффекта свободной кислоты и препарата сравнения – анальгина [21]. Кроме того, вскрытие лабораторных животных не показало ульцерогенного воздействия H3L и ее комплекса [Cu(H2L)2(Н2О)2] в дозах, соответствующих ЕД50, на желудочно-кишечный тракт, в отличие от салициловой кислоты.
Известно, что всемирная организация здравоохранения и международное медико-биологическое общество рекомендуют использовать альтернативные методы и модели, такие как, например, применение перевиваемых клеточных культур взамен общепринятых тестов на лабораторных животных [36]. Это связано с вопросами этического и экономического использования лабораторных животных, а также с тем, что эксперименты с использованием животных трудоемки, длительны и не всегда воспроизводимы, поэтому дальнейшее изучение биологических свойств производных 2-оксифенилфосфоновой кислоты проводили на клетках аденокарциномы шейки матки человека HeLa. В работе изучены цитотоксические свойства кислоты H3L и комплекса I в отношении клеток HeLa (рис. 6). Установлено, что H3L является малотоксичным соединением: в концентрации до 150 мкмоль/л она не оказывает существенного влияния на выживаемость клеток HeLa, что согласуется с результатами исследования острой токсичности этой кислоты, полученными на лабораторных животных [20, 21].
Рис. 6.
Цитотоксичность кислоты H3L и комплекса I в отношении клеток HeLa. Результаты жизнеспособности клеток измерены с помощью анализа восстановления МТТ после 48 ч действия соединения.
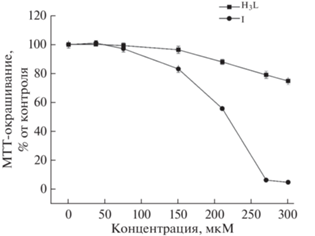
Показано, что кислота H3L и комплекс I обладают схожей цитотоксической активностью при малых концентрациях. Однако, в отличие от цитотоксического действия кислоты H3L, влияние комплекса I на клетки HeLa значительно снижало их жизнеспособность при концентрациях >150 мкмоль/л. Данный результат подтверждается вычисленными значениями количественного критерия цитотоксической активности IC50 (концентрация исследуемого соединения, вызывающая 50%-ное ингибирование роста клеточной популяции). Для комплекса I доза IC50 составила 205.4 ± 5.9 мкмоль/л, для кислоты H3L доза IC50 не определена, так как находится выше пределов ее растворимости (>300 мкмоль/л).
Результаты исследования внутриклеточного проникновения комплекса I на клеточной линии HeLa показаны на рис. 7. Инкубацию клеток с комплексом проводили в течение 24 ч, добавляя в питательную среду растворенный в ДМСО комплекс I с конечной концентрацией 100 мкмоль/л. Проведение этого исследования стало возможным благодаря спектральным характеристикам комплекса: в спектре флуоресценции (λex = 288 нм) раствора комплекса I в ДМСО присутствуют полосы при 364 и 700 нм. По данным флуоресцентной микроскопии (лазерная линия с длиной волны 405 нм) можно сделать вывод, что исследуемый комплекс проникает через клеточную мембрану клеток HeLa (рис. 7, панель 2), в то время как в контрольных образцах (рис. 7, панель 1) при возбуждении лазерной линией при 310–460 нм флуоресценция отсутствует.
Рис. 7.
Конфокальные изображения клеток HeLa при совместной инкубации в течение 24 ч с комплексом I (100 мкМ, панель 2). На панели 1 представлены контрольные клетки, не обработанные соединением. а – фазовый контраст; б – локализация комплекса в клетках; в – совмещение изображений. Шкала – 20 мкм.
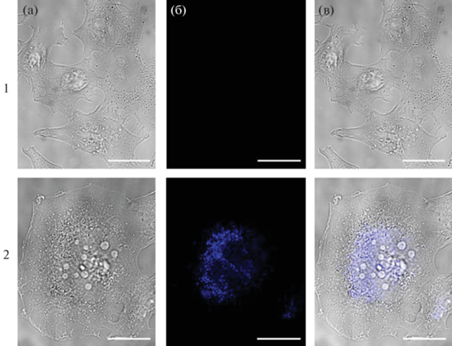
Накопление соединений биомедицинского назначения в живых клетках может происходить различными путями и приводить к изменению физиологии и биохимии клеток, вследствие чего могут наблюдаться такие явления, как нарушение окислительно-восстановительного баланса клетки, образование активных форм кислорода, апоптоз. В работе на данном этапе не представилось возможности определить количество и внутриклеточную локализацию комплекса I. Однако понимание механизмов биоаккумуляции данного комплекса важно для изучения его регуляции на клеточном уровне.
ЗАКЛЮЧЕНИЕ
Определено строение комплекса цинка(II) с 2-окси-5-этилфенилфосфоновой кислотой (H3L), которое существенным образом отличается от строения комплексов меди(II) c производными 2-оксифенилфосфоновой кислоты [21–23]. Методом потенциометрического титрования впервые определены константы устойчивости комплексов H3L с перхлоратом цинка в воде. Ион Zn2+ с L3– образует простой комплекс ZnL– и комплекс ZnL(OH)2–, в то время как для Cu2+ обнаружено существование комплексов CuL–, ${\text{lg}}{\kern 1pt} \beta ~\,\, = ~\,\,\frac{{\sum\limits_{i = 1}^m {\frac{1}{{HR{{F}_{i}}}}{\text{\;lg}}{\kern 1pt} {{\beta }^{i}}} }}{{\sum\limits_{i = 1}^m {\frac{1}{{HR{{F}_{i}}}}} }}.$, [Cu(OH)L]2– и [Cu(OH)L2]5– как для H3L, так и для ее аналогов [21–23].
Установлено, что кислота H3L является малотоксичным соединением in vitro, что согласуется с результатами исследования острой токсичности in vivo [20, 21]. Низкая токсичность комплекса цинка и его способность к биоаккумуляции являются важным критерием для дальнейшего изучения его биологической активности.
Список литературы
Zhang C.X., Lippard S.J. // Curr. Opin. Chem. Biol. 2003. V. 7. № 4. P. 481. https://doi.org/10.1016/s1367-5931(03)00081-4
Hambley T.W. // Science. 2007. V. 318. № 5855. P. 1392. https://doi.org/10.1126/science.1150504
Barry N.P., Sadler P.J. // ACS Nano. 2013. V. 7. № 7. P. 5654. https://doi.org/10.1021/nn403220e
Patra M., Gasser G. // ChemBioChem. 2012. V. 13. № 9. P. 1232. https://doi.org/10.1002/cbic.201200159
Yu G., Jiang M., Huang F., Chen X. // Curr. Opin. Chem. Biol. 2021. V. 61. P. 19. https://doi.org/10.1016/j.cbpa.2020.08.007
Pöthig A., Casini A. // Theranostics. 2019. V. 9. № 11. P. 3150. https://doi.org/10.7150/thno.31828
Prasad A.S., Kucuk O. // Cancer Metastasis Rev. 2002. V. 21. № 3–4. P. 291. https://doi.org/10.1023/A:1021215111729
Dhawan D.K., Chadha V.D. // Indian J. Med. Res. 2010. V. 132. № 6. P. 676.
Chasapis C.T., Ntoupa P.-S.A., Spiliopoulou C.A., Stefanidou M.E. // Arch. Toxicol. 2020. V. 94. № 5. P. 1443. https://doi.org/10.1007/s00204-020-02702-9
Budimir A. // Acta Pharm. 2011. V. 61. № 1. P. 1. https://doi.org/10.2478/v10007-011-0006-6
Crichton R.R., Dexter D.T., Ward R.J. // Coord. Chem. Rev. 2008. V. 252. № 10–11. P. 1189. https://doi.org/10.1016/j.ccr.2007.10.019
Crichton R.R., Dexter D.T., Ward R.J. // J. Neural Transm. 2011. V. 118. № 3. P. 301. https://doi.org/10.1007/s00702-010-0470-z
Tougu V., Palumaa P. // Coord. Chem. Rev. 2012. V. 256. № 19–20. P. 2219. https://doi.org/10.1016/j.ccr.2011.12.008
Haas K.L., Franz K.J. // Chem. Rev. 2009. V. 109. № 10. P. 4921. https://doi.org/10.1021/cr900134a
Karalis T.T., Chatzopoulos A., Kodyli A. et al. // Matrix Biol. Plus. 2020. V. 6–7. P. 100031. https://doi.org/10.1016/j.mbplus.2020.100031
Tran P.O.T., Gleason C.E., Robertson R.P. // Diabetes. 2002. V. 51. № 6. P. 1772. https://doi.org/10.2337/diabetes.51.6.1772
Gnanaprakasam J.N.R., Lopez-Banuelos L., Vega L. // Toxicol. Appl. Pharmacol. 2021. V. 410. P. 115359. https://doi.org/0.1016/j.taap.2020.115359
O’Brien A.J., Villani L.A., Broadfield L.A. et al. // Biochem. J. 2015. V. 469. № 2. P. 177. https://doi.org/10.1042/BJ20150122
Chen H., Wang D., Fan L. et al. // Sci. Rep. 2022. V. 12. P. 4545. https://doi.org/10.1038/s41598-022-08704-0
Баулин В.Е., Калашникова И.П., Вихарев Ю.Б. и др. // Журн. общ. химии. 2018. Т. 88. № 9. С. 1438. https://doi.org/10.1134/S0044460X18090044
Иванова И.С., Цебрикова Г.С., Рогачева Ю.И. и др. // Журн. неорган. химии. 2021. Т. 66. № 12. С. 1723. https://doi.org/10.31857/S0044457X21120060
Цебрикова Г.С., Рогачева Ю.И., Иванова И.С. и др. // Журн. общ. химии. 2021. Т. 91. № 11. С. 1704. https://doi.org/10.31857/S0044460X2111007X
Иванова И.С., Цебрикова Г.С., Лапшина М.А. и др. // Изв. АH. Сер. хим. 2022. № 11. С. 2365.
Цебрикова Г.С., Барсамян Р.Т., Соловьев В.П. и др. // Изв. АH. Сер. хим. 2018. № 12. С. 2184.
Solov’ev V.P., Tsivadze A.Y. // Prot. Met. Phys. Chem. Surfaces. 2015. V. 51. № 1. P. 1. https://doi.org/10.1134/S2070205115010153
Соловьев В.П. Программа ChemEqui для расчета констант химических равновесий и сопутствующих параметров исходя из экспериментальных результатов физико-химических методов, таких как УФ-, ИК- и ЯМР-спектроскопия, калориметрия, потенциометрия и кондуктометрия. http://vpsolovev.ru/programs/ (Дата обращения 1 марта 2022).
Brinkley S.R. // J. Chem. Phys. 1947. V. 15. № 2. P. 107. https://doi.org/10.1063/1.1746420
Bandyopadhyay S., Das A., Mukherjee G.N. et al. // Inorg. Chim. Acta. 2004. V. 357. P. 3563. https://doi.org/10.1016/j.ica.2004.05.010
Бек М., Надьпал И. Исследование комплексообразования новейшими методами. М.: Мир, 1989. С. 225.
APEX III and SAINT. Madison (W, USA): Bruker AXS Inc., 2016.
Sheldrick G.M. SADABS. Göttingen, Germany, 1997.
Sheldrick G.M. // Acta Crystallogr., Sect. C. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053229614024218
Sheldrick G.M. CellNow. University of Göttingen, Germany, 2005.
Solov’ev V., Tsivadze A., Marcou G., Varnek A. // Mol. Inf. 2019. V. 38. № 6. P. 1900002. https://doi.org/10.1002/minf.201900002
Solov’ev V., Tsivadze A. // Comments Inorg. Chem. 2023. V. 43. № 1. P. 16. https://doi.org/10.1080/02603594.2022.2087637
Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях / Под ред. Каркищенко Н.Н., Грачева С.В. М., 2010. 344 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии