Журнал общей биологии, 2022, T. 83, № 1, стр. 29-37
Изменения комплекса симбиотических дрожжей Drosophila melanogaster при адаптации мух к субстратам с повышенным содержанием NaCl
А. С. Дмитриева 1, *, Е. Ю. Яковлева 1, И. А. Максимова 1, А. А. Белов 1, А. В. Марков 1, 2
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Ленинские горы, 1, стр. 12, Россия
2 Палеонтологический институт им. А.А. Борисяка РАН
117997 Москва, ул. Профсоюзная, 123, Россия
* E-mail: dmnastya89@mail.ru
Поступила в редакцию 02.09.2021
После доработки 06.10.2021
Принята к публикации 25.10.2021
- EDN: ZDPHLF
- DOI: 10.31857/S0044459622010043
Аннотация
Модельный организм Drosophila melanogaster является удобным объектом для изучения механизмов адаптации к неблагоприятным условиям среды. В ходе эволюционного эксперимента, проводимого на кафедре биологической эволюции МГУ, разные линии дрозофил адаптировались к кормам с различным содержанием NaCl (0, 2, 4 и 7%). Ранее нами было показано, что некоторые штаммы симбиотических дрожжей могут вносить вклад в адаптацию дрозофил к соленым субстратам, однако зависимость численности и состава дрожжевого населения дрозофил от концентрации соли в корме до сих пор специально не изучалась. В данной работе исследован количественный и качественный состав дрожжевой составляющей микробиома дрозофил из 11 лабораторных линий D. melanogaster и пяти обжитых ими кормов. Показано, что по мере роста концентрации соли в корме дрожжевой микробиом дрозофил претерпевает значительные изменения. Общая численность дрожжей меняется нелинейно: она минимальна при концентрации соли 0% и максимальна при 2–4%, при концентрации 7% численность дрожжей в мухах и их корме меньше, чем при 2–4%, но значительно больше, чем при 0%. При низкой концентрации соли в мухах резко преобладает вид Pichia occidentalis, при промежуточных концентрациях видовое разнообразие дрожжей возрастает при сохранении прежнего доминанта, а при 7% появляется новый доминант Starmerella bacillaris и сильно меняется состав минорных компонентов. Полученные данные согласуются с гипотезой о том, что дрожжи S. bacillaris помогают мухам выдерживать высокую концентрацию NaCl на ранних этапах адаптации, но в дальнейшем эти полезные симбионты могут быть потеряны мухами на фоне постепенного развития генетических адаптаций насекомых (или других компонентов микробиома) к соленому корму.
Вид Drosophila melanogaster Meig. (Diptera, Drosophilidae) – один из наиболее популярных модельных объектов для изучения взаимоотношений макроорганизма и микробиома, в том числе по причине относительной простоты его микробного населения, сходного по ряду признаков с микробиомом млекопитающих (Erkosar et al., 2013; Erkosar, Leulier, 2014; Newell, Douglas, 2014; Hoang et al., 2015; Trinder et al., 2017; Douglas, 2018). Ключевыми компонентами микробиома D. melanogaster являются бактерии и дрожжи, переносимые мухами в кишечнике и на поверхности тела.
Адаптация дрозофил к соли в лабораторных эволюционных экспериментах давно используется как модель для изучения механизмов микроэволюции (Waddington, 1959; Te Velde et al., 1988), однако роль микробиома в такой адаптации начала изучаться лишь недавно. Особый интерес представляет дрожжевая часть микробиома, которая в целом изучена слабее, чем бактериальная. При этом известно, что дрожжи обычно служат основной пищей для дрозофил на разных стадиях развития и необходимы для нормального развития личинок D. melanogaster на природных субстратах (Becher et al., 2012). Разные виды дрожжей по-разному влияют на выживаемость и скорость развития личинок, а личинки проявляют избирательность, предпочитая питаться теми дрожжами, которые положительно влияют на их рост (Starmer, 1981; Anagnostou et al., 2010). Личинки и имаго дрозофил, со своей стороны, влияют на видовой состав дрожжевых сообществ, развивающихся на кормах, способствуя размножению определенных видов дрожжей и препятствуя росту мицелиальных грибов (Stamps et al., 2012). Некоторые виды дрожжей выдерживают прохождение через кишечник дрозофил, что позволяет дрозофилам служить эффективными распространителями дрожжей в природных условиях (Reuter et al., 2007; Coluccio et al., 2008; Stamps et al., 2012; Hoang et al., 2015; Günther, Goddard, 2019). Также известно, что видовой состав дрожжевой составляющей микробиома дрозофилид сильно зависит от диеты мух (Chandler et al., 2012). По-видимому, живые дрожжевые клетки могут передаваться от личинки к имаго в ходе метаморфоза, но только при наличии в кишечнике личинки определенных кишечных бактерий (Guilhot et al., 2020).
Ранее мы показали, что некоторые штаммы дрожжей (в особенности Starmerella bacillaris) помогают линиям D. melanogaster адаптироваться к корму с 4% NaCl (Панченко и др., 2017; Ивницкий и др., 2018; Dmitrieva et al., 2019). Однако общие закономерности изменения численности и состава дрожжевого микробиома дрозофил по мере роста концентрации соли в корме, к которому адаптируются насекомые, до сих пор не изучались. В данном исследовании мы попытались восполнить этот пробел, охарактеризовав численность и видовой состав дрожжевой части микробиома 11 лабораторных линий D. melanogaster, адаптированных к различным концентрациям соли.
МАТЕРИАЛЫ И МЕТОДЫ
Подопытные линии мух и корма. В работе использовались 11 лабораторных линий взрослых мух (имаго) D. melanogaster и пять обжитых ими кормов. Все линии произведены от одной исходной аутбредной популяции дикого типа в октябре 2014 г. и содержатся на разных кормах в рамках эволюционного эксперимента, проводимого на кафедре биологической эволюции МГУ (Марков и др., 2015; Belkina et al., 2018; Dmitrieva et al., 2019).
Проведен анализ дрожжевого населения следующих 16 проб:
─ N1flies, N2flies – контрольные линии мух, выращиваемые на стандартном корме (60 г инактивированных дрожжей, 35 г манной крупы, 50 г сахара, 45 г измельченного изюма, 8 г агара, 2 г пропионовой кислоты на 1 л корма) без добавления соли в боксах (см. ниже);
– N3flies – контрольная линия мух, выращиваемая на таком же корме без добавления соли в банке (см. ниже);
– N2medium, N3medium – корм, освоенный мухами N2flies и N3flies соответственно;
– 2S1flies, 2S2flies, 2S3flies – линии мух, содержащиеся в банках на таком же корме с добавлением 2% соли (20 г NaCl на 1 л корма);
– 2S1medium – корм дрозофил линии 2S1flies;
– 4S1flies, 4S2flies, 4S3flies – линии мух, содержащиеся в банках на таком же корме с добавлением 4% соли;
– 4S1medium – корм дрозофил линии 4S1flies;
– 7S1flies, 7S2flies – линии мух, содержащиеся в боксах на таком же корме с добавлением 7% соли (эти линии в 2014–2016 гг. содержались на 4% соли, а затем постепенно, путем прибавления по 0.5% соли каждые два–три месяца, переведены на корм с 7% соли);
– 7S1medium – корм дрозофил линии 7S1flies.
Линии мух N3flies, 2S1flies, 2S2flies, 2S3flies, 4S1flies, 4S2flies, 4S3flies содержатся в цилиндрических стеклянных банках с кормом диаметром 64 мм и высотой 100 мм, закрытых ватно-марлевыми пробками, при естественном освещении и температуре 22–25°С. В каждой банке находится 50 мл корма и поилка – цилиндрический пластиковый резервуар объемом 1 мл, заполненный мокрой ватой. Каждые две недели все имаго, находящиеся в банке, обездвиживаются углекислым газом и извлекаются из сосуда на стерилизованную охлажденную плитку, затем из них случайным образом отбираются 10 самцов и 10 самок, которые помещаются в банку со свежим кормом.
Линии мух N1flies, N2flies, 7S1flies, 7S2flies содержатся в боксах из оргстекла, в каждом из которых корм находится в 12 открытых цилиндрических стеклянных пробирках диаметром 22 мм и высотой 100 мм, содержащих по 10 мл корма. Еженедельно в бокс добавляются четыре пробирки со свежим кормом и удаляются четыре пробирки, простоявшие в боксе три недели. Помимо пробирок с кормом, в каждом боксе находится поилка – пробирка со смоченной ватой, заменяемая еженедельно.
Методика проведения эксперимента и приготовления гомогенатов имаго. Изучение микробиоты дрозофил и их кормов проводилось с октября 2020 г. по февраль 2021 г.
Для анализа микробиоты из каждой линии мух брали по 10 имаго в возрасте 7 сут после выхода из куколки. Ранее мы показали, что именно в этом возрасте численность дрожжей в мухах, как правило, достигает максимума (Дмитриева и др., 2021). Чтобы смыть клетки дрожжей с поверхности насекомых, мух помещали в стерильные пробирки и промывали в 10 мл стерильной воды на вортексе MultiReax (Heidolph, Германия) в режиме 1700 об/мин в течение 15 мин. После этого насекомых доставали стерильной петлей и переносили в стерильные микропробирки, в которых проводилась их гомогенизация в 1 мл стерильной воды с помощью силиконового пестика, после чего каждый гомогенат еще раз был обработан на вортексе в течение 3 мин. Параллельно исследовали пять обжитых мухами кормов (см. выше). Для этого брали 10 мг корма с поверхности, а затем гомогенизировали и разводили по методике, описанной выше.
Для определения дрожжевого компонента микробиоты дрозофил и кормов из полученных образцов было сделано два последовательных десятикратных разведения, которые в 10-кратной повторности высевали на чашки Петри по методу Дригальского. В качестве питательной среды использовали глюкозо-пептонно-дрожжевой агар (глюкоза – 20 г/л, пептон – 10 г/л, дрожжевой экстракт – 5 г/л, агар – 20 г/л), в который перед разливом в чашки для подавления роста бактерий добавляли хлорамфеникол (1 г/л). Посевы инкубировали в течение 3 сут при комнатной температуре (20–22°С), а затем еще 4–7 сут в холодильнике при температуре 4–6°С для того, чтобы колонии хорошо сформировались, но не слились воедино.
Методика оценки состава дрожжевого компонента микробиома. Выросшие колонии были разделены на типы на основании макроморфологических признаков и подсчитаны. В результате для каждого образца была определена численность представителей каждого морфотипа колоний, а также общая численность дрожжей в колониеобразующих единицах (КОЕ) в пересчете на одну муху или на 1 мг корма (поскольку масса дрозофилы составляет примерно 1 мг). По две–три колонии из каждого морфотипа были выделены в чистую культуру, а затем сгруппированы на основании культуральных и микроморфологических признаков.
По одному–два представителя каждой группы были идентифицированы до вида на основании анализа нуклеотидных последовательностей ITS региона рДНК. Для выделения ДНК чистые культуры наращивали на жидкой глюкозо-пептонно-дрожжевой среде в течение 3–4 сут. Клетки осаждали центрифугированием при 3000 об/мин в течение 5 мин. Далее удаляли надосадочную жидкость, клетки промывали в стерильном фосфатно-солевом (рН 7.4) буферном растворе (ЭкоСервис, Россия) и ресуспендировали в Трис-ЭДТА буфере (рН 8.0). Полученные суспензии инкубировали на водяной бане при температуре 100°C в течение 10 мин, добавляли 100 мг стерильных стеклянных шариков (200–300 мкм) и обрабатывали на гомогенизаторе Minilys (Bertin Instruments, Франция) в течение 30 с при 5000 об/мин. Полученные лизаты центрифугировали при 14 500 об/мин в течение 3 мин и полученную надосадочную жидкость использовали в качестве матрицы для постановки ПЦР.
Амплификацию проводили по следующей программе: 1) первичная денатурация при 96°С в течение 2 мин; 2) далее 35 циклов: денатурация при 96°С – 20 с, отжиг праймеров при 52°С – 50 с, синтез дочерней цепи 72°С – 1.5 мин; 3) финальная элонгация при 72°С в течение 7 мин. При амплификации использовали праймеры ITS1f (5'-CTTGGTCATTTAGAGGAAGTA-3') и NL4 (5'-GGTCCGTGTTTCAAGACGG-3'). Визуализацию полученных ПЦР-продуктов проводили с помощью горизонтального электрофореза в 1.5% агарозном геле.
Секвенирование выполнено с использованием праймера NL4 научно-исследовательской компанией “Евроген” (Москва). Редактирование полученных последовательностей выполнено с использованием программы Chromas Lite 2.01. Для выравнивания и сравнения последовательностей использовали программу Clustal Omega (http://www.ebi.ac.uk/Tools/msa/clustalo/). При идентификации чистых культур использовали алгоритмы BLAST базы данных GenBank NCBI (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Полученные последовательности депонированы в базе данных GenBank NCBI под номерами OK181114–OK181159.
Разнообразие дрожжевого микробиома оценивали с помощью индекса видового разнообразия Шеннона, рассчитываемого по формуле $H = - \sum\nolimits_{i = 1}^k {\frac{{{{N}_{i}}}}{N}\ln \frac{{{{N}_{i}}}}{N}} $, где N – общая численность дрожжей всех видов в пробе, ${{N}_{i}}$ – численность i‑го вида дрожжей в пробе, i изменяется от 1 до k, где k – количество видов дрожжей в пробе. Данный индекс учитывает одновременно и видовое богатство дрожжей в пробе и выравненность распределения КОЕ по видам (рис. 1). Значение индекса равно нулю, если в пробе всего один вид дрожжей. При прочих равных, чем больше индекс Шеннона, тем более разнообразным можно считать дрожжевое сообщество пробы.
Рис. 1.
Индекс Шеннона, характеризующий видовое разнообразие дрожжевого населения в пробах. Закрашенные ромбы – линии мух, незакрашенные – пробы корма. Ноль означает, что микробное сообщество состоит только из одного вида (дрожжей). В пробе N3flies дрожжей не обнаружено, поэтому значение отсутствует.

РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основные результаты представлены в табл. 1. Для каждой пробы приведена общая численность дрожжей всех видов и численность каждого вида в отдельности. Данные величины – усредненные, так как посев производился в 10-кратной повторности. Приведено их стандартное отклонение. Также рассчитано относительное обилие каждого вида дрожжей в пробе (в процентах).
Таблица 1.
Численность дрожжей в гомогенатах мух и кормовых средах при разной концентрации NaCl. Для каждой из 16 проб указано относительное обилие каждого вида дрожжей (%) и абсолютное число КОЕ (на 1 муху или на 1 мг корма) ± стандартное отклонение
| Проба | Starmerella bacillaris | S. etchellsii | Pichia occidentalis | P. membrani-faciens | Candida californica | Zygosaccharomyces bailii | Geotrichum candidum | Gen. et sp. indet. | Общая численность КОЕ/муха (мг корма) | Стандартное отклонение общей численности |
|---|---|---|---|---|---|---|---|---|---|---|
| N2medium | 0 | 0 | 0 | 0 | 0 | 100% (20 ± 63) | 0 | 0 | 20 | 63 |
| N3medium | 0 | 0 | 54.9% (560 ± 420) | 0 | 2.0% (20 ± 63) | 43.1% (440 ± 523) | 0 | 0 | 1020 | 670 |
| N1flies | 0 | 0 | 100% (3480 ± 972) | 0 | 0 | 0 | 0 | 0 | 3480 | 972 |
| N2flies | 0 | 0 | 100% (560 ± 246) | 0 | 0 | 0 | 0 | 0 | 560 | 246 |
| N3flies | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2S1medium | 0 | 0 | 99.7% (118 640 ± 20 243) | 0.2% (220 ± 220) | 0.07% (80 ± 103) | 0.02% (20 ± 63) | 0 | 0 | 118 960 | 20 188 |
| 2S1flies | 0 | 0 | 98.4% (95 160 ± 10 087) | 0 | 1.6% (1540 ± 1334) | 0.04% (40 ± 84) | 0 | 0 | 96 740 | 10 688 |
| 2S2flies | 0 | 0 | 98.9% (188 960 ± 60 303) | 0 | 1.1% (2200 ± 1941) | 0 | 0 | 0 | 191 160 | 60 733 |
| 2S3flies | 0 | 0 | 99.4% (293 480 ± 82 848) | 0 | 0.6% (1820 ± 1872) | 0 | 0 | 0 | 295 300 | 83 388 |
| 4S1medium | 0 | 0 | 99.9% (201 040 ± 59 974) | 0 | 0.1% (200 ± 432) | 0 | 0 | 0 | 201 240 | 59 948 |
| 4S1flies | 0 | 0 | 98.0% (130 660 ± 32 080) | 2.0% (2740 ± 499) | 0 | 0 | 0 | 0 | 133 400 | 32 146 |
| 4S2flies | 0 | 0 | 99.99% (139 100 ± 41 200) | 0.01% (20 ± 63) | 0 | 0 | 0 | 0 | 139 120 | 41 235 |
| 4S3flies | 0 | 0 | 98.0% (494 400 ± 147 912) | 0.06% (320 ± 424) | 0 | 1.9% (9720 ± 4884) | 0 | 0 | 504 440 | 149 799 |
| 7S1medium | 23.2% (6880 ± 3198) | 0 | 67.2% (19 900 ± 9069) | 1.2% (356 ± 400) | 0 | 0 | 0 | 8.3% (2460 ± 7164) | 29 596 | 11 460 |
| 7S1flies | 99.5% (52 140 ± 12 417) | 0 | 0.5% (238 ± 238) | 0 | 0 | 0 | 0.02% (8 ± 14) | 0 | 52 306 | 12 370 |
| 7S2flies | 89.3% (1846 ± 1009) | 1.0% (20 ± 28) | 9.6% (198 ± 186) | 0.2% (4 ± 13) | 0 | 0 | 0 | 0 | 2068 | 1029 |
В исследованных образцах обнаружено в общей сложности шесть видов дрожжей:
1) Starmerella bacillaris (Kroemer & Krumbholz) F.L. Duarte & A. Fonseca, 2012;
2) Starmerella etchellsii (Lodder & Kreger-van Rij) C.A. Rosa & Lachance, 2018;
3) Candida californica (Mrak & McClung ex K.W. Anderson & C.E. Skinner, 2006);
4) Pichia membranifaciens (Hansen, 1904) E.C. Hansen;
5) Pichia occidentalis (Kurtzman, Smiley & Johnson, 2008) Kurtzman, Robnett & Basehoar-Powers;
6) Zygosaccharomyces bailii (Barnett et al., 1983).
Кроме того, в линии 7S1flies встречаются колонии мицелиального гриба Geotrichum candidum (Link, 1809).
Дрожжи обнаружены во всех пробах, кроме одной (N3flies). Дрожжевой микробиом каждой отдельной пробы может включать от одного до четырех видов дрожжей. Пробы сильно различаются по значению индекса разнообразия Шеннона (рис. 1).
На кормах без добавления соли общая численность дрожжей невелика (рис. 2). На корме N3medium доминируют два вида: P. occidentalis и Z. bailii; а C. californica – минорный компонент дрожжевого микробиома. В корме N2medium дрожжевое население на 100% состоит из дрожжей Z. bailii.
Рис. 2.
Общая численность дрожжей. Значения приведены в логарифмической шкале, отрезками показано стандартное отклонение. Закрашенные ромбы – линии мух, незакрашенные – пробы корма.
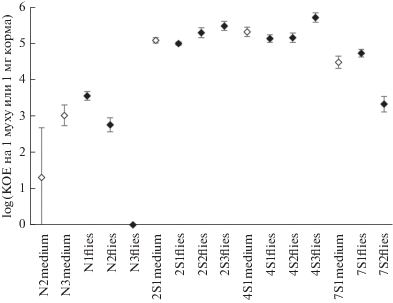
На корме с 2% соли дрожжей на два порядка больше. Этот корм населен почти исключительно дрожжами P. occidentalis. Дрожжи P. membranifaciens, C. californica и Z. bailii представлены единичными редкими колониями.
Корм с добавлением 4% соли по таксономическому составу дрожжевого населения похож на корм с 2% соли, однако численность дрожжей на нем больше примерно в 2 раза.
На корме с 7% соли дрожжей тоже довольно много, хотя и меньше, чем на кормах с 2 и 4% соли (рис. 2). Дрожжевое население корма 7S1medium довольно разнообразно и при этом характеризуется видами, не встречающимися на других кормах. Доминантным видом выступает P. occidentalis, в роли субдоминанта – S. bacillaris. Первый вид распространен в разных линиях мух и на кормах, а второй встречался ранее в линиях, содержащихся на корме с 4% NaCl (Ивницкий и др., 2018; Dmitrieva et al., 2019), но в настоящем исследовании он в них не обнаружен и встречается только в линиях, живущих на корме с 7% NaCl. Это дает основания предположить, что дрожжи S. bacillaris маркируют определенный этап адаптации мух к корму с высоким содержанием соли. Возможно, данный этап уже завершился на корме с 4% соли и еще идет на корме с 7% соли (Дмитриева и др., 2021). Кроме того, более 8% колониеобразующих единиц в корме 7S1medium принадлежат не встречавшимся ранее видам дрожжей, которые пока не удалось надежно определить.
Соотношение численности дрожжей в мухах, живущих на кормах с разной концентрацией соли, аналогично ситуации на кормах. Меньше всего дрожжей в мухах, живущих на корме без добавления соли, больше всего – в мухах на кормах с добавлением 2 и 4% соли. Мухи, живущие на корме с 7% соли, имеют больше дрожжей, чем те, что живут без соли, и меньше, чем те, что живут на кормах с 2 и 4% соли.
Дрожжевое население мух из линий, живущих на корме без добавления соли, наименее разнообразное. В линиях N1flies и N2flies оно полностью состоит из дрожжей вида P. occidentalis. У мух из линии N3flies дрожжи не обнаружены вовсе (поэтому точка на рис. 1, соответствующая данной линии, отсутствует). Последний результат выглядит неожиданным, учитывая, что дрожжевое население корма N3medium довольно разнообразно. Причины контрастных различий дрожжевого населения мух и кормов, на которых они живут, пока неясны.
При повышении концентрации соли до 2–4% разнообразие дрожжей в мухах заметно возрастает. Дрожжевое население мух из линий, живущих на корме с добавлением 2% соли, сходно во всех трех репликах (2S1flies, 2S2flies, 2S3flies). Оно также сходно с дрожжевым сообществом корма 2S1medium. Доминирующим видом дрожжей является P. occidentalis, а C. californica – основной минорный вид. В пробaх 2S1flies и 2S1medium также обнаружены единичные колонии Z. bailii.
Дрожжевое население мух из линий, живущих на корме с добавлением 4% соли, сходно во всех трех репликах. Также оно схоже с дрожжевым микробиомом корма 4S1medium. Доминирующий вид дрожжей – P. occidentalis. P. membranifaciens встречается в небольшом количестве во всех трех линиях 4S, а в линии 4S3flies встречаются также дрожжи Z. bailii. Таким образом, дрожжевой микробиом мух, живущих на 2 и 4% соли, в целом схож.
При росте концентрации соли в корме от 2–4 до 7% в кишечнике мух происходит смена доминанта с P. occidentalis на S. bacillaris, доля P. occidentalis резко снижается и меняется состав минорных компонентов: исчезают C. californica и Z. bailii, появляются S. etchellsii и Geotrichum candidum. Дрожжевое сообщество, населяющее корм с 7% соли, сильно отличается от дрожжевого населения кишечника мух, живущих на этом корме. Доминант на корме – P. occidentalis, а в кишечнике мух обеих линий (7S1flies, 7S2flies) доминирует вид S. bacillaris.
Интересно, что в пробе 7S2flies появляется еще один вид дрожжей из того же рода – S. etchellsii, не встречавшийся ранее ни в одной из рассматриваемых линий (Ивницкий и др., 2018; Dmitrieva et al., 2019; Дмитриева и др., 2021). Об экологии вида S. etchellsii известно немного. Этот вид спорадически выделяется из самых разных источников (Kurtzman et al., 2011), но чаще всего его обнаруживали на пчелах и в субстратах, посещаемых этими насекомыми (Rosa et al., 2003; Teixeira et al., 2003). Также в литературе есть сведения об осмотолерантности этих дрожжей, их использовании при производстве соевого соуса, а также неоднократном обнаружении в субстратах с высоким содержанием соли, например, в огуречном рассоле (Lee et al., 1992; Suzuki et al., 1992; Wanakhachornkrai, Lertsiri, 2003; Feng et al., 2012).
Как видно из приведенного описания и табл. 1, дрожжевое население корма и мух существенно различается при минимальной (0%) и максимальной (7%) концентрации соли, но сходно при промежуточных концентрациях (2 и 4%). Так, при концентрации соли 0% в гомогенатах мух обнаружен только один вид дрожжей (P. occidentalis), тогда как в корме выявлены три вида (P. occidentalis, Z. bailii, C. californica). При концентрации 7% в гомогенатах доминируют дрожжи S. bacillaris, а в корме – P. occidentalis. Различаются и минорные компоненты дрожжевого микробиома: только в гомогенатах мух 7S обнаружены виды S. etchellsii и G. candidum, в то время как дрожжи Gen. et sp. indet. (пока не идентифицированные, но отличные от всех идентифицированных видов) обнаружены только в корме, где они составляют свыше 8% от общего числа колониеобразующих единиц. При концентрациях соли 2 и 4% дрожжевое население мух и корма, напротив, сходно по составу: всегда преобладает P. occidentalis, а все минорные компоненты (P. membranifaciens, C. californica, Z. bailii) встречаются и в гомогенатах, и в корме (хоть и не всегда, т.е. не в каждой пробе).
При всех четырех концентрациях NaCl численность дрожжей (КОЕ) в 1 мг корма сопоставима с их численностью в одной гомогенизированной мухе, масса которой составляет тоже примерно 1 мг. Поскольку перед приготовлением гомогената мухи промывались водой, а присутствие значительного количества дрожжей в полости тела, мышцах и других тканях и органах насекомого маловероятно, мы предполагаем, что в гомогенатах представлены в основном те дрожжи, которые находились в пищеварительном тракте. Поскольку масса содержимого пищеварительного тракта существенно меньше массы целого насекомого, можно говорить о повышенной концентрации дрожжей в пищеварительной системе мух по сравнению с кормом. Это может объясняться отчасти преимущественным питанием мух дрожжевой биомассой, а отчасти тем, что пищеварительная система мух предоставляет более благоприятные условия для некоторых видов дрожжей, чем корм.
Особый интерес представляет отсутствие вида S. bacillaris в линиях мух, содержащихся на корме с 4% соли, и его присутствие в линиях, содержащихся на корме с 7% соли. Ранее (в 2017–2018 гг.) дрожжи S. bacillaris доминировали в линиях 4S (Ивницкий и др., 2018; Dmitrieva et al., 2019), однако в дальнейшем (2019–2020 гг.) они перестали обнаруживаться в гомогенатах мух из этих линий (Дмитриева и др., 2021). При этом, как мы показали ранее, данный вид дрожжей вносит существенный вклад в адаптацию дрозофил к соли, повышая эффективность размножения мух на корме с 4% NaCl (Dmitrieva et al., 2019). Тот факт, что теперь вид S. bacillaris обнаружен у мух, адаптированных к 7% NaCl (ранее микробиом этих мух не изучался), хотя у линий 4S его по-прежнему нет, позволяет предположить, что мы имеем дело с некой сложной коэволюционной динамикой, отражающей различные этапы адаптации холобионта (симбиотического комплекса, включающего макроорганизм и его микробиом (Margulis, Fester, 1991)) к соленому корму. Например, не исключено, что дрожжи S. bacillaris успешно развиваются в линиях дрозофил, недавно помещенных на соленый корм (или недавно переведенных на более соленый корм с менее соленого, как линии 7S) и еще не успевших к нему адаптироваться генетически. На этом этапе дрожжи S. bacillaris, по-видимому, помогают мухам выдерживать высокую концентрацию NaCl, как показали ранее наши эксперименты (Dmitrieva et al., 2019). В дальнейшем, однако, эти полезные симбионты могут быть потеряны мухами (Дмитриева и др., 2021). Это может происходить на фоне постепенного развития генетических адаптаций насекомых к соленому корму или в результате изменения структуры самого микробиома. Возможно, S. bacillaris доминирует в микробном сообществе только пока оно не приспособилось к повышенной концентрации NaCl, но по мере адаптации других видов дрожжей к изменившимся условиям S. bacillaris вытесняется из сообщества. Кроме того, на процесс становления дрожжевого компонента микробного сообщества может оказывать влияние его бактериальный компонент. Для проверки этих гипотез и выявления механизмов предполагаемых тенденций (если они подтвердятся) необходимы дальнейшие эксперименты.
ВЫВОДЫ
Анализ дрожжевого компонента микробиома дрозофил, содержащихся на кормах с разным содержанием соли, позволил выявить следующие закономерности.
1. Общая численность дрожжей как в мухах, так и в их корме меняется с ростом концентрации NaCl немонотонно: она минимальна при концентрации соли 0%, максимальна – при концентрации 2 и 4%, при концентрации 7% численность дрожжей в мухах и их корме меньше, чем при 2–4%, но значительно больше, чем при 0% (рис. 2).
2. По мере роста концентрации соли в корме дрожжевой микробиом дрозофил претерпевает значительные изменения. При концентрации 0% как численность, так и разнообразие дрожжей в гомогенатах мух минимальны, обнаруживается только P. occidentalis. При повышении концентрации до 2–4% численность и разнообразие дрожжей резко возрастают. Вид P. occidentalis по-прежнему доминирует, но к нему добавляются минорные компоненты: P. membranifaciens, C. californica, Z. bailii. При росте концентрации до 7% появляется новый доминант – S. bacillaris, а процентная доля P. occidentalis резко снижается. Меняется и состав других минорных компонентов: исчезают C. californica и Z. bailii, появляются S. etchellsii и G. candidum.
3. Дрожжевое население корма и мух существенно различается при минимальной (0%) и максимальной (7%) концентрациях соли, но сходно при промежуточных (2 и 4%) концентрациях.
4. Концентрация дрожжей (живых дрожжевых клеток) в пищеварительной системе мух значительно выше, чем в корме.
5. Дрожжи вида S. bacillaris, ранее доминировавшие в микробиоме мух, живущих на корме с 4% соли, больше не встречаются ни в этих мухах, ни в их корме. Однако они присутствуют в линиях, живущих на корме с 7% соли. Возможно, данный вид дрожжей маркирует начальный этап адаптации холобионта к повышению концентрации соли. Это согласуется с обнаруженным ранее фактом, что S. bacillaris вносит существенный вклад в адаптацию дрозофил к соли, повышая эффективность размножения мух на корме с 4% NaCl (Dmitrieva et al., 2019). Для проверки этой гипотезы, а также для оценки относительного вклада генетических и эпигенетических изменений мух и компонентов их микробиома в адаптацию холобионта к повышению концентрации соли в корме требуются дальнейшие исследования.
Список литературы
Дмитриева А.С., Максимова И.А., Качалкин А.В., Марков А.В., 2021. Возрастные изменения дрожжевой составляющей микробиома Drosophila melanogaster // Микробиология. Т. 90. № 2. С. 226–235.
Ивницкий С.Б., Максимова И.А., Панченко П.Л., Дмитриева А.С., Качалкин А.В. и др., 2018. Роль микробиома в адаптации Drosophila melanogaster к кормовому субстрату с повышенной концентрацией NaCl // Журн. общ. биологии. Т. 79. № 5. С. 393–403.
Марков А.В., Ивницкий С.Б., Корнилова М.Б., Наймарк Е.Б., Широкова Н.Г., Перфильева К.С., 2015. Материнский эффект маскирует адаптацию к неблагоприятным условиям и затрудняет дивергенцию у Drosophila melanogaster // Журн. общ. биологии. Т. 76. № 6. С. 429–437.
Панченко П.Л., Корнилова М.Б., Перфильева К.С., Марков А.В., 2017. Симбиотическая микробиота вносит вклад в адаптацию Drosophila melanogaster к неблагоприятной кормовой среде // Изв. РАН. Сер. биол. Т. 44. С. 341–351.
Anagnostou C., Dorsch M., Rohlfs M., 2010. Influence of dietary yeasts on Drosophila melanogaster life-history traits // Entomol. Exp. Appl. V. 136. P. 1–11.
Becher P.G., Flick G., Rozpędowska E., Schmidt A., Hagman A. et al., 2012. Yeast, not fruit volatiles mediate Drosophila melanogaster attraction, oviposition and development // Funct. Ecol. V. 26. P. 822–828.
Belkina E.G., Naimark E.B., Gorshkova A.A., Markov A.V., 2018. Does adaptation to different diets result in assortative mating? Ambiguous results from experiments on Drosophila // J. Evol. Biol. V. 31. P. 1803–1814.
Chandler J.A., Eisen J.A., Kopp A., 2012. Yeast communities of diverse Drosophila species: Comparison of two symbiont groups in the same hosts // Appl. Environ. Microbiol. V. 78. P. 7327–7336.
Coluccio A.E., Rodriguez R.K., Kernan M.J., Neiman A.M., 2008. The yeast spore wall enables spores to survive passage through the digestive tract of Drosophila // PLoS One. V. 3. https://doi.org/10.1371/journal.pone.0002873
Dmitrieva A.S., Ivnitsky S.B., Maksimova I.A., Panchenko P.L., Kachalkin A.V., Markov A.V., 2019. Symbiotic yeasts affect adaptation of Drosophila melanogaster to food substrate with high NaCl concentration // PLoS One. V. 14. https://doi.org/10.1371/journal.pone.0224811
Douglas A.E., 2018. The Drosophila model for microbiome research // Lab. Anim. V. 47. P. 157–164.
Erkosar B., Leulier F., 2014. Transient adult microbiota, gut homeostasis and longevity: Novel insights from the Drosophila model // FEBS Lett. V. 588. № 22. P. 4250–4257.
Erkosar B., Storelli G., Defaye A., Leulier F., 2013. Host-intestinal microbiota mutualism: “learning on the fly” // Cell Host Microbe. V. 13. P. 8–14.
Feng J., Zhan X.-B., Wang D., Zhang L.-M., Lin C.-C., 2012. Identification and analysis of the metabolic functions of a high-salt-tolerant halophilic aromatic yeast Candida etchellsii for soy sauce production // World J. Microbiol. Biotechnol. V. 28. № 4. P. 1451–1458.
Guilhot R., Rombaut A., Xuéreb A., Howell K., Fellous S., 2020. Bacterial influence on the maintenance of symbiotic yeast through Drosophila metamorphosis // bioRxiv. https://doi.org/10.1101/2020.05.31.126185
Günther C.S., Goddard M.R., 2019. Do yeasts and Drosophila interact just by chance? // Fungal Ecol. V. 38. P. 37–43.
Hoang D., Kopp A., Chandler J.A., 2015. Interactions between Drosophila and its natural yeast symbionts – Is Saccharomyces cerevisiae a good model for studying the fly-yeast relationship? // PeerJ. V. 3. https://doi.org/10.7717/peerj.1116
Kurtzman C.P., Fell J.W., Boekhout T., 2011. The Yeasts, a Taxonomic Study. 5th edn. Amsterdam: Elsevier. 2080 p.
Lee F.-L., Lee C.-F., Okada S., Hsu W.-H., Kozaki M., 1992. Chemotaxonomic comparison of osmotolerant yeasts isolated from “Inyu” (black soybean sauce) mash in Taiwan and “Shoyu” (soybean sauce) mash in Japan // Bull. Jpn. Fed. Cult. Coll. V. 8. P. 11–17.
Margulis L., Fester R., 1991. Symbiosis as a Source of Evolutionary Innovation: Speciation and Morphogenesis. Boston: MIT Press. 470 p.
Newell P.D., Douglas A.E., 2014. Interspecies interactions determine the impact of the gut microbiota on nutrient allocation in Drosophila melanogaster // Appl. Environ. Microbiol. V. 80. № 2. P. 788–796.
Reuter M., Bell G., Greig D., 2007. Increased outbreeding in yeast in response to dispersal by an insect vector // Curr. Biol. V. 17. P. R81–R83.
Rosa C.A., Lachance M.-A., Silva J.O.C., Teixeira A.C.P., Marini M.M. et al., 2003. Yeast communities associated with stingless bees // FEMS Yeast Res. V. 4. № 3. P. 271–275.
Stamps J.A., Yang L.H., Morales V.M., Boundy-Mills K.L., 2012. Drosophila regulate yeast density and increase yeast community similarity in a natural substrate // PLoS One. V. 7. https://doi.org/10.1371/journal.pone.0042238
Starmer W.T., 1981. A comparison of Drosophila habitats according to the physiological attributes of the associated yeast communities // Evolution. V. 35. P. 38–52.
Suzuki M., Nakase T., Mori H., Toriumi H., Kurtzman C.P., 1992. Chemotaxonomic study on halophilic/halotolerant yeasts in the matured soy sauce mashes // Bull. Jpn. Fed. Cult. Coll. V. 8. P. 18–27.
Te Velde J.H., Molthoff C.F.M., Scharloo W., 1988. The function of anal papillae in salt adaptation of Drosophila melanogaster larvae // J. Evol. Biol. V. 2. P. 139–153.
Teixeira A.C.P., Marini M.M., Nicoli J.R., Antonini Y., Martins R.P. et al., 2003. Starmerella meliponinorum sp. nov., a novel ascomycetous yeast species associated with stingless bees // Int. J. Syst. Evol. Microbiol. V. 53. P. 339–343.
Trinder M., Daisley B.A., Dubeet J.S., Reiв G., 2017. Drosophila melanogaster as a high-throughput model for host–microbiota interactions // Front. Microbiol. V. 8. https://doi.org/10.3389/fmicb.2017.00751
Waddington C.H., 1959. Canalization of development and genetic assimilation of acquired characters // Nature. V. 183. P. 1654–1655.
Wanakhachornkrai P., Lertsiri S., 2003. Comparison of determination method for volatile compounds in Thai soy sauce // Food Chem. V. 83. P. 619–629.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


